Middle East And Africa Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Taille du marché en milliards USD
TCAC :
% 
 USD
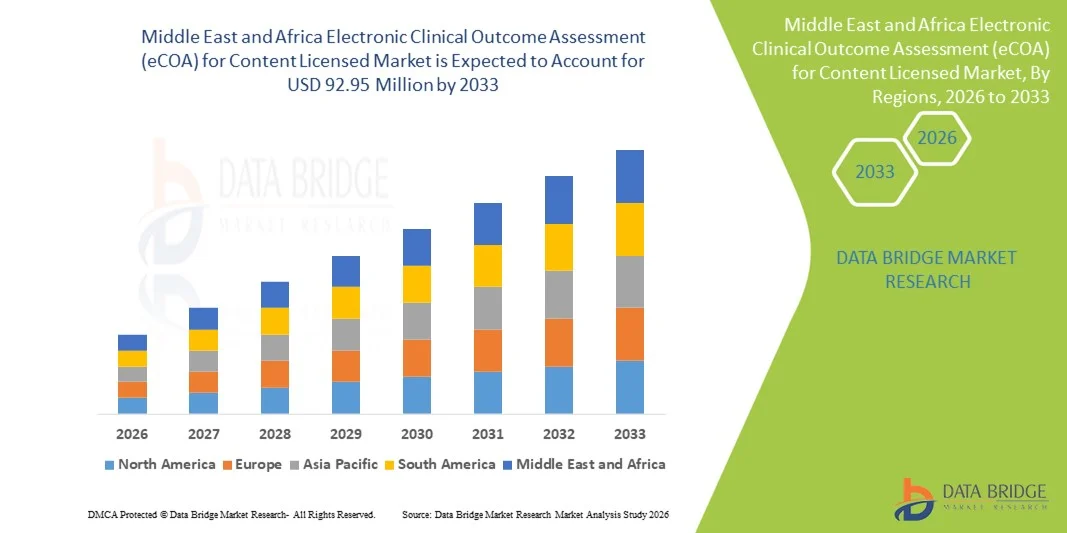
41.22 Million
USD
92.95 Million
2025
2033
USD
41.22 Million
USD
92.95 Million
2025
2033
| 2026 –2033 | |
| USD 41.22 Million | |
| USD 92.95 Million | |
|
|
|
|
Segmentation du marché des solutions électroniques d'évaluation des résultats cliniques (eCOA) au Moyen-Orient et en Afrique, par produit (solutions sur site, solutions cloud et solutions web), par approche (évaluation des résultats rapportés par le clinicien (ClinRO), par le patient (PRO), par l'observateur (ObsRO) et par l'évaluation des performances (PerfO)), par utilisateur final (prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements d'enseignement supérieur) et par plateforme (organismes de recherche sous contrat, entreprises pharmaceutiques et biopharmaceutiques , fabricants de dispositifs médicaux , hôpitaux et laboratoires d'analyses, sociétés de conseil, recherche et enseignement supérieur, et autres) - Tendances du secteur et prévisions jusqu'en 2033
Taille du marché de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence au Moyen-Orient et en Afrique
- Le marché des systèmes d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence au Moyen-Orient et en Afrique était évalué à 41,22 millions de dollars en 2025 et devrait atteindre 92,95 millions de dollars d'ici 2033 , soit un taux de croissance annuel composé (TCAC) de 10,70 % au cours de la période de prévision.
- La croissance du marché est largement alimentée par l'adoption croissante des technologies numériques dans les essais cliniques, l'importance accrue accordée à la recherche centrée sur le patient et le besoin de collecte de données précises et en temps réel dans tous les domaines thérapeutiques. L'intégration des plateformes cloud, des applications mobiles et des résultats rapportés par les patients (ePRO) stimule davantage l'expansion du marché de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence.
- De plus, la demande croissante de solutions d'essais cliniques conformes à la réglementation, conviviales et évolutives fait des systèmes eCOA un élément essentiel de la recherche clinique moderne. L'amélioration de l'efficacité, la réduction des charges administratives et l'engagement accru des patients accélèrent l'adoption de l'évaluation électronique des résultats cliniques (eCOA) pour les solutions sous licence de contenu, stimulant ainsi considérablement la croissance du marché.
Analyse du marché des contenus sous licence au Moyen-Orient et en Afrique
- La croissance du marché des solutions d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence est largement alimentée par l'adoption croissante des solutions de recueil électronique des résultats rapportés par les patients (ePRO) et d'eCOA dans les essais cliniques, elle-même motivée par le besoin d'une collecte de données précise et en temps réel et d'un meilleur suivi des patients dans le secteur de la santé et la recherche pharmaceutique.
- La demande croissante de processus d'essais cliniques simplifiés, de conformité réglementaire et de gestion efficace des données accélère l'adoption de l'évaluation électronique des résultats cliniques (eCOA) pour les solutions sous licence de contenu, stimulant ainsi considérablement la croissance du secteur.
- L’Arabie saoudite a dominé le marché des systèmes d’évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence, avec une part de revenus d’environ 36,9 % en 2025. Cette domination s’explique par d’importants investissements publics dans la numérisation des soins de santé dans le cadre de la Vision 2030, le développement des infrastructures de recherche clinique, l’adoption croissante des technologies numériques pour les essais cliniques et un soutien réglementaire de plus en plus fort aux évaluations électroniques des résultats pour les patients. Le pays connaît une croissance soutenue des déploiements d’eCOA dans les hôpitaux et les centres de recherche, grâce aux plateformes cloud, à la saisie de données mobiles et à l’intégration avec les systèmes centralisés de gestion des essais cliniques et des données.
- Les Émirats arabes unis devraient connaître la croissance la plus rapide sur le marché des systèmes d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence au cours de la période de prévision, avec un TCAC à deux chiffres. Cette croissance est alimentée par l'essor des essais cliniques, la hausse des dépenses de santé, l'adoption rapide des solutions de santé numérique et les initiatives gouvernementales fortes qui encouragent l'innovation, la médecine de précision et la recherche clinique centrée sur le patient. L'utilisation croissante des technologies de saisie électronique des données et de recueil des résultats rapportés par les patients dans les hôpitaux, les établissements universitaires et les entreprises pharmaceutiques contribue également à accélérer la croissance du marché aux Émirats arabes unis.
- Le segment des solutions basées sur le cloud a dominé le marché avec une part de revenus de 45,3 % en 2025, grâce à un déploiement évolutif, une facilité d'accès à distance et une intégration avec de multiples appareils.
Portée du rapport et évaluation électronique des résultats cliniques (eCOA) pour la segmentation du marché des contenus sous licence
|
Attributs |
Évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence : principaux enseignements du marché |
|
Segments couverts |
|
|
Pays couverts |
Moyen-Orient et Afrique
|
|
Acteurs clés du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
En plus des informations sur les scénarios de marché tels que la valeur du marché, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché élaborés par Data Bridge Market Research comprennent également une analyse approfondie par des experts, l'épidémiologie des patients, l'analyse du pipeline, l'analyse des prix et le cadre réglementaire. |
Tendances du marché de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence au Moyen-Orient et en Afrique
Adoption croissante des solutions numériques pour les essais cliniques
- Une tendance majeure du marché mondial des certificats électroniques d'autorisation (eCOA) pour les contenus sous licence est l'adoption croissante de solutions d'essais cliniques numériques et à distance, motivée par le besoin d'une collecte de données efficace, en temps réel et centrée sur le patient.
- Par exemple, en mars 2023, CRF Health (qui fait désormais partie de Signant Health) a étendu sa plateforme eCOA au Moyen-Orient et en Afrique pour soutenir des essais cliniques entièrement décentralisés, permettant la collecte électronique des résultats rapportés par les patients (ePRO) dans plusieurs langues et selon différents protocoles d'étude.
- Les outils numériques eCOA réduisent les erreurs, accélèrent la collecte de données et améliorent l'observance des patients par rapport aux méthodes traditionnelles sur papier.
- La pandémie de COVID-19 a accéléré cette tendance, soulignant la nécessité d'une surveillance à distance des patients et d'une collecte de données sans contact, qui devrait persister après la pandémie.
- Les entreprises pharmaceutiques et les organismes de recherche sous contrat (CRO) intègrent de plus en plus les plateformes eCOA à d'autres technologies d'essais cliniques numériques, telles que les évaluations électroniques des résultats cliniques pour les biomarqueurs numériques et les dispositifs portables.
Dynamique du marché des contenus sous licence au Moyen-Orient et en Afrique : évaluation électronique des résultats cliniques (eCOA)
Conducteur
Importance croissante accordée aux essais cliniques centrés sur le patient
- L'importance croissante accordée à la centralité du patient dans les essais cliniques favorise l'adoption des plateformes eCOA, permettant la collecte en temps réel des résultats rapportés par les patients (PRO), le suivi des symptômes et les données relatives à la qualité de vie liée à la santé.
- Par exemple, en juillet 2024, Parexel International a lancé une nouvelle solution eCOA adaptée aux essais cliniques en oncologie à travers l'Europe, permettant aux patients de déclarer leurs résultats directement depuis leur domicile via des interfaces web ou mobiles, améliorant ainsi l'engagement et la fidélisation.
- Les organismes de réglementation, notamment l'Agence européenne des médicaments (EMA), recommandent de plus en plus la collecte numérique des données rapportées par les patients (PRO) pour les demandes d'autorisation de mise sur le marché des médicaments, encourageant ainsi une adoption plus large.
- La capacité de recueillir à distance des données longitudinales, standardisées et de haute qualité permet aux promoteurs d'optimiser la conception des essais et de réduire la charge de travail des sites.
- L'intégration aux systèmes de saisie électronique des données (EDC) et aux plateformes centralisées de gestion des essais cliniques offre un flux de travail fluide aux promoteurs d'essais cliniques et aux CRO, renforçant ainsi leur adoption.
Retenue/Défi
Confidentialité des données, conformité réglementaire et coûts de mise en œuvre
- Le marché des certificats d'authenticité électroniques (eCOA) est confronté à des défis liés à la confidentialité des données, à la conformité au RGPD et aux coûts de mise en œuvre élevés , ce qui peut ralentir son adoption à l'échelle mondiale.
- Par exemple, en septembre 2022, plusieurs CRO européennes ont signalé des retards dans le déploiement de solutions eCOA en Allemagne et en France en raison de réglementations strictes en matière de protection des données et de la nécessité d'un stockage sécurisé des données des patients.
- Garantir la conformité aux lois locales, aux directives réglementaires et aux exigences de validation complexifie la mise en œuvre des certificats d'analyse électroniques (eCOA), en particulier pour les essais multinationaux.
- De plus, les coûts d'intégration aux systèmes d'essais cliniques existants , y compris la formation du personnel et la validation des logiciels, peuvent être importants, ce qui constitue un obstacle pour les CRO ou les promoteurs de petite et moyenne taille.
- Pour relever ces défis, il est nécessaire d'investir dans une cybersécurité robuste, une harmonisation réglementaire et des stratégies de déploiement rentables et évolutives afin de soutenir la croissance du marché à long terme.
Moyen-Orient et Afrique Évaluation électronique des résultats cliniques (eCOA) pour le périmètre du marché des contenus sous licence
Le marché est segmenté en fonction du produit, de l'approche, de l'utilisateur final et de la plateforme.
- Sous-produit
Selon le type de produit, le marché des solutions d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence se divise en solutions sur site, solutions cloud et solutions web. Le segment des solutions cloud a dominé le marché en 2025 avec une part de revenus de 45,3 %, grâce à un déploiement évolutif, une facilité d'accès à distance et une intégration avec de multiples appareils. Les plateformes cloud permettent aux promoteurs, aux CRO et aux centres cliniques de gérer les données de manière centralisée, d'améliorer la conformité et de réduire les coûts informatiques. Leur forte adoption dans les essais cliniques multicentriques, leurs protocoles de sécurité robustes et leurs rapports en temps réel renforcent leur position dominante. La flexibilité des modèles d'abonnement, l'alignement réglementaire et l'intégration avec les systèmes EDC et ePRO contribuent également à leur croissance. Les grandes entreprises pharmaceutiques privilégient les solutions cloud pour les essais internationaux. La pandémie de COVID-19 a accéléré leur adoption en raison des besoins de télésurveillance. L'amélioration de la disponibilité et du support fournisseur renforce les parts de marché. La validation standardisée entre les sites garantit la fiabilité. La rentabilité et l'optimisation des flux de travail sont des atouts majeurs. Les fonctionnalités d'analyse et de tableaux de bord améliorées attirent les utilisateurs finaux. L'intégration avec des applications mobiles améliore l'observance des patients. Globalement, ces facteurs maintiennent la domination.
Le segment des solutions sur site devrait connaître le taux de croissance annuel composé (TCAC) le plus rapide, à 14,8 %, entre 2026 et 2033, porté par les organisations exigeant un contrôle et une personnalisation de leurs données internes. Les hôpitaux, les CRO et les entreprises de biotechnologie, soumis à une gouvernance des données rigoureuse, adoptent les systèmes sur site. L'intégration aux infrastructures informatiques existantes renforce leur attrait. Les exigences élevées en matière de sécurité des données cliniques sensibles favorisent leur adoption. La demande croissante dans les régions aux réglementations strictes en matière de protection des données alimente la croissance. Les fonctionnalités avancées de reporting et d'analyse améliorent l'efficacité opérationnelle. Les déploiements à l'échelle de l'entreprise accélèrent l'utilisation. La disponibilité de modules personnalisables attire les grands investisseurs. Le support informatique interne garantit une maintenance robuste. Le besoin croissant d'options de déploiement hybrides accompagne l'expansion. Les investissements de l'industrie pharmaceutique dans les essais de médecine personnalisée stimulent encore davantage l'adoption. La formation et le support technique facilitent la mise en œuvre. L'alignement réglementaire pour la conformité aux normes FDA et EMA garantit une adoption accélérée.
- Par approche
Selon l'approche adoptée, le marché est segmenté en ClinRO, PRO, ObsRO et PerfO. Le segment des résultats rapportés par les patients (PRO) a dominé le marché avec une part de revenus de 42,1 % en 2025, grâce à son utilisation croissante dans les dossiers réglementaires, les essais centrés sur le patient et les études en vie réelle. Les PRO permettent une mesure directe de l'état de santé du patient, de sa satisfaction à l'égard du traitement et de sa qualité de vie. L'intégration avec les applications mobiles et les plateformes cloud favorise leur adoption. Le soutien important des recommandations de la FDA et de l'EMA renforce la demande. La forte prévalence des maladies chroniques et les essais en oncologie stimulent l'utilisation. Les critères d'évaluation cliniques reposent de plus en plus sur les données PRO. La prise en charge multilingue favorise un déploiement mondial. Les rappels automatisés améliorent l'observance. La collecte fréquente de données augmente le volume et l'utilité des données. L'intégration avec les certificats d'analyse électroniques (eCOA), les journaux électroniques et les dispositifs portables renforce le flux de travail. Les investissements de l'industrie pharmaceutique dans les critères d'évaluation basés sur les PRO accélèrent l'adoption. L'évolutivité entre les sites et les essais contribue à sa position dominante. L'analyse avancée permet la segmentation des patients et le suivi des résultats.
Le segment ObsRO devrait connaître la croissance annuelle composée la plus rapide (15,6 %) entre 2026 et 2033, grâce à son adoption croissante dans le domaine des maladies rares, en pédiatrie et pour l'évaluation des résultats rapportés par les aidants. Les données rapportées par les observateurs améliorent la mesure chez les populations incapables de s'auto-évaluer. La croissance des études pédiatriques et gériatriques stimule la demande. L'intégration aux plateformes de télésurveillance facilite l'adoption. Les investissements des entreprises pharmaceutiques et biotechnologiques dans les essais cliniques sur les maladies rares soutiennent l'expansion. La standardisation multicentrique améliore la fiabilité des données. Les solutions cloud et web accélèrent l'adoption. La transmission des données par les observateurs via mobile améliore la conformité. Les marchés émergents adoptent de plus en plus les approches ObsRO. L'acceptation réglementaire des critères d'évaluation ObsRO stimule la croissance. La formation et le soutien aux sites encouragent la mise en œuvre. Les progrès technologiques réduisent les erreurs de saisie manuelle. La forte valeur ajoutée des essais multipartites accélère la croissance.
- Par l'utilisateur final
En fonction de l'utilisateur final, le marché est segmenté en prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements d'enseignement supérieur. Le segment des hôpitaux et centres de transplantation a dominé le marché avec une part de revenus de 47,2 % en 2025, grâce à une activité intense d'essais cliniques, à un grand nombre de patients et au besoin de systèmes intégrés d'évaluation des résultats. Les hôpitaux utilisent l'eCOA pour la gestion des maladies chroniques, les essais en oncologie et le suivi des résultats chirurgicaux. Son adoption massive dans les essais multicentriques renforce son utilisation. L'intégration aux systèmes de dossiers médicaux électroniques (DME) améliore l'efficacité des flux de travail. Les obligations réglementaires en matière de collecte de données sur les résultats cliniques stimulent la demande. Des programmes de formation et d'assistance à grande échelle garantissent son adoption. La sécurité des données et la conformité aux normes HIPAA/RGPD renforcent la confiance. La prise en charge de plusieurs appareils améliore l'engagement des patients et des cliniciens. L'analyse en temps réel facilite les décisions opérationnelles. Les partenariats avec les CRO (Organisations de Recherche Contractuelle) accélèrent le déploiement. La télésurveillance des patients étend la portée du marché. L'investissement dans la recherche clinique hospitalière favorise le leadership. Les programmes d'amélioration continue maintiennent la position dominante.
Le segment des prestataires de services commerciaux devrait connaître la croissance annuelle composée la plus rapide, soit 16,3 %, entre 2026 et 2033, portée par l'externalisation croissante des essais cliniques et le besoin grandissant de gestion spécialisée des certificats électroniques d'analyse (eCOA). Les CRO et les fournisseurs de services cliniques proposent des solutions cloud et web pour les essais multicentriques. L'essor de la recherche contractuelle en oncologie, en neurologie et dans les maladies rares stimule cette croissance. La flexibilité des services proposés attire les PME et les ETI pharmaceutiques. Les outils de reporting et d'analyse avancés améliorent l'efficacité des essais. L'expansion sur les marchés émergents favorise l'adoption. La formation et l'assistance à distance facilitent la mise en œuvre. L'intégration avec les systèmes EDC et PRO garantit un flux de travail optimal. La sécurité des données et la conformité réglementaire demeurent des facteurs clés. L'évolutivité pour les essais internationaux accélère l'adoption. Les partenariats stratégiques avec les promoteurs élargissent la portée du marché. L'innovation dans l'intégration mobile et portable favorise une adoption rapide.
- Par plateforme
En fonction de la plateforme, le marché est segmenté en organismes de recherche sous contrat (CRO), entreprises pharmaceutiques et biopharmaceutiques, fabricants de dispositifs médicaux, hôpitaux et laboratoires d'analyses médicales, sociétés de conseil, recherche et enseignement supérieur, et autres. Le segment des entreprises pharmaceutiques et biopharmaceutiques a dominé le marché avec une part de revenus de 44,7 % en 2025, grâce à des programmes de développement clinique à grande échelle, à l'adoption d'essais de médecine de précision et au recours aux données électroniques de résultats pour les soumissions réglementaires. Les entreprises pharmaceutiques investissent dans des plateformes eCOA intégrées pour les études en oncologie, cardiologie et maladies chroniques. Le volume élevé d'essais et l'envergure mondiale des opérations contribuent à cette domination. L'intégration avec les systèmes EDC, PRO et les dispositifs portables rationalise les flux de travail. La conformité réglementaire favorise l'adoption. La gestion centralisée des données améliore l'efficacité des essais. Des partenariats à long terme avec les fournisseurs renforcent le leadership. Le déploiement multi-appareils et multi-sites facilite l'utilisation. Les solutions cloud améliorent l'accessibilité. L'investissement dans les tests compagnons augmente l'utilisation de la plateforme. Les rapports en temps réel améliorent la prise de décision. L'analyse avancée accélère les programmes de développement de médicaments.
Le segment des organismes de recherche sous contrat (CRO) devrait connaître la croissance annuelle composée la plus rapide, soit 15,8 %, entre 2026 et 2033. Cette croissance est portée par l'externalisation des essais cliniques, la complexité croissante de ces essais et la demande grandissante de services complets de gestion des certificats électroniques d'analyse (eCOA). Les CRO proposent des plateformes eCOA évolutives et basées sur le cloud pour les études multinationales. L'adoption rapide de ces plateformes sur les marchés émergents accélère la croissance. L'intégration aux systèmes des promoteurs améliore l'efficacité opérationnelle. Des analyses avancées et des tableaux de bord permettent d'enrichir les informations recueillies lors des essais. La flexibilité des modèles de déploiement séduit les PME et les TPE. La formation et le support technique facilitent l'adoption. L'harmonisation des réglementations internationales renforce la confiance. L'adoption dans plusieurs domaines thérapeutiques stimule l'expansion. Le reporting mobile et à distance améliore la conformité. Les collaborations stratégiques avec les hôpitaux et les universités consolident leur présence. L'ensemble de ces facteurs contribue à une forte croissance.
Analyse régionale du marché des contenus sous licence au Moyen-Orient et en Afrique
- Le marché des systèmes d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence au Moyen-Orient et en Afrique devrait connaître une croissance annuelle composée (TCAC) substantielle tout au long de la période de prévision.
- Portée par l'adoption croissante des solutions numériques pour les essais cliniques, un cadre réglementaire rigoureux et une demande accrue de suivi efficace des résultats des patients
- La croissance est alimentée par l'intégration de plateformes cloud, la collecte de données mobiles et les résultats rapportés par les patients, ainsi que par l'accent mis dans la région sur l'amélioration des infrastructures de soins de santé et la numérisation de la recherche clinique.
Analyse du marché britannique de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence
Le marché britannique des systèmes d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence a dominé le marché des systèmes d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence en 2025, avec une part de revenus d'environ 38,7 %. Cette domination s'explique par une infrastructure de santé bien établie, une forte adoption des technologies numériques pour les essais cliniques et un cadre réglementaire solide encadrant le suivi électronique des résultats des patients. La croissance substantielle de ce marché est portée par les innovations dans les plateformes cloud, la collecte de données mobiles et l'intégration fluide avec les systèmes centralisés de gestion des essais cliniques, permettant ainsi une mesure plus efficace et précise des résultats des patients.
Analyse du marché allemand de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence
Le marché allemand de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence devrait connaître la croissance la plus rapide au cours de la période de prévision, avec un taux de croissance annuel composé (TCAC) à deux chiffres. Cette croissance est alimentée par l'intensification des essais cliniques, la hausse des dépenses de santé, l'accès accru aux solutions de santé numérique et l'adoption croissante des technologies de saisie électronique des données et de recueil des résultats rapportés par les patients dans les hôpitaux, les centres de recherche et les entreprises pharmaceutiques. Par ailleurs, l'accent mis par l'Allemagne sur l'innovation technologique et les infrastructures de santé numérique contribue également à cette expansion rapide du marché.
Moyen-Orient et Afrique : Évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence – Part de marché
Le secteur de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence est principalement dirigé par des entreprises bien établies, notamment :
• Medidata Solutions, Inc. (États-Unis)
• CRF Health (Royaume-Uni)
• Signant Health (États-Unis)
• Clinion (États-Unis)
• Celegence (États-Unis) •
Icon plc (Irlande
) • PPD, Inc. (États-Unis)
• Veeva Systems (États-Unis)
• Oracle Health Sciences (
États-Unis) • Synteract (États-Unis)
• Bioclinica, Inc. (États-Unis)
•
Complion (États-Unis)
• Curebase (États-Unis) • ClinOne (États-Unis)
• CRF Bracket (États-Unis)
• Datatrak International (États-Unis)
• Electronic Data Capture, LLC (États-Unis)
• PAREXEL International (États-Unis)
• Health Solutions International (Royaume-Uni)
Dernières évolutions au Moyen-Orient et en Afrique concernant l'évaluation électronique des résultats cliniques (eCOA) pour le marché des contenus sous licence
- En juin 2023, ICON plc a lancé sa plateforme numérique ICON, une solution intégrée comprenant des applications mobiles pour les patients, le consentement électronique, les certificats d'analyse électroniques (eCOA), la saisie directe de données pour les services à domicile et la gestion des technologies de santé numérique. Cette plateforme vise à simplifier l'engagement des patients et la collecte de données dans le cadre des essais cliniques, marquant ainsi une extension majeure des capacités des eCOA aux opérations numériques plus vastes des essais cliniques.
- En juillet 2023, Signant Health a fait l'acquisition de DSG, Inc., élargissant ainsi son portefeuille de technologies eCOA et d'essais hybrides pour y inclure des capacités EDC/DDC améliorées et renforçant sa présence dans des environnements de recherche clinique complexes, notamment en Europe.
- En novembre 2023, Clinical Ink a enrichi ses solutions d'engagement des patients en intégrant l'outil de diagnostic comportemental SPUR à sa suite eCOA et de biomarqueurs numériques, offrant ainsi une compréhension plus approfondie du comportement des patients et améliorant l'évaluation globale des résultats cliniques dans les essais cliniques.
- En novembre 2024, uMotif a finalisé l'acquisition de ClinOne, combinant les fonctionnalités eCOA/ePRO avec des outils de productivité des sites et de gestion du consentement afin de créer une plateforme unifiée qui réduit les frais administratifs et améliore l'efficacité de l'engagement dans les essais cliniques.
- En février 2025, YPrime a annoncé le lancement de sa fonctionnalité de formulaire automatisé de modification des données (DCF) dans le cadre de sa plateforme eCOA 7.x, offrant une gestion simplifiée et efficace des données cliniques et améliorant la précision des flux de travail des données d'essais.
- En 2025, Medable Inc. a été désignée comme leader dans l'évaluation PEAK Matrix des produits eCOA des sciences de la vie du groupe Everest, une reconnaissance pour son innovation en IA, ses analyses en temps réel et sa capture de données multimodales qui simplifient les évaluations des résultats cliniques et améliorent l'engagement des patients.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.