North America Endotoxin And Pyrogen Testing Market
Tamaño del mercado en miles de millones de dólares
Tasa de crecimiento anual compuesta (CAGR) :
% 
 USD
1,262.52 Billion
USD
2,628.58 Billion
2025
2033
USD
1,262.52 Billion
USD
2,628.58 Billion
2025
2033
| 2026 –2033 | |
| USD 1,262.52 Billion | |
| USD 2,628.58 Billion | |
|
|
|
|
Segmentación del mercado de pruebas de endotoxinas y pirógenos en América del Norte, por tipo de producto (kits y reactivos de detección, instrumentos, sistemas y software, servicios de pruebas de endotoxinas, consumibles y accesorios), tipo de prueba (prueba de lisado de amebocitos de Limulus [LAL], prueba de Tal, prueba de activación de monocitos [MAT], prueba de pirógenos de conejo y ensayo de C recombinante [RFC]), aplicación (fabricación farmacéutica, fabricación de dispositivos médicos, producción de materias primas y fabricación de envases), método (prueba de endotoxinas de coágulo de gel, prueba de endotoxinas cromogénicas y prueba de endotoxinas turbidimétrica), modo de compra (grupo grande, grupo mediano y pequeño e individual), producto final (vacuna y/o CGT, productos biológicos, inyectables y otros), usuario final (empresas farmacéuticas, empresas de biotecnología, empresas biomédicas, empresas de dispositivos médicos, organizaciones de investigación por contrato [CRO] y organizaciones de fabricación por contrato [CMO]) - Tendencias de la industria y pronóstico hasta 2033
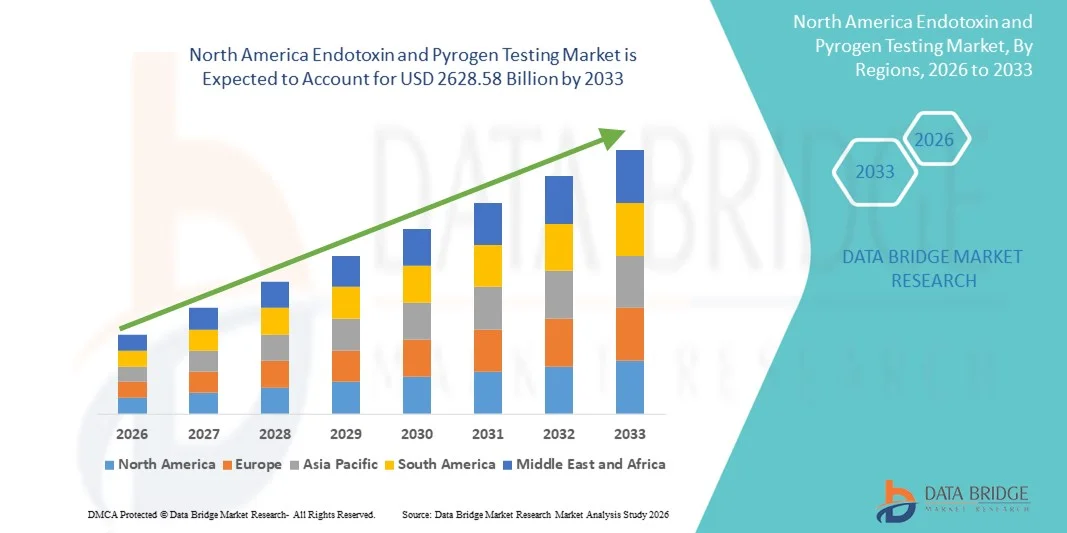
Tamaño del mercado de pruebas de endotoxinas y pirógenos en América del Norte
- El tamaño del mercado de pruebas de endotoxinas y pirógenos de América del Norte se valoró en USD 1262,52 mil millones en 2025 y se espera que alcance los USD 2628,58 mil millones para 2033 , con una CAGR del 9,60% durante el período de pronóstico.
- El crecimiento del mercado se ve impulsado en gran medida por el creciente énfasis en la seguridad del paciente, los estrictos requisitos regulatorios y los crecientes estándares de control de calidad en la fabricación de productos farmacéuticos, biotecnológicos y de dispositivos médicos, lo que lleva a una mayor adopción de soluciones confiables de pruebas de endotoxinas y pirógenos tanto en entornos clínicos como industriales.
- Además, la creciente demanda de métodos de prueba rápidos, precisos y que cumplan con las normas, junto con los avances en las tecnologías de prueba de pirógenos recombinantes y alternativos, está posicionando las pruebas de endotoxinas y pirógenos como un componente crítico de los sistemas modernos de garantía de calidad, lo que impulsa significativamente el crecimiento general de la industria.
Análisis del mercado de pruebas de endotoxinas y pirógenos en América del Norte
- Las soluciones de prueba de endotoxinas y pirógenos desempeñan un papel fundamental para garantizar la seguridad de los productos farmacéuticos, biológicos y dispositivos médicos, ya que ayudan a detectar toxinas bacterianas dañinas que pueden causar reacciones adversas en los pacientes, lo que las convierte en una parte esencial del control de calidad y el cumplimiento normativo tanto en entornos clínicos como industriales.
- La creciente demanda de pruebas de endotoxinas y pirógenos se debe principalmente a directrices regulatorias más estrictas, al aumento de la producción de medicamentos inyectables y productos biológicos y a una mayor conciencia sobre la seguridad del paciente, junto con un cambio gradual hacia métodos de prueba avanzados y sin animales, como los ensayos de factor C recombinante (rFC).
- Estados Unidos dominó el mercado de pruebas de endotoxinas y pirógenos con la mayor participación en los ingresos de aproximadamente el 41,8 % en 2025, impulsado por su sólido ecosistema de fabricación de productos farmacéuticos y biotecnológicos, una alta concentración de instalaciones reguladas por la FDA, sólidas inversiones en I+D y una amplia adopción de tecnologías avanzadas de pruebas de endotoxinas y pirógenos en la producción de medicamentos, productos biológicos y dispositivos médicos.
- Se espera que Canadá sea el país de más rápido crecimiento en el mercado de pruebas de endotoxinas y pirógenos durante el período de pronóstico, registrando una CAGR estimada de alrededor del 7,9%, respaldada por la expansión de la capacidad de fabricación de productos biológicos y vacunas, el aumento del apoyo gubernamental a las ciencias biológicas, el aumento de la subcontratación a organizaciones de pruebas contratadas y la creciente alineación con los estándares regulatorios globales de calidad y seguridad.
- El segmento de grandes grupos dominó el mercado con una participación en los ingresos del 48,3 % en 2025, impulsado por instituciones de atención médica establecidas y grandes organizaciones farmacéuticas que requieren adquisiciones a granel para satisfacer las demandas de pruebas de gran volumen.
Alcance del informe y segmentación del mercado de pruebas de endotoxinas y pirógenos
|
Atributos |
Análisis de endotoxinas y pirógenos: perspectivas clave del mercado |
|
Segmentos cubiertos |
|
|
Países cubiertos |
América del norte
|
|
Actores clave del mercado |
• Charles River Laboratories (EE. UU.) |
|
Oportunidades de mercado |
|
|
Conjuntos de información de datos de valor añadido |
Además de los conocimientos sobre escenarios de mercado, como el valor de mercado, la tasa de crecimiento, la segmentación, la cobertura geográfica y los principales actores, los informes de mercado seleccionados por Data Bridge Market Research también incluyen un análisis en profundidad de expertos, epidemiología de pacientes, análisis de la cartera de productos, análisis de precios y marco regulatorio. |
Tendencias del mercado de pruebas de endotoxinas y pirógenos en América del Norte
Creciente adopción de métodos avanzados de detección de endotoxinas y pirógenos
- Una tendencia significativa y en aceleración en el mercado de pruebas de endotoxinas y pirógenos es la creciente adopción de métodos de detección avanzados, incluidas las pruebas microbiológicas rápidas y los ensayos de factor C recombinante (rFC), para mejorar la precisión de las pruebas y el tiempo de respuesta.
- Por ejemplo, en 2023, varios fabricantes farmacéuticos en Brasil ampliaron el uso de pruebas de endotoxinas basadas en factor C recombinante para cumplir con las expectativas regulatorias globales y al mismo tiempo reducir la dependencia de las pruebas LAL tradicionales.
- Los laboratorios de toda la región se están centrando en mejorar la eficiencia y la sensibilidad de las pruebas para garantizar la seguridad de los productos farmacéuticos, biológicos y dispositivos médicos.
- El cambio hacia métodos de prueba alternativos y sostenibles también está ganando terreno debido a las preocupaciones éticas y al estímulo regulatorio.
- Esta tendencia está transformando las prácticas de control de calidad en América del Sur, apoyando una producción más segura de medicamentos y la preparación para la exportación a los mercados internacionales.
Dinámica del mercado de pruebas de endotoxinas y pirógenos en América del Norte
Conductor
Crecientes actividades de fabricación de productos farmacéuticos y biológicos
- La expansión constante de las actividades de fabricación de productos farmacéuticos, biotecnológicos y de dispositivos médicos en América del Sur, en consonancia con las tendencias de producción mundiales, es un impulsor clave que acelera la demanda de soluciones de pruebas de endotoxinas y pirógenos.
- Por ejemplo, en 2024, un importante fabricante brasileño de productos biológicos amplió sus capacidades internas de pruebas de endotoxinas para respaldar la producción a gran escala de vacunas inyectables y biosimilares destinados tanto al uso nacional como a los mercados internacionales.
- Los requisitos reglamentarios armonizados a nivel mundial que enfatizan la garantía de esterilidad y la seguridad del paciente exigen pruebas rutinarias de endotoxinas y pirógenos durante las etapas de desarrollo de fármacos, fabricación clínica y producción comercial.
- El aumento de las inversiones públicas y privadas en infraestructura de atención de la salud, investigación en ciencias biológicas y fabricación farmacéutica localizada en las economías emergentes y desarrolladas está fortaleciendo aún más la demanda de soluciones de prueba confiables y validadas.
- La creciente exportación de productos farmacéuticos y biológicos de América del Norte a mercados regulados como América del Norte y Europa requiere un estricto cumplimiento de las normas internacionales de calidad y seguridad, lo que refuerza la adopción de protocolos de pruebas de endotoxinas y pirógenos.
Restricción/Desafío
Altos costos de prueba y experiencia técnica limitada
- Los altos costos operativos y de capital asociados con los sistemas avanzados de pruebas de endotoxinas y pirógenos continúan representando una restricción importante, en particular para los laboratorios pequeños y medianos de América del Norte y otras regiones sensibles a los costos a nivel mundial.
- Por ejemplo, varios laboratorios de pruebas por contrato en Argentina han informado de demoras en la adopción de tecnologías de pruebas rápidas y alternativas debido a limitaciones presupuestarias, altos costos de los equipos y gastos de mantenimiento continuos.
- Una disponibilidad limitada de profesionales capacitados y calificados capaces de realizar, validar e interpretar pruebas complejas de endotoxinas y pirógenos restringe aún más una penetración más amplia en el mercado.
- Las diferencias en la aplicación de las normas y las directrices de prueba entre países crean desafíos para lograr prácticas de prueba estandarizadas, especialmente para los fabricantes que operan en múltiples mercados globales.
- Superar estos desafíos mediante el desarrollo de soluciones de prueba rentables, iniciativas ampliadas de capacitación de la fuerza laboral y una mayor armonización regulatoria internacional será esencial para respaldar el crecimiento sostenido del mercado mundial de pruebas de endotoxinas y pirógenos.
Alcance del mercado de pruebas de endotoxinas y pirógenos en América del Norte
El mercado está segmentado según el tipo de producto, tipo de prueba, aplicación, método, modo de compra, producto final y usuario final.
- Por tipo de producto
Según el tipo de producto, el mercado de análisis de endotoxinas y pirógenos se segmenta en kits y reactivos de detección, instrumentos, sistemas y software, servicios de análisis de endotoxinas, y consumibles y accesorios. El segmento de kits y reactivos de detección dominó la mayor cuota de mercado con un 41,6 % en 2025, principalmente debido a su uso esencial y recurrente en los procesos de fabricación de productos farmacéuticos, biotecnológicos y de dispositivos médicos. Estos productos son necesarios en múltiples etapas, como el análisis de materias primas, los controles de calidad durante el proceso y las pruebas de liberación del producto final. Las autoridades reguladoras exigen kits y reactivos validados, lo que garantiza una demanda constante independientemente de la escala de producción. La alta frecuencia de análisis en entornos de fabricación estériles aumenta aún más el volumen de consumo. Los kits de detección son comparativamente rentables, lo que los hace accesibles tanto para laboratorios grandes como pequeños. La innovación continua, que mejora la sensibilidad y la especificidad, fortalece la adopción. La compatibilidad con múltiples métodos de análisis mejora la flexibilidad. La expansión global de la fabricación de fármacos inyectables impulsa el crecimiento de la demanda. El aumento de la producción de productos biológicos también contribuye significativamente. Las redes de proveedores consolidadas garantizan una disponibilidad ininterrumpida. La fuerte dependencia regulatoria asegura un dominio a largo plazo.
Se prevé que el segmento de sistemas y software experimente el crecimiento más rápido, con una tasa de crecimiento anual compuesta (TCAC) del 19,1 % entre 2026 y 2033, impulsado por la rápida adopción de herramientas de automatización de laboratorios y cumplimiento normativo digital. Los fabricantes farmacéuticos priorizan cada vez más las soluciones automatizadas para minimizar el error humano y mejorar la eficiencia de las pruebas. Las plataformas de software respaldan la integridad de los datos, los registros de auditoría y la documentación regulatoria. La integración con sistemas LIMS mejora la transparencia operativa. El creciente énfasis en los laboratorios inteligentes acelera la adopción. Los grandes fabricantes invierten fuertemente en la transformación digital. La automatización reduce el tiempo de respuesta para la liberación de lotes. Las inspecciones regulatorias priorizan cada vez más los registros digitales. Los sistemas basados en la nube mejoran la escalabilidad. La demanda es especialmente fuerte entre los directores de marketing (CMO). La creciente inversión en sistemas de calidad avanzados impulsa un crecimiento sostenido.
- Por tipo de prueba
Según el tipo de prueba, el mercado de pruebas de endotoxinas y pirógenos se segmenta en pruebas de lisado de amebocitos de Limulus (LAL), pruebas de TAL, pruebas de activación de monocitos (MAT), pruebas de pirógenos de conejo y análisis de factor C recombinante (RFC). El segmento de pruebas LAL obtuvo la mayor participación en los ingresos del mercado, con un 47,3 % en 2025, gracias a su amplia aceptación regulatoria en EE. UU., Europa y Asia. La prueba se utiliza ampliamente para medicamentos inyectables, vacunas y dispositivos médicos implantables. Su probada fiabilidad y sensibilidad impulsan su continua preferencia. Su disponibilidad en formatos de gel clot, cromogénico y turbidimétrico aumenta su versatilidad. Las compañías farmacéuticas confían en LAL para las pruebas rutinarias de lotes. Los protocolos establecidos reducen la complejidad de la validación. Un sólido historial de datos respalda el cumplimiento normativo. La disponibilidad de proveedores garantiza un acceso constante. La alta familiaridad entre los profesionales de laboratorio refuerza su posición dominante. Su rentabilidad en comparación con los métodos más nuevos facilita su adopción. La armonización global de normas respalda su uso.
Se espera que el segmento de análisis de factor C recombinante (RFC) crezca a la tasa de crecimiento anual compuesta (TCAC) más rápida, del 22,6 %, entre 2026 y 2033, impulsada por la transición global hacia métodos de prueba sin animales. Las preocupaciones éticas en torno a la pesca del cangrejo herradura impulsan su adopción. Las agencias reguladoras apoyan cada vez más los métodos alternativos. El RFC ofrece mayor especificidad y reproducibilidad. La menor variabilidad mejora la consistencia de los resultados. Los fabricantes biofarmacéuticos prefieren el RFC para terapias avanzadas. Un mejor rendimiento de los análisis aumenta la confianza. Los avances tecnológicos mejoran la sensibilidad. Las iniciativas de sostenibilidad aceleran la demanda. El creciente respaldo regulatorio fortalece la adopción. La expansión de la cartera de productos biológicos impulsa el crecimiento. Los beneficios ecológicos a largo plazo refuerzan la aceptación en el mercado.
- Por aplicación
Según su aplicación, el mercado de pruebas de endotoxinas y pirógenos se segmenta en fabricación farmacéutica, fabricación de dispositivos médicos, producción de materias primas y fabricación de envases. El segmento de fabricación farmacéutica dominó el mercado con una participación en los ingresos del 44,8 % en 2025, impulsado por estrictos requisitos de esterilidad y control de endotoxinas. Las pruebas de endotoxinas son obligatorias durante el desarrollo y la comercialización de fármacos. Los altos volúmenes de producción aumentan la frecuencia de las pruebas. El crecimiento de los fármacos inyectables y biológicos sustenta la demanda. Las inspecciones regulatorias garantizan el cumplimiento. Los protocolos de liberación de lotes requieren pruebas validadas. La expansión de las instalaciones de fabricación farmacéutica global impulsa la adopción. La monitorización continua de los procesos aumenta el uso de las pruebas. Una sólida supervisión regulatoria garantiza un dominio sostenido. Las operaciones a gran escala impulsan la demanda de volumen. La inversión en control de calidad fortalece el uso.
Se proyecta que el segmento de fabricación de dispositivos médicos crecerá a la tasa de crecimiento anual compuesta (TCAC) más rápida, del 19,8 %, entre 2026 y 2033, debido al aumento de la producción de dispositivos implantables e invasivos. El mayor escrutinio regulatorio exige pruebas de pirógenos. La expansión global de las exportaciones de dispositivos médicos impulsa la demanda. El crecimiento de los procedimientos mínimamente invasivos impulsa la expansión del mercado. Los estándares más estrictos de seguridad del paciente impulsan la adopción de pruebas. Los mercados emergentes aumentan la capacidad de fabricación. La armonización regulatoria mejora los requisitos de cumplimiento. Los materiales avanzados requieren pruebas rigurosas. El crecimiento de los mercados de dispositivos ortopédicos y cardiovasculares impulsa el crecimiento. El aumento de la subcontratación a CMO acelera la demanda de pruebas. La innovación en el diseño de dispositivos aumenta la complejidad de las pruebas.
- Por método
Según el método, el mercado de pruebas de endotoxinas y pirógenos se segmenta en pruebas de endotoxinas de coágulo de gel, pruebas cromogénicas de endotoxinas y pruebas turbidimétricas de endotoxinas. El segmento de pruebas de endotoxinas de coágulo de gel representó la mayor participación en los ingresos, con un 39,5 %, en 2025, gracias a su simplicidad y aceptación regulatoria. El método requiere una instrumentación mínima. Es rentable para pruebas de rutina. Se utiliza ampliamente en laboratorios pequeños y medianos. Los resultados cualitativos satisfacen los requisitos básicos de cumplimiento normativo. Su amplio historial de validación respalda la confianza. Su fácil interpretación fortalece la adopción. Es adecuado para pruebas de bajo volumen. Los requisitos mínimos de capacitación benefician a los laboratorios. Su rendimiento consistente garantiza la fiabilidad. Su amplio reconocimiento regulatorio mantiene su dominio.
Se prevé que el segmento de pruebas de endotoxinas cromogénicas crezca a la tasa de crecimiento anual compuesta (TCAC) más alta, del 20,9 %, entre 2026 y 2033, impulsada por la demanda de pruebas cuantitativas y de alta sensibilidad. Las compañías farmacéuticas prefieren la medición precisa de endotoxinas. La compatibilidad con la automatización mejora el rendimiento. Es adecuado para productos biológicos complejos. La mayor precisión facilita el cumplimiento normativo. La alta reproducibilidad reduce la variabilidad. El aumento de la producción de productos biológicos acelera su adopción. La integración con sistemas automatizados aumenta la eficiencia. Las formulaciones avanzadas requieren una detección sensible. El crecimiento de la fabricación a gran escala impulsa la demanda. Las mejoras tecnológicas mejoran el rendimiento.
- Por modo de compra
Según el modo de compra, el mercado de pruebas de endotoxinas y pirógenos se segmenta en grupos grandes, grupos medianos y pequeños, e individuales. El segmento de grupos grandes dominó el mercado con una participación en los ingresos del 48,3 % en 2025, impulsado por instituciones sanitarias consolidadas y grandes organizaciones farmacéuticas que requieren adquisiciones a gran escala para satisfacer la demanda de pruebas de alto volumen. Los grupos grandes se benefician de contratos a largo plazo con proveedores, economías de escala y procesos de validación optimizados. Las operaciones centralizadas de control de calidad y los ciclos de producción continuos requieren pruebas frecuentes. El estricto cumplimiento normativo y las auditorías rutinarias refuerzan la adopción de las pruebas. La alta capacidad de inversión permite el acceso a tecnologías de prueba avanzadas. La integración con laboratorios internos mejora la eficiencia y la precisión. El segmento también registra una demanda constante de empresas multinacionales con operaciones globales. Los procedimientos operativos estándar (POE) y los sistemas de gestión de calidad consolidados refuerzan su dominio.
Se espera que el segmento Individual experimente la tasa de crecimiento anual compuesta (TCAC) más rápida, del 19,4 %, entre 2026 y 2033, impulsada por la creciente adopción entre pequeñas empresas de biotecnología, startups e institutos de investigación. Las personas buscan cada vez más opciones de externalización para reducir la inversión de capital. El creciente número de ensayos clínicos realizados por entidades más pequeñas impulsa la demanda. La adopción se acelera gracias a modelos de servicio flexibles y pruebas a demanda. Una mayor concienciación regulatoria garantiza pruebas basadas en el cumplimiento normativo. La expansión de las líneas de productos biológicos y terapia celular y génica en pequeñas organizaciones impulsa el crecimiento. El acceso a pedidos digitales e informes optimizados aumenta el atractivo. Los mercados emergentes y el crecimiento de las startups contribuyen aún más a la expansión del mercado. Los clientes individuales suelen aprovechar los servicios de CRO/CMO, lo que aumenta la frecuencia de las pruebas.
- Por producto final
En función del producto final, el mercado de pruebas de endotoxinas y pirógenos se segmenta en vacunas y/o terapia celular y génica (CGT), productos biológicos, inyectables y otros. El segmento de productos biológicos dominó el mercado con una participación en los ingresos del 42,6 % en 2025, respaldado por el uso generalizado de productos biológicos en aplicaciones terapéuticas y los estrictos requisitos regulatorios para las pruebas de esterilidad y endotoxinas. La producción a gran escala de anticuerpos monoclonales, proteínas recombinantes y enzimas terapéuticas impulsa las pruebas rutinarias. Las auditorías regulatorias y los programas de garantía de calidad garantizan ciclos de prueba frecuentes. La alta inversión en I+D y ensayos clínicos refuerza la demanda. La presencia de fabricantes líderes de biotecnología facilita la adopción de métodos de prueba avanzados. La producción de productos biológicos requiere marcos sólidos de control de calidad para prevenir la contaminación. La infraestructura establecida en América del Norte y Europa fortalece el dominio. Las asociaciones con organizaciones de pruebas por contrato amplían el alcance. La adopción en el mercado se ve reforzada por una mayor concienciación sobre la seguridad de los productos biológicos.
Se anticipa que el segmento de Vacunas y/o Terapia Celular y Génica (TCG) experimentará la CAGR más rápida del 22,3% entre 2026 y 2033, impulsada por el desarrollo acelerado de nuevas vacunas y terapias celulares y génicas avanzadas. Las iniciativas de salud global, la preparación para pandemias y el aumento de los programas de inmunización aumentan la demanda de pruebas. Los productos TCG requieren pruebas de endotoxinas altamente sensibles debido a los complejos procesos de fabricación. La expansión de la medicina personalizada y las terapias dirigidas impulsa su adopción. La subcontratación a CRO y laboratorios especializados garantiza el cumplimiento. El enfoque regulatorio en productos medicinales de terapia avanzada impulsa el crecimiento. La innovación en tecnologías de ARNm y vectores virales impulsa el volumen. Las empresas biotecnológicas emergentes buscan activamente soluciones de pruebas de alto rendimiento. El aumento de la financiación para la I+D de vacunas respalda la expansión del mercado. La adopción de plataformas de pruebas automatizadas y rápidas acelera la eficiencia.
- Por el usuario final
En función del usuario final, el mercado de análisis de endotoxinas y pirógenos se segmenta en compañías farmacéuticas, biotecnológicas, biomédicas, de dispositivos médicos, CRO y CMO. Las compañías farmacéuticas dominaron el mercado con una participación en los ingresos del 45,7 % en 2025, gracias a sus exhaustivos controles de calidad internos. Los grandes volúmenes de fabricación aumentan la necesidad de realizar pruebas. Las auditorías regulatorias exigen una validación frecuente. La inversión en laboratorios internos refuerza el dominio. Los ciclos de producción continuos impulsan la demanda. Los altos estándares de cumplimiento exigen pruebas rutinarias. La expansión de la cartera de productos biológicos impulsa su uso. La sólida capacidad financiera facilita la adopción de pruebas avanzadas. La presencia global aumenta la escala de las pruebas. Los marcos de calidad consolidados refuerzan el dominio.
Se prevé que el segmento de CRO y CMO crezca a la tasa de crecimiento anual compuesta (TCAC) más alta, del 21,7 %, entre 2026 y 2033, impulsada por el aumento de las tendencias de externalización. Las compañías farmacéuticas buscan optimizar costes. La externalización de pruebas mejora la eficiencia. Las CMO amplían su capacidad global. El cumplimiento normativo impulsa la demanda de servicios. Las pequeñas empresas biotecnológicas confían en las CRO. La experiencia especializada facilita la adopción. El crecimiento de la fabricación por contrato acelera el volumen de pruebas. Los modelos de servicio flexibles atraen clientes. La expansión en los mercados emergentes impulsa el crecimiento. El aumento de la actividad de ensayos clínicos incrementa la demanda.
Análisis regional del mercado de pruebas de endotoxinas y pirógenos en América del Norte
- América del Norte dominó el mercado de pruebas de endotoxinas y pirógenos con una participación en los ingresos en constante expansión en 2025, impulsada por la creciente base de fabricación farmacéutica y biotecnológica en toda la región, junto con un énfasis regulatorio cada vez mayor en la seguridad del producto y el cumplimiento de la calidad.
- Los fabricantes de dispositivos médicos y farmacéuticos en América del Norte están adoptando cada vez más las pruebas de endotoxinas y pirógenos para cumplir con los estándares internacionales como USP, EP y JP, particularmente para medicamentos inyectables, productos biológicos y dispositivos médicos implantables.
- El crecimiento del mercado se ve respaldado además por el aumento del gasto en atención médica, la expansión de los laboratorios de pruebas contratados y el aumento de las inversiones en infraestructura de control de calidad, lo que posiciona las pruebas de endotoxinas y pirógenos como un componente crítico para garantizar la seguridad del paciente en toda la región.
Análisis del mercado estadounidense de pruebas de endotoxinas y pirógenos
El mercado estadounidense de pruebas de endotoxinas y pirógenos dominó el mercado norteamericano, con la mayor participación en los ingresos, de aproximadamente el 41,8 % en 2025. Este mercado se vio impulsado por su sólido ecosistema de fabricación farmacéutica y biotecnológica, la alta concentración de instalaciones reguladas por la FDA, las sólidas inversiones en I+D y la adopción generalizada de tecnologías avanzadas de pruebas de endotoxinas y pirógenos en la producción de fármacos, productos biológicos y dispositivos médicos. Los fabricantes recurren cada vez más a las pruebas de endotoxinas y pirógenos para cumplir con los estándares internacionales, garantizando así la seguridad de los fármacos inyectables, productos biológicos y dispositivos implantables. La creciente demanda de vacunas y productos biológicos impulsa aún más la adopción de estas pruebas. El mercado estadounidense se beneficia de una infraestructura de laboratorio avanzada, el suministro de reactivos e instrumentos de alta calidad y la colaboración con CRO globales. Las plataformas de pruebas automatizadas y la gestión digital de datos mejoran la precisión y reducen el error humano. Las inversiones en tecnologías de ensayo de alta sensibilidad y en métodos de prueba cromogénicos, de gel-clot y recombinantes refuerzan la fiabilidad. El mercado también experimenta un crecimiento gracias a las organizaciones de pruebas por contrato que atienden a múltiples empresas farmacéuticas y biotecnológicas. La aplicación de las normas garantiza la adopción consistente de protocolos de pruebas estandarizados, lo que refuerza a Estados Unidos como el principal contribuyente de ingresos en América del Norte.
Análisis del mercado canadiense de pruebas de endotoxinas y pirógenos
Se prevé que el mercado canadiense de pruebas de endotoxinas y pirógenos sea el de mayor crecimiento en Norteamérica durante el período de pronóstico, registrando una tasa de crecimiento anual compuesta (TCAC) estimada del 7,9 %. Este crecimiento se ve impulsado por la expansión de la capacidad de fabricación de productos biológicos y vacunas, el mayor apoyo gubernamental a las ciencias de la vida, la creciente subcontratación de empresas de pruebas por contrato y la creciente conformidad con los estándares regulatorios globales de calidad y seguridad. La expansión de la capacidad de fabricación nacional de biosimilares, vacunas y fármacos parenterales acelera la adopción de soluciones para pruebas de endotoxinas y pirógenos. Las empresas farmacéuticas y biotecnológicas canadienses están invirtiendo en plataformas de pruebas automatizadas y de alta sensibilidad. El mayor cumplimiento de las directrices de la FDA, la EMA y Health Canada garantiza la adopción constante de protocolos de prueba estandarizados. Las alianzas con CRO y CMO internacionales brindan acceso a tecnologías de prueba avanzadas. El creciente enfoque en la seguridad del paciente, el control de calidad y la automatización del laboratorio impulsa aún más el crecimiento. La innovación continua en métodos de análisis, informes digitales y gestión del flujo de trabajo mejora la eficiencia y la precisión. Las iniciativas de Canadá en materia de ciencias biológicas y sus inversiones en infraestructura de I+D posicionan al país como un mercado de alto crecimiento dentro del sector de pruebas de endotoxinas y pirógenos de América del Norte.
Cuota de mercado de pruebas de endotoxinas y pirógenos en América del Norte
La industria de pruebas de endotoxinas y pirógenos está liderada principalmente por empresas bien establecidas, entre las que se incluyen:
• Charles River Laboratories (EE. UU.)
• Lonza Group (Suiza)
• Thermo Fisher Scientific (EE. UU.)
• Merck KGaA (Alemania)
• Associates of Cape Cod (EE. UU.)
• WuXi AppTec (China )
• Eurofins Scientific (Luxemburgo)
• BioMérieux (Francia)
• ToxinSensor (EE. UU.)
• Hyglos GmbH (Alemania )
• Fujifilm Wako Chemicals (Japón)
• GenScript Biotech (China)
• Seikagaku Corporation (Japón)
• Pacific BioLabs (EE. UU .)
• Cambrex Corporation (EE. UU.)
• SGS SA (Suiza)
• Kinetic-QCL (EE. UU.)
• Nelson Laboratories (EE. UU.)
• RANDOX Laboratories (Reino Unido)
• Creative Diagnostics (EE. UU.)
Últimos avances en el mercado de pruebas de endotoxinas y pirógenos en América del Norte
- En abril de 2021, Associates of Cape Cod, Inc. lanzó su reactivo LAL recombinante PyroSmart NextGen, un producto sostenible para pruebas de endotoxinas bacterianas diseñado para mejorar la consistencia del ensayo y al mismo tiempo reducir la dependencia de materiales derivados de animales.
- En junio de 2021, la Comisión de la Farmacopea Europea anunció una medida regulatoria para eliminar la prueba de pirógenos de conejo de la Farmacopea Europea en un plazo de cinco años, recomendando alternativas como la Prueba de Activación de Monocitos (MAT) para cumplir con los estándares en evolución.
- En enero de 2024, FUJIFILM Wako Chemicals USA Corporation actualizó su cartera de reactivos de lisado de amebocitos de Limulus (LAL) para ofrecer mayor sensibilidad y menor variabilidad, mejorando la confiabilidad de las pruebas de endotoxinas en medicamentos parenterales y dispositivos médicos.
- En febrero de 2024, Charles River Laboratories presentó plataformas mejoradas de prueba de activación de monocitos (MAT) con integración de automatización, lo que aumenta el rendimiento y la reproducibilidad de los flujos de trabajo de detección de pirógenos en pruebas de terapia celular y productos biológicos.
- En marzo de 2024, Lonza Group amplió su oferta de pruebas de endotoxinas y pirógenos con el lanzamiento de un nuevo kit de análisis basado en factor C recombinante (rFC), en línea con las tendencias de la industria hacia métodos de prueba sostenibles y sin animales.
SKU-
Obtenga acceso en línea al informe sobre la primera nube de inteligencia de mercado del mundo
- Panel de análisis de datos interactivo
- Panel de análisis de empresas para oportunidades con alto potencial de crecimiento
- Acceso de analista de investigación para personalización y consultas
- Análisis de la competencia con panel interactivo
- Últimas noticias, actualizaciones y análisis de tendencias
- Aproveche el poder del análisis de referencia para un seguimiento integral de la competencia
Metodología de investigación
La recopilación de datos y el análisis del año base se realizan utilizando módulos de recopilación de datos con muestras de gran tamaño. La etapa incluye la obtención de información de mercado o datos relacionados a través de varias fuentes y estrategias. Incluye el examen y la planificación de todos los datos adquiridos del pasado con antelación. Asimismo, abarca el examen de las inconsistencias de información observadas en diferentes fuentes de información. Los datos de mercado se analizan y estiman utilizando modelos estadísticos y coherentes de mercado. Además, el análisis de la participación de mercado y el análisis de tendencias clave son los principales factores de éxito en el informe de mercado. Para obtener más información, solicite una llamada de un analista o envíe su consulta.
La metodología de investigación clave utilizada por el equipo de investigación de DBMR es la triangulación de datos, que implica la extracción de datos, el análisis del impacto de las variables de datos en el mercado y la validación primaria (experto en la industria). Los modelos de datos incluyen cuadrícula de posicionamiento de proveedores, análisis de línea de tiempo de mercado, descripción general y guía del mercado, cuadrícula de posicionamiento de la empresa, análisis de patentes, análisis de precios, análisis de participación de mercado de la empresa, estándares de medición, análisis global versus regional y de participación de proveedores. Para obtener más información sobre la metodología de investigación, envíe una consulta para hablar con nuestros expertos de la industria.
Personalización disponible
Data Bridge Market Research es líder en investigación formativa avanzada. Nos enorgullecemos de brindar servicios a nuestros clientes existentes y nuevos con datos y análisis que coinciden y se adaptan a sus objetivos. El informe se puede personalizar para incluir análisis de tendencias de precios de marcas objetivo, comprensión del mercado de países adicionales (solicite la lista de países), datos de resultados de ensayos clínicos, revisión de literatura, análisis de mercado renovado y base de productos. El análisis de mercado de competidores objetivo se puede analizar desde análisis basados en tecnología hasta estrategias de cartera de mercado. Podemos agregar tantos competidores sobre los que necesite datos en el formato y estilo de datos que esté buscando. Nuestro equipo de analistas también puede proporcionarle datos en archivos de Excel sin procesar, tablas dinámicas (libro de datos) o puede ayudarlo a crear presentaciones a partir de los conjuntos de datos disponibles en el informe.