North America Endotoxin And Pyrogen Testing Market
Taille du marché en milliards USD
TCAC :
% 
 USD
1,262.52 Billion
USD
2,628.58 Billion
2025
2033
USD
1,262.52 Billion
USD
2,628.58 Billion
2025
2033
| 2026 –2033 | |
| USD 1,262.52 Billion | |
| USD 2,628.58 Billion | |
|
|
|
|
Segmentation du marché nord-américain des tests d'endotoxines et de pyrogènes, par type de produit (kits et réactifs de détection, instruments, systèmes et logiciels, services de tests d'endotoxines, consommables et accessoires), type de test (test LAL, test TAL, test d'activation des monocytes, test de pyrogènes chez le lapin et dosage de la protéine C recombinante (RFC)), application (fabrication pharmaceutique, fabrication de dispositifs médicaux, production de matières premières et fabrication d'emballages), méthode (test d'endotoxines par coagulation en gel, test d'endotoxines chromogénique et test d'endotoxines turbidimétrique), mode d'achat (grands groupes, groupes moyens et petits, et particuliers), produit final (vaccins et/ou thérapies géniques, produits biologiques, produits injectables et autres), utilisateur final (entreprises pharmaceutiques, entreprises de biotechnologie, entreprises biomédicales, fabricants de dispositifs médicaux, organismes de recherche sous contrat (CRO) et organismes de fabrication sous contrat (CMO)) - Tendances du secteur et prévisions jusqu'en 2033
Taille du marché des tests d'endotoxines et de pyrogènes en Amérique du Nord
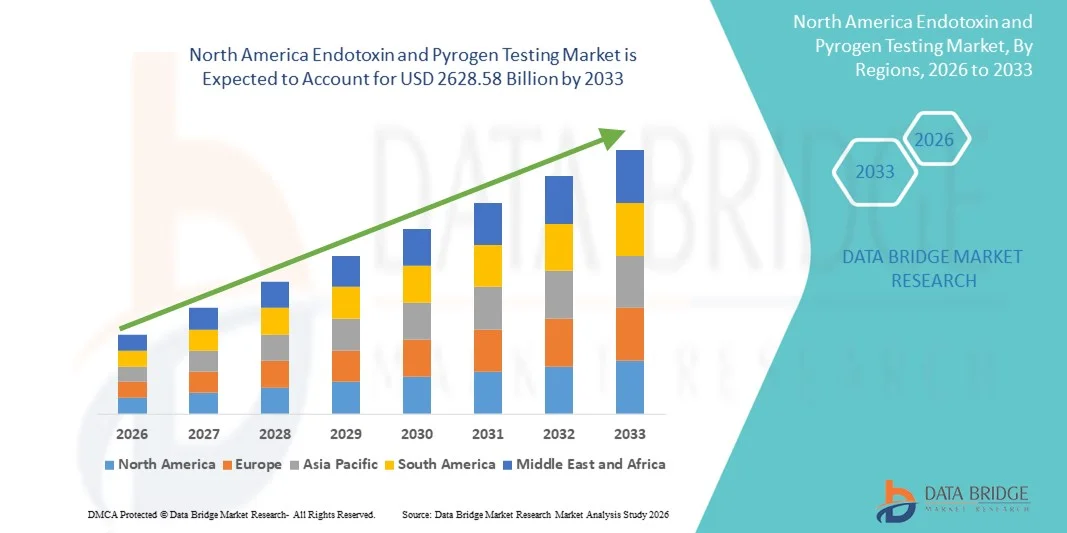
- Le marché nord-américain des tests d'endotoxines et de pyrogènes était évalué à 1 262,52 milliards de dollars américains en 2025 et devrait atteindre 2 628,58 milliards de dollars américains d'ici 2033 , soit un TCAC de 9,60 % au cours de la période de prévision.
- La croissance du marché est largement alimentée par l'importance accrue accordée à la sécurité des patients, les exigences réglementaires strictes et le renforcement des normes de contrôle de la qualité dans les secteurs pharmaceutique, biotechnologique et de la fabrication de dispositifs médicaux, ce qui conduit à une adoption plus large de solutions fiables de test des endotoxines et des pyrogènes dans les milieux cliniques et industriels.
- De plus, la demande croissante de méthodes de test rapides, précises et conformes, ainsi que les progrès réalisés dans les technologies de test des pyrogènes recombinants et alternatifs, positionnent les tests d'endotoxines et de pyrogènes comme un élément essentiel des systèmes modernes d'assurance qualité, stimulant ainsi considérablement la croissance globale du secteur.
Analyse du marché des tests d'endotoxines et de pyrogènes en Amérique du Nord
- Les solutions de test d'endotoxines et de pyrogènes jouent un rôle crucial pour garantir la sécurité des produits pharmaceutiques, des produits biologiques et des dispositifs médicaux, car elles permettent de détecter les toxines bactériennes nocives susceptibles de provoquer des réactions indésirables chez les patients. Elles constituent ainsi un élément essentiel du contrôle qualité et de la conformité réglementaire dans les environnements cliniques et industriels.
- La demande croissante de tests d'endotoxines et de pyrogènes est principalement due à des directives réglementaires plus strictes, à l'augmentation de la production de médicaments injectables et de produits biologiques, et à une sensibilisation accrue à la sécurité des patients, ainsi qu'à une transition progressive vers des méthodes de test avancées et sans animaux telles que les tests du facteur C recombinant (rFC).
- Les États-Unis ont dominé le marché des tests d'endotoxines et de pyrogènes, représentant la plus grande part de revenus (environ 41,8 %) en 2025. Cette domination s'explique par un écosystème de production pharmaceutique et biotechnologique solide, une forte concentration d'installations réglementées par la FDA, des investissements importants en R&D et une adoption généralisée des technologies de pointe en matière de tests d'endotoxines et de pyrogènes dans la production de médicaments, de produits biologiques et de dispositifs médicaux.
- Le Canada devrait connaître la croissance la plus rapide sur le marché des tests d'endotoxines et de pyrogènes au cours de la période de prévision, avec un TCAC estimé à environ 7,9 %. Cette croissance est soutenue par l'expansion des capacités de production de produits biologiques et de vaccins, le renforcement du soutien gouvernemental aux sciences de la vie, la hausse du recours à l'externalisation auprès d'organismes de tests sous contrat et l'harmonisation croissante avec les normes réglementaires internationales en matière de qualité et de sécurité.
- Le segment des grands groupes a dominé le marché avec une part de revenus de 48,3 % en 2025, grâce aux établissements de santé établis et aux grandes entreprises pharmaceutiques qui ont besoin d'achats en gros pour répondre à la demande croissante de tests.
Portée du rapport et segmentation du marché des tests d'endotoxines et de pyrogènes
|
Attributs |
Analyses clés du marché des tests d'endotoxines et de pyrogènes |
|
Segments couverts |
|
|
Pays couverts |
Amérique du Nord
|
|
Acteurs clés du marché |
• Charles River Laboratories (États-Unis) |
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
En plus des informations sur les scénarios de marché tels que la valeur du marché, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché élaborés par Data Bridge Market Research comprennent également une analyse approfondie par des experts, l'épidémiologie des patients, l'analyse du pipeline, l'analyse des prix et le cadre réglementaire. |
Tendances du marché des tests d'endotoxines et de pyrogènes en Amérique du Nord
Adoption croissante des méthodes avancées de détection des endotoxines et des pyrogènes
- Une tendance significative et croissante sur le marché des tests d'endotoxines et de pyrogènes est l'adoption accrue de méthodes de détection avancées, notamment les tests microbiologiques rapides et les dosages du facteur C recombinant (rFC), afin d'améliorer la précision des tests et les délais d'obtention des résultats.
- Par exemple, en 2023, plusieurs fabricants pharmaceutiques brésiliens ont étendu l'utilisation des tests d'endotoxines basés sur le facteur C recombinant afin de se conformer aux exigences réglementaires mondiales tout en réduisant leur dépendance aux tests LAL traditionnels.
- Les laboratoires de toute la région s'efforcent d'améliorer l'efficacité et la sensibilité des tests afin de garantir la sécurité des produits pharmaceutiques, biologiques et des dispositifs médicaux.
- Le passage à des méthodes de test alternatives et durables gagne également du terrain en raison de préoccupations éthiques et d'incitations réglementaires.
- Cette tendance remodèle les pratiques de contrôle de la qualité en Amérique du Sud, favorisant une production de médicaments plus sûre et une meilleure préparation à l'exportation vers les marchés internationaux.
Dynamique du marché des tests d'endotoxines et de pyrogènes en Amérique du Nord
Conducteur
Développement des activités de fabrication de produits pharmaceutiques et biologiques
- L'expansion constante des activités de fabrication de produits pharmaceutiques, biotechnologiques et de dispositifs médicaux en Amérique du Sud, en phase avec les tendances mondiales de production, est un facteur clé qui accélère la demande de solutions de test d'endotoxines et de pyrogènes.
- Par exemple, en 2024, un important fabricant brésilien de produits biologiques a étendu ses capacités internes de tests d'endotoxines afin de soutenir la production à grande échelle de vaccins injectables et de biosimilaires destinés à la fois au marché national et aux marchés internationaux.
- Les exigences réglementaires harmonisées à l'échelle mondiale, qui mettent l'accent sur l'assurance de la stérilité et la sécurité des patients, imposent des tests de routine pour les endotoxines et les pyrogènes tout au long des phases de développement, de fabrication clinique et de production commerciale des médicaments.
- L'augmentation des investissements publics et privés dans les infrastructures de santé, la recherche en sciences de la vie et la production pharmaceutique locale, tant dans les économies émergentes que développées, renforce encore la demande de solutions de test fiables et validées.
- L'augmentation des exportations de produits pharmaceutiques et biologiques d'Amérique du Nord vers des marchés réglementés comme l'Amérique du Nord et l'Europe exige le strict respect des normes internationales de qualité et de sécurité, renforçant ainsi l'adoption de protocoles de tests d'endotoxines et de pyrogènes.
Retenue/Défi
Coûts de test élevés et expertise technique limitée
- Les coûts d'investissement et d'exploitation élevés associés aux systèmes de test avancés d'endotoxines et de pyrogènes continuent de constituer une contrainte importante, en particulier pour les petits et moyens laboratoires en Amérique du Nord et dans d'autres régions du monde sensibles aux coûts.
- Par exemple, plusieurs laboratoires d'essais sous contrat en Argentine ont signalé des retards dans l'adoption de technologies de test rapides et alternatives en raison de contraintes budgétaires, du coût élevé des équipements et des frais de maintenance continus.
- La disponibilité limitée de professionnels qualifiés et formés, capables de réaliser, de valider et d'interpréter des tests complexes d'endotoxines et de pyrogènes, restreint davantage la pénétration du marché.
- Les différences en matière d'application de la réglementation et de directives d'essai d'un pays à l'autre créent des difficultés pour parvenir à des pratiques d'essai standardisées, en particulier pour les fabricants opérant sur plusieurs marchés mondiaux.
- Le dépassement de ces défis, grâce au développement de solutions de test rentables, à l'expansion des initiatives de formation de la main-d'œuvre et à une plus grande harmonisation réglementaire internationale, sera essentiel pour soutenir la croissance durable du marché mondial des tests d'endotoxines et de pyrogènes.
Portée du marché des tests d'endotoxines et de pyrogènes en Amérique du Nord
Le marché est segmenté en fonction du type de produit, du type de test, de l'application, de la méthode, du mode d'achat, du produit final et de l'utilisateur final.
- Par type de produit
Le marché des tests d'endotoxines et de pyrogènes est segmenté, selon le type de produit, en kits et réactifs de détection, instruments, systèmes et logiciels, services de test d'endotoxines, et consommables et accessoires. Le segment des kits et réactifs de détection représentait la plus grande part de marché (41,6 %) en 2025, principalement grâce à son utilisation essentielle et récurrente dans les processus de fabrication pharmaceutique, biotechnologique et de dispositifs médicaux. Ces produits sont requis à plusieurs étapes, notamment pour le contrôle des matières premières, les contrôles qualité en cours de production et les tests de libération du produit fini. Les autorités réglementaires imposent des kits et réactifs validés, garantissant une demande constante quelle que soit l'échelle de production. La fréquence élevée des tests en environnement de fabrication stérile accroît encore les volumes de consommation. Les kits de détection sont relativement économiques, ce qui les rend accessibles aux laboratoires de toutes tailles. L'innovation continue, qui améliore la sensibilité et la spécificité, favorise leur adoption. La compatibilité avec de multiples méthodes de test renforce la flexibilité. L'expansion mondiale de la fabrication de médicaments injectables soutient la croissance de la demande. L'augmentation de la production de produits biologiques y contribue également de manière significative. Des réseaux de fournisseurs établis garantissent une disponibilité continue. Une forte dépendance à la réglementation assure une position dominante à long terme.
Le segment des systèmes et logiciels devrait connaître la croissance la plus rapide, avec un TCAC de 19,1 % entre 2026 et 2033, portée par l'adoption rapide de l'automatisation des laboratoires et des outils de conformité numérique. Les fabricants pharmaceutiques privilégient de plus en plus les solutions automatisées pour minimiser les erreurs humaines et améliorer l'efficacité des tests. Les plateformes logicielles garantissent l'intégrité des données, les pistes d'audit et la documentation réglementaire. L'intégration avec les systèmes LIMS renforce la transparence opérationnelle. L'importance croissante accordée aux laboratoires intelligents accélère l'adoption de ces solutions. Les grands fabricants investissent massivement dans la transformation numérique. L'automatisation réduit les délais de libération des lots. Les inspections réglementaires privilégient de plus en plus les enregistrements numériques. Les systèmes basés sur le cloud améliorent l'évolutivité. La demande est particulièrement forte de la part des CMO (Contract Manufacturing Organizations). L'augmentation des investissements dans les systèmes de qualité avancés soutient une croissance durable.
- Par type de test
Le marché des tests d'endotoxines et de pyrogènes est segmenté, selon le type de test, en test LAL (Limulus Amoebocyte Lysate), test TAL (Limulus Amoebocyte Lysate), test d'activation des monocytes (MAT), test de pyrogènes chez le lapin et dosage du facteur C recombinant (RFC). En 2025, le segment du test LAL détenait la plus grande part de marché (47,3 %), grâce à son acceptation réglementaire de longue date aux États-Unis, en Europe et en Asie. Ce test est largement utilisé pour les médicaments injectables, les vaccins et les dispositifs médicaux implantables. Sa fiabilité et sa sensibilité éprouvées expliquent sa popularité constante. Disponible sous forme de gel-coagulant, chromogénique et turbidimétrique, il offre une grande polyvalence. Les entreprises pharmaceutiques font confiance au test LAL pour les contrôles de lots de routine. Des protocoles établis simplifient la validation. Des données historiques solides garantissent la conformité. La disponibilité des fournisseurs assure un accès constant. La grande familiarité des professionnels de laboratoire avec ce test renforce sa position dominante. Son rapport coût-efficacité par rapport aux méthodes plus récentes favorise son adoption. L'harmonisation mondiale des normes soutient son utilisation.
Le segment des tests de facteur C recombinant (RFC) devrait connaître la croissance annuelle composée la plus rapide, soit 22,6 %, entre 2026 et 2033, portée par l'adoption croissante de méthodes de test sans animaux à l'échelle mondiale. Les préoccupations éthiques liées à la collecte de limules favorisent cette adoption. Les organismes de réglementation soutiennent de plus en plus les méthodes alternatives. Le RFC offre une spécificité et une reproductibilité accrues. La réduction de la variabilité améliore la cohérence des résultats. Les fabricants de produits biopharmaceutiques privilégient le RFC pour les thérapies innovantes. L'amélioration des performances des tests renforce la confiance. Les progrès technologiques améliorent la sensibilité. Les initiatives de développement durable accélèrent la demande. L'approbation croissante des autorités réglementaires favorise l'adoption. L'expansion des portefeuilles de produits biologiques soutient la croissance. Les avantages écologiques à long terme renforcent l'acceptation du marché.
- Sur demande
Selon l'application, le marché des tests d'endotoxines et de pyrogènes est segmenté en fabrication pharmaceutique, fabrication de dispositifs médicaux, production de matières premières et fabrication d'emballages. Le segment de la fabrication pharmaceutique dominait le marché avec une part de revenus de 44,8 % en 2025, grâce à des exigences strictes de stérilité et de contrôle des endotoxines. Les tests d'endotoxines sont obligatoires tout au long du développement et de la commercialisation des médicaments. Les volumes de production élevés augmentent la fréquence des tests. La croissance des médicaments injectables et biologiques soutient la demande. Les inspections réglementaires garantissent la conformité. Les protocoles de libération des lots exigent des tests validés. L'expansion des sites de production pharmaceutique à l'échelle mondiale stimule l'adoption de ces tests. La surveillance continue des processus accroît leur utilisation. Un contrôle réglementaire rigoureux assure une position dominante durable. Les opérations à grande échelle génèrent une forte demande. L'investissement dans l'assurance qualité renforce l'utilisation de ces tests.
Le secteur de la fabrication de dispositifs médicaux devrait connaître la croissance annuelle composée la plus rapide (19,8 %) entre 2026 et 2033, grâce à l'augmentation de la production de dispositifs implantables et invasifs. Le renforcement du contrôle réglementaire impose des tests de pyrogénicité. L'expansion mondiale des exportations de dispositifs médicaux stimule la demande. Le développement des interventions mini-invasives favorise la croissance du marché. Des normes de sécurité des patients plus strictes encouragent l'adoption des tests. Les marchés émergents augmentent les capacités de production. L'harmonisation réglementaire améliore les exigences de conformité. Les matériaux avancés nécessitent des tests rigoureux. La croissance des marchés des dispositifs orthopédiques et cardiovasculaires soutient la croissance. Le recours accru à l'externalisation auprès des CMO (Contract Manufacturing Organizations) accélère la demande de tests. L'innovation dans la conception des dispositifs accroît la complexité des tests.
- Par méthode
Le marché des tests d'endotoxines et de pyrogènes est segmenté, selon la méthode utilisée, en tests d'endotoxines par coagulation en gel, tests chromogéniques et tests turbidimétriques. En 2025, le segment des tests d'endotoxines par coagulation en gel représentait la plus grande part de revenus (39,5 %), grâce à sa simplicité et à son acceptation réglementaire. Cette méthode nécessite un minimum d'instrumentation et est rentable pour les analyses de routine. Largement utilisée dans les petits et moyens laboratoires, elle fournit des résultats qualitatifs répondant aux exigences de conformité de base. Son historique de validation étendu inspire confiance et sa facilité d'interprétation favorise son adoption. Adaptée aux analyses à faible volume, elle requiert une formation minimale, ce qui est un avantage pour les laboratoires. Ses performances constantes garantissent sa fiabilité et sa large reconnaissance réglementaire lui assure une position dominante.
Le segment des tests chromogéniques d'endotoxines devrait connaître la croissance annuelle composée la plus rapide (20,9 %) entre 2026 et 2033, portée par la demande de tests quantitatifs et ultrasensibles. Les entreprises pharmaceutiques privilégient une mesure précise des endotoxines. La compatibilité avec l'automatisation améliore le débit. Ce test est adapté aux produits biologiques complexes. Une précision accrue favorise la conformité réglementaire. Une reproductibilité élevée réduit la variabilité. L'augmentation de la production de produits biologiques accélère son adoption. L'intégration aux systèmes automatisés renforce l'efficacité. Les formulations avancées nécessitent une détection sensible. La croissance de la production à grande échelle soutient la demande. Les progrès technologiques améliorent les performances.
- Par mode d'achat
Selon le mode d'achat, le marché des tests d'endotoxines et de pyrogènes se segmente en trois catégories : grands groupes, groupes de taille moyenne et petits, et particuliers. Le segment des grands groupes a dominé le marché en 2025, avec une part de revenus de 48,3 %. Cette domination est due aux établissements de santé et aux grandes entreprises pharmaceutiques qui nécessitent des achats en gros pour répondre à leurs importants besoins en tests. Les grands groupes bénéficient de contrats fournisseurs à long terme, d'économies d'échelle et de processus de validation rationalisés. La centralisation des opérations de contrôle qualité et les cycles de production continus exigent des tests fréquents. Le respect rigoureux des réglementations et les audits réguliers favorisent l'adoption des tests. Une capacité d'investissement élevée permet l'accès à des technologies de pointe. L'intégration avec les laboratoires internes améliore l'efficacité et la précision. Ce segment bénéficie également d'une demande constante de la part des multinationales présentes à l'international. Des procédures opérationnelles standardisées (SOP) et des systèmes de gestion de la qualité bien établis renforcent sa position dominante.
Le segment des particuliers devrait connaître le taux de croissance annuel composé (TCAC) le plus rapide, soit 19,4 %, entre 2026 et 2033, porté par l'adoption croissante de ces solutions par les petites entreprises de biotechnologie, les startups et les instituts de recherche. Les particuliers recherchent de plus en plus des solutions d'externalisation pour réduire leurs dépenses d'investissement. La multiplication des essais cliniques menés par les petites structures alimente la demande. L'adoption est accélérée par la flexibilité des modèles de service et les tests à la demande. Une meilleure sensibilisation aux réglementations garantit des tests conformes. Le développement des produits biologiques et des thérapies cellulaires et géniques au sein des petites organisations soutient la croissance. L'accès à la commande numérique et à des rapports simplifiés renforce l'attractivité du marché. Les marchés émergents et la croissance des startups contribuent également à son expansion. Les clients particuliers font souvent appel aux services des CRO/CMO, ce qui augmente la fréquence des tests.
- Par produit final
Le marché des tests d'endotoxines et de pyrogènes est segmenté, selon le produit final, en vaccins et/ou thérapie cellulaire et génique (TCG), produits biologiques, produits injectables et autres. Le segment des produits biologiques a dominé le marché en 2025, représentant 42,6 % des revenus. Cette domination s'explique par l'utilisation généralisée des produits biologiques dans les applications thérapeutiques et par les exigences réglementaires strictes en matière de stérilité et de tests d'endotoxines. La production à grande échelle d'anticorps monoclonaux, de protéines recombinantes et d'enzymes thérapeutiques stimule les tests de routine. Les audits réglementaires et les programmes d'assurance qualité garantissent des cycles de tests fréquents. Les investissements importants en R&D et en essais cliniques renforcent la demande. La présence de grands fabricants de biotechnologies facilite l'adoption de méthodes de test avancées. La production de produits biologiques exige des cadres de contrôle qualité rigoureux afin de prévenir toute contamination. Une infrastructure établie en Amérique du Nord et en Europe consolide la position dominante du marché. Les partenariats avec des organismes de tests sous contrat étendent la portée du marché. L'adoption de ces tests est également favorisée par une sensibilisation accrue à la sécurité des produits biologiques.
Le segment des vaccins et/ou des thérapies cellulaires et géniques (TCG) devrait connaître le taux de croissance annuel composé (TCAC) le plus rapide, à 22,3 %, entre 2026 et 2033, grâce à l'accélération du développement de nouveaux vaccins et de thérapies cellulaires et géniques avancées. Les initiatives mondiales de santé, la préparation aux pandémies et la multiplication des programmes de vaccination accroissent la demande de tests. Les produits TCG nécessitent des tests d'endotoxines très sensibles en raison de la complexité de leurs procédés de fabrication. Le développement de la médecine personnalisée et des thérapies ciblées stimule l'adoption de ces technologies. L'externalisation auprès d'organismes de recherche sous contrat (CRO) et de laboratoires spécialisés garantit la conformité. L'attention portée par les autorités réglementaires aux médicaments de thérapie innovante favorise la croissance. L'innovation dans les technologies d'ARNm et de vecteurs viraux stimule les volumes. Les entreprises de biotechnologie émergentes recherchent activement des solutions de tests à haut débit. L'augmentation des financements alloués à la R&D des vaccins soutient l'expansion du marché. L'adoption de plateformes de tests automatisées et rapides améliore l'efficacité.
- Par l'utilisateur final
Le marché des tests d'endotoxines et de pyrogènes est segmenté, selon l'utilisateur final, en entreprises pharmaceutiques, biotechnologiques, biomédicales, de dispositifs médicaux, CRO et CMO. Les entreprises pharmaceutiques dominaient le marché en 2025, avec une part de revenus de 45,7 %, grâce à leurs importants processus de contrôle qualité internes. Les volumes de production élevés augmentent les besoins en tests. Les audits réglementaires exigent des validations fréquentes. L'investissement dans des laboratoires internes renforce leur position dominante. Les cycles de production continus stimulent la demande. Des normes de conformité élevées imposent des tests de routine. Le développement des produits biologiques favorise leur utilisation. Une solide capacité financière permet l'adoption de tests avancés. Une présence mondiale accroît l'échelle des tests. Des cadres de qualité établis consolident leur position dominante.
Le segment des CRO et CMO devrait connaître la croissance annuelle composée la plus rapide, à 21,7 %, entre 2026 et 2033, portée par l'externalisation croissante. Les entreprises pharmaceutiques recherchent l'optimisation des coûts. L'externalisation des tests améliore l'efficacité. Les CMO développent leurs capacités mondiales. La conformité réglementaire stimule la demande de services. Les petites entreprises de biotechnologie font appel aux CRO. L'expertise spécialisée favorise l'adoption de ces services. La croissance de la fabrication à façon accélère l'augmentation des volumes de tests. La flexibilité des modèles de services attire les clients. L'expansion sur les marchés émergents soutient la croissance. L'augmentation des essais cliniques accroît la demande.
Analyse régionale du marché des tests d'endotoxines et de pyrogènes en Amérique du Nord
- L'Amérique du Nord a dominé le marché des tests d'endotoxines et de pyrogènes en 2025, avec une part de revenus en constante augmentation. Cette croissance est due à l'essor des industries pharmaceutiques et biotechnologiques dans la région, ainsi qu'à un renforcement des réglementations en matière de sécurité et de qualité des produits.
- Les fabricants de produits pharmaceutiques et de dispositifs médicaux en Amérique du Nord adoptent de plus en plus les tests d'endotoxines et de pyrogènes pour se conformer aux normes internationales telles que l'USP, l'EP et la JP, notamment pour les médicaments injectables, les produits biologiques et les dispositifs médicaux implantables.
- La croissance du marché est également soutenue par l'augmentation des dépenses de santé, l'expansion des laboratoires d'analyse sous contrat et l'accroissement des investissements dans les infrastructures de contrôle de la qualité, ce qui positionne les tests d'endotoxines et de pyrogènes comme un élément essentiel pour garantir la sécurité des patients dans toute la région.
Analyse du marché américain des tests d'endotoxines et de pyrogènes
Le marché américain des tests d'endotoxines et de pyrogènes a dominé le marché nord-américain en 2025, avec une part de revenus d'environ 41,8 %. Cette domination s'explique par un écosystème de production pharmaceutique et biotechnologique solide, une forte concentration d'établissements réglementés par la FDA, des investissements importants en R&D et une adoption généralisée des technologies de pointe en matière de tests d'endotoxines et de pyrogènes dans la production de médicaments, de produits biologiques et de dispositifs médicaux. Les fabricants s'appuient de plus en plus sur ces tests pour se conformer aux normes internationales et garantir la sécurité des médicaments injectables, des produits biologiques et des dispositifs implantables. La demande croissante de vaccins et de produits biologiques stimule également l'adoption de ces tests. Le marché américain bénéficie d'infrastructures de laboratoire avancées, d'un approvisionnement en réactifs et instruments de haute qualité et d'une collaboration avec des CRO internationales. Les plateformes de test automatisées et la gestion numérique des données améliorent la précision et réduisent les erreurs humaines. Les investissements dans les technologies d'analyse à haute sensibilité et les méthodes de test chromogéniques, de coagulation sur gel et recombinantes renforcent la fiabilité. Le marché connaît également une croissance grâce aux organismes de tests sous contrat qui travaillent pour de nombreuses entreprises pharmaceutiques et biotechnologiques. L’application de la réglementation garantit l’adoption uniforme des protocoles de test normalisés, renforçant ainsi le rôle des États-Unis en tant que principal contributeur aux revenus en Amérique du Nord.
Aperçu du marché canadien des tests d'endotoxines et de pyrogènes
Le marché canadien des tests d'endotoxines et de pyrogènes devrait connaître la croissance la plus rapide en Amérique du Nord au cours de la période de prévision, avec un TCAC estimé à 7,9 %. Cette croissance est alimentée par l'expansion des capacités de production de produits biologiques et de vaccins, le soutien gouvernemental croissant aux sciences de la vie, le recours accru à l'externalisation auprès d'organismes de tests sous contrat et l'harmonisation croissante avec les normes réglementaires internationales en matière de qualité et de sécurité. L'expansion des capacités de production nationales de biosimilaires, de vaccins et de médicaments parentéraux accélère l'adoption des solutions de tests d'endotoxines et de pyrogènes. Les entreprises pharmaceutiques et biotechnologiques canadiennes investissent dans des plateformes de tests automatisées et à haute sensibilité. Le respect accru des directives de la FDA, de l'EMA et de Santé Canada garantit l'adoption uniforme de protocoles de tests standardisés. Les partenariats avec des CRO et des CMO internationaux donnent accès à des technologies de pointe. L'accent mis sur la sécurité des patients, l'assurance qualité et l'automatisation des laboratoires contribue également à cette croissance. L'innovation continue dans les méthodes d'analyse, la production de rapports numériques et la gestion des flux de travail améliore l'efficacité et la précision. Les initiatives du Canada en sciences de la vie et ses investissements dans les infrastructures de recherche et développement le positionnent comme un marché à forte croissance au sein du secteur des tests d'endotoxines et de pyrogènes en Amérique du Nord.
Part de marché des tests d'endotoxines et de pyrogènes en Amérique du Nord
Le secteur des tests d'endotoxines et de pyrogènes est principalement dominé par des entreprises bien établies, notamment :
• Charles River Laboratories (États-Unis)
• Lonza Group (Suisse)
• Thermo Fisher Scientific (États-Unis)
• Merck KGaA (Allemagne)
• Associates of Cape Cod (États-Unis)
• WuXi AppTec (Chine )
• Eurofins Scientific (Luxembourg)
• BioMérieux (France)
• ToxinSensor (États-Unis)
• Hyglos GmbH (Allemagne)
• Fujifilm Wako Chemicals (Japon)
• GenScript Biotech (Chine)
• Seikagaku Corporation (Japon)
• Pacific BioLabs (États-Unis)
• Cambrex Corporation (États-Unis)
• SGS SA (Suisse)
• Kinetic-QCL (États-Unis)
• Nelson Laboratories (États- Unis)
• RANDOX Laboratories (Royaume-Uni)
• Creative Diagnostics (États-Unis)
Dernières évolutions du marché nord-américain des tests d'endotoxines et de pyrogènes
- En avril 2021, Associates of Cape Cod, Inc. a lancé son réactif LAL recombinant PyroSmart NextGen, un produit de test d'endotoxines bactériennes durable conçu pour améliorer la cohérence des analyses tout en réduisant la dépendance aux matières premières d'origine animale.
- En juin 2021, la Commission de la Pharmacopée européenne a annoncé une mesure réglementaire visant à supprimer le test de pyrogénicité chez le lapin de la Ph. Eur. d'ici cinq ans, recommandant des alternatives telles que le test d'activation des monocytes (MAT) pour se conformer aux normes en constante évolution.
- En janvier 2024, FUJIFILM Wako Chemicals USA Corporation a amélioré sa gamme de réactifs LAL (Limulus Amebocyte Lysate) afin d'accroître la sensibilité et de réduire la variabilité, renforçant ainsi la fiabilité des tests d'endotoxines dans les médicaments parentéraux et les dispositifs médicaux.
- En février 2024, Charles River Laboratories a lancé des plateformes de test d'activation des monocytes (MAT) améliorées, intégrant l'automatisation, ce qui a permis d'accroître le débit et la reproductibilité des flux de travail de détection des pyrogènes dans les tests de produits biologiques et de thérapie cellulaire.
- En mars 2024, le groupe Lonza a élargi son offre de tests d'endotoxines et de pyrogènes en lançant un nouveau kit de dosage basé sur le facteur C recombinant (rFC), s'alignant ainsi sur les tendances du secteur en faveur de méthodes de test durables et sans animaux.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.