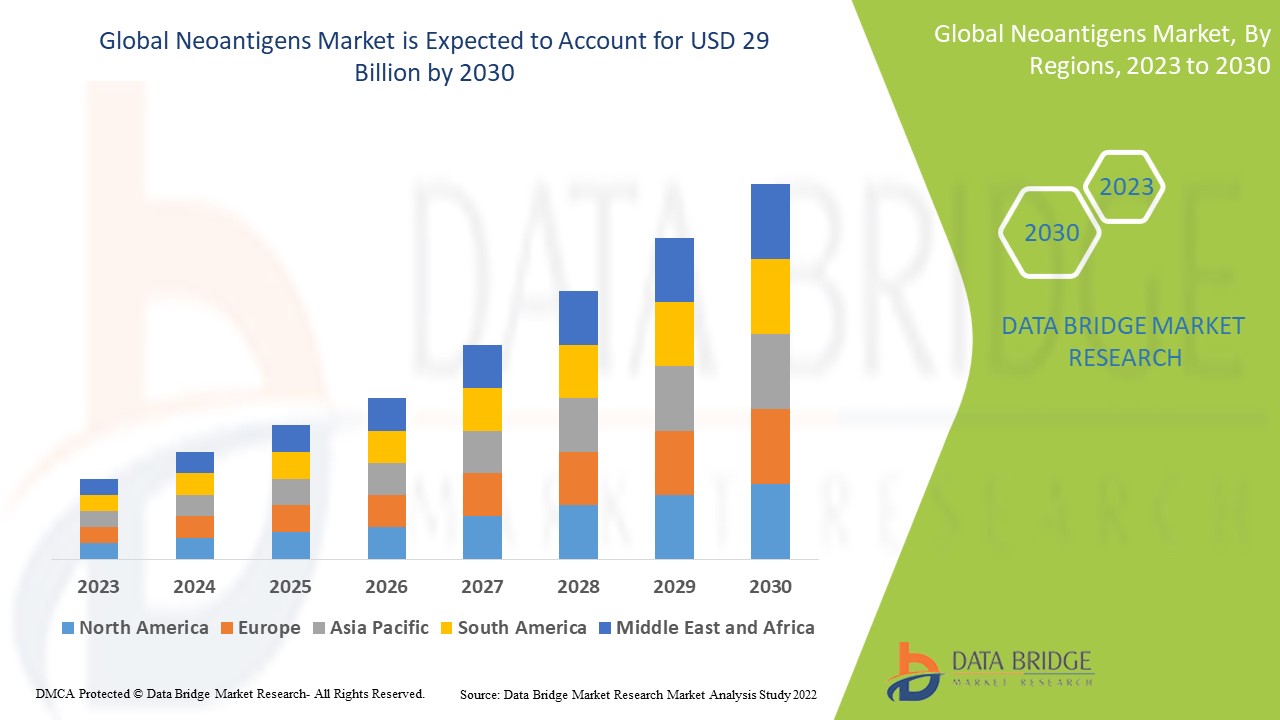
Global Neoantigens Market
市场规模(十亿美元)
CAGR :
% 
 USD
2.62 Billion
USD
29.00 Billion
2022
2030
USD
2.62 Billion
USD
29.00 Billion
2022
2030
| 2023 –2030 | |
| USD 2.62 Billion | |
| USD 29.00 Billion | |
|
|
|
|
全球腫瘤新抗原市場,依治療方法(聯合療法和單一療法)、治療專科(肺癌、泌尿系統癌症、黑色素瘤、肝癌、頭頸癌、血液和骨髓癌)、治療路線(一線、二線和後續線)、最終用戶(醫院、家庭護理、專科中心、其他)、分銷渠道(醫院藥房、網上藥房、零售藥房 2030 年階段。
腫瘤新抗原市場分析及規模
癌症發生率的上升給全球醫療保健系統帶來了巨大壓力。根據世界衛生組織 (WHO) 的數據,2019 年,癌症是 183 個國家 70 歲以下人口的主要死因,並在 123 個國家中位列第四大死因。近期生物技術的臨床進展以及對腫瘤新抗原及其相關機制研究的投入不斷增加,預計將推動全球腫瘤新抗原市場的成長。
數據橋市場研究公司 (Data Bridge Market Research) 分析了 2023-2030 年預測期內全球腫瘤新生抗原市場的成長率。預計在上述預測期內,全球腫瘤新生抗原市場的複合年增長率約為 35.00%。 2022 年,該市場價值為 26.2 億美元,到 2030 年將成長至 290 億美元。除了市場價值、成長率、細分市場、地理覆蓋範圍、市場參與者和市場情景等市場洞察外,數據橋市場研究團隊整理的市場報告還包含深入的專家分析、患者流行病學、產品線分析、定價分析和監管框架。
腫瘤新抗原市場範圍和細分
|
報告指標 |
細節 |
|
預測期 |
2023年至2030年 |
|
基準年 |
2022 |
|
歷史歲月 |
2021(可自訂為 2015 - 2020 年) |
|
定量單位 |
收入(十億美元)、銷售(單位)、定價(美元) |
|
涵蓋的領域 |
治療(合併療法和單一療法)、治療專科(肺癌、泌尿系統癌症、黑色素瘤、肝癌、頭頸癌、血液和骨髓癌)、治療線(一線、二線和後續線)、最終用戶(醫院、家庭護理、專科中心、其他)、分銷渠道(醫院藥房、網上藥房、零售藥房) |
|
覆蓋國家 |
北美洲的美國、加拿大和墨西哥、德國、法國、英國、荷蘭、瑞士、比利時、俄羅斯、義大利、西班牙、土耳其、歐洲其他地區、中國、日本、印度、韓國、新加坡、馬來西亞、澳洲、泰國、印尼、菲律賓、亞太地區 (APAC) 的其他地區、沙烏地阿拉伯、阿聯酋、南非、埃及、以色列、中東和非洲 (MEA) 的其他地區、其他地區的歐洲地區 |
|
涵蓋的市場參與者 |
Achilles Therapeutics plc(英國)、Advaxis Immunotherapies(美國)、Genocea(美國)、Gradalis, Inc.(美國)、Gritstone bio(美國)、Iovance Biotherapetics Inc(美國)、Medigene AG(德國)、BioNTech SE(美國)、Let, Inc. Ltd.(瑞士)、Merck KGaA(德國)、Sun Pharmaceutical Industries Ltd.(印度) |
|
市場機會 |
|
市場定義
新抗原是指新形成的、先前未被免疫系統辨識的抗原。新抗原可用於標靶治療,以治療癌細胞。它具有腫瘤特異性和高度免疫原性。因此,新抗原不會在健康組織中表現。新抗原在腫瘤特異性T細胞介導的抗腫瘤反應和癌症免疫療法中扮演重要角色。此外,許多研究表明,新抗原可能有助於免疫逃脫、免疫編輯以及對免疫檢查點抑制劑的敏感性。
全球新抗原市場動態
驅動程式
- 癌症發生率不斷上升
預計各種癌症盛行率的上升將促進市場的成長。 2012年,世界衛生組織預測全球有820萬人死於各種惡性腫瘤。肺癌、大腸癌、乳癌和肝癌是最常見的癌症,其中以肺癌、大腸癌和乳癌最為常見。腦瘤(髓母細胞瘤和膠質瘤)和神經母細胞瘤是最常見的實體腫瘤,而橫紋肌肉瘤和骨肉瘤則是較不常見的實體腫瘤。
- 對生物技術進步的需求更高
生物技術的進步使得免疫療法逐漸被接受,並推動了其在個人化醫療中的應用。免疫療法常用於治療癌症;有些療法會利用癌細胞表面的新抗原。因此,新抗原在癌症治療中的應用正在深入研究。
機會
- 政府加大對癌症治療的投入
許多政府已啟動旨在改善癌症治療和預防的倡議和計畫。例如,2017年,世界衛生大會通過了《癌症決議》(WHA70.12),提出了一項全面的癌症預防和控制方案。此方案敦促世衛組織和其他各國政府加大力度,實現《預防和管理非傳染性疾病全球行動計畫(2013-2020年)》和《2030年聯合國永續發展議程》中提出的減少癌症相關過早死亡的目標。
- 提高藥物上市量,促進患者快速康復
為了加快康復進程,各種藥物已被廣泛上市。例如,康寧公司於2019年10月推出了兩款新產品Elplasia和Matrigel,豐富了其類器官培養產品組合,為球狀體和類器官培養模型提供支援。 Elplasia是一款3D細胞培養微孔板,採用微腔技術,可實現大容量球狀體的形成、培養與分析。用於類器官培養的Matrigel基質經過優化,可支持類器官的生長和分化。因此,這一因素為市場成長創造了許多機會。
限制/挑戰
- 新抗原成本高昂
各種腫瘤新抗原的巨額支出阻礙了市場的成長,許多部門都難以承受,從而限制了市場的成長。
這份全球腫瘤新生抗原市場報告詳細介紹了最新發展動態、貿易法規、進出口分析、生產分析、價值鏈優化、市場份額、國內和本地市場參與者的影響,並分析了新興收入來源、市場法規變化、戰略市場增長分析、市場規模、類別市場增長、應用領域和市場主導地位、產品審批、產品發布、地域擴張以及市場技術創新等方面的機遇。如需了解更多關於全球腫瘤新生抗原市場的信息,請聯繫 Data Bridge 市場研究部門獲取分析師簡報,我們的團隊將幫助您做出明智的市場決策,實現市場成長。
全球新抗原市場範圍
全球腫瘤新生抗原市場根據治療類型、治療專科、治療線、通路和最終用戶進行細分。這些細分市場的成長將有助於您分析行業中成長乏力的細分市場,並為用戶提供有價值的市場概覽和市場洞察,幫助他們做出策略決策,確定核心市場應用。
治療專科
- 肺癌
- 泌尿系統癌症
- 黑色素瘤
- 肝癌
- 頭頸癌
- 血液和骨髓癌
治療
- 合併治療
- 單一療法
治療線
- 第一行
- 第二行
- 後記
最終用戶
- 醫院
- 居家護理
- 專科中心
- 其他的
分銷管道
- 醫院藥房
- 網路藥局
- 零售藥局
腫瘤新抗原市場區域分析/洞察
對全球新抗原市場進行了分析,並根據上述治療、治療專業、治療路線、分銷管道和最終用戶提供了市場規模洞察和趨勢。
全球腫瘤抗原市場報告涵蓋的主要國家 有:北美的美國、加拿大和墨西哥、歐洲的德國、法國、英國、荷蘭、瑞士、比利時、俄羅斯、義大利、西班牙、土耳其、歐洲其他地區、中國、日本、印度、韓國、新加坡、馬來西亞、澳洲、泰國、印尼、菲律賓、亞太地區(APAC)的其他地區、沙烏地阿拉伯、阿聯酋、南非、澳洲、美國南美洲的其他
由於主要產品製造商的存在、不斷增加的研發活動以及醫療保健支出,預計亞太地區將擁有最高的市場成長。
由於最新的技術發展和各種創新藥物分子的存在以增強治療程序,北美在市場佔據主導地位。
報告的國家部分還提供了各個市場的影響因素以及國內市場監管變化,這些變化會影響市場的當前和未來趨勢。此外,報告還考慮了全球品牌的存在和可用性,以及它們因本土和國內品牌的激烈競爭或稀缺而面臨的挑戰,以及國內關稅和貿易路線的影響,並對各國數據進行了預測分析。
競爭格局與全球新抗原市場份額分析
全球腫瘤新生抗原市場競爭格局提供了按競爭對手劃分的詳細資訊。詳細資訊包括公司概況、公司財務狀況、收入、市場潛力、研發投入、新市場計劃、全球佈局、生產基地和設施、生產能力、公司優勢和劣勢、產品發布、產品寬度和廣度以及應用主導地位。以上數據僅與公司在全球腫瘤新生抗原市場的重點相關。
全球新抗原市場的主要參與者包括:
- Achilles Therapeutics plc(英國)
- Advaxis 免疫療法(美國)
- Genocea(美國)
- Gradalis, Inc.(美國)
- Gritstone bio(美國)
- Iovance Biotherapetics Inc(美國)
- Medigene AG(德國)
- BioNTech SE(美國)
- 禮來(美國)
- Scicomvisuals(荷蘭)
- Moderna公司(美國)
- F. Hoffmann-La Roche Ltd.(瑞士)。
- 默克集團(德國)
- 太陽製藥工業有限公司(印度)
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Interactive Data Analysis Dashboard
- Company Analysis Dashboard for high growth potential opportunities
- Research Analyst Access for customization & queries
- Competitor Analysis with Interactive dashboard
- Latest News, Updates & Trend analysis
- Harness the Power of Benchmark Analysis for Comprehensive Competitor Tracking
目录
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL NEOANTIGENS MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL NEOANTIGENS MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 EPIDEMIOLOGY BASED MODEL
2.2.12 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.13 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL NEOANTIGENS MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3 MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4 EXECUTIVE SUMMARY
5 PREMIUM INSIGHTS
5.1 PESTEL ANALYSIS
5.2 PORTER’S 5 FORCES MODEL
6 INDUSTRY INSIGHTS
6.1 PATENT ANALYSIS
6.1.1 PATENT LANDSCAPE
6.1.2 USPTO NUMBER
6.1.3 PATENT EXPIRY
6.1.4 EPIO NUMBER
6.1.5 PATENT STRENGTH AND QUALITY
6.1.6 PATENT CLAIMS
6.1.7 PATENT CITATIONS
6.1.8 PATENT LITIGATION AND LICENSING
6.1.9 FILE OF PATENT
6.1.10 PATENT RECEIVED CONTRIES
6.1.11 TECHNOLOGY BACKGROUND
6.2 DRUG TREATMENT RATE BY MATURED MARKETS
6.3 DEMOGRAPHIC TRENDS: IMPACTS ON ALL INCIDENCE RATES
6.4 PATIENT FLOW DIAGRAM
6.5 KEY PRICING STRATEGIES
6.6 KEY PATIENT ENROLLMENT STRATEGIES
6.7 INTERVIEWS WITH SPECIALIST
6.8 OTHER KOL SNAPSHOTS
7 MERGERS AND ACQUISITION
7.1 LICENSING
7.2 COMMERCIALIZATION AGREEMENTS
8 REGULATORY FRAMEWORK
8.1 REGULATORY APPROVAL PROCESS
8.2 GEOGRAPHIES’ EASE OF REGULATORY APPROVAL
8.3 REGULATORY APPROVAL PATHWAYS
8.4 LICENSING AND REGISTRATION
8.5 POST-MARKETING SURVEILLANCE
8.6 GOOD MANUFACTURING PRACTICES (GMPS) GUIDELINES
9 PIPELINE ANALYSIS
9.1 CLINICAL TRIALS AND PHASE ANALYSIS
9.2 DRUG THERAPY PIPELINE
9.3 PHASE III CANDIDATES
9.4 PHASE II CANDIDATES
9.5 PHASE I CANDIDATES
9.6 OTHERS (PRE-CLINICAL AND RESEARCH)
10 R & D ANALYSIS
10.1 COMPARATIVE ANALYSIS
10.2 DRUG DEVELOPMENTAL LANDSCAPE
10.3 IN-DEPTH INSIGHTS ON REGULATORY MILESTONES
10.4 THERAPEUTIC ASSESSMENT
10.5 ASSET-BASED COLLABORATIONS AND PARTNERSHIPS
11 GLOBAL NEOANTIGENS MARKET, BY TREATMENT
11.1 OVERVIEW
11.2 COMBINATION THERAPY
11.3 MONO THERAPY
12 GLOBAL NEOANTIGENS MARKET, BY TYPE
12.1 OVERVIEW
12.2 PERSONALIZED NEOANTIGEN VACCINES
12.3 OFF-THE-SHELF NEOANTIGEN VACCINES
13 GLOBAL NEOANTIGENS MARKET, BY PRODUCT TYPE
13.1 OVERVIEW
13.2 VACCINES
13.2.1 NUCLEIC ACID/DNA VACCINES
13.2.1.1. BY THERAPY
13.2.1.1.1. COMBINATION THERAPY
13.2.1.1.2. MONO THERAPY
13.2.1.2. BY TYPE
13.2.1.2.1. PERSONALIZED NEOANTIGEN VACCINES
13.2.1.2.2. OFF-THE-SHELF NEOANTIGEN VACCINES
13.2.2 RNA VACCINES
13.2.2.1. BY TYPE
13.2.2.1.1. COMBINATION THERAPY
13.2.2.1.2. MONO THERAPY
13.2.2.2. BY TYPE
13.2.2.2.1. PERSONALIZED NEOANTIGEN VACCINES
13.2.2.2.2. OFF-THE-SHELF NEOANTIGEN VACCINES
13.2.3 PEPTIDE VACCINES
13.2.3.1. BY TYPE
13.2.3.1.1. COMBINATION THERAPY
13.2.3.1.2. MONO THERAPY
13.2.3.2. BY TYPE
13.2.3.2.1. PERSONALIZED NEOANTIGEN VACCINES
13.2.3.2.2. OFF-THE-SHELF NEOANTIGEN VACCINES
13.2.4 DENDRITIC CELL–BASED VACCINES
13.2.4.1. BY TYPE
13.2.4.1.1. COMBINATION THERAPY
13.2.4.1.2. MONO THERAPY
13.2.4.2. BY TYPE
13.2.4.2.1. PERSONALIZED NEOANTIGEN VACCINES
13.2.4.2.2. OFF-THE-SHELF NEOANTIGEN VACCINES
13.3 ADOPTIVE T CELL THERAPY
13.3.1 EMERGING DRUGS
13.3.1.1. NIVOLUMAB
13.3.1.2. PEMBROLIZUMAB
13.3.1.3. FLUDARABINE
13.3.1.4. CYCLOPHOSPHAMIDE
13.3.1.5. OTHERS
14 GLOBAL NEOANTIGENS MARKET, BY APPROACH
14.1 OVERVIEW
14.2 NEOANTIGEN-BASED CANCER VACCINES
14.3 NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
15 GLOBAL NEOANTIGENS MARKET, BY LINE OF THERAPY
15.1 OVERVIEW
15.2 FIRST LINE NEOVACCINES REGIMENS
15.3 SECOND LINE NEOVACCINE REGIMENS
15.4 LATER LINES NEOVACCINES REGIMENS
16 GLOBAL NEOANTIGENS MARKET, BY THERAPEUTIC
16.1 OVERVIEW
16.2 HEMATOLOGICAL MALIGNANCIES
16.2.1 BY APPROCH
16.2.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.2.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.2.2 BY LINE OF THERAPY
16.2.2.1. FIRST LINE NEOVACCINES REGIMENS
16.2.2.2. SECOND LINE NEOVACCINE REGIMENS
16.2.2.3. LATER LINES NEOVACCINES REGIMENS
16.3 MELANOMA
16.3.1 BY APPROCH
16.3.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.3.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.3.2 BY LINE OF THERAPY
16.3.2.1. FIRST LINE NEOVACCINES REGIMENS
16.3.2.2. SECOND LINE NEOVACCINE REGIMENS
16.3.2.3. LATER LINES NEOVACCINES REGIMENS
16.4 BREAST CANCER
16.4.1 BY APPROCH
16.4.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.4.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.4.2 BY LINE OF THERAPY
16.4.2.1. FIRST LINE NEOVACCINES REGIMENS
16.4.2.2. SECOND LINE NEOVACCINE REGIMENS
16.4.2.3. LATER LINES NEOVACCINES REGIMENS
16.5 GASTROINTESTINAL CANCER
16.5.1 BY APPROCH
16.5.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.5.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.5.2 BY LINE OF THERAPY
16.5.2.1. FIRST LINE NEOVACCINES REGIMENS
16.5.2.2. SECOND LINE NEOVACCINE REGIMENS
16.5.2.3. LATER LINES NEOVACCINES REGIMENS
16.6 LUNG CANCER
16.6.1 BY APPROCH
16.6.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.6.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.6.2 BY LINE OF THERAPY
16.6.2.1. FIRST LINE NEOVACCINES REGIMENS
16.6.2.2. SECOND LINE NEOVACCINE REGIMENS
16.6.2.3. LATER LINES NEOVACCINES REGIMENS
16.7 SOLID TUMORS
16.7.1 BY APPROCH
16.7.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.7.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.7.2 BY LINE OF THERAPY
16.7.2.1. FIRST LINE NEOVACCINES REGIMENS
16.7.2.2. SECOND LINE NEOVACCINE REGIMENS
16.7.2.3. LATER LINES NEOVACCINES REGIMENS
16.8 URINARY SYSTEM CANCER
16.8.1 BY APPROCH
16.8.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.8.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.8.2 BY LINE OF THERAPY
16.8.2.1. FIRST LINE NEOVACCINES REGIMENS
16.8.2.2. SECOND LINE NEOVACCINE REGIMENS
16.8.2.3. LATER LINES NEOVACCINES REGIMENS
16.9 PROSTATE CANCER
16.9.1 BY APPROCH
16.9.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.9.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.9.2 BY LINE OF THERAPY
16.9.2.1. FIRST LINE NEOVACCINES REGIMENS
16.9.2.2. SECOND LINE NEOVACCINE REGIMENS
16.9.2.3. LATER LINES NEOVACCINES REGIMENS
16.1 HEAD AND NECK CANCERS
16.10.1 BY APPROCH
16.10.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.10.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.10.2 BY LINE OF THERAPY
16.10.2.1. FIRST LINE NEOVACCINES REGIMENS
16.10.2.2. SECOND LINE NEOVACCINE REGIMENS
16.10.2.3. LATER LINES NEOVACCINES REGIMENS
16.11 GYNECOLOGIC CANCERS
16.11.1 BY APPROCH
16.11.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.11.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.11.2 BY LINE OF THERAPY
16.11.2.1. FIRST LINE NEOVACCINES REGIMENS
16.11.2.2. SECOND LINE NEOVACCINE REGIMENS
16.11.2.3. LATER LINES NEOVACCINES REGIMENS
16.12 BRAIN CANCER
16.12.1 BY APPROCH
16.12.1.1. NEOANTIGEN-BASED CANCER VACCINES
16.12.1.2. NEOANTIGEN-BASED ADOPTIVE CELL TRANSFER (ACT)
16.12.2 BY LINE OF THERAPY
16.12.2.1. FIRST LINE NEOVACCINES REGIMENS
16.12.2.2. SECOND LINE NEOVACCINE REGIMENS
16.12.2.3. LATER LINES NEOVACCINES REGIMENS
16.13 OTHERS
17 GLOBAL NEOANTIGENS MARKET, BY AGE GROUP
17.1 OVERVIEW
17.2 PEDIATRICS
17.3 ADULTS
17.4 GERIATRICS
18 GLOBAL NEOANTIGENS MARKET, BY GENDER
18.1 OVERVIEW
18.2 MALE
18.3 FEMALE
19 GLOBAL NEOANTIGENS MARKET, BY END USER
19.1 OVERVIEW
19.2 HOSPITAL
19.2.1 PUBLIC
19.2.2 PRIVATE
19.3 CLINICS
19.4 COMMUNITY CENTERS
19.5 OTHERS
20 GLOBAL NEOANTIGENS MARKET, BY DISTRIBUTION
20.1 OVERVIEW
20.2 DIRECT TENDER
20.3 RETAIL SALES
20.4 OTHERS
21 GLOBAL NEOANTIGENS MARKET, COMPANY LANDSCAPE
21.1 COMPANY SHARE ANALYSIS: GLOBAL
21.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
21.3 COMPANY SHARE ANALYSIS: EUROPE
21.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
21.5 MERGERS & ACQUISITIONS
21.6 NEW PRODUCT DEVELOPMENT & APPROVALS
21.7 EXPANSIONS
21.8 REGULATORY CHANGES
21.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
22 GLOBAL NEOANTIGENS MARKET, BY GEOGRAPHY
Global Neoantigens market (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
22.1 NORTH AMERICA
22.1.1 U.S.
22.1.2 CANADA
22.1.3 MEXICO
22.2 EUROPE
22.2.1 GERMANY
22.2.2 FRANCE
22.2.3 U.K.
22.2.4 HUNGARY
22.2.5 LITHUANIA
22.2.6 AUSTRIA
22.2.7 IRELAND
22.2.8 NORWAY
22.2.9 POLAND
22.2.10 ITALY
22.2.11 SPAIN
22.2.12 RUSSIA
22.2.13 TURKEY
22.2.14 NETHERLANDS
22.2.15 SWITZERLAND
22.2.16 REST OF EUROPE
22.3 ASIA-PACIFIC
22.3.1 JAPAN
22.3.2 CHINA
22.3.3 SOUTH KOREA
22.3.4 INDIA
22.3.5 AUSTRALIA
22.3.6 SINGAPORE
22.3.7 THAILAND
22.3.8 MALAYSIA
22.3.9 INDONESIA
22.3.10 PHILIPPINES
22.3.11 VIETNAM
22.3.12 REST OF ASIA-PACIFIC
22.4 SOUTH AMERICA
22.4.1 BRAZIL
22.4.2 ARGENTINA
22.4.3 PERU
22.4.4 REST OF SOUTH AMERICA
22.5 MIDDLE EAST AND AFRICA
22.5.1 SOUTH AFRICA
22.5.2 SAUDI ARABIA
22.5.3 UAE
22.5.4 EGYPT
22.5.5 KUWAIT
22.5.6 ISRAEL
22.5.7 REST OF MIDDLE EAST AND AFRICA
22.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
23 GLOBAL NEOANTIGENS MARKET, SWOT AND DBMR ANALYSIS
24 GLOBAL NEOANTIGENS MARKET, COMPANY PROFILE
24.1 MODERNA, INC.
24.1.1 COMPANY OVERVIEW
24.1.2 REVENUE ANALYSIS
24.1.3 GEOGRAPHIC PRESENCE
24.1.4 PRODUCT PORTFOLIO
24.1.5 RECENT DEVELOPEMENTS
24.2 F. HOFFMANN-LA ROCHE LTD
24.2.1 COMPANY OVERVIEW
24.2.2 REVENUE ANALYSIS
24.2.3 GEOGRAPHIC PRESENCE
24.2.4 PRODUCT PORTFOLIO
24.2.5 RECENT DEVELOPEMENTS
24.3 AGENUS INC.
24.3.1 COMPANY OVERVIEW
24.3.2 REVENUE ANALYSIS
24.3.3 GEOGRAPHIC PRESENCE
24.3.4 PRODUCT PORTFOLIO
24.3.5 RECENT DEVELOPEMENTS
24.4 ADVAXIS, INC./AMGEN INC
24.4.1 COMPANY OVERVIEW
24.4.2 REVENUE ANALYSIS
24.4.3 GEOGRAPHIC PRESENCE
24.4.4 PRODUCT PORTFOLIO
24.4.5 RECENT DEVELOPEMENTS
24.5 MEDIGENE AG
24.5.1 COMPANY OVERVIEW
24.5.2 REVENUE ANALYSIS
24.5.3 GEOGRAPHIC PRESENCE
24.5.4 PRODUCT PORTFOLIO
24.5.5 RECENT DEVELOPEMENTS
24.6 GRITSTONE ONCOLOGY
24.6.1 COMPANY OVERVIEW
24.6.2 REVENUE ANALYSIS
24.6.3 GEOGRAPHIC PRESENCE
24.6.4 PRODUCT PORTFOLIO
24.6.5 RECENT DEVELOPEMENTS
24.7 NOUSCOM
24.7.1 COMPANY OVERVIEW
24.7.2 REVENUE ANALYSIS
24.7.3 GEOGRAPHIC PRESENCE
24.7.4 PRODUCT PORTFOLIO
24.7.5 RECENT DEVELOPEMENTS
24.8 BIOLINERX LTD.
24.8.1 COMPANY OVERVIEW
24.8.2 REVENUE ANALYSIS
24.8.3 GEOGRAPHIC PRESENCE
24.8.4 PRODUCT PORTFOLIO
24.8.5 RECENT DEVELOPEMENTS
24.9 GENEOS THERAPEUTICS, INC.
24.9.1 COMPANY OVERVIEW
24.9.2 REVENUE ANALYSIS
24.9.3 GEOGRAPHIC PRESENCE
24.9.4 PRODUCT PORTFOLIO
24.9.5 RECENT DEVELOPEMENTS
24.1 ACHILLES THERAPEUTICS PLC
24.10.1 COMPANY OVERVIEW
24.10.2 REVENUE ANALYSIS
24.10.3 GEOGRAPHIC PRESENCE
24.10.4 PRODUCT PORTFOLIO
24.10.5 RECENT DEVELOPMENTS
24.11 BIONTECH SE
24.11.1 COMPANY OVERVIEW
24.11.2 REVENUE ANALYSIS
24.11.3 GEOGRAPHIC PRESENCE
24.11.4 PRODUCT PORTFOLIO
24.11.5 RECENT DEVELOPEMENTS
24.12 GRADALIS, INC.
24.12.1 COMPANY OVERVIEW
24.12.2 REVENUE ANALYSIS
24.12.3 GEOGRAPHIC PRESENCE
24.12.4 PRODUCT PORTFOLIO
24.12.5 RECENT DEVELOPEMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
25 RELATED REPORTS
26 CONCLUSION
27 QUESTIONNAIRE
28 ABOUT DATA BRIDGE MARKET RESEARCH
研究方法
数据收集和基准年分析是使用具有大样本量的数据收集模块完成的。该阶段包括通过各种来源和策略获取市场信息或相关数据。它包括提前检查和规划从过去获得的所有数据。它同样包括检查不同信息源中出现的信息不一致。使用市场统计和连贯模型分析和估计市场数据。此外,市场份额分析和关键趋势分析是市场报告中的主要成功因素。要了解更多信息,请请求分析师致电或下拉您的询问。
DBMR 研究团队使用的关键研究方法是数据三角测量,其中包括数据挖掘、数据变量对市场影响的分析和主要(行业专家)验证。数据模型包括供应商定位网格、市场时间线分析、市场概览和指南、公司定位网格、专利分析、定价分析、公司市场份额分析、测量标准、全球与区域和供应商份额分析。要了解有关研究方法的更多信息,请向我们的行业专家咨询。
可定制
Data Bridge Market Research 是高级形成性研究领域的领导者。我们为向现有和新客户提供符合其目标的数据和分析而感到自豪。报告可定制,包括目标品牌的价格趋势分析、了解其他国家的市场(索取国家列表)、临床试验结果数据、文献综述、翻新市场和产品基础分析。目标竞争对手的市场分析可以从基于技术的分析到市场组合策略进行分析。我们可以按照您所需的格式和数据样式添加您需要的任意数量的竞争对手数据。我们的分析师团队还可以为您提供原始 Excel 文件数据透视表(事实手册)中的数据,或者可以帮助您根据报告中的数据集创建演示文稿。