Europe Endotoxin And Pyrogen Testing Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
1,136.47 Billion
USD
2,169.86 Billion
2025
2033
USD
1,136.47 Billion
USD
2,169.86 Billion
2025
2033
| 2026 –2033 | |
| USD 1,136.47 Billion | |
| USD 2,169.86 Billion | |
|
|
|
|
Marktsegmentierung für Endotoxin- und Pyrogentests in Europa nach Produkttyp (Nachweiskits und Reagenzien, Instrumente, Systeme und Software, Endotoxintestdienstleistungen und Verbrauchsmaterialien und Zubehör), Testart (Limulus-Amöbozytenlysat-Test (LAL-Test), Tal-Test, Monozytenaktivierungstest (MAT), Kaninchenpyrogentest und rekombinanter C-Assay (RFC)), Anwendung (Pharmazeutische Herstellung, Medizinprodukteherstellung, Rohstoff- und Verpackungsherstellung), Methode (Gelgerinnungs-Endotoxintest, chromogener Endotoxintest und turbidimetrischer Endotoxintest), Kaufart (Großunternehmen, mittlere und kleine Unternehmen und Einzelpersonen), Endprodukt (Impfstoffe und/oder Gentherapieprodukte, Biologika, Injektionspräparate und Sonstige), Endnutzer (Pharmazeutische Unternehmen, Biotechnologieunternehmen, Biomedizinische Unternehmen, Medizinproduktehersteller, Auftragsforschungsinstitute (CRO) und Auftragshersteller (CMO)) – Branchentrends und Prognose bis 2033
Marktgröße für Endotoxin- und Pyrogentests in Europa
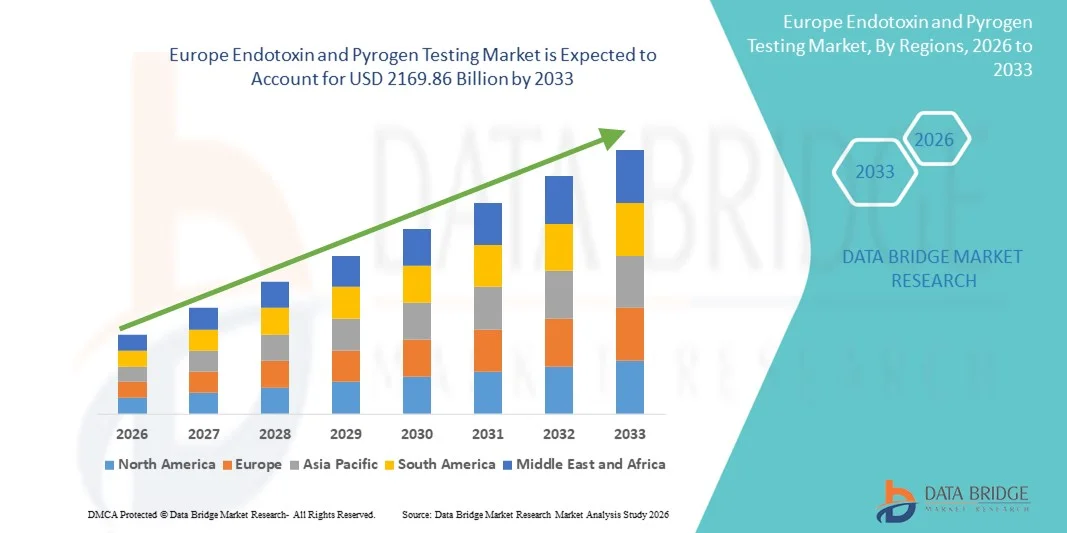
- Der europäische Markt für Endotoxin- und Pyrogentests hatte im Jahr 2025 einen Wert von 1136,47 Milliarden US-Dollar und wird voraussichtlich bis 2033 auf 2169,86 Milliarden US-Dollar anwachsen , was einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 8,42 % im Prognosezeitraum entspricht.
- Das Marktwachstum wird maßgeblich durch den zunehmenden Fokus auf Patientensicherheit, strenge regulatorische Anforderungen und steigende Qualitätskontrollstandards in der pharmazeutischen, biotechnologischen und medizintechnischen Industrie angetrieben, was zu einer verstärkten Nutzung zuverlässiger Testlösungen für Endotoxine und Pyrogene im klinischen und industriellen Bereich führt.
- Darüber hinaus positioniert die steigende Nachfrage nach schnellen, präzisen und konformen Testmethoden – zusammen mit Fortschritten bei rekombinanten und alternativen Pyrogen-Testtechnologien – die Endotoxin- und Pyrogenprüfung als kritischen Bestandteil moderner Qualitätssicherungssysteme und trägt somit maßgeblich zum Gesamtwachstum der Branche bei.
Marktanalyse für Endotoxin- und Pyrogentests in Europa
- Lösungen zur Prüfung von Endotoxinen und Pyrogenen spielen eine entscheidende Rolle für die Sicherheit von Arzneimitteln, Biologika und Medizinprodukten. Sie helfen, schädliche bakterielle Toxine nachzuweisen, die unerwünschte Reaktionen bei Patienten hervorrufen können, und sind daher ein wesentlicher Bestandteil der Qualitätskontrolle und der Einhaltung regulatorischer Vorgaben im klinischen und industriellen Bereich.
- Die wachsende Nachfrage nach Endotoxin- und Pyrogentests wird in erster Linie durch strengere regulatorische Richtlinien, die zunehmende Produktion von injizierbaren Arzneimitteln und Biologika sowie das steigende Bewusstsein für Patientensicherheit und den allmählichen Übergang zu fortschrittlichen und tierversuchsfreien Testmethoden wie z. B. rekombinanten Faktor-C-Assays (rFC) angetrieben.
- Großbritannien dominierte den Markt für Endotoxin- und Pyrogentests mit dem größten Umsatzanteil von rund 38,7 % im Jahr 2025. Dies ist auf die etablierte Pharma- und Biotechnologiebranche, den starken regulatorischen Rahmen, die signifikanten Investitionen in Forschung und Entwicklung sowie die hohe Akzeptanz fortschrittlicher Endotoxin- und Pyrogentesttechnologien in der Herstellung von Biologika, Impfstoffen und Medizinprodukten zurückzuführen.
- Deutschland dürfte im Prognosezeitraum das am schnellsten wachsende Land im Markt für Endotoxin- und Pyrogentests sein und eine geschätzte durchschnittliche jährliche Wachstumsrate (CAGR) von rund 8,3 % verzeichnen. Unterstützt wird dieses Wachstum durch den Ausbau der pharmazeutischen und biotechnologischen Produktionsinfrastruktur, zunehmende staatliche Initiativen im Bereich der Lebenswissenschaften, steigende Auftragsforschungs- und Prüfdienstleistungen sowie die Einhaltung strenger EU- und internationaler Qualitätsstandards.
- Das Segment der Großunternehmen dominierte den Markt mit einem Umsatzanteil von 48,3 % im Jahr 2025. Treiber dieser Entwicklung waren etablierte Gesundheitseinrichtungen und große Pharmaunternehmen, die für die Deckung des hohen Testbedarfs große Mengen an Produkten benötigen.
Berichtsumfang und Marktsegmentierung für Endotoxin- und Pyrogentests
|
Attribute |
Endotoxin- und Pyrogenprüfung: Wichtigste Markteinblicke |
|
Abgedeckte Segmente |
|
|
Abgedeckte Länder |
Europa
|
|
Wichtige Marktteilnehmer |
• Charles River Laboratories (USA) |
|
Marktchancen |
|
|
Mehrwertdaten-Infosets |
Zusätzlich zu den Erkenntnissen über Marktszenarien wie Marktwert, Wachstumsrate, Segmentierung, geografische Abdeckung und Hauptakteure enthalten die von Data Bridge Market Research erstellten Marktberichte auch detaillierte Expertenanalysen, Patientenepidemiologie, Pipeline-Analyse, Preisanalyse und regulatorische Rahmenbedingungen. |
Trends auf dem europäischen Markt für Endotoxin- und Pyrogentests
Zunehmende Nutzung fortschrittlicher Endotoxin- und Pyrogen-Nachweismethoden
- Ein bedeutender und sich beschleunigender Trend auf dem Markt für Endotoxin- und Pyrogentests ist die zunehmende Anwendung fortschrittlicher Nachweismethoden, einschließlich mikrobiologischer Schnelltests und rekombinanter Faktor-C-Assays (rFC), um die Testgenauigkeit und die Bearbeitungszeit zu verbessern.
- Beispielsweise haben im Jahr 2023 mehrere Pharmahersteller in Brasilien die Anwendung von Endotoxintests auf Basis von rekombinantem Faktor C ausgeweitet, um den globalen regulatorischen Anforderungen gerecht zu werden und gleichzeitig die Abhängigkeit von traditionellen LAL-Tests zu verringern.
- Labore in der gesamten Region konzentrieren sich auf die Verbesserung der Effizienz und Sensitivität von Tests, um die Produktsicherheit bei Arzneimitteln, Biologika und Medizinprodukten zu gewährleisten.
- Der Trend hin zu alternativen und nachhaltigen Testmethoden gewinnt auch aufgrund ethischer Bedenken und regulatorischer Anreize an Bedeutung.
- Dieser Trend verändert die Qualitätskontrollpraktiken in Südamerika und unterstützt eine sicherere Arzneimittelproduktion sowie die Exportbereitschaft für internationale Märkte.
Marktdynamik für Endotoxin- und Pyrogentests in Europa
Treiber
Wachsende pharmazeutische und biologische Herstellungsaktivitäten
- Die stetige Expansion der pharmazeutischen, biotechnologischen und medizintechnischen Produktionsaktivitäten in Südamerika, im Einklang mit globalen Produktionstrends, ist ein wichtiger Faktor für die steigende Nachfrage nach Lösungen für Endotoxin- und Pyrogentests.
- Beispielsweise erweiterte im Jahr 2024 ein führender brasilianischer Hersteller von Biologika seine internen Endotoxin-Testkapazitäten, um die großtechnische Produktion von injizierbaren Impfstoffen und Biosimilars für den Inlandsmarkt und internationale Märkte zu unterstützen.
- Weltweit harmonisierte regulatorische Anforderungen, die die Gewährleistung der Sterilität und die Patientensicherheit betonen, schreiben routinemäßige Endotoxin- und Pyrogentests während der gesamten Arzneimittelentwicklung, der klinischen Herstellung und der kommerziellen Produktion vor.
- Steigende öffentliche und private Investitionen in die Infrastruktur des Gesundheitswesens, die Forschung in den Lebenswissenschaften und die lokale pharmazeutische Produktion in Schwellen- und Industrieländern verstärken die Nachfrage nach zuverlässigen und validierten Testlösungen zusätzlich.
- Der zunehmende Export von pharmazeutischen und biologischen Produkten aus Europa in regulierte Märkte wie Europa und Europa erfordert die strikte Einhaltung internationaler Qualitäts- und Sicherheitsstandards und verstärkt damit die Anwendung von Endotoxin- und Pyrogen-Testprotokollen.
Zurückhaltung/Herausforderung
Hohe Testkosten und begrenztes technisches Fachwissen
- Die hohen Investitions- und Betriebskosten, die mit fortschrittlichen Endotoxin- und Pyrogen-Testsystemen verbunden sind, stellen weiterhin eine erhebliche Einschränkung dar, insbesondere für kleine und mittlere Labore in Europa und anderen kostensensiblen Regionen weltweit.
- Beispielsweise berichteten mehrere Auftragsprüflaboratorien in Argentinien von Verzögerungen bei der Einführung schneller und alternativer Testtechnologien aufgrund von Budgetbeschränkungen, hohen Gerätekosten und laufenden Wartungskosten.
- Die begrenzte Verfügbarkeit von qualifizierten Fachkräften, die komplexe Endotoxin- und Pyrogentests durchführen, validieren und interpretieren können, schränkt eine breitere Marktdurchdringung zusätzlich ein.
- Unterschiede in der Durchsetzung von Vorschriften und in den Testrichtlinien zwischen den Ländern stellen eine Herausforderung für die Erreichung standardisierter Testverfahren dar, insbesondere für Hersteller, die auf mehreren globalen Märkten tätig sind.
- Die Bewältigung dieser Herausforderungen durch die Entwicklung kosteneffizienter Testlösungen, den Ausbau von Schulungsmaßnahmen für Fachkräfte und eine stärkere internationale Harmonisierung der Regulierungen wird unerlässlich sein, um ein nachhaltiges Wachstum des globalen Marktes für Endotoxin- und Pyrogentests zu unterstützen.
Marktumfang für Endotoxin- und Pyrogentests in Europa
Der Markt ist segmentiert nach Produkttyp, Testart, Anwendung, Methode, Kaufart, Endprodukt und Endnutzer.
- Nach Produkttyp
Basierend auf dem Produkttyp ist der Markt für Endotoxin- und Pyrogentests in Nachweiskits und Reagenzien, Instrumente, Systeme und Software, Endotoxintestdienstleistungen sowie Verbrauchsmaterialien und Zubehör unterteilt. Das Segment der Nachweiskits und Reagenzien dominierte 2025 mit einem Marktanteil von 41,6 %, vor allem aufgrund seiner essenziellen und wiederkehrenden Verwendung in der pharmazeutischen, biotechnologischen und medizintechnischen Fertigung. Diese Produkte werden in verschiedenen Phasen benötigt, darunter die Rohmaterialprüfung, die Inprozesskontrolle und die Freigabeprüfung des Endprodukts. Zulassungsbehörden schreiben validierte Kits und Reagenzien vor und gewährleisten so eine gleichbleibende Nachfrage unabhängig vom Produktionsumfang. Die hohe Testfrequenz in sterilen Produktionsumgebungen steigert den Verbrauch zusätzlich. Nachweiskits sind vergleichsweise kostengünstig und daher sowohl für große als auch für kleine Labore zugänglich. Kontinuierliche Innovationen zur Verbesserung von Sensitivität und Spezifität fördern die Akzeptanz. Die Kompatibilität mit verschiedenen Testmethoden erhöht die Flexibilität. Die globale Expansion der Herstellung injizierbarer Arzneimittel unterstützt das Nachfragewachstum. Auch die steigende Produktion von Biologika trägt wesentlich dazu bei. Etablierte Lieferantennetzwerke gewährleisten eine unterbrechungsfreie Verfügbarkeit. Starke regulatorische Abhängigkeit sichert die langfristige Vorherrschaft.
Das Segment Systeme und Software wird voraussichtlich mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 19,1 % von 2026 bis 2033 das schnellste Wachstum verzeichnen. Treiber dieser Entwicklung ist die rasche Verbreitung von Laborautomatisierung und digitalen Compliance-Tools. Pharmahersteller setzen zunehmend auf automatisierte Lösungen, um menschliche Fehler zu minimieren und die Testeffizienz zu steigern. Softwareplattformen unterstützen Datenintegrität, Audit-Trails und die regulatorische Dokumentation. Die Integration mit LIMS-Systemen verbessert die operative Transparenz. Der wachsende Fokus auf intelligente Labore beschleunigt die Einführung dieser Technologien. Große Hersteller investieren massiv in die digitale Transformation. Automatisierung verkürzt die Bearbeitungszeiten für die Chargenfreigabe. Regulatorische Inspektionen bevorzugen zunehmend digitale Aufzeichnungen. Cloudbasierte Systeme verbessern die Skalierbarkeit. Die Nachfrage ist insbesondere bei Auftragsherstellern (CMOs) hoch. Steigende Investitionen in fortschrittliche Qualitätssysteme unterstützen das nachhaltige Wachstum.
- Nach Testart
Basierend auf der Testart ist der Markt für Endotoxin- und Pyrogentests in Limulus-Amöbozytenlysat-Test (LAL-Test), TAL-Test, Monozytenaktivierungstest (MAT), Kaninchenpyrogentest und rekombinanten Faktor-C-Assay (RFC-Assay) unterteilt. Das Segment der LAL-Tests erzielte 2025 mit 47,3 % den größten Marktanteil, was auf seine langjährige regulatorische Akzeptanz in den USA, Europa und Asien zurückzuführen ist. Der Test wird häufig für injizierbare Arzneimittel, Impfstoffe und implantierbare Medizinprodukte eingesetzt. Seine bewährte Zuverlässigkeit und Sensitivität tragen zu seiner anhaltenden Beliebtheit bei. Die Verfügbarkeit in Gelgerinnungs-, chromogenen und turbidimetrischen Formaten erhöht die Vielseitigkeit. Pharmaunternehmen nutzen den LAL-Test für routinemäßige Chargenprüfungen. Etablierte Protokolle reduzieren den Validierungsaufwand. Umfangreiche historische Daten unterstützen die Einhaltung der Vorschriften. Die Verfügbarkeit von Lieferanten gewährleistet einen kontinuierlichen Zugang. Die hohe Vertrautheit mit dem Test unter Laborfachkräften stärkt seine Marktführerschaft. Die Kosteneffizienz im Vergleich zu neueren Methoden fördert die Akzeptanz. Die globale Harmonisierung der Standards unterstützt die Anwendung.
Das Segment der rekombinanten Faktor-C-Assays (RFC) wird voraussichtlich von 2026 bis 2033 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 22,6 % am schnellsten wachsen. Treiber dieser Entwicklung ist der weltweite Trend hin zu tierversuchsfreien Testmethoden. Ethische Bedenken hinsichtlich der Ernte von Pfeilschwanzkrebsen fördern die Akzeptanz. Zulassungsbehörden unterstützen zunehmend alternative Methoden. RFC bietet eine höhere Spezifität und Reproduzierbarkeit. Die geringere Variabilität verbessert die Ergebniskonsistenz. Biopharmazeutische Hersteller bevorzugen RFC für innovative Therapien. Die verbesserte Assay-Performance erhöht das Vertrauen. Technologische Fortschritte steigern die Sensitivität. Nachhaltigkeitsinitiativen beschleunigen die Nachfrage. Zunehmende regulatorische Unterstützung stärkt die Akzeptanz. Die Erweiterung der Biologika-Pipelines fördert das Wachstum. Langfristige ökologische Vorteile stärken die Marktakzeptanz.
- Durch Bewerbung
Basierend auf den Anwendungsgebieten ist der Markt für Endotoxin- und Pyrogentests in die Segmente pharmazeutische Herstellung, Medizinprodukteherstellung, Rohstoffproduktion und Verpackungsherstellung unterteilt. Das Segment der pharmazeutischen Herstellung dominierte den Markt mit einem Umsatzanteil von 44,8 % im Jahr 2025, bedingt durch strenge Anforderungen an Sterilität und Endotoxinkontrolle. Endotoxintests sind während der gesamten Arzneimittelentwicklung und -vermarktung obligatorisch. Hohe Produktionsvolumina erhöhen die Testfrequenz. Das Wachstum bei injizierbaren und biologischen Arzneimitteln sichert die Nachfrage. Behördenkontrollen gewährleisten die Einhaltung der Vorschriften. Chargenfreigabeprotokolle erfordern validierte Tests. Der Ausbau globaler pharmazeutischer Produktionsstätten fördert die Akzeptanz. Kontinuierliche Prozessüberwachung steigert die Testnutzung. Strenge regulatorische Aufsicht sichert die anhaltende Marktführerschaft. Großproduktionsanlagen treiben die Nachfrage an. Investitionen in die Qualitätssicherung stärken die Anwendung.
Der Bereich der Medizinprodukteherstellung wird aufgrund der steigenden Produktion implantierbarer und invasiver Geräte voraussichtlich mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 19,8 % von 2026 bis 2033 am schnellsten wachsen. Verstärkte regulatorische Kontrollen erfordern Pyrogentests. Die weltweite Expansion der Medizinprodukteexporte treibt die Nachfrage an. Das Wachstum minimalinvasiver Eingriffe unterstützt die Marktexpansion. Höhere Patientensicherheitsstandards fördern die Anwendung von Testverfahren. Schwellenländer erhöhen ihre Produktionskapazitäten. Die Harmonisierung der regulatorischen Vorgaben verbessert die Einhaltung der Vorschriften. Moderne Materialien erfordern strenge Tests. Wachsende Märkte für orthopädische und kardiovaskuläre Geräte unterstützen das Wachstum. Verstärktes Outsourcing an Auftragsfertiger (CMOs) beschleunigt die Nachfrage nach Tests. Innovationen im Gerätedesign erhöhen die Komplexität der Tests.
- Nach Methode
Basierend auf der Testmethode ist der Markt für Endotoxin- und Pyrogentests in Gelgerinnungs-, chromogene und turbidimetrische Endotoxintests unterteilt. Der Gelgerinnungstest erzielte 2025 mit 39,5 % den größten Umsatzanteil, was auf seine Einfachheit und die hohe regulatorische Akzeptanz zurückzuführen ist. Die Methode erfordert nur minimale Instrumentierung und ist kostengünstig für Routineuntersuchungen. Sie findet breite Anwendung in kleinen und mittelgroßen Laboren. Die qualitativen Ergebnisse erfüllen die grundlegenden Compliance-Anforderungen. Die lange Validierungsgeschichte schafft Vertrauen. Die einfache Interpretation fördert die Akzeptanz. Die Methode eignet sich für geringe Testvolumina. Der geringe Schulungsaufwand ist für Labore von Vorteil. Die konsistente Leistung gewährleistet Zuverlässigkeit. Die breite regulatorische Anerkennung sichert die Marktführerschaft.
Das Segment der chromogenen Endotoxintests wird voraussichtlich von 2026 bis 2033 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 20,9 % am schnellsten wachsen. Treiber dieser Entwicklung ist die Nachfrage nach quantitativen und hochempfindlichen Tests. Pharmaunternehmen bevorzugen präzise Endotoxinmessungen. Die Kompatibilität mit Automatisierungssystemen erhöht den Durchsatz. Die Tests eignen sich für komplexe Biologika. Verbesserte Genauigkeit unterstützt die Einhaltung regulatorischer Vorgaben. Hohe Reproduzierbarkeit reduziert die Variabilität. Die steigende Produktion von Biologika beschleunigt die Einführung der Tests. Die Integration in automatisierte Systeme steigert die Effizienz. Fortschrittliche Formulierungen erfordern einen empfindlichen Nachweis. Das Wachstum in der Großproduktion stützt die Nachfrage. Technologische Verbesserungen optimieren die Leistung.
- Nach Kaufart
Basierend auf der Bezugsart ist der Markt für Endotoxin- und Pyrogentests in Großunternehmen, mittlere und kleine Unternehmen sowie Einzelpersonen unterteilt. Das Segment der Großunternehmen dominierte den Markt mit einem Umsatzanteil von 48,3 % im Jahr 2025. Treiber dieses Wachstums sind etablierte Gesundheitseinrichtungen und große Pharmaunternehmen, die aufgrund ihres hohen Testbedarfs große Mengen an Testsubstanzen beschaffen müssen. Großunternehmen profitieren von langfristigen Lieferantenverträgen, Skaleneffekten und optimierten Validierungsprozessen. Zentralisierte Qualitätskontrollen und kontinuierliche Produktionszyklen erfordern häufige Tests. Strenge regulatorische Vorgaben und regelmäßige Audits fördern die Testakzeptanz. Hohe Investitionskapazitäten ermöglichen den Zugang zu fortschrittlichen Testtechnologien. Die Integration in interne Labore steigert Effizienz und Genauigkeit. Das Segment verzeichnet zudem eine kontinuierliche Nachfrage von multinationalen Unternehmen mit globaler Präsenz. Etablierte Standardarbeitsanweisungen (SOPs) und Qualitätsmanagementsysteme stärken die Marktführerschaft.
Das Segment der Einzelkunden wird voraussichtlich von 2026 bis 2033 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 19,4 % das schnellste Wachstum verzeichnen. Treiber dieser Entwicklung ist die zunehmende Nutzung durch kleine Biotech-Unternehmen, Startups und Forschungsinstitute. Einzelpersonen suchen vermehrt nach Outsourcing-Optionen, um ihre Investitionskosten zu senken. Die steigende Anzahl klinischer Studien, die von kleineren Einrichtungen durchgeführt werden, treibt die Nachfrage an. Flexible Servicemodelle und On-Demand-Tests beschleunigen die Akzeptanz. Ein gesteigertes Bewusstsein für regulatorische Vorgaben gewährleistet konformitätsorientierte Tests. Die Expansion der Pipelines für Biologika sowie Zell- und Gentherapien in kleinen Organisationen unterstützt das Wachstum. Der Zugang zu digitalen Bestellmöglichkeiten und optimierten Berichten steigert die Attraktivität. Schwellenländer und das Wachstum von Startups tragen zusätzlich zur Marktexpansion bei. Einzelkunden nutzen häufig CRO/CMO-Dienstleistungen, wodurch die Testfrequenz steigt.
- Nach Endprodukt
Basierend auf dem Endprodukt ist der Markt für Endotoxin- und Pyrogentests in Impfstoffe und/oder Zell- und Gentherapie (CGT), Biologika, Injektionspräparate und Sonstige unterteilt. Das Segment Biologika dominierte den Markt mit einem Umsatzanteil von 42,6 % im Jahr 2025. Dies ist auf die weitverbreitete Anwendung von Biologika in der Therapie und die strengen regulatorischen Anforderungen an Sterilitäts- und Endotoxintests zurückzuführen. Die großtechnische Produktion von monoklonalen Antikörpern, rekombinanten Proteinen und therapeutischen Enzymen treibt die routinemäßigen Tests voran. Regulatorische Audits und Qualitätssicherungsprogramme gewährleisten häufige Testzyklen. Hohe Investitionen in Forschung und Entwicklung sowie klinische Studien verstärken die Nachfrage. Die Präsenz führender Biotech-Hersteller fördert die Anwendung fortschrittlicher Testmethoden. Die Biologika-Produktion erfordert robuste Qualitätskontrollsysteme, um Kontaminationen zu vermeiden. Eine etablierte Infrastruktur in Nordamerika und Europa stärkt die Marktführerschaft. Partnerschaften mit Auftragsprüfinstituten erweitern die Reichweite. Die Marktakzeptanz wird durch das wachsende Bewusstsein für die Sicherheit von Biologika weiter gefördert.
Das Segment Impfstoffe und/oder Zell- und Gentherapie (CGT) wird voraussichtlich von 2026 bis 2033 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 22,3 % das schnellste Wachstum verzeichnen. Treiber dieser Entwicklung sind die beschleunigte Entwicklung neuartiger Impfstoffe und fortschrittlicher Zell- und Gentherapien. Globale Gesundheitsinitiativen, Pandemievorsorge und zunehmende Impfprogramme erhöhen die Nachfrage nach Tests. CGT-Produkte erfordern aufgrund komplexer Herstellungsverfahren hochempfindliche Endotoxintests. Die Ausweitung personalisierter Medizin und zielgerichteter Therapien fördert die Akzeptanz. Die Auslagerung an Auftragsforschungsinstitute (CROs) und spezialisierte Labore gewährleistet die Einhaltung der Vorschriften. Der regulatorische Fokus auf Arzneimittel für neuartige Therapien (ART) treibt das Wachstum an. Innovationen in der mRNA- und viralen Vektortechnologie erhöhen das Produktionsvolumen. Aufstrebende Biotech-Unternehmen suchen aktiv nach Hochdurchsatz-Testlösungen. Steigende Fördermittel für die Impfstoffforschung und -entwicklung unterstützen die Marktexpansion. Die Einführung automatisierter und schneller Testplattformen beschleunigt die Effizienz.
- Vom Endbenutzer
Basierend auf den Endnutzern ist der Markt für Endotoxin- und Pyrogentests in Pharmaunternehmen, Biotechnologieunternehmen, biomedizinische Unternehmen, Medizintechnikunternehmen, CROs und CMOs unterteilt. Pharmaunternehmen dominierten den Markt mit einem Umsatzanteil von 45,7 % im Jahr 2025, was auf umfangreiche interne Qualitätskontrollverfahren zurückzuführen ist. Große Produktionsmengen erhöhen den Testbedarf. Regulatorische Audits erfordern häufige Validierungen. Investitionen in eigene Labore stärken die Marktführerschaft. Kontinuierliche Produktionszyklen treiben die Nachfrage an. Hohe Compliance-Standards erfordern routinemäßige Tests. Die Erweiterung der Biologika-Pipeline unterstützt die Nutzung. Starke Finanzkraft ermöglicht die Einführung fortschrittlicher Tests. Globale Präsenz erhöht den Testumfang. Etablierte Qualitätsrahmen festigen die Marktführerschaft.
Das CRO- und CMO-Segment wird voraussichtlich von 2026 bis 2033 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 21,7 % am schnellsten wachsen, angetrieben durch den zunehmenden Trend zum Outsourcing. Pharmaunternehmen streben Kostenoptimierung an. Ausgelagerte Tests verbessern die Effizienz. CMOs erweitern ihre globalen Kapazitäten. Regulatorische Vorgaben treiben die Nachfrage nach Dienstleistungen an. Kleine Biotech-Unternehmen sind auf CROs angewiesen. Spezialisierte Expertise fördert die Akzeptanz. Das Wachstum der Auftragsfertigung beschleunigt das Testvolumen. Flexible Servicemodelle ziehen Kunden an. Die Expansion in Schwellenländer unterstützt das Wachstum. Steigende Aktivitäten im Bereich klinischer Studien erhöhen die Nachfrage.
Regionale Analyse des europäischen Marktes für Endotoxin- und Pyrogentests
- Der europäische Markt für Endotoxin- und Pyrogentests wird im Prognosezeitraum voraussichtlich ein deutliches Wachstum verzeichnen, vor allem aufgrund strenger regulatorischer Standards und der steigenden Nachfrage nach sicheren und qualitativ hochwertigen Arzneimitteln, Biologika und Medizinprodukten.
- Die zunehmende Urbanisierung, das Wachstum der Biotechnologie- und Pharmabranche sowie der starke Fokus auf Qualitätskontrolle fördern die Anwendung von Endotoxin- und Pyrogentests in der gesamten Region. Europäische Hersteller integrieren vermehrt fortschrittliche Testplattformen, darunter Gelgerinnungs-, chromogene und rekombinante Technologien, um die Richtlinien von USP, EP und JP zu erfüllen. Investitionen in automatisierte Testsysteme, digitale Berichtserstellung und Laborinfrastruktur verbessern Effizienz, Zuverlässigkeit und Compliance zusätzlich. Die Nachfrage erstreckt sich auf Krankenhäuser, CROs, CMOs und Pharmaunternehmen, insbesondere für injizierbare Arzneimittel, Impfstoffe und Biologika.
- Das wachsende Bewusstsein für Patientensicherheit und Qualitätssicherung im Gesundheitswesen treibt die Marktexpansion voran. Standardisierte Testprotokolle werden sowohl in neuen Einrichtungen als auch bei der Modernisierung bestehender Labore flächendeckend implementiert. Die zunehmende Zusammenarbeit zwischen Pharmaunternehmen und Auftragslaboren unterstützt die Akzeptanz und gewährleistet den Zugang zu modernsten Testtechnologien. Europas Fokus auf Nachhaltigkeit und Innovation fördert ein kontinuierliches Wachstum in allen Segmenten der Endotoxin- und Pyrogen-Testdienstleistungen.
Markteinblicke für Endotoxin- und Pyrogentests in Großbritannien:
Der britische Markt für Endotoxin- und Pyrogentests dominierte 2025 mit einem Umsatzanteil von rund 38,7 % den europäischen Markt . Treiber dieses Wachstums sind die etablierte Pharma- und Biotechnologiebranche, der starke regulatorische Rahmen, signifikante Investitionen in Forschung und Entwicklung sowie die weitverbreitete Anwendung fortschrittlicher Testtechnologien für Endotoxine und Pyrogene in der Herstellung von Biologika, Impfstoffen und Medizinprodukten. Hersteller in Großbritannien setzen zunehmend auf automatisierte Testplattformen und hochempfindliche Assays, um internationale Qualitätsstandards zu erfüllen. Die staatliche Förderung der Lebenswissenschaften und der biomedizinischen Forschung trägt zum weiteren Marktwachstum bei. Die breite Nutzung von Auftragsanalysen, moderner Labortechnik und digitalem Workflow-Management steigert die betriebliche Effizienz. Die wachsende Produktion von injizierbaren Arzneimitteln, Biosimilars und Impfstoffen treibt die Testnachfrage an. Standardisierte Testprotokolle und die Einhaltung der Vorschriften von FDA, EMA und USP gewährleisten hohe Zuverlässigkeit. Der Markt profitiert zudem von der Zusammenarbeit zwischen Pharmaunternehmen und spezialisierten CROs. Der verstärkte Fokus auf Patientensicherheit, Compliance und Qualitätssicherung trägt weiterhin dazu bei, dass Großbritannien das umsatzstärkste Land auf dem europäischen Markt für Endotoxin- und Pyrogentests bleibt.
Markteinblicke für Endotoxin- und Pyrogentests in Deutschland:
Der deutsche Markt für Endotoxin- und Pyrogentests wird im Prognosezeitraum voraussichtlich der am schnellsten wachsende in Europa sein und eine geschätzte durchschnittliche jährliche Wachstumsrate (CAGR) von rund 8,3 % verzeichnen . Dieses Wachstum wird durch den Ausbau der pharmazeutischen und biotechnologischen Produktionsinfrastruktur, zunehmende staatliche Initiativen im Bereich der Lebenswissenschaften, steigende Auftragsforschung und -analyse sowie die Einhaltung strenger EU- und internationaler Qualitätsstandards begünstigt. Der Einsatz automatisierter Testsysteme, darunter chromogene, Gelgerinnungs- und rekombinante Assays, gewährleistet hohe Genauigkeit und die Einhaltung regulatorischer Vorgaben. Die steigende inländische Produktion von Impfstoffen, Biologika und parenteralen Arzneimitteln beschleunigt die Nachfrage nach Endotoxin- und Pyrogentests. Deutschlands Fokus auf Innovation, die Digitalisierung von Laboren und Nachhaltigkeit fördert das Marktwachstum. Unternehmen investieren in die Modernisierung ihrer Labore, digitale Berichtssysteme und Hochdurchsatz-Testplattformen. Die Zusammenarbeit mit globalen CROs und CMOs ermöglicht den Zugang zu fortschrittlichen Testtechnologien. Die regulatorische Angleichung an die EMA- und globalen Sicherheitsstandards gewährleistet die breite Anwendung standardisierter Testprotokolle. Der Markt wird zudem durch ein steigendes Bewusstsein für Patientensicherheit, verbesserte Qualitätskontrollmaßnahmen und die Integration automatisierter Testlösungen in Krankenhäusern, Pharmaunternehmen und Auftragslaboratorien angetrieben.
Marktanteil bei Endotoxin- und Pyrogentests in Europa
Die Branche für Endotoxin- und Pyrogentests wird hauptsächlich von etablierten Unternehmen dominiert, darunter:
• Charles River Laboratories (USA)
• Lonza Group (Schweiz)
• Thermo Fisher Scientific (USA)
• Merck KGaA (Deutschland)
• Associates of Cape Cod (USA)
• WuXi AppTec (China)
• Eurofins Scientific (Luxemburg)
• BioMérieux (Frankreich)
• ToxinSensor (USA)
• Hyglos GmbH (Deutschland)
• Fujifilm Wako Chemicals (Japan)
• GenScript Biotech (China)
• Seikagaku Corporation (Japan)
• Pacific BioLabs (USA)
• Cambrex Corporation (USA)
• SGS SA (Schweiz)
• Kinetic-QCL (USA)
• Nelson Laboratories (USA)
• RANDOX Laboratories (Großbritannien)
• Creative Diagnostics (USA)
Neueste Entwicklungen auf dem europäischen Markt für Endotoxin- und Pyrogentests
- Im April 2021 brachte Associates of Cape Cod, Inc. sein PyroSmart NextGen rekombinantes LAL-Reagenz auf den Markt, ein nachhaltiges Produkt zum Nachweis bakterieller Endotoxine, das die Konsistenz der Testergebnisse verbessern und gleichzeitig die Abhängigkeit von tierischen Materialien verringern soll.
- Im Juni 2021 kündigte die Europäische Arzneibuchkommission eine regulatorische Maßnahme zur Abschaffung des Kaninchenpyrogentests im Europäischen Arzneibuch (Ph. Eur.) innerhalb von fünf Jahren an und empfahl Alternativen wie den Monozyten-Aktivierungstest (MAT), um den sich entwickelnden Standards zu entsprechen.
- Im Januar 2024 hat die FUJIFILM Wako Chemicals USA Corporation ihr Portfolio an Limulus-Amöbozytenlysat (LAL)-Reagenzien verbessert, um eine höhere Sensitivität und geringere Variabilität zu erzielen und so die Zuverlässigkeit von Endotoxintests in parenteralen Arzneimitteln und Medizinprodukten zu erhöhen.
- Im Februar 2024 führte Charles River Laboratories verbesserte Plattformen für den Monocyte Activation Test (MAT) mit integrierter Automatisierung ein, wodurch der Durchsatz und die Reproduzierbarkeit von Arbeitsabläufen zur Pyrogenbestimmung in der Biologika- und Zelltherapieprüfung erhöht wurden.
- Im März 2024 erweiterte die Lonza-Gruppe ihr Angebot an Endotoxin- und Pyrogentests durch die Einführung eines neuen, auf rekombinantem Faktor C (rFC) basierenden Testkits und folgte damit dem Branchentrend hin zu tierversuchsfreien, nachhaltigen Testmethoden.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.