Global Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
543.06 Million
USD
1,593.17 Million
2024
2032
USD
543.06 Million
USD
1,593.17 Million
2024
2032
| 2025 –2032 | |
| USD 543.06 Million | |
| USD 1,593.17 Million | |
|
|
|
|
Globale Marktsegmentierung für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte nach Produkt (On-Premise-Lösungen, Cloud-basierte Lösungen und webbasierte Lösungen), Ansatz (Clinician Reported Outcome Assessment (ClinRO), Patient Reported Outcome Assessment (PRO), Observer Reported Outcome Assessment (ObsRO) und Performance Outcome Assessment (PerfO)), Endbenutzer (kommerzielle Dienstleister, Krankenhäuser und Transplantationszentren, Forschungslabore und akademische Einrichtungen), Plattform (Auftragsforschungsinstitute, Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte, Krankenhäuser und klinische Labore, Beratungsdienstleister, Forschung und Wissenschaft und andere) – Branchentrends und Prognose bis 2032
Elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte Marktgröße
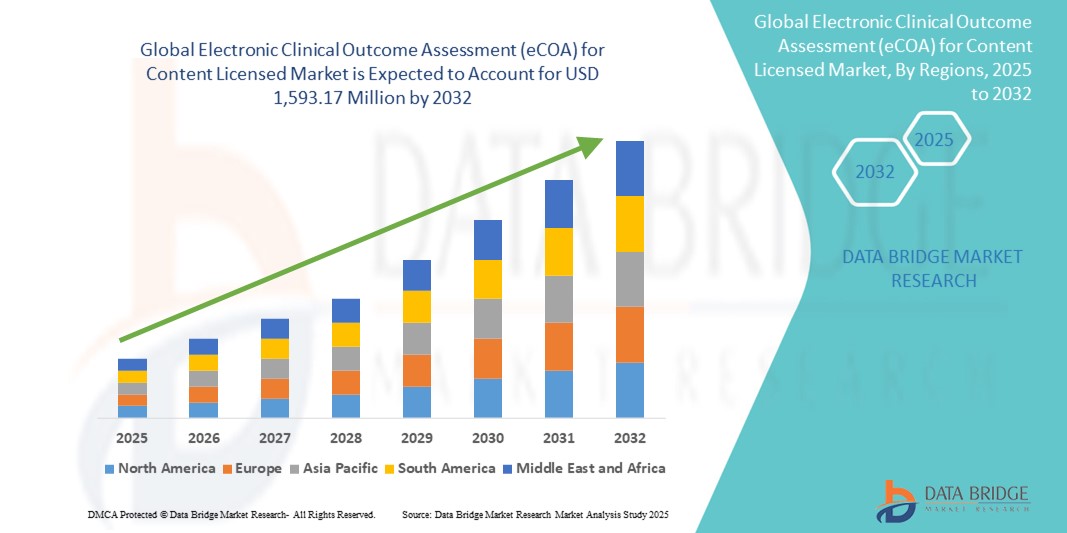
- Der globale Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte hatte im Jahr 2024 einen Wert von 543,06 Millionen US-Dollar und dürfte bis 2032 einen Wert von 1.593,17 Millionen US-Dollar erreichen , was einer jährlichen Wachstumsrate (CAGR) von 14,40 % im Prognosezeitraum entspricht.
- Das Marktwachstum wird maßgeblich durch die steigende Nachfrage nach digitaler Transformation bei klinischen Studien und die zunehmende Betonung der patientenzentrierten Datenerfassung in Echtzeit vorangetrieben, die die Qualität und Compliance der Studien verbessert.
- Darüber hinaus positionieren die zunehmende regulatorische Unterstützung und die Einführung standardisierter, validierter eCOA-Inhalte in der Pharmaindustrie lizenzierte eCOA-Lösungen als bevorzugte Methode zur Erfassung klinischer Endpunkte. Diese konvergierenden Faktoren beschleunigen die Einführung lizenzierter eCOA-Tools und fördern damit das Wachstum der Branche erheblich.
Elektronische klinische Ergebnisbewertung (eCOA) für die Marktanalyse lizenzierter Inhalte
- Lizenzierte eCOA-Lösungen, die von Patienten, Ärzten und Beobachtern gemeldete Ergebnisse digital erfassen, werden aufgrund ihrer verbesserten Datengenauigkeit, ihres Echtzeitzugriffs und ihrer Kompatibilität mit dezentralen Studienmodellen zu unverzichtbaren Werkzeugen in der modernen klinischen Forschung.
- Die steigende Nachfrage nach lizenzierten eCOA-Inhalten wird vor allem durch die zunehmende Komplexität klinischer Studien, den regulatorischen Schwerpunkt auf standardisierte und validierte Datenerfassungsmethoden und die zunehmende Nutzung digitaler Gesundheitsplattformen durch Pharma- und Biotechunternehmen angetrieben.
- Nordamerika dominierte den Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte mit dem größten Umsatzanteil von 46,8 % im Jahr 2024, was auf eine starke regulatorische Infrastruktur, die frühe Einführung digitaler klinischer Technologien und die Präsenz großer klinischer Forschungsorganisationen und eCOA-Lösungsanbieter zurückzuführen ist.
- Der asiatisch-pazifische Raum dürfte im Prognosezeitraum die am schnellsten wachsende Region im Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte sein. Grund dafür sind die zunehmenden klinischen Forschungsaktivitäten, die Harmonisierung der Vorschriften und ein zunehmender Fokus auf die patientenzentrierte Datenerfassung.
- Das Segment der patientenberichteten Ergebnisbewertung (PRO) dominierte den Markt für elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte mit einem Anteil von 50,2 % im Jahr 2024. Dies ist auf seine entscheidende Rolle bei der Bewertung der Behandlungswirksamkeit und des Patientenwohls zurückzuführen, zusammen mit der zunehmenden Betonung der Erfassung direkter Patienteneingaben in Studienprotokollen.
Berichtsumfang und elektronische klinische Ergebnisbewertung (eCOA) für die Marktsegmentierung lizenzierter Inhalte
|
Eigenschaften |
Elektronische klinische Ergebnisbewertung (eCOA) für Inhalte Lizenzierte Schlüsselmarkteinblicke |
|
Abgedeckte Segmente |
|
|
Abgedeckte Länder |
Nordamerika
Europa
Asien-Pazifik
Naher Osten und Afrika
Südamerika
|
|
Wichtige Marktteilnehmer |
|
|
Marktchancen |
|
|
Wertschöpfungsdaten-Infosets |
Zusätzlich zu den Einblicken in Marktszenarien wie Marktwert, Wachstumsrate, Segmentierung, geografische Abdeckung und wichtige Akteure enthalten die von Data Bridge Market Research kuratierten Marktberichte auch ausführliche Expertenanalysen, Preisanalysen, Markenanteilsanalysen, Verbraucherumfragen, demografische Analysen, Lieferkettenanalysen, Wertschöpfungskettenanalysen, eine Übersicht über Rohstoffe/Verbrauchsmaterialien, Kriterien für die Lieferantenauswahl, PESTLE-Analysen, Porter-Analysen und regulatorische Rahmenbedingungen. |
Elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte – Markttrends
„Digitale Standardisierung und KI-gesteuerte Verbesserungen bei klinischen Studien“
- Ein bedeutender und sich entwickelnder Trend im globalen eCOA-Markt für lizenzierte Inhalte ist die Integration von künstlicher Intelligenz (KI) und standardisierten digitalen Inhalten zur Verbesserung der Datenqualität, der Einhaltung gesetzlicher Vorschriften und der Patientenbeteiligung an klinischen Studien. Diese Konvergenz optimiert die Datenerfassung und verbessert die Studieneffizienz.
- Beispielsweise bieten Unternehmen wie Medidata Solutions und ERT KI-gestützte lizenzierte eCOA-Lösungen an, die eine Echtzeitüberwachung von Patientendaten und prädiktive Analysen für eine bessere Prognose von Studienergebnissen ermöglichen. KI-gestützte Plattformen können Datenanomalien erkennen, eine erneute Validierung veranlassen und adaptive Studiendesigns unterstützen.
- Lizenzierte eCOA-Inhalte stellen sicher, dass alle von Patienten, Ärzten und Beobachtern berichteten Ergebnisse den regulatorischen und wissenschaftlichen Standards entsprechen und so die Konsistenz und Zuverlässigkeit multinationaler Studien fördern. Diese Inhaltslizenzen werden zunehmend mit fortschrittlichen eCOA-Plattformen gebündelt, um schlüsselfertige Lösungen bereitzustellen.
- Die Integration mit eConsent-Plattformen und tragbaren Geräten verbessert die Patientencompliance zusätzlich und reduziert den Aufwand vor Ort durch die Automatisierung von Datenerfassungsabläufen. So ermöglicht Signant Health beispielsweise die Verknüpfung lizenzierter PRO-Maßnahmen mit biometrischen Daten von tragbaren Geräten, um ein ganzheitlicheres Verständnis der Behandlungsauswirkungen zu ermöglichen.
- Der Trend zu digitalisierten, validierten Inhalten auf KI-fähigen eCOA-Plattformen verändert die Art und Weise, wie Stakeholder globale klinische Studien durchführen und verwalten. Daher investieren Unternehmen wie IQVIA und Kayentis in skalierbare, mehrsprachige lizenzierte Inhaltsbibliotheken, die in benutzerfreundliche, KI-gestützte Plattformen eingebettet sind.
- Die Nachfrage nach eCOA-Lösungen mit vorab genehmigten, gesetzeskonformen Inhalten wächst rasant, da Sponsoren und CROs versuchen, das Risiko von Studien zu verringern und sowohl die Patientenerfahrung als auch die Datengenauigkeit durch intelligente digitale Tools zu verbessern.
Elektronische klinische Ergebnisbewertung (eCOA) für die Dynamik des Marktes für lizenzierte Inhalte
Treiber
„Steigende regulatorische Anforderungen und digitaler Wandel in der klinischen Forschung“
- Die zunehmende Bedeutung von Datenstandardisierung und Einhaltung gesetzlicher Vorschriften bei klinischen Studien sowie die digitale Transformation klinischer Forschungsprozesse sind ein Haupttreiber des Marktes für lizenzierte eCOA-Inhalte.
- So brachte Clinical Ink im März 2024 eine Reihe vorvalidierter eCOA-Instrumente auf den Markt, die für globale Studien lizenziert sind. Dies verkürzt die Einrichtungszeit und reduziert das regulatorische Risiko. Solche Initiativen unterstreichen den Trend der Branche hin zu validierten digitalen Datenerfassungsmethoden.
- Da Studiensponsoren und Aufsichtsbehörden patientenzentrierte Ergebnisse und die Generierung robuster Beweise priorisieren, bieten lizenzierte eCOA-Instrumente wissenschaftlich validierte Methoden, die den regulatorischen Erwartungen entsprechen und Verzögerungen bei der Studiengenehmigung oder Dateneinreichung reduzieren.
- Die zunehmende Verlagerung hin zu dezentralen und hybriden klinischen Studien hat auch die Nachfrage nach digitalen Tools beschleunigt, die eine konsistente Patientendatenerfassung über verschiedene Regionen und Bevölkerungsgruppen hinweg gewährleisten. Lizenzierte Inhalte, die in digitale Plattformen integriert werden, verbessern sowohl die Skalierbarkeit als auch die Compliance.
- Darüber hinaus fördert der verbesserte Zugang zu eCOA-Tools über mobile Geräte, kombiniert mit intuitiven Schnittstellen und mehrsprachigem Support, die Akzeptanz bei Studienteilnehmern weltweit und trägt zu einer stärkeren Patientenbeteiligung und Datenzuverlässigkeit bei.
Einschränkung/Herausforderung
„Komplexe Lizenzmodelle und Integrationsbarrieren“
- Eine der größten Herausforderungen bei der Einführung lizenzierter eCOA-Inhalte ist die Komplexität der Lizenzvereinbarungen und die Integration in klinische Systeme. Zahlreiche Interessengruppen, hohe Kosten und regionale regulatorische Unterschiede können die Implementierung verzögern oder erschweren.
- Beispielsweise kann die Lizenzierung bestimmter standardisierter PROs wie EQ-5D oder SF-36 komplizierte Verhandlungen mit den Rechteinhabern nach sich ziehen, insbesondere bei der Verwendung in multinationalen Studien, was die Projektzeitpläne und -kosten verlängert.
- Darüber hinaus erfordert die Integration lizenzierter Inhalte in bestehende elektronische Datenerfassungs- (EDC) oder eSource-Plattformen oft eine kundenspezifische Entwicklung oder Middleware, was zu technischen Verzögerungen oder einem erhöhten Betriebsaufwand führen kann.
- Die Gewährleistung der Interoperabilität zwischen lizenzierten eCOA-Instrumenten und Sponsor-/CRO-Systemen bleibt eine technische Hürde, insbesondere bei der Verwaltung unterschiedlicher Geräte, Studienumgebungen und Patientenpopulationen.
- Hohe Vorlaufkosten für validierte Inhaltsbibliotheken und laufende Lizenzgebühren können auch die Einführung bei kleineren Biotech-Unternehmen oder akademischen Forschern mit begrenztem Budget behindern.
- Die Überwindung dieser Hindernisse durch einheitliche Lizenzierungsrahmen, Cloud-basierte Bereitstellungsmodelle und benutzerfreundliche Integrationstools wird für die Ausweitung der Nutzung lizenzierter eCOA-Inhalte in der zukünftigen klinischen Forschung von entscheidender Bedeutung sein.
Elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte – Marktumfang
Der Markt ist nach Produkt, Ansatz, Endbenutzer und Plattform segmentiert.
- Nach Produkt
Der Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte ist produktbezogen in On-Premise-Lösungen, Cloud-Lösungen und webbasierte Lösungen unterteilt. Das Segment der Cloud-Lösungen dominierte den Markt mit dem größten Umsatzanteil im Jahr 2024 aufgrund seiner Skalierbarkeit, einfachen Bereitstellung und der Fähigkeit, dezentrale und hybride klinische Studien zu unterstützen. Sponsoren und CROs bevorzugen zunehmend Cloud-basierte eCOA-Plattformen, da diese Echtzeit-Datenerfassung, Fernzugriff und nahtlose Integration mit anderen eClinical-Systemen bieten und gleichzeitig Infrastrukturkosten und IT-Komplexität reduzieren.
Das Segment webbasierter Lösungen wird voraussichtlich von 2025 bis 2032 das höchste Wachstum verzeichnen. Dies ist auf die zunehmende Internetdurchdringung, die Ausweitung globaler Studien und die Nachfrage nach browserbasierten Plattformen mit minimalem Einrichtungsaufwand zurückzuführen. Webbasierte eCOA-Tools bieten Patienten und Studienzentren über Regionen und Gerätetypen hinweg umfassenden Zugriff und fördern so die Akzeptanz in multinationalen Studien.
- Nach Ansatz
Basierend auf dem Ansatz ist die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte in die Bereiche Clinician Reported Outcome Assessment (ClinRO), Patient Reported Outcome Assessment (PRO), Observer Reported Outcome Assessment (ObsRO) und Performance Outcome Assessment (PerfO) segmentiert. Das Segment Patient Reported Outcome (PRO) dominierte den Markt mit dem größten Umsatzanteil von 50,2 % im Jahr 2024, da Aufsichtsbehörden zunehmend die Berücksichtigung der Patientenperspektive in der klinischen Forschung vorschreiben. Lizenzierte PRO-Instrumente bieten validierte und standardisierte Methoden zur Bewertung von Lebensqualität, Symptomen und Behandlungseffekten aus Patientensicht und tragen so zu stärkeren klinischen Nachweisen und Zulassungsanträgen bei.
Das Segment der Leistungsergebnisbewertung (PerfO) wird voraussichtlich zwischen 2025 und 2032 aufgrund der steigenden Nachfrage nach objektiven und funktionalen Bewertungen in klinischen Studien das schnellste Wachstum verzeichnen. PerfO-Tools erfassen Echtzeitdaten basierend auf den von Patienten ausgeführten Aufgaben, häufig mithilfe digitaler Geräte oder Wearables, und ermöglichen so präzisere Wirksamkeitsbewertungen und Studienendpunkte.
- Nach Endbenutzer
Der Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte ist nach Endnutzern segmentiert: kommerzielle Dienstleister, Krankenhäuser und Transplantationszentren, Forschungslabore und akademische Einrichtungen. Das Segment der kommerziellen Dienstleister hatte 2024 den größten Anteil, was auf die umfassende Nutzung von eCOA-Plattformen durch Auftragsforschungsinstitute (CROs), Datenmanagementfirmen und Technologieanbieter zurückzuführen ist. Diese Dienstleister fungieren als Vermittler zwischen Sponsoren und klinischen Standorten, implementieren lizenzierte Inhaltslösungen in großem Umfang und gewährleisten die Einhaltung von Studienprotokollen und globalen Standards.
Das Segment der akademischen Einrichtungen wird voraussichtlich zwischen 2025 und 2032 am stärksten wachsen. Dies wird durch zunehmende akademisch geleitete Forschungsinitiativen, einen verbesserten Zugang zu Fördermitteln für digitale klinische Instrumente und gemeinsame Studien mit Industriepartnern vorangetrieben. Die Einführung von eCOA-Tools mit lizenzierten Inhalten in akademischen Studien trägt zu einer verbesserten Datengenauigkeit und Reproduzierbarkeit bei.
- Nach Plattform
Der Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte ist plattformbasiert in Auftragsforschungsinstitute (CROs), Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte, Krankenhäuser und klinische Labore, Beratungsunternehmen, Forschung und Lehre und weitere segmentiert. Das Segment der Pharma- und Biopharmaunternehmen dominierte den Markt im Jahr 2024, da diese Unternehmen den Großteil der globalen klinischen Studien durchführen und validierte, gesetzeskonforme eCOA-Lösungen für patientenzentrierte Ergebnisse benötigen. Ihre Investitionen in lizenzierte Inhalte verbessern die Studieneffizienz, die globale Konsistenz und die regulatorische Akzeptanz.
Das Segment der Auftragsforschungsinstitute (CROs) wird voraussichtlich von 2025 bis 2032 das schnellste Wachstum verzeichnen, unterstützt durch Outsourcing-Trends in der klinischen Entwicklung. CROs nutzen zunehmend schlüsselfertige eCOA-Plattformen mit integrierten lizenzierten Inhalten, um Sponsoren umfassende Studienmanagement-Services anzubieten, insbesondere für länderübergreifende Studien, bei denen standardisierte Ergebnismessungen entscheidend sind.
Elektronische klinische Ergebnisbewertung (eCOA) für die regionale Analyse des Marktes für lizenzierte Inhalte
- Nordamerika dominierte den Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte mit dem größten Umsatzanteil von 46,8 % im Jahr 2024, was auf eine starke regulatorische Infrastruktur, die frühe Einführung digitaler klinischer Technologien und die Präsenz großer klinischer Forschungsorganisationen und eCOA-Lösungsanbieter zurückzuführen ist.
- Interessenvertreter in der Region, darunter Pharmaunternehmen, CROs und akademische Einrichtungen, legen Wert auf die Verwendung validierter, standardisierter Ergebnismessungen, um die Erwartungen der FDA und EMA zu erfüllen, was die Nachfrage nach lizenzierten eCOA-Lösungen ankurbelt.
- Die Dominanz der Region wird durch hohe Investitionen in Forschung und Entwicklung, fortschrittliche eClinical-Ökosysteme und eine zunehmende Anzahl dezentraler und hybrider Studien weiter unterstützt. Dadurch werden lizenzierte eCOA-Inhalte zu einer entscheidenden Komponente für die Gewährleistung von Datengenauigkeit, Compliance und Patientenbeteiligung in modernen klinischen Studien.
US Electronic Clinical Outcome Assessment (eCOA) für Content Licensed Market Insight
Der US-Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte erzielte 2024 mit 79,5 % den größten Umsatzanteil in Nordamerika. Dies ist auf die führende Rolle des Landes bei klinischen Studien und die Einhaltung standardisierter Ergebnismessungen zurückzuführen. Das Engagement der FDA für patientenorientierte Arzneimittelentwicklung und validierte PRO-Instrumente fördert weiterhin die breite Einführung lizenzierter eCOA-Tools. Darüber hinaus treiben die Verbreitung dezentraler Studien und die schnelle Einführung digitaler Gesundheitstechnologien durch Sponsoren und CROs die Nachfrage nach eCOA-Plattformen mit lizenzierten, gesetzeskonformen Inhalten weiter voran.
Europa: Elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte – Markteinblick
Der europäische Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte wird im Prognosezeitraum voraussichtlich mit einer deutlichen jährlichen Wachstumsrate wachsen, vor allem aufgrund der regulatorischen Harmonisierung der Region durch die EMA und steigender Investitionen in patientenzentrierte Forschung. Die wachsende Zahl länderübergreifender Studien und die Nachfrage nach mehrsprachigen, validierten PRO- und ObsRO-Inhalten fördern die Akzeptanz. Der Trend zur Digitalisierung aller Aspekte klinischer Studien, einschließlich Einwilligungs- und Ergebnisbewertungen, unterstützt die Marktexpansion in verschiedenen Therapiebereichen und klinischen Forschungsnetzwerken.
UK Electronic Clinical Outcome Assessment eCOA für lizenzierte Inhalte Market Insight
Der britische Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte wird im Prognosezeitraum voraussichtlich mit einer bemerkenswerten jährlichen Wachstumsrate wachsen, angetrieben durch vom NHS unterstützte digitale Gesundheitsinitiativen und den Fokus auf die Generierung von Real-World-Evidenz. Der Schwerpunkt auf der Erfassung von Patientenergebnissen in einem standardisierten digitalen Format hat Pharmaunternehmen und Forschungseinrichtungen dazu ermutigt, in lizenzierte eCOA-Instrumente zu investieren. Darüber hinaus fördern das starke akademische Forschungsökosystem und die aktive Studienbeteiligung im ganzen Land eine breitere Akzeptanz von eCOA.
Deutschland Elektronische klinische Ergebnisbewertung eCOA für Inhalte Lizenzierter Markteinblick
Der deutsche Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte wird im Prognosezeitraum voraussichtlich mit einer beträchtlichen jährlichen Wachstumsrate wachsen. Dies wird durch den starken Fokus Deutschlands auf regulatorische Compliance, klinische Datenqualität und Innovation im digitalen Gesundheitswesen unterstützt. Die deutsche Pharma- und Medizintechnikbranche ist ein früher Anwender validierter eCOA-Inhalte, insbesondere in der Onkologie und bei Studien zu seltenen Krankheiten. Das Engagement Deutschlands für Präzisionsmedizin und Datenschutz harmoniert gut mit lizenzierten eCOA-Lösungen, die eine sichere und standardisierte Ergebniserfassung ermöglichen.
Elektronische klinische Ergebnisbewertung (eCOA) für den asiatisch-pazifischen Raum für Einblicke in den Markt lizenzierter Inhalte
Der Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte im asiatisch-pazifischen Raum wird im Prognosezeitraum von 2025 bis 2032 voraussichtlich mit einer durchschnittlichen jährlichen Wachstumsrate von 23,2 % wachsen. Dies ist auf einen Anstieg der klinischen Studien in Schwellenländern und erhöhte Investitionen in die digitale Gesundheitsinfrastruktur zurückzuführen. Länder wie China, Japan und Indien beschleunigen die Einführung dieser Lösungen aufgrund ihrer Teilnahme an globalen Studien, der Lokalisierung lizenzierter Inhalte und des steigenden Bedarfs an patientenorientierten, mehrsprachigen eCOA-Lösungen.
Japan Electronic Clinical Outcome Assessment eCOA für lizenzierte Inhalte – Markteinblick
Die elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte in Japan gewinnt an Dynamik, da das Land großen Wert auf Innovationen im Gesundheitswesen, Altenpflege und strenge regulatorische Aufsicht legt. Japanische Pharmaunternehmen setzen lizenzierte PRO- und ClinRO-Tools ein, um qualitativ hochwertige Daten in späten Studienphasen und der Marktüberwachung sicherzustellen. Die Integration von eCOA-Systemen mit breiteren eClinical-Plattformen und IoT-Medizingeräten unterstützt eine verbesserte Patienteneinbindung und Ergebnisüberwachung.
Indien Elektronische klinische Ergebnisbewertung eCOA für lizenzierte Inhalte Markteinblick
Der indische Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte erzielte 2024 den größten Umsatzanteil im asiatisch-pazifischen Raum. Dies ist auf die wachsende klinische Studienlandschaft des Landes, die schnelle digitale Transformation und die kosteneffiziente Leistungserbringung durch Auftragsforschungsinstitute (CROs) zurückzuführen. Die staatlich geförderte Digitalisierung des Gesundheitswesens und der Aufstieg inländischer Anbieter von eClinical-Technologien beschleunigen die Einführung lizenzierter eCOA-Instrumente. Indiens mehrsprachige Bevölkerung und die vielfältigen Gesundheitseinrichtungen treiben zudem die Nachfrage nach flexiblen, validierten Inhalten voran, die an die regionalen Studienanforderungen angepasst sind.
Elektronische klinische Ergebnisbewertung (eCOA) für den Marktanteil lizenzierter Inhalte
Die elektronische klinische Ergebnisbewertung (eCOA) für die Inhaltslizenzbranche wird hauptsächlich von etablierten Unternehmen durchgeführt, darunter:
- Medidata Solutions, Inc. (USA)
- Signant Health (USA)
- IQVIA Inc. (USA)
- YPrime, Inc. (USA)
- Clario (USA)
- Clinical Ink, Inc. (USA)
- ERT, Inc. (USA)
- Kayentis SAS (Frankreich)
- Veeva Systems Inc. (USA)
- Oracle Health Sciences (USA)
- Parexel International Corporation (USA)
- eResearch Technology, Inc. (USA)
- ArisGlobal LLC (USA)
- Calyx (USA)
- Castor EDC (Niederlande)
- Datatrak International, Inc. (USA)
- Medrio, Inc. (USA)
- OpenClinica, LLC (USA)
- Trial By Fire Solutions, LLC (USA)
Was sind die jüngsten Entwicklungen im globalen Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte?
- Im Mai 2024 brachte Medidata Solutions, ein Unternehmen von Dassault Systèmes, eine verbesserte Version seiner myMedidata-Plattform auf den Markt. Diese bietet erweiterte Unterstützung für lizenzierte klinische Ergebnisbewertungen in globalen Studien. Dieses Update umfasst mehrsprachige, validierte eCOA-Instrumente, die nahtlos in eConsent und tragbare Daten integriert sind und so die dezentrale Durchführung von Studien vereinfachen. Die Markteinführung unterstreicht Medidatas Engagement für einheitliche, gesetzeskonforme Lösungen, die die Patienteneinbindung und Datenintegrität in allen Therapiebereichen verbessern.
- Im April 2024 gab Signant Health die Erweiterung seiner lizenzierten Inhaltsbibliothek durch neue Vereinbarungen mit mehreren Lizenzgebern für PRO-Messungen bekannt. Dieser Schritt ermöglicht eine schnellere Bereitstellung standardisierter Ergebnismessungen innerhalb der eCOA-Plattform, insbesondere für Onkologie- und ZNS-Studien. Diese Entwicklung unterstreicht Signants Strategie, seine Fähigkeiten zur validierten Datenerfassung zu stärken und gleichzeitig die Einrichtungszeit für globale Studien zu verkürzen.
- Im März 2024 stellte IQVIA seine KI-gestützte eCOA-Suite vor, die mit lizenzierten PROs integriert ist, um die Datenerfassung in der Praxis und in der klinischen Forschung zu optimieren. Die Plattform nutzt prädiktive Analysen und intelligente Patientenhinweise, um die Antwortraten zu verbessern und Datenlücken zu minimieren. Dies spiegelt IQVIAs Fokus auf Innovation und regulatorische Anpassung bei digitalen Studien wider.
- Im Februar 2024 kooperierte YPrime mit mehreren akademischen Einrichtungen, um vorlizenzierte eCOA-Lösungen für Studien zu seltenen Krankheiten bereitzustellen. Dies beschleunigte den Studienstart und verbesserte die Einhaltung gesetzlicher Vorschriften. Die Zusammenarbeit ermöglicht einen breiteren Zugang zu schwer zugänglichen Ergebnismessungen und unterstreicht YPrimes Engagement für den Ausbau der Forschungskapazitäten in unterversorgten Therapiebereichen.
- Im Januar 2024 führte Clinical Ink eine neue digitale Plattform ein, die schlüsselfertigen Zugang zu validierten, lizenzierten eCOA-Instrumenten für den Einsatz in dezentralen Studien bietet. Die Lösung wurde entwickelt, um den globalen Einsatz zu vereinfachen. Sie umfasst integrierte Übersetzungen und ein automatisiertes Compliance-Tracking. Dies spiegelt das Ziel des Unternehmens wider, die eCOA-Implementierung effizienter, skalierbarer und an die sich entwickelnden regulatorischen Erwartungen anzupassen.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.