Global Medical Device Clinical Investigation Advisory Solutions Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
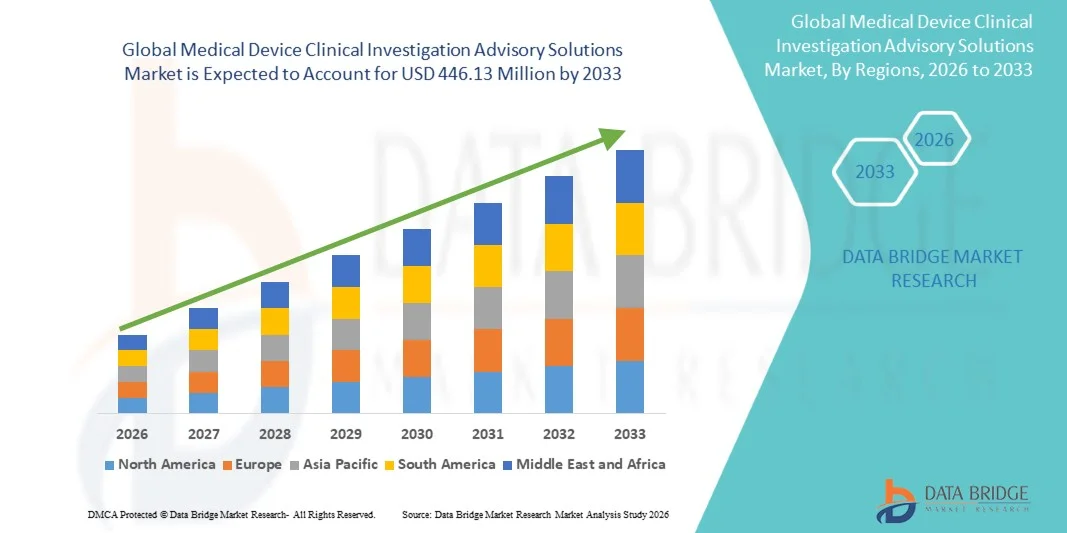
186.21 Million
USD
446.13 Million
2025
2033
USD
186.21 Million
USD
446.13 Million
2025
2033
| 2026 –2033 | |
| USD 186.21 Million | |
| USD 446.13 Million | |
|
|
|
|
Marktsegmentierung des globalen Marktes für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte nach Dienstleistungsart (Zulassungsberatung und Management klinischer Studien), Endnutzer (Medizintechnikunternehmen und Auftragsforschungsinstitute (CROs)) – Branchentrends und Prognose bis 2033
Marktgröße für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten
- Der globale Markt für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte hatte im Jahr 2025 einen Wert von 186,21 Millionen US-Dollar und wird voraussichtlich bis 2033 auf 446,13 Millionen US-Dollar anwachsen , was einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 11,54 % im Prognosezeitraum entspricht.
- Das Marktwachstum wird maßgeblich durch die zunehmende Komplexität der regulatorischen Rahmenbedingungen in der Medizinprodukteindustrie angetrieben, verbunden mit der steigenden Nutzung von Outsourcing-Dienstleistungen für die Beratung im Bereich klinischer Studien, um schnellere Produktzulassungen und die Einhaltung der Vorschriften auf den globalen Märkten zu gewährleisten.
- Darüber hinaus führt die steigende Nachfrage nach kosteneffizienter und fachlich fundierter Beratung zu klinischen Studien dazu, dass Medizinproduktehersteller verstärkt auf spezialisierte Beratungslösungen zurückgreifen, was das Wachstum der Branche erheblich ankurbelt.
Marktanalyse für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten
- Beratungsleistungen für klinische Studien mit Medizinprodukten, die von Experten geleitete Beratung und regulatorische Unterstützung für klinische Prüfungen bieten, sind für Hersteller von Medizinprodukten zunehmend unerlässlich, um Produktzulassungen zu beschleunigen, die Einhaltung von Vorschriften sicherzustellen und klinische Abläufe auf globalen Märkten zu optimieren.
- Die steigende Nachfrage nach diesen Beratungsleistungen wird vor allem durch die zunehmende Komplexität regulatorischer Rahmenbedingungen, den Bedarf an kürzeren Markteinführungszeiten und die verstärkte Nutzung von Outsourcing durch Medizintechnikunternehmen angetrieben, die kosteneffiziente und spezialisierte Unterstützung bei klinischen Studien suchen.
- Nordamerika dominierte 2025 mit einem Umsatzanteil von 39,2 % den Markt für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte. Dies ist auf die starke Präsenz wichtiger Medizinprodukteunternehmen, eine ausgereifte Infrastruktur für die klinische Forschung und strenge regulatorische Anforderungen zurückzuführen.
- Der asiatisch-pazifische Raum dürfte im Prognosezeitraum aufgrund des rasanten Wachstums der Medizintechnikbranche, zunehmender klinischer Studien und des verstärkten Outsourcings von regulatorischen und Beratungsdienstleistungen die am schnellsten wachsende Region auf dem Markt sein.
- Das Segment „Regulatorische Beratung“ dominierte 2025 mit einem Marktanteil von 58,4 % den Marktumsatz, was auf die zunehmende Komplexität der Vorschriften für Medizinprodukte in Regionen wie Nordamerika, Europa und dem asiatisch-pazifischen Raum zurückzuführen ist.
Berichtsumfang und Marktsegmentierung für Beratungsleistungen im Bereich klinischer Studien mit Medizinprodukten
|
Attribute |
Beratungslösungen für klinische Studien mit Medizinprodukten – Wichtigste Markteinblicke |
|
Abgedeckte Segmente |
|
|
Abgedeckte Länder |
Nordamerika
Europa
Asien-Pazifik
Naher Osten und Afrika
Südamerika
|
|
Wichtige Marktteilnehmer |
|
|
Marktchancen |
|
|
Mehrwertdaten-Infosets |
Zusätzlich zu den Erkenntnissen über Marktszenarien wie Marktwert, Wachstumsrate, Segmentierung, geografische Abdeckung und Hauptakteure enthalten die von Data Bridge Market Research erstellten Marktberichte auch detaillierte Expertenanalysen, Patientenepidemiologie, Pipeline-Analyse, Preisanalyse und regulatorische Rahmenbedingungen. |
Markttrends für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten
„ Zunehmende Nutzung von Beratungsleistungen im Bereich fortschrittlicher klinischer Studien “
- Ein bemerkenswerter Trend auf dem globalen Markt für Beratungsleistungen im Bereich klinischer Prüfungen von Medizinprodukten ist die zunehmende Inanspruchnahme spezialisierter Beratungsdienstleistungen zur Unterstützung klinischer Studien, Zulassungsanträge und der Marktüberwachung von Medizinprodukten.
- Unternehmen investieren zunehmend in Lösungen, die dazu beitragen, die Planung klinischer Studien, die Protokollentwicklung und die Einhaltung regulatorischer Vorgaben zu optimieren, um die Markteinführungszeit zu verkürzen und Risiken zu minimieren.
- Beispielsweise haben im Jahr 2024 mehrere Medizinproduktehersteller in Nordamerika Partnerschaften mit Anbietern von Beratungslösungen geschlossen, um ihre Strategien für klinische Studien zu optimieren und schnellere behördliche Zulassungen zu gewährleisten.
- Zudem besteht eine steigende Nachfrage nach integrierten Lösungen, die wissenschaftliche, regulatorische und operative Expertise kombinieren, um Hersteller bei der effizienten Durchführung qualitativ hochwertiger und regelkonformer klinischer Studien zu unterstützen.
- Dieser Trend spiegelt die zunehmende Komplexität der regulatorischen Rahmenbedingungen und den Bedarf an fachkundiger Beratung während des gesamten Produktlebenszyklus wider und treibt die Inanspruchnahme von Beratungsleistungen für klinische Prüfungen weltweit voran.
Marktdynamik von Beratungslösungen für klinische Studien mit Medizinprodukten
Treiber
„Wachsender Bedarf an regulatorischer Konformität und effizientem Management klinischer Studien“
- Die steigenden regulatorischen Anforderungen an Medizinprodukte, einschließlich strenger Sicherheits- und Wirksamkeitsstandards, sind ein Hauptgrund für die zunehmende Nutzung von Beratungslösungen.
- Hersteller suchen fachkundige Unterstützung, um sich in den komplexen Vorschriften zurechtzufinden, Zulassungsanträge vorzubereiten und die Einhaltung der Vorgaben von Behörden wie der FDA, der EMA und anderen regionalen Behörden sicherzustellen.
- Anfang 2025 beauftragte beispielsweise ein europäisches Medizinprodukteunternehmen Beratungsleistungen, um die Einhaltung der neuen EU-MDR-Vorschriften zu erleichtern und so das Risiko von Verzögerungen bei der Zulassung zu verringern.
- Darüber hinaus treibt der Bedarf an optimierter Effizienz klinischer Studien, reduzierten Betriebskosten und kürzeren Produktentwicklungszyklen die Nachfrage nach diesen Lösungen an.
- Das zunehmende Bewusstsein für Patientensicherheit, Qualität klinischer Evidenz und Risikomanagement ermutigt Hersteller zusätzlich, auf professionelle Beratungsleistungen zurückzugreifen, um Studiendesigns und -ergebnisse zu verbessern.
Zurückhaltung/Herausforderung
„ Hohe Kosten und begrenzte Verfügbarkeit von Fachkompetenz “
- Die vergleichsweise hohen Kosten für die Inanspruchnahme von Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte können insbesondere für kleine und mittlere Hersteller in Schwellenländern ein Hindernis darstellen.
- Fortgeschrittene Beratungsleistungen erfordern oft langfristige Verträge oder Honorarvereinbarungen, was für Organisationen mit begrenzten Budgets ein unerschwingliches Budget darstellen kann.
- Beispielsweise verzögerten mehrere Startups in Asien im Jahr 2023 aufgrund von Budgetbeschränkungen die Beauftragung von Beratungsleistungen, was sich auf das Tempo ihrer klinischen Studien auswirkte.
- Die begrenzte Verfügbarkeit qualifizierter und erfahrener Berater in bestimmten Regionen schränkt ebenfalls die Marktdurchdringung ein und kann zu Projektverzögerungen führen.
- Die Bewältigung dieser Herausforderungen durch kosteneffiziente Servicemodelle, die regionale Expansion von Beratungsunternehmen und Fernberatungsoptionen wird der Schlüssel für ein nachhaltiges Marktwachstum sein.
Marktumfang für Beratungsleistungen im Bereich klinischer Studien mit Medizinprodukten
Der Markt ist nach Art der Dienstleistung und Endnutzern segmentiert.
• Nach Serviceart
Basierend auf der Art der Dienstleistung ist der Markt für Beratungsleistungen im Bereich klinischer Prüfungen von Medizinprodukten in regulatorische Beratung und Management klinischer Studien unterteilt. Das Segment der regulatorischen Beratung dominierte 2025 mit einem Marktanteil von 58,4 % den größten Umsatzanteil. Treiber dieser Entwicklung ist die zunehmende Komplexität der Vorschriften für Medizinprodukte in Regionen wie Nordamerika, Europa und dem asiatisch-pazifischen Raum. Medizinproduktehersteller sind stark auf regulatorische Beratungsleistungen angewiesen, um Zulassungsverfahren, die Einhaltung der Vorschriften nach der Markteinführung und die Einreichung von Unterlagen zu bewältigen. Der wachsende Fokus auf Patientensicherheit und Produktqualitätsstandards treibt die Nachfrage an. Regulatorische Berater bieten Unterstützung bei Risikomanagement, Kennzeichnung und Dokumentation und gewährleisten so einen schnelleren Marktzugang. Strenge Compliance-Anforderungen von Behörden wie FDA, EMA und PMDA verstärken die Abhängigkeit von diesen Dienstleistungen. Technologische Fortschritte bei elektronischen Einreichungen und der digitalen Nachverfolgung regulatorischer Prozesse steigern die Effizienz zusätzlich. Das Segment profitiert von langfristigen Verträgen mit führenden Medizinprodukteherstellern. Steigende Markteinführungszahlen innovativer Geräte und hochwertiger Diagnoseinstrumente sorgen für eine kontinuierliche Nachfrage. Regulatorische Beratungsleistungen reduzieren die rechtlichen und operativen Risiken für Hersteller. Die zunehmende Fokussierung auf die globale Harmonisierung von Standards stärkt die Marktführerschaft dieses Segments. Durch das Outsourcing regulatorischer Expertise können Unternehmen Kosten optimieren und die Markteinführungszeit verkürzen. Diese Faktoren zusammengenommen machen die regulatorische Beratung zum größten Dienstleistungssegment.
Das Segment „Management klinischer Studien“ wird voraussichtlich von 2026 bis 2033 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 11,3 % das schnellste Wachstum verzeichnen. Treiber dieser Entwicklung ist die steigende Anzahl klinischer Studien und Post-Market-Studien für neue und innovative Medizinprodukte. Die zunehmende Nutzung digitaler Studienmanagement-Plattformen gewährleistet eine optimierte Studienplanung, Patientenrekrutierung, Überwachung und Berichterstattung. Das Outsourcing des Studienmanagements an spezialisierte Anbieter reduziert den operativen Aufwand für Medizinproduktehersteller. Die steigende Komplexität multizentrischer Studien und der Bedarf an Echtzeit-Datenerfassung fördern dieses Wachstum. Regulierungsbehörden legen Wert auf Datenintegrität, Auditbereitschaft und risikobasierte Überwachung, was die Nachfrage weiter steigert. Die Expansion der F&E-Pipelines für Medizinprodukte in Schwellenländern treibt die Akzeptanz an. CROs bieten zunehmend umfassende Studienmanagement-Lösungen für mehr Effizienz an. Fortschrittliche Analysen und KI-gestützte Überwachung im Studienmanagement verbessern die Genauigkeit und verkürzen die Bearbeitungszeiten. Die Nachfrage nach kosteneffizienten Lösungen während der Produktentwicklung unterstützt die Akzeptanz. Die Integration mit elektronischen Patientenakten und Wearables beschleunigt die Effizienz klinischer Studien. Der wachsende Trend zu patientenzentrierten Studien fördert die Akzeptanz. Zusammengenommen machen diese Faktoren das Management klinischer Studien zum am schnellsten wachsenden Dienstleistungssegment.
• Von Endnutzern
Basierend auf den Endnutzern ist der Markt für Beratungsleistungen im Bereich klinischer Prüfungen für Medizinprodukte in Medizinprodukteunternehmen und Auftragsforschungsinstitute (CROs) unterteilt. Das Segment der Medizinprodukteunternehmen erzielte 2025 mit 64,7 % den größten Marktanteil, bedingt durch die weltweit steigende Anzahl von Produkteinführungen und die Notwendigkeit, strenge regulatorische Standards einzuhalten. Unternehmen sind stark auf externe Beratungsleistungen angewiesen, um den Markteintritt zu beschleunigen und die Compliance sicherzustellen. Die zunehmende Komplexität von Produktklassifizierungen, Sicherheitsprüfungen und der Marktbeobachtung treibt die Nachfrage an. Große und mittelständische Medizinproduktehersteller lagern regulatorische und klinische Expertise aus, um Kosten zu optimieren und eine schnelle Markteinführung zu gewährleisten. Rasante Innovationen bei diagnostischen, chirurgischen und implantierbaren Medizinprodukten erhöhen die Abhängigkeit von Beratungsleistungen. Unternehmen benötigen kontinuierliche Unterstützung bei Etikettenänderungen, der Meldung von unerwünschten Ereignissen und der Auditvorbereitung. Globale Harmonisierungsinitiativen wie ISO 13485 und die MDR fördern die Akzeptanz. Partnerschaften mit CROs und Beratungsunternehmen steigern die betriebliche Effizienz. Regulatorische Verzögerungen werden minimiert, wodurch das kommerzielle Risiko reduziert wird. Hochwertige Verträge und langfristige Beratungspartnerschaften stärken die Marktführerschaft des Segments. Unternehmen in Nordamerika und Europa sind führend bei der Einführung, aber auch Schwellenländer tragen zunehmend dazu bei. Diese Faktoren zusammengenommen machen Medizintechnikunternehmen zum dominierenden Endkundensegment.
Das Segment der Auftragsforschungsinstitute (CROs) wird voraussichtlich von 2026 bis 2033 mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 10,2 % das schnellste Wachstum verzeichnen. Treiber dieses Trends ist die zunehmende Auslagerung klinischer Studien und regulatorischer Unterstützungsleistungen. CROs suchen verstärkt nach Beratungsleistungen, um ihr Dienstleistungsangebot zu erweitern und die betriebliche Effizienz zu steigern. Die steigende Anzahl multizentrischer und globaler klinischer Studien erfordert ein effizientes Studienmanagement und Compliance-Beratung. Die zunehmende Zusammenarbeit zwischen Medizinprodukteherstellern und CROs fördert das Wachstum. Technologische Fortschritte wie KI-gestütztes Monitoring und digitale Studienplattformen beschleunigen die Akzeptanz. CROs streben danach, Zeitaufwand und Betriebskosten zu reduzieren und gleichzeitig Datenqualität und regulatorische Konformität sicherzustellen. Die Ausweitung der Dienstleistungen auf Schwellenländer unterstützt die Akzeptanz. Die starke Nachfrage nach spezialisierter Expertise in Hochrisiko-Medizinproduktekategorien beschleunigt das Wachstum. CROs setzen auf Beratungsleistungen, um erfolgreiche Zulassungsanträge zu stellen und Risiken zu minimieren. Steigende Investitionen in die Gesundheitsinfrastruktur und innovative Produkteinführungen erhöhen das Marktpotenzial zusätzlich. Die Nutzung virtueller und hybrider Studienmodelle fördert die Inanspruchnahme von Beratungsleistungen. All diese Faktoren machen CROs zum am schnellsten wachsenden Endkundensegment.
Marktanalyse für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten
- Nordamerika dominierte den Markt für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte mit dem größten Umsatzanteil von 39,2 % im Jahr 2025.
- Angetrieben von einem ausgereiften Ökosystem im Gesundheitswesen, einer hohen Konzentration von Medizintechnikunternehmen und starken regulatorischen Rahmenbedingungen, die die klinische Forschung unterstützen
- Die Region profitiert von fortschrittlichen Infrastrukturen für klinische Studien, hochqualifizierten Forschungsexperten und etablierten Systemen zur Einhaltung regulatorischer Bestimmungen, was die Auslagerung von Beratungsleistungen für die Entwicklung von Medizinprodukten, die klinische Validierung und die Einreichung von Zulassungsanträgen begünstigt.
Markteinblicke in US-amerikanische Beratungslösungen für klinische Studien mit Medizinprodukten
Der US-amerikanische Markt für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte erzielte 2025 den Großteil des Umsatzes in Nordamerika. Treiber dieser Entwicklung sind die hohe Inanspruchnahme ausgelagerter klinischer Beratungsleistungen und der wachsende Bedarf an regulatorischer Expertise bei der Zulassung von Medizinprodukten. Unternehmen nutzen zunehmend spezialisierte Beratungsfirmen, um klinische Studien zu konzipieren, regulatorische Strategien zu entwickeln und Zulassungsanträge effizient zu bearbeiten. Dies ist besonders wichtig für neuartige Medizinprodukte, die eine Marktzulassung oder die Einhaltung von FDA-Vorschriften erfordern. Die starke Forschungsinfrastruktur des Landes, gepaart mit dem Fokus auf Innovation und beschleunigte Zulassungsverfahren, treibt das Marktwachstum weiterhin an.
Markteinblicke für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten in Europa
Der europäische Markt für Beratungsleistungen im Bereich klinischer Prüfungen von Medizinprodukten wird im Prognosezeitraum voraussichtlich ein deutliches Wachstum verzeichnen. Treiber dieser Entwicklung sind strenge regulatorische Vorgaben wie die EU-Medizinprodukteverordnung (MDR), die zunehmende Verbreitung innovativer Medizinprodukte und wachsende Initiativen im Bereich der klinischen Forschung. Unternehmen lagern klinische Beratungsleistungen vermehrt aus, um komplexe Compliance-Anforderungen zu erfüllen, multizentrische Studien zu managen und Zulassungsanträge schneller einzureichen.
Markteinblicke für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten in Großbritannien
Der Markt für Beratungsleistungen im Bereich klinischer Prüfungen von Medizinprodukten in Großbritannien dürfte dank eines ausgereiften Gesundheitssystems, einer robusten Infrastruktur für klinische Forschung und staatlicher Initiativen zur Förderung von Innovationen in der Medizintechnik stetig wachsen. Das regulatorische Umfeld des Landes begünstigt die Auslagerung von Aufgaben wie dem Management klinischer Studien, der Entwicklung regulatorischer Strategien und der Einhaltung sowohl der britischen Medizinprodukteverordnung (MDR) als auch internationaler Standards an spezialisierte Beratungsunternehmen. Der zunehmende Einsatz minimalinvasiver und technologisch fortschrittlicher Medizinprodukte hat zudem die Nachfrage nach Expertenberatung bei der klinischen Validierung und Markteintrittsstrategien erhöht.
Markteinblicke für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten in Deutschland
Der deutsche Markt für Beratungsleistungen im Bereich klinischer Prüfungen von Medizinprodukten trägt maßgeblich zum europäischen Marktwachstum bei. Treiber dieser Entwicklung sind die gut ausgebaute Gesundheitsinfrastruktur, die hohe Akzeptanz medizinischer Technologien und der starke Fokus auf Forschung und Entwicklung. Deutsche Medizinproduktehersteller setzen zunehmend auf Beratungsleistungen im Bereich klinischer Prüfungen, um die MDR-Vorschriften einzuhalten, effektive klinische Studien zu konzipieren und eine schnellere Zulassung innovativer Produkte zu erreichen. Der Fokus des Landes auf Präzisionsmedizin, digitale Gesundheitstechnologien und modernste Diagnostik verstärkt die Nachfrage nach ausgelagerten Beratungsleistungen zusätzlich.
Markteinblicke für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten im asiatisch-pazifischen Raum
Der Markt für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte im asiatisch-pazifischen Raum wird im Prognosezeitraum voraussichtlich das schnellste Wachstum verzeichnen. Gründe hierfür sind die rasante Expansion der Medizinprodukteindustrie, das zunehmende Outsourcing klinischer Beratungsleistungen und steigende regulatorische Anforderungen. Der Ausbau der Gesundheitsinfrastruktur, die wachsende Produktion von Medizinprodukten und der kostengünstige Zugang zu Beratungsexpertise sind die wichtigsten Wachstumstreiber. Länder wie China, Indien und Japan verzeichnen eine erhöhte Nachfrage nach klinischen Beratungsleistungen, um die rechtzeitige Einhaltung der Vorschriften und die Marktzulassung innovativer Medizinprodukte sicherzustellen.
Markteinblicke für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten in Japan
Das Wachstum des japanischen Marktes für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte wird durch den hochentwickelten Gesundheitssektor, die alternde Bevölkerung und die starke Nachfrage nach innovativen Medizinprodukten angetrieben. Klinische Beratungsunternehmen unterstützen Gerätehersteller bei der Einreichung von Zulassungsanträgen, der Studienplanung und der Einhaltung lokaler Standards und ermöglichen so eine effiziente klinische Validierung und einen schnelleren Marktzugang.
Markteinblicke für Beratungslösungen im Bereich klinischer Studien mit Medizinprodukten in China
Der chinesische Markt für Beratungsleistungen im Bereich klinischer Studien für Medizinprodukte wird 2025 den größten Marktanteil im asiatisch-pazifischen Raum halten. Treiber dieses Wachstums sind die rasch expandierende heimische Medizinprodukteindustrie, staatliche Initiativen zur Förderung der Einhaltung regulatorischer Vorgaben und die Zusammenarbeit mit globalen Beratungsunternehmen. Dieses Umfeld hat kürzere Zulassungszyklen und einen verbesserten Marktzugang für Medizinprodukte ermöglicht und die Nachfrage nach Beratungsleistungen im Bereich klinischer Studien weiter gesteigert.
Marktanteil
Die Branche der Beratungsleistungen für klinische Studien mit Medizinprodukten wird hauptsächlich von etablierten Unternehmen dominiert, darunter:
- Medpace (USA)
- ICON plc (Irland)
- PPD Inc. (USA)
- Parexel International (USA)
- Charles River Laboratories (USA)
- Covance Inc. (USA)
- Medtronic Clinical Trials Services (USA)
- Syneos Health (USA)
- Eurofins Scientific (Luxemburg)
- Pharmazeutische Produktentwicklung (PPD) (USA)
- Wuxi AppTec (China)
- SGS Life Sciences (Schweiz)
- Labcorp Arzneimittelentwicklung (USA)
- Parexel International Corp (USA)
- CRF Health (UK)
- PRA Health Sciences (USA)
- Accenture Life Sciences (Irland)
- Covance (USA)
- Clinipace (USA)
Neueste Entwicklungen auf dem globalen Markt für Beratungsleistungen im Bereich klinischer Studien mit Medizinprodukten
- Im Januar 2025 erweiterte Tigermed seine strategische Partnerschaft mit Medidata, um klinische Studien für Medizinprodukte mithilfe der digitalen Plattform von Medidata zu beschleunigen. Dadurch werden die Datenerfassung automatisiert und die Abläufe von CROs in globalen klinischen Studien optimiert, was die Effizienz des Studienmanagements verbessert.
- Im Januar 2025 erwarb NAMSA die US-amerikanischen Testaktivitäten für Medizinprodukte von WuXi AppTec und erweiterte damit sein Portfolio an klinischen Forschungs- und Testlösungen, um Herstellern von Medizinprodukten, die behördliche Zulassungen und Marktreife anstreben, umfassendere präklinische und klinische Beratungsleistungen anbieten zu können.
- Im Januar 2025 schloss Canyon Labs die Übernahme des Labordienstleistungs- und Beratungsgeschäfts von iuvo BioScience ab und stärkte damit seine CRO-Unterstützungsleistungen wie Biokompatibilitätstests und analytische Tests, die wesentliche Bestandteile von Beratungslösungen über den gesamten Lebenszyklus von Medizinprodukten hinweg sind.
- Im Februar 2025 erwarb Arterex Phoenix, ein in Italien ansässiges Unternehmen für die Entwicklung und das Design von Medizinprodukten. Dadurch konnte Arterex seine umfassende Unterstützung für die klinische Entwicklung sowie seine Beratungsleistungen für Gerätetests und die Einhaltung regulatorischer Vorgaben auf den europäischen Märkten verbessern.
- Im Februar 2025 erwarb Arterex zudem Adroit und erweiterte damit seine globalen Kapazitäten in den Bereichen Auftragsforschung und -fertigung. Dies ermöglicht es Medizinprodukteherstellern, die klinische Entwicklung und die regulatorische Beratung effizienter zu gestalten.
- Im März 2025 kündigte InTandem Capital eine strategische Investition in Clinilabs an, was auf ein wachsendes Interesse von Investoren an spezialisierten CROs im Bereich der Medizinprodukteforschung hindeutet. Dies trägt indirekt zu Beratungsleistungen in Bezug auf Prüf- und Zulassungsstrategien bei.
- Im März 2025 erweiterte ICON plc ihre Dienstleistungen im Bereich Regulatory Outsourcing in der Asien-Pazifik-Region und konzentrierte sich dabei auf eine schnellere und regionsspezifische regulatorische Beratung sowie die Unterstützung klinischer Tests für Medizinproduktehersteller in Märkten wie China und Indien.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.