Asia Pacific Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Tamaño del mercado en miles de millones de dólares
Tasa de crecimiento anual compuesta (CAGR) :
% 
 USD
130.00 Million
USD
403.24 Million
2025
2033
USD
130.00 Million
USD
403.24 Million
2025
2033
| 2026 –2033 | |
| USD 130.00 Million | |
| USD 403.24 Million | |
|
|
|
|
Segmentación del mercado de evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia, por producto (soluciones locales, soluciones en la nube y soluciones web), enfoque (evaluación de resultados informada por el médico [ClinRO], evaluación de resultados informada por el paciente [PRO], evaluación de resultados informada por el observador [ObsRO] y evaluación de resultados de rendimiento [PerfO]), usuario final (proveedores de servicios comerciales, hospitales y centros de trasplantes, laboratorios de investigación e instituciones académicas), plataforma (organizaciones de investigación por contrato, empresas farmacéuticas y biofarmacéuticas, fabricantes de dispositivos médicos, hospitales y laboratorios clínicos, empresas de servicios de consultoría, investigación y academia, entre otros): tendencias de la industria y pronóstico hasta 2033.
Evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para el tamaño del mercado de contenido con licencia
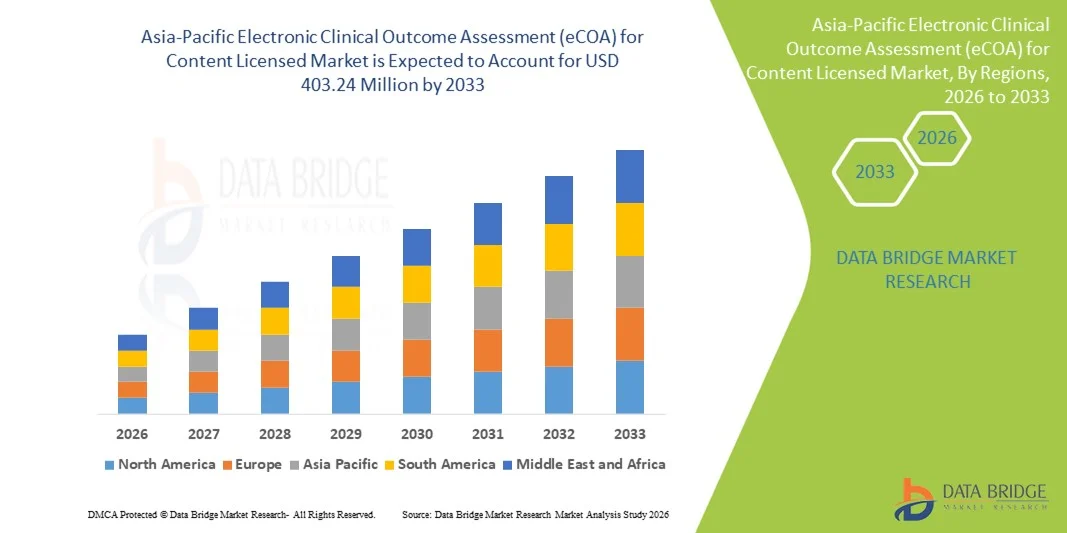
- El tamaño del mercado de la Evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para el contenido con licencia se valoró en USD 130,00 millones en 2025 y se espera que alcance los USD 403,24 millones para 2033 , con una CAGR del 15,2 % durante el período de pronóstico.
- El crecimiento del mercado se debe en gran medida a la creciente adopción de tecnologías de salud digital en ensayos clínicos, el fomento regulatorio de la captura electrónica de datos y la creciente demanda de soluciones de monitorización remota de resultados centradas en el paciente. Estas tendencias están impulsando a los patrocinadores de investigación clínica y a las CRO a cambiar de los métodos tradicionales en papel a plataformas digitales de evaluación de resultados en tiempo real.
- Además, la rápida expansión de la actividad de ensayos clínicos en los principales mercados de Asia-Pacífico, la creciente inversión en plataformas eCOA móviles/en la nube y el fuerte énfasis en la precisión de los datos, el cumplimiento normativo y la integración con sistemas eClinical más amplios están acelerando su adopción. Estos factores convergentes están posicionando el eCOA como un componente esencial de la infraestructura moderna de investigación clínica, impulsando así significativamente el crecimiento del sector.
Evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para el análisis del mercado de contenido con licencia
- Las soluciones de evaluación electrónica de resultados clínicos (eCOA), que proporcionan plataformas digitales para capturar los resultados informados por los pacientes, los resultados informados por los médicos y los resultados informados por los observadores, se están convirtiendo en herramientas esenciales en los ensayos clínicos en los sectores farmacéutico y de dispositivos médicos debido a su capacidad para mejorar la precisión de los datos, permitir el monitoreo en tiempo real e integrarse perfectamente con sistemas eClinical más amplios.
- La creciente adopción de eCOA está impulsada principalmente por el enfoque cada vez mayor en ensayos clínicos centrados en el paciente, el estímulo regulatorio para la captura electrónica de datos y la creciente demanda de soluciones de ensayos remotos y descentralizados que minimicen las visitas al sitio al tiempo que mejoran el cumplimiento y la participación.
- Japón dominó el mercado de evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia en 2025 con la mayor participación en los ingresos del 38,5 %, caracterizado por una infraestructura de atención médica digital avanzada, una gran cantidad de ensayos clínicos en curso y la presencia de proveedores de tecnología líderes que ofrecen plataformas eCOA integradas.
- Se espera que China sea el país de más rápido crecimiento en el mercado durante el período de pronóstico debido al aumento de la actividad de ensayos clínicos, la creciente inversión en plataformas móviles y basadas en la nube, la expansión del apoyo regulatorio para la captura electrónica de datos y la creciente adopción de soluciones digitales centradas en el paciente.
- El segmento de resultados informados por el paciente (PRO) dominó el mercado de evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia con una participación de mercado del 45,2 % en 2025, impulsado por su papel fundamental en la captura de comentarios de los pacientes en tiempo real, garantizando el cumplimiento de los estándares regulatorios y brindando información procesable para los patrocinadores de ensayos.
Alcance del informe y segmentación del mercado de la evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia
|
Atributos |
Evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para información clave del mercado con licencia de contenido |
|
Segmentos cubiertos |
|
|
Países cubiertos |
Asia-Pacífico
|
|
Actores clave del mercado |
|
|
Oportunidades de mercado |
|
|
Conjuntos de información de datos de valor añadido |
Además de los conocimientos sobre escenarios de mercado como el valor de mercado, la tasa de crecimiento, la segmentación, la cobertura geográfica y los principales actores, los informes de mercado seleccionados por Data Bridge Market Research también incluyen un análisis profundo de expertos, epidemiología de pacientes, análisis de canalización, análisis de precios y marco regulatorio. |
Tendencias del mercado de la evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia
Integración digital y móvil para ensayos centrados en el paciente
- Una tendencia significativa y en aceleración en el mercado de licencias de contenido electrónico (eCOA) de Asia-Pacífico es la integración de dispositivos móviles, plataformas en la nube y aplicaciones para pacientes, lo que permite la recopilación en tiempo real de resultados clínicos al tiempo que mejora la participación del paciente y la adherencia a los ensayos.
- Por ejemplo, plataformas como Medidata eCOA Mobile permiten a los pacientes enviar PRO y resultados informados por el médico a través de teléfonos inteligentes y tabletas, lo que permite una captura de datos remota sin inconvenientes y un mejor cumplimiento.
- La integración de plataformas digitales y móviles con historias clínicas electrónicas (HCE) y sistemas clínicos electrónicos más amplios permite la monitorización de datos en tiempo real, la reducción de errores y la optimización de los informes regulatorios. Por ejemplo, esto permite a los patrocinadores realizar un seguimiento instantáneo de las respuestas de los pacientes y ajustar los protocolos según sea necesario.
- La creciente adopción de dispositivos portátiles y sensores para la monitorización continua de pacientes complementa las plataformas eCOA, lo que permite la recopilación de datos objetivos de alta frecuencia junto con resultados subjetivos para una visión más integral de la salud del paciente.
- Esta tendencia hacia una evaluación digital de resultados más integrada, intuitiva y en tiempo real está transformando radicalmente los procesos de los ensayos clínicos. Por ejemplo, empresas como CRF Health y ERT están desarrollando soluciones de COA electrónicas para dispositivos móviles con interfaces personalizables y recordatorios automatizados para mejorar el cumplimiento del paciente.
- La demanda de plataformas eCOA digitales, móviles e integradas en la nube está creciendo rápidamente en los ensayos de dispositivos médicos y farmacéuticos, ya que los patrocinadores priorizan la recopilación de datos eficiente, precisa y centrada en el paciente.
- El uso de interfaces eCOA multilingües y adaptadas culturalmente es cada vez más común para brindar apoyo a diversas poblaciones de pacientes en los países de Asia-Pacífico. Por ejemplo, las plataformas ahora incluyen idiomas locales y formatos de preguntas culturalmente sensibles para mejorar el cumplimiento normativo y la calidad de los datos.
Dinámica del mercado de evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia
Conductor
Creciente demanda de ensayos clínicos remotos y centrados en el paciente
- El enfoque creciente en los ensayos centrados en el paciente, junto con el cambio hacia ensayos clínicos descentralizados e híbridos, es un impulsor clave del eCOA de Asia-Pacífico para el mercado de contenido con licencia.
- Por ejemplo, en 2025, Medrio lanzó un módulo eCOA diseñado para ensayos remotos en India y China, que permite a los patrocinadores capturar resultados sin necesidad de visitas frecuentes al sitio.
- A medida que los patrocinadores de los ensayos buscan mejorar la participación y el cumplimiento de los pacientes, las plataformas eCOA brindan monitoreo, alertas y recordatorios en tiempo real, lo que reduce los datos faltantes y mejora la calidad general del ensayo.
- Además, la creciente adopción de tecnologías digitales y móviles en los sitios de investigación clínica está convirtiendo las soluciones eCOA en una opción preferida, ofreciendo una integración perfecta con otras herramientas eClinical y sistemas de datos.
- La capacidad de capturar de forma remota los resultados informados por los pacientes, los resultados informados por los médicos y los resultados informados por los observadores a través de teléfonos inteligentes o tabletas es un factor clave que acelera la adopción en ensayos de dispositivos médicos y farmacéuticos.
- La expansión de los ensayos híbridos y descentralizados en Asia-Pacífico, combinada con un creciente estímulo regulatorio para la captura electrónica de datos, respalda aún más el sólido crecimiento de las soluciones eCOA.
- La creciente inversión de compañías farmacéuticas multinacionales en ensayos clínicos en Asia-Pacífico está incrementando la demanda de plataformas de eCOA escalables y estandarizadas. Por ejemplo, los patrocinadores están implementando plataformas unificadas en varios países para mejorar la eficiencia y el cumplimiento normativo.
- El creciente énfasis en la toma de decisiones basada en datos y la agilización de los plazos de los ensayos clínicos está animando a los patrocinadores a adoptar soluciones de eCOA que ofrecen análisis e informes instantáneos. Por ejemplo, los paneles de control en tiempo real permiten a los gestores de ensayos supervisar las respuestas de los pacientes y ajustar los protocolos de forma proactiva.
Restricción/Desafío
Preocupaciones sobre la privacidad de los datos y obstáculos para el cumplimiento normativo
- Las preocupaciones en torno a la seguridad de los datos de los pacientes, la privacidad y el cumplimiento normativo plantean desafíos importantes para una adopción más amplia de las plataformas eCOA en Asia-Pacífico.
- Por ejemplo, los informes de alto perfil sobre violaciones de datos electrónicos de salud han hecho que algunos patrocinadores y pacientes sean cautelosos sobre la recopilación remota de datos digitales.
- Para garantizar el cumplimiento de las regulaciones regionales, como la Ley de Protección de Información Personal (APPI) de Japón y la Ley de Protección de Información Personal (PIPL) de China, se requiere un cifrado sólido, una autenticación segura y un software validado, cuya implementación puede ser compleja y costosa.
- Además, las diferencias en los estándares y requisitos regulatorios entre los países de Asia-Pacífico pueden retrasar la implementación y adopción de la plataforma, lo que requiere esfuerzos adicionales de localización y validación.
- Si bien las plataformas eCOA móviles y en la nube mejoran la conveniencia y la eficiencia, el riesgo percibido de violaciones de ciberseguridad e incumplimiento puede obstaculizar su adopción, en particular entre patrocinadores más pequeños o CRO con recursos de TI limitados.
- Superar estos desafíos mediante fuertes medidas de seguridad de datos, cumplimiento de las directrices regulatorias y una comunicación clara de las prácticas de cumplimiento será vital para el crecimiento sostenido del mercado.
- La experiencia técnica y la infraestructura limitadas en centros clínicos más pequeños de ciertos países de Asia-Pacífico pueden ralentizar la adopción de soluciones avanzadas de eCOA. Por ejemplo, los centros pueden carecer del soporte informático necesario para implementar sistemas de eCOA móviles o basados en la nube de forma eficiente.
- La variabilidad en la alfabetización digital de los pacientes también puede ser un obstáculo, ya que algunos participantes pueden tener dificultades con las plataformas móviles o web. Por ejemplo, los patrocinadores deben proporcionar capacitación e interfaces intuitivas para garantizar una recopilación de datos precisa y completa.
Evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para el mercado de contenido con licencia
El mercado está segmentado en función del producto, el enfoque, el usuario final y la plataforma.
- Por producto
En función del producto, el mercado de eCOA de Asia-Pacífico para licencias de contenido se segmenta en soluciones locales, soluciones en la nube y soluciones web. Las soluciones en la nube dominaron el mercado con la mayor cuota de ingresos en 2025, gracias a su flexibilidad, escalabilidad y capacidad para respaldar ensayos clínicos remotos en múltiples centros. Los patrocinadores prefieren cada vez más las plataformas en la nube, ya que permiten el acceso en tiempo real a los resultados informados por el paciente (PRO), los resultados informados por el médico (ClinRO) y otros datos de eCOA sin necesidad de una infraestructura de TI extensa en cada centro. Las soluciones en la nube también facilitan la integración con otros sistemas eClinical, lo que reduce las discrepancias de datos y acelera el análisis. Su adopción se ve respaldada por la aceptación regulatoria de la captura electrónica de datos en ensayos descentralizados. La compatibilidad con dispositivos móviles, tabletas y wearables mejora la participación del paciente y el cumplimiento. Las soluciones en la nube también permiten actualizaciones de software fluidas y la gestión centralizada de los datos de los ensayos, lo que reduce los costes operativos para los patrocinadores.
Se prevé que las soluciones web experimenten el mayor crecimiento entre 2026 y 2033, impulsado por la creciente necesidad de plataformas accesibles desde navegador que no requieran la instalación de software complejo. Las herramientas web de eCOA permiten a los centros clínicos y a los pacientes introducir datos desde cualquier dispositivo con conexión a internet, lo que mejora la participación en ensayos descentralizados. Resultan especialmente atractivas para instituciones académicas y pequeñas organizaciones de investigación que buscan soluciones rentables y escalables. Las soluciones web también admiten interfaces multilingües y adaptadas a diferentes culturas, lo cual es fundamental para ensayos que abarcan varios países de Asia-Pacífico. La facilidad de uso, el bajo mantenimiento y la compatibilidad con diversos sistemas operativos son factores clave para su adopción. La creciente preferencia por ensayos híbridos que combinan visitas a centros clínicos con captura remota de datos acelera aún más la adopción de soluciones web.
- Por enfoque
Sobre la base del enfoque, el mercado está segmentado en Evaluación de Resultados Informada por el Clínico (ClinRO), Evaluación de Resultados Informada por el Paciente (PRO), Evaluación de Resultados Informada por el Observador (ObsRO) y Evaluación de Resultados de Rendimiento (PerfO). La Evaluación de Resultados Informada por el Paciente (PRO) dominó el mercado con la mayor participación en los ingresos del 45,2% en 2025, impulsada por el creciente énfasis en los ensayos clínicos centrados en el paciente. Las plataformas PRO permiten a los pacientes informar directamente sobre sus síntomas, calidad de vida y respuestas al tratamiento, proporcionando a los patrocinadores información auténtica y en tiempo real. La adopción de plataformas PRO móviles y habilitadas para la nube ha mejorado el cumplimiento y reducido los datos faltantes, particularmente en ensayos descentralizados o híbridos. Las agencias reguladoras, incluidas la PMDA de Japón y la NMPA de China, fomentan cada vez más la recopilación electrónica de datos PRO para obtener puntos finales precisos. Las soluciones PRO también permiten la monitorización en tiempo real y las alertas automatizadas, lo que permite a los equipos clínicos responder rápidamente a los eventos adversos o al incumplimiento. Su dominio está respaldado por una creciente demanda en áreas terapéuticas como la oncología, la neurología y las enfermedades crónicas, donde la opinión de los pacientes es fundamental.
Se prevé que la Evaluación de Resultados Reportados por el Observador (ObsRO) experimente el mayor crecimiento entre 2026 y 2033, especialmente en ensayos pediátricos, geriátricos y de enfermedades raras. Las plataformas ObsRO permiten a los cuidadores o al personal del estudio informar los resultados de los pacientes en casos en que estos no pueden hacerlo ellos mismos, lo que garantiza una recopilación de datos completa y precisa. El auge de la monitorización remota y las plataformas móviles ha impulsado la adopción de ObsRO, facilitando a los observadores el envío de datos en tiempo real. Las soluciones ObsRO también están cobrando impulso debido al énfasis regulatorio en la inclusión de poblaciones de pacientes vulnerables en los ensayos. La creciente complejidad de los estudios clínicos y la necesidad de validación de datos de múltiples fuentes impulsan aún más la adopción de ObsRO. La integración con otros enfoques de eCOA, como PRO y ClinRO, mejora la calidad de los datos y proporciona información integral a los patrocinadores.
- Por el usuario final
En función del usuario final, el mercado se segmenta en proveedores de servicios comerciales, hospitales y centros de trasplantes, laboratorios de investigación e instituciones académicas. Los proveedores de servicios comerciales dominaron el mercado con la mayor participación en los ingresos en 2025, impulsados por su experiencia en proporcionar soluciones de eCOA escalables y validadas para múltiples patrocinadores y ensayos. Estos proveedores ofrecen servicios integrales que incluyen implementación de software, capacitación, soporte técnico y orientación sobre cumplimiento normativo. Su dominio se ve respaldado además por la creciente tendencia a la externalización entre las empresas farmacéuticas y biotecnológicas, que prefieren a los proveedores comerciales para gestionar ensayos complejos y descentralizados. La implementación basada en la nube y los servicios de monitorización en tiempo real mejoran la eficiencia y el cumplimiento del paciente. Los proveedores de servicios comerciales también ofrecen soluciones personalizables adaptadas a las áreas terapéuticas, el tamaño del estudio y las regulaciones regionales, lo que los convierte en la opción preferida para ensayos multinacionales. Su capacidad de integración con otras plataformas eClinical garantiza una gestión centralizada de datos y plazos de ensayo más rápidos.
Se prevé que las instituciones académicas experimenten el mayor crecimiento entre 2026 y 2033, impulsado por el aumento de la actividad de investigación clínica en universidades y hospitales docentes de Asia-Pacífico. Estas instituciones requieren soluciones de eCOA rentables y flexibles que respalden los protocolos de investigación, la participación de los pacientes y el cumplimiento normativo. La adopción de plataformas de eCOA web y móviles facilita la participación en ensayos multicéntricos y estudios colaborativos. Los usuarios finales académicos también se benefician de plataformas que permiten la anonimización de datos y el intercambio seguro con fines de investigación. El aumento de la financiación gubernamental y las iniciativas para digitalizar la investigación clínica en países como India, China y Japón están acelerando aún más la adopción. La necesidad de informes y análisis de resultados en tiempo real para las publicaciones académicas también impulsa el crecimiento en este segmento.
- Por plataforma
Sobre la base de la plataforma, el mercado está segmentado en organizaciones de investigación por contrato, compañías farmacéuticas y biofarmacéuticas, fabricantes de dispositivos médicos, hospitales y laboratorios clínicos, compañías de servicios de consultoría, investigación y academia, y otros. Las Organizaciones de Investigación por Contrato (CRO) dominaron el mercado con la mayor participación en los ingresos en 2025, impulsadas por su capacidad para gestionar múltiples ensayos clínicos en diversas geografías utilizando sistemas eCOA centralizados y validados. Las CRO brindan a los patrocinadores la ventaja de externalizar complejidades técnicas y regulatorias, incluyendo configuración del sistema, capacitación y auditorías de cumplimiento. Sus plataformas basadas en la nube permiten acceso en tiempo real a datos de resultados clínicos, mejorando el monitoreo y acelerando la toma de decisiones. Las CRO también aprovechan el análisis habilitado por IA para identificar tendencias, monitorear el cumplimiento del paciente y marcar inconsistencias. Su dominio se ve reforzado por fuertes alianzas con compañías farmacéuticas y biotecnológicas que realizan ensayos a gran escala en Asia-Pacífico. Las plataformas eCOA estandarizadas en todas las CRO también facilitan presentaciones regulatorias en múltiples países.
Se prevé que las empresas farmacéuticas y biofarmacéuticas experimenten el mayor crecimiento entre 2026 y 2033, a medida que adopten cada vez más plataformas internas de eCOA para optimizar los ensayos clínicos y mejorar la captura de datos centrada en el paciente. La implementación directa permite a los patrocinadores mantener el control sobre la integridad y el cumplimiento normativo de los datos, a la vez que reduce la dependencia de proveedores de servicios externos. El crecimiento se ve impulsado por la creciente inversión en soluciones móviles y en la nube que admiten modelos de ensayo híbridos y descentralizados. Las empresas también están aprovechando las plataformas de eCOA para acelerar los plazos de los ensayos, mejorar la participación de los pacientes y cumplir con los requisitos regulatorios para la recopilación electrónica de datos. La integración con otros sistemas digitales, como la historia clínica electrónica (HCE) y la gestión de datos de laboratorio, refuerza aún más la adopción entre las empresas farmacéuticas y biotecnológicas.
Análisis regional del mercado de la evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para el contenido con licencia
- Japón dominó el mercado de evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia en 2025 con la mayor participación en los ingresos del 38,5 %, caracterizado por una infraestructura de atención médica digital avanzada, una gran cantidad de ensayos clínicos en curso y la presencia de proveedores de tecnología líderes que ofrecen plataformas eCOA integradas.
- Los patrocinadores y los sitios clínicos en Japón valoran mucho la eficiencia, el monitoreo en tiempo real y las funciones que cumplen con las regulaciones que ofrecen las plataformas eCOA, lo que permite la captura precisa y oportuna de los resultados informados por pacientes, médicos y observadores.
- Esta adopción generalizada está respaldada además por redes de investigación clínica bien establecidas, un apoyo gubernamental cada vez mayor a las tecnologías de salud digital y un interés creciente de las empresas farmacéuticas y biofarmacéuticas en modelos de ensayos descentralizados e híbridos, lo que establece a eCOA como una solución preferida para la captura de resultados clínicos.
Evaluación electrónica de resultados clínicos (eCOA) de Japón para el análisis del mercado de contenido con licencia
El mercado japonés de Evaluación Electrónica de Resultados Clínicos (eCOA) para contenido con licencia está cobrando impulso gracias a la avanzada infraestructura de atención médica digital del país, la alta actividad de ensayos clínicos y el enfoque en la investigación centrada en el paciente. La adopción de plataformas PRO y ClinRO compatibles con dispositivos móviles se ve impulsada por el creciente número de hospitales inteligentes y centros de investigación clínica conectados. La integración con sistemas de Historias Clínicas Electrónicas (HCE) y plataformas eClínicas más amplias está mejorando la monitorización en tiempo real, el cumplimiento normativo y la eficiencia operativa. El envejecimiento de la población japonesa también impulsa la demanda de soluciones intuitivas para el paciente y de resultados informados por el observador (ObsRO) en ensayos clínicos, tanto residenciales como hospitalarios. Además, los patrocinadores están aprovechando la IA y el análisis de datos en las plataformas eCOA para mejorar la calidad de los datos y optimizar la toma de decisiones en los ensayos clínicos.
Evaluación electrónica de resultados clínicos (eCOA) de China para el mercado de contenido con licencia
Se prevé que el mercado chino de Evaluación Electrónica de Resultados Clínicos (eCOA) para contenido con licencia crezca al ritmo más rápido de la región Asia-Pacífico durante el período de pronóstico, impulsado por un aumento repentino de los ensayos clínicos, incentivos gubernamentales para la adopción de la salud digital y un mayor uso de plataformas de evaluación de resultados móviles y en la nube. Los patrocinadores implementan cada vez más ensayos descentralizados para llegar a poblaciones más amplias de pacientes, aprovechando las soluciones eCOA para la monitorización de pacientes en tiempo real. La integración con dispositivos portátiles y herramientas de generación de informes remotos está mejorando la precisión y el cumplimiento normativo de los datos. Este crecimiento también se ve respaldado por la expansión de los servicios de las CRO y de los proveedores de plataformas nacionales que ofrecen soluciones escalables y rentables. Además, la aceptación regulatoria de los datos electrónicos de PRO, ClinRO y ObsRO está fomentando su adopción entre las empresas farmacéuticas y biotecnológicas.
Evaluación electrónica de resultados clínicos (eCOA) en India para el análisis del mercado de contenido con licencia
El mercado indio de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia representó la mayor participación en los ingresos en Asia-Pacífico en 2025, gracias al crecimiento de la industria de externalización de investigación clínica, la creciente alfabetización digital de los pacientes y la rápida adopción de tecnologías móviles de salud. El auge de los ensayos descentralizados, junto con plataformas de eCOA asequibles y escalables basadas en la nube, está facilitando una adopción más amplia en hospitales, instituciones académicas y organizaciones de investigación por contrato (CRO). El creciente ecosistema de ensayos clínicos de India, respaldado por el fomento regulatorio para la captura electrónica de resultados, está permitiendo una recopilación de datos más rápida y un mejor cumplimiento del paciente. Además, los patrocinadores multinacionales eligen cada vez más a India para estudios multinacionales debido a su rentabilidad y la disponibilidad de personal cualificado. La adopción de soluciones PRO y ObsRO centradas en el paciente está mejorando aún más la calidad de los ensayos y las capacidades de monitorización en tiempo real.
Evaluación electrónica de resultados clínicos (eCOA) de Australia para el mercado de contenido con licencia
El mercado australiano de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia está experimentando un crecimiento constante gracias a la avanzada infraestructura sanitaria del país, la alta adopción de tecnologías de salud digital y el creciente número de ensayos clínicos realizados en hospitales e instituciones de investigación. Los patrocinadores y las CRO valoran a Australia por su alineamiento regulatorio con los estándares globales, lo que facilita la implementación de las plataformas electrónicas PRO, ClinRO, ObsRO y PerfO. El uso generalizado de soluciones eCOA móviles y web mejora la participación y el cumplimiento del paciente, especialmente en ensayos descentralizados o híbridos. La integración con historias clínicas electrónicas (HCE) y otros sistemas digitales mejora la precisión de los datos y agiliza la gestión de los ensayos. Además, el personal clínico cualificado de Australia y el énfasis en la investigación centrada en el paciente impulsan la adopción de plataformas eCOA innovadoras en ensayos farmacéuticos, biofarmacéuticos y de dispositivos médicos.
Evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para la cuota de mercado de contenido con licencia
La industria de la evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia está liderada principalmente por empresas bien establecidas, entre las que se incluyen:
- Veeva Systems (EE. UU.)
- Kayentis (Francia)
- Signant Health (EE. UU.)
- IQVIA Holdings, Inc. (EE. UU.)
- Clinical Ink, Inc. (EE. UU.)
- Soluciones Medidata (EE. UU.)
- eCOA GmbH (Alemania)
- CRF Health (Reino Unido)
- Motentia, LLC (EE. UU.)
- Bracket Global LLC (EE. UU.)
- SHYFT Analytics (EE. UU.)
- Soluciones Mednet (Australia)
- SureClinical (EE. UU.)
- Relypsa (EE. UU.)
- OpenClinica, LLC (EE. UU.)
- Clario (EE. UU.)
- Datacubed Health (EE. UU.)
- Florence Healthcare (EE. UU.)
- bloqcube (EE. UU.)
- Clínica en tiempo real (EE. UU.)
¿Cuáles son los últimos avances en el mercado de evaluación electrónica de resultados clínicos (eCOA) de Asia-Pacífico para contenido con licencia?
- En marzo de 2024, los principales proveedores de servicios de investigación clínica como PPD (Thermo Fisher Scientific) destacaron públicamente sus ecosistemas de ensayos digitales y descentralizados, haciendo hincapié en las herramientas y metodologías que respaldan la captura de resultados digitales, incluido el eCOA diseñado para mejorar la calidad de los datos, reducir la carga de los pacientes y aumentar la participación en los ensayos en todas las regiones, incluida Asia-Pacífico.
- En diciembre de 2023, ObvioHealth anunció el lanzamiento de su innovadora solución de evaluación electrónica de resultados clínicos (eCOA) integrada en su plataforma ObvioGo®, lo que permite la creación rápida de eCOA, una mayor participación del paciente y plazos de implementación hasta un 70 % más rápidos para ensayos clínicos.
- En agosto de 2023, la Administración Nacional de Productos Médicos de China (NMPA) y el Centro de Evaluación de Medicamentos (CDE) publicaron las Directrices Técnicas para la Implementación de Ensayos Clínicos de Medicamentos Centrados en el Paciente, que reconocen formalmente herramientas electrónicas como el COA electrónico (eCOA), el consentimiento electrónico (eConsent) y la recopilación remota de datos para modernizar las prácticas de ensayos clínicos. Esta claridad regulatoria respalda el uso ampliado de las tecnologías de COA electrónico en los ensayos de Asia-Pacífico.
- En junio de 2023, ICON plc anunció una importante actualización de su Plataforma Digital ICON, que incluye un módulo integrado de eCOA precargado con bibliotecas de evaluación validadas. La plataforma facilita la participación del paciente, el consentimiento electrónico, el eCOA y la captura remota de datos en ensayos clínicos tradicionales y descentralizados, lo que reduce el tiempo de configuración y mejora la consistencia de los datos de resultados.
- En abril de 2023, Almac Clinical Technologies anunció el lanzamiento de su Red de Colaboración IXRS®3, que permite a los patrocinadores biofarmacéuticos y a las CRO compartir datos y tecnologías clínicas interoperables, incluyendo módulos eCOA, para crear experiencias de ensayo más fluidas e inclusivas para centros y pacientes. Esta iniciativa prioriza la interoperabilidad y la colaboración para optimizar la captura de datos de ensayos y mejorar la integración de eCOA en estudios multicéntricos.
SKU-
Obtenga acceso en línea al informe sobre la primera nube de inteligencia de mercado del mundo
- Panel de análisis de datos interactivo
- Panel de análisis de empresas para oportunidades con alto potencial de crecimiento
- Acceso de analista de investigación para personalización y consultas
- Análisis de la competencia con panel interactivo
- Últimas noticias, actualizaciones y análisis de tendencias
- Aproveche el poder del análisis de referencia para un seguimiento integral de la competencia
Metodología de investigación
La recopilación de datos y el análisis del año base se realizan utilizando módulos de recopilación de datos con muestras de gran tamaño. La etapa incluye la obtención de información de mercado o datos relacionados a través de varias fuentes y estrategias. Incluye el examen y la planificación de todos los datos adquiridos del pasado con antelación. Asimismo, abarca el examen de las inconsistencias de información observadas en diferentes fuentes de información. Los datos de mercado se analizan y estiman utilizando modelos estadísticos y coherentes de mercado. Además, el análisis de la participación de mercado y el análisis de tendencias clave son los principales factores de éxito en el informe de mercado. Para obtener más información, solicite una llamada de un analista o envíe su consulta.
La metodología de investigación clave utilizada por el equipo de investigación de DBMR es la triangulación de datos, que implica la extracción de datos, el análisis del impacto de las variables de datos en el mercado y la validación primaria (experto en la industria). Los modelos de datos incluyen cuadrícula de posicionamiento de proveedores, análisis de línea de tiempo de mercado, descripción general y guía del mercado, cuadrícula de posicionamiento de la empresa, análisis de patentes, análisis de precios, análisis de participación de mercado de la empresa, estándares de medición, análisis global versus regional y de participación de proveedores. Para obtener más información sobre la metodología de investigación, envíe una consulta para hablar con nuestros expertos de la industria.
Personalización disponible
Data Bridge Market Research es líder en investigación formativa avanzada. Nos enorgullecemos de brindar servicios a nuestros clientes existentes y nuevos con datos y análisis que coinciden y se adaptan a sus objetivos. El informe se puede personalizar para incluir análisis de tendencias de precios de marcas objetivo, comprensión del mercado de países adicionales (solicite la lista de países), datos de resultados de ensayos clínicos, revisión de literatura, análisis de mercado renovado y base de productos. El análisis de mercado de competidores objetivo se puede analizar desde análisis basados en tecnología hasta estrategias de cartera de mercado. Podemos agregar tantos competidores sobre los que necesite datos en el formato y estilo de datos que esté buscando. Nuestro equipo de analistas también puede proporcionarle datos en archivos de Excel sin procesar, tablas dinámicas (libro de datos) o puede ayudarlo a crear presentaciones a partir de los conjuntos de datos disponibles en el informe.