Europe Eclinical Solutions Market
Taille du marché en milliards USD
TCAC :
% 
 USD
2.85 Billion
USD
7.75 Billion
2024
2032
USD
2.85 Billion
USD
7.75 Billion
2024
2032
| 2025 –2032 | |
| USD 2.85 Billion | |
| USD 7.75 Billion | |
|
|
|
|
Segmentation du marché européen des solutions e-cliniques, par produit (systèmes de saisie électronique de données et de gestion des données d'essais cliniques, systèmes de gestion des essais cliniques, plateformes d'analyse clinique, dossiers médicaux de coordination des soins (CCMR), gestion de la randomisation et de l'approvisionnement des essais, plateformes d'intégration de données cliniques, solutions d'évaluation électronique des résultats cliniques, solutions de sécurité, systèmes de fichiers maîtres d'essais électroniques, solutions de gestion des informations réglementaires, etc.), mode de livraison (solutions hébergées sur le Web (à la demande), solutions d'entreprise sous licence (sur site) et solutions cloud (SAAS)), phase d'essai clinique (phases I, II, III et IV), taille de l'organisation (petite, moyenne et grande), appareil utilisateur (ordinateur de bureau, tablette, assistant numérique personnel, smartphone, etc.), utilisateur final (laboratoires pharmaceutiques et biopharmaceutiques, organismes de recherche sous contrat, sociétés de conseil, fabricants de dispositifs médicaux, hôpitaux et instituts de recherche universitaires) - Tendances et prévisions du secteur jusqu'en 2032
Taille du marché européen des solutions cliniques électroniques
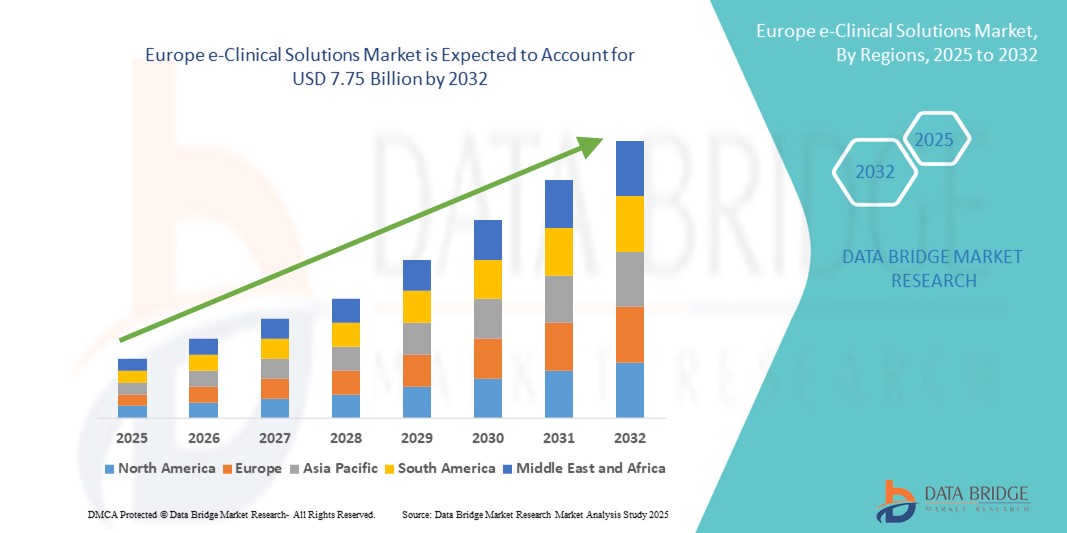
- La taille du marché européen des solutions e-cliniques était évaluée à 2,85 milliards USD en 2024 et devrait atteindre 7,75 milliards USD d'ici 2032 , à un TCAC de 13,3 % au cours de la période de prévision.
- La croissance du marché est largement alimentée par l'adoption croissante des technologies d'essais cliniques numériques, le volume croissant d'essais cliniques et les exigences réglementaires strictes favorisant une gestion efficace des données dans les sociétés pharmaceutiques et les organisations de recherche sous contrat (CRO).
- En outre, les avancées technologiques telles que le cloud computing, l'intelligence artificielle et les modèles d'essais décentralisés, combinés au soutien réglementaire tel que l'Espace européen des données de santé (EHDS), améliorent l'efficacité des essais et l'accessibilité des données, stimulant ainsi considérablement l'adoption de solutions e-cliniques à travers l'Europe.
Analyse du marché européen des solutions cliniques électroniques
- Les solutions e-cliniques, englobant la capture électronique des données (EDC), les systèmes de gestion des essais cliniques (CTMS) et d'autres plateformes numériques, sont de plus en plus essentielles pour rationaliser les essais cliniques et garantir la conformité réglementaire dans toute l'Europe en raison de leur efficacité, de leur accès aux données en temps réel et de leurs capacités d'intégration avec des modèles d'essais décentralisés.
- La demande croissante de solutions e-cliniques est principalement motivée par le nombre croissant d'essais cliniques, l'accent croissant mis sur la recherche centrée sur le patient, les exigences réglementaires strictes et l'adoption croissante des technologies de santé numériques parmi les sociétés pharmaceutiques et les organisations de recherche sous contrat (CRO).
- L'Allemagne a dominé le marché des solutions e-cliniques avec la plus grande part de revenus de 28,5 % en 2024, caractérisée par une industrie pharmaceutique mature, une adoption précoce de solutions numériques et un solide soutien réglementaire, avec des entreprises leaders déployant des plateformes de gestion d'essais basées sur l'IA et le cloud.
- La France devrait être le pays connaissant la croissance la plus rapide au cours de la période de prévision en raison de l'expansion des activités d'essais cliniques, de l'augmentation des investissements dans les soins de santé et d'une participation accrue aux études de recherche multinationales.
- Le segment des systèmes de gestion des essais cliniques (CTMS) a dominé le marché européen des solutions e-cliniques avec une part de marché de 38,5 % en 2024, grâce à leur capacité à planifier, suivre et gérer efficacement des essais complexes tout en garantissant la conformité aux normes réglementaires en constante évolution.
Portée du rapport et segmentation du marché européen des solutions cliniques électroniques
|
Attributs |
Perspectives clés du marché des solutions cliniques électroniques en Europe |
|
Segments couverts |
|
|
Pays couverts |
Europe
|
|
Principaux acteurs du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
Outre les informations sur les scénarios de marché tels que la valeur marchande, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché organisés par Data Bridge Market Research comprennent également une analyse approfondie des experts, une analyse des prix, une analyse de la part de marque, une enquête auprès des consommateurs, une analyse démographique, une analyse de la chaîne d'approvisionnement, une analyse de la chaîne de valeur, un aperçu des matières premières/consommables, des critères de sélection des fournisseurs, une analyse PESTLE, une analyse Porter et un cadre réglementaire. |
Tendances du marché européen des solutions cliniques électroniques
Transformation numérique et essais cliniques pilotés par l'IA
- Une tendance significative et croissante sur le marché européen des solutions e-cliniques est l'adoption croissante de l'intelligence artificielle (IA) et de l'apprentissage automatique dans la gestion des essais cliniques, le recrutement des patients et l'analyse des données. Ces technologies améliorent considérablement l'efficacité, la précision et les perspectives prédictives des essais.
- Par exemple, des plateformes telles que Medidata Rave et EDC d'Oracle Health Sciences intègrent l'IA pour identifier l'éligibilité des patients, surveiller le respect du protocole et signaler les anomalies en temps réel, réduisant ainsi les erreurs et accélérant les délais des essais.
- L'analyse pilotée par l'IA dans les solutions e-cliniques permet la modélisation prédictive, la surveillance basée sur les risques et l'aide à la décision en temps réel. Par exemple, certains systèmes Medidata et Veeva utilisent l'IA pour optimiser la sélection des centres et prévoir les taux d'abandon des patients, améliorant ainsi les taux de réussite des essais. De plus, des plateformes cloud avancées permettent un partage fluide des données entre les centres d'étude, les promoteurs et les autorités réglementaires, garantissant ainsi une exécution plus rapide et plus conforme des essais.
- L'intégration des solutions e-cliniques avec des modèles d'essais décentralisés et hybrides facilite la surveillance à distance des patients, le consentement électronique et les suivis basés sur la télémédecine, créant ainsi une expérience d'essai numérique unifiée.
- Cette tendance vers des essais cliniques intelligents, interconnectés et centrés sur le patient remodèle les attentes en matière de gestion des essais, avec des entreprises telles que Veeva Systems et Oracle Health Sciences qui élargissent leurs offres basées sur l'IA pour une efficacité opérationnelle et une conformité réglementaire améliorées.
- La demande de plateformes e-cliniques entièrement intégrées et améliorées par l'IA augmente rapidement dans toute l'Europe, stimulée par les sociétés pharmaceutiques, les sociétés de biotechnologie et les organisations de recherche sous contrat (CRO) à la recherche d'opérations d'essais cliniques plus rapides, plus précises et plus conformes.
Dynamique du marché européen des solutions cliniques électroniques
Conducteur
Augmentation des essais cliniques et de la pression réglementaire
- Le nombre croissant d'essais cliniques en Europe, associé à des exigences réglementaires strictes telles que les lignes directrices de l'Agence européenne des médicaments (EMA) et la conformité au RGPD, constitue un moteur important pour l'adoption de solutions e-cliniques.
- Par exemple, en mars 2025, l'initiative Espace européen des données de santé (EHDS) a mis l'accent sur l'utilisation standardisée des données de santé électroniques, incitant les sociétés pharmaceutiques à adopter des plateformes cliniques électroniques intégrées pour une gestion efficace des essais et des rapports réglementaires.
- Alors que les organisations recherchent des essais plus rapides, plus sûrs et plus rentables, les solutions e-Clinical offrent des fonctionnalités telles que la surveillance en temps réel, la gestion des sites basée sur les risques et la vérification électronique des données sources, offrant des avantages évidents par rapport aux processus manuels traditionnels.
- En outre, l’adoption de modèles d’essais décentralisés et hybrides rend les solutions e-cliniques essentielles pour permettre la surveillance à distance des patients, les visites virtuelles et le suivi de la conformité en temps réel.
- La combinaison de la pression réglementaire, des avancées technologiques et du besoin d'efficacité opérationnelle accélère l'adoption de plateformes e-cliniques basées sur le cloud, activées par l'IA et entièrement intégrées dans les secteurs pharmaceutiques et biotechnologiques européens.
Retenue/Défi
Préoccupations relatives à la confidentialité des données et coûts de mise en œuvre élevés
- Les préoccupations concernant la confidentialité des données des patients, la conformité au RGPD et les vulnérabilités en matière de cybersécurité des plateformes d'essais cliniques numériques constituent un obstacle majeur à leur adoption par le marché. Les solutions e-cliniques impliquant le traitement de données de santé sensibles, les entreprises doivent mettre en œuvre un chiffrement robuste, des protocoles d'accès sécurisés et des audits réguliers.
- Par exemple, des incidents très médiatisés de violations de données de santé en Europe ont rendu certaines organisations hésitantes à numériser entièrement la gestion des essais, en particulier pour les études multinationales.
- Répondre à ces préoccupations en matière de confidentialité et de sécurité des données grâce à un chiffrement avancé, un stockage cloud sécurisé et la formation du personnel est essentiel pour instaurer la confiance entre les promoteurs et les autorités de réglementation. De plus, le coût initial relativement élevé des plateformes e-cliniques sophistiquées peut constituer un obstacle pour les petites entreprises de biotechnologie et les CRO aux budgets limités.
- Alors que les solutions évolutives basées sur le cloud réduisent progressivement les barrières, les fonctionnalités premium telles que l'analyse prédictive basée sur l'IA, la surveillance intégrée des patients ou les outils de résultats électroniques rapportés par les patients (ePRO) ont souvent un prix plus élevé.
- Surmonter ces défis grâce à des mesures de cybersécurité renforcées, un soutien à la conformité et des modèles de plateforme rentables sera essentiel pour une croissance soutenue du marché européen des solutions e-cliniques.
Portée du marché européen des solutions e-cliniques
Le marché est segmenté en fonction du produit, du mode de livraison, de la phase d’essai clinique, de la taille de l’organisation, de l’appareil utilisateur et de l’utilisateur final.
- Par produit
En termes de produits, le marché européen des solutions e-cliniques est segmenté en systèmes de saisie électronique de données et de gestion des données d'essais cliniques, systèmes de gestion des essais cliniques (CTMS), plateformes d'analyse clinique, dossiers médicaux de coordination des soins (CCMR), gestion de la randomisation et de l'approvisionnement des essais, plateformes d'intégration de données cliniques, solutions électroniques d'évaluation des résultats cliniques, solutions de sécurité, systèmes de fichiers maîtres d'essais électroniques, solutions de gestion des informations réglementaires, etc. Le segment des systèmes de gestion des essais cliniques (CTMS) a dominé le marché avec la plus grande part de chiffre d'affaires (38,5 %) en 2024, grâce à sa capacité à planifier, suivre et gérer efficacement des essais complexes tout en garantissant la conformité réglementaire. Les entreprises pharmaceutiques et les CRO privilégient souvent les CTMS pour leur supervision complète des essais, leur gestion centralisée des données et leur intégration avec d'autres systèmes e-cliniques. Ce segment bénéficie également d'une adoption croissante dans les essais multinationaux à grande échelle, où une automatisation robuste des flux de travail et une surveillance basée sur les risques sont essentielles.
Le segment des plateformes d'analyse clinique devrait connaître le TCAC le plus rapide, soit 17,5 % entre 2025 et 2032, grâce à la demande croissante d'informations issues de l'IA, d'analyses prédictives et d'aide à la décision en temps réel dans les essais cliniques. La capacité d'analyser de vastes ensembles de données, d'identifier les tendances et d'optimiser les performances des essais rend ces plateformes très attractives pour les promoteurs en quête d'une efficacité opérationnelle et d'un taux de réussite accrus. Face à la complexité croissante des essais cliniques et à l'ampleur des données générées, les solutions d'analyse clinique deviennent indispensables pour améliorer les résultats des essais et l'efficacité opérationnelle.
- Par mode de livraison
En fonction du mode de livraison, le marché européen des solutions e-cliniques est segmenté en solutions hébergées sur le web (à la demande), solutions d'entreprise sous licence (sur site) et solutions cloud (SaaS). Les solutions cloud (SaaS) détenaient la plus grande part de marché (42 %) en 2024 grâce à leur évolutivité, leurs coûts initiaux réduits, leur accessibilité à distance et leur intégration transparente aux opérations d'essais décentralisées. Ces solutions sont particulièrement prisées par les CRO et les entreprises pharmaceutiques de taille moyenne qui recherchent un déploiement rapide et des modèles d'abonnement flexibles.
Les solutions hébergées sur le web (à la demande) devraient connaître la croissance la plus rapide entre 2025 et 2032, portées par la nécessité d'un déploiement agile et rentable, et par l'adoption croissante de modèles d'essais cliniques hybrides et décentralisés en Europe. Ces solutions permettent aux parties prenantes, notamment les promoteurs, les investigateurs et les patients, d'accéder aux données des essais en toute sécurité, où qu'ils se trouvent, améliorant ainsi l'efficacité des essais et réduisant les délais opérationnels.
- Par phase d'essai clinique
En fonction de la phase des essais cliniques, le marché européen des solutions e-cliniques est segmenté en essais de phase I, II, III et IV. Les essais de phase III ont dominé le marché avec une part de 40 % en 2024, en raison de leur plus grande envergure, de la complexité de leur gestion des données et d'une surveillance réglementaire plus stricte. Des solutions e-cliniques performantes sont essentielles dans les essais de phase III pour garantir un suivi en temps réel, la qualité des données et la conformité aux réglementations de l'EMA. Elles facilitent une assurance qualité des données rigoureuse, la conformité aux réglementations de l'EMA et locales, ainsi que la simplification des rapports, autant d'éléments essentiels à la réussite des essais cliniques de stade avancé.
Les essais de phase II devraient connaître leur croissance la plus rapide entre 2025 et 2032, grâce à la multiplication des essais en phase précoce et à l'adoption croissante des plateformes numériques pour le recrutement des patients, le respect des protocoles et l'analyse des résultats. Ces interventions numériques réduisent la durée des cycles d'essai, améliorent la précision et permettent aux promoteurs de prendre plus rapidement des décisions d'autorisation ou de refus pour les programmes de développement de médicaments.
- Par taille d'organisation
En fonction de la taille des organisations, le marché européen des solutions e-cliniques est segmenté en petites, moyennes et grandes organisations. Les grandes organisations dominaient le marché avec une part de marché de 55 % en 2024, bénéficiant de budgets plus importants pour des plateformes e-cliniques avancées, de portefeuilles d'essais étendus et d'exigences réglementaires plus strictes. Ces organisations ont la capacité d'investir dans des plateformes intégrées, multifonctionnelles et basées sur l'IA pour garantir l'efficacité des essais, respecter les normes réglementaires et gérer des volumes importants de données.
Les PME devraient connaître la croissance la plus rapide au cours de la période de prévision, grâce aux solutions cloud et SaaS qui réduisent les coûts initiaux et permettent un déploiement flexible pour les essais à petite échelle. L'essor des solutions cloud et SaaS a abaissé les barrières à l'entrée pour les PME, leur permettant de déployer des plateformes e-cliniques avec un investissement initial minimal, d'accéder à des outils d'analyse avancés et de mener efficacement des essais décentralisés ou hybrides.
- Par appareil utilisateur
En fonction de l'appareil utilisé, le marché européen des solutions e-cliniques est segmenté en ordinateurs de bureau, tablettes, assistants numériques personnels (PDA), smartphones et autres. En 2024, les solutions de bureau détenaient la plus grande part de marché, soit 45 %, grâce à leur fiabilité, leur accès complet aux fonctionnalités et leur adéquation aux tâches complètes de gestion des essais cliniques effectuées sur les sites de recherche et chez les promoteurs. Les ordinateurs de bureau restent essentiels pour des tâches telles que la conception des protocoles, la mise en place des essais, la production de rapports réglementaires et l'analyse avancée.
Les smartphones et les tablettes devraient connaître la croissance la plus rapide entre 2025 et 2032, portée par les modèles d'essais décentralisés, la télésurveillance, la collecte de données ePRO et le besoin de communication en temps réel entre patients, investigateurs et promoteurs. Les solutions cliniques électroniques mobiles améliorent l'engagement des patients, le respect des protocoles d'essai et permettent une prise de décision plus rapide.
- Par utilisateur final
En fonction de l'utilisateur final, le marché européen des solutions e-cliniques est segmenté en entreprises pharmaceutiques et biopharmaceutiques, organisations de recherche sous contrat (CRO), sociétés de conseil, fabricants de dispositifs médicaux, hôpitaux et instituts de recherche universitaires. En 2024, les entreprises pharmaceutiques et biopharmaceutiques dominaient le marché avec une part de 50 %, grâce à leurs vastes portefeuilles d'essais cliniques, à leurs obligations réglementaires et au besoin de plateformes e-cliniques robustes et intégrées.
Les organisations de recherche contractuelle (CRO) devraient connaître leur croissance annuelle moyenne la plus rapide entre 2025 et 2032, portées par l'externalisation croissante des opérations d'essais cliniques, la demande de gestion centralisée des essais et l'adoption de solutions cloud et d'IA pour optimiser l'efficacité et la rentabilité des essais. Les CRO s'appuient de plus en plus sur les solutions e-cliniques pour gérer simultanément les essais de plusieurs promoteurs, optimiser les flux de travail et garantir la conformité aux normes réglementaires européennes.
Analyse régionale du marché européen des solutions cliniques électroniques
- L'Allemagne a dominé le marché des solutions e-cliniques avec la plus grande part de revenus de 28,5 % en 2024, caractérisée par une industrie pharmaceutique mature, une adoption précoce de solutions numériques et un solide soutien réglementaire, avec des entreprises leaders déployant des plateformes de gestion d'essais basées sur l'IA et le cloud.
- Les organisations du pays apprécient grandement l’efficacité, la surveillance en temps réel et la conformité réglementaire offertes par les solutions e-Clinical, permettant une gestion plus rapide et plus précise des essais cliniques complexes sur plusieurs sites.
- Cette adoption généralisée est en outre soutenue par une infrastructure technologique avancée, une forte concentration d'organisations de recherche sous contrat (CRO) et des investissements croissants dans les essais cliniques décentralisés et hybrides, établissant les solutions e-cliniques comme un choix privilégié pour les institutions de recherche pharmaceutique, biotechnologique et universitaire à travers l'Allemagne.
Aperçu du marché allemand des solutions cliniques électroniques
L'Allemagne a dominé le marché européen des solutions e-cliniques avec une part de chiffre d'affaires record de 28,5 % en 2024, grâce à un secteur pharmaceutique et biotechnologique dynamique, une infrastructure de santé de pointe et l'adoption précoce de plateformes e-cliniques basées sur le cloud et l'IA. Les organisations allemandes accordent une grande importance aux solutions sécurisées et respectueuses de la vie privée, ainsi qu'à l'intégration de modèles d'essais décentralisés et hybrides, prenant en charge les essais cliniques de phase II et III. L'accent mis sur l'innovation et la conformité réglementaire continue de faire de l'Allemagne un contributeur clé au marché européen.
Analyse du marché des solutions e-cliniques en France
La France devrait être le pays enregistrant la plus forte croissance sur le marché européen des solutions e-cliniques au cours de la période de prévision, grâce à l'augmentation des activités d'essais cliniques, aux initiatives réglementaires favorables et à l'adoption croissante de plateformes de gestion et d'analyse des essais basées sur l'IA. Les laboratoires pharmaceutiques et les CRO français exploitent de plus en plus les solutions e-cliniques pour optimiser le recrutement des patients, le respect des protocoles et le reporting en temps réel. L'accent croissant mis sur la numérisation et la prise de décision basée sur les données stimule l'expansion rapide du marché en France.
Aperçu du marché britannique des solutions cliniques électroniques
Le marché britannique des solutions e-cliniques devrait connaître une croissance annuelle moyenne (TCAC) remarquable au cours de la période de prévision, portée par l'adoption d'essais décentralisés, un écosystème robuste des sciences de la vie et la conformité aux réglementations de la MHRA et de l'EMA. Les entreprises pharmaceutiques et les CRO britanniques exploitent de plus en plus l'IA, l'analyse en temps réel et la surveillance à distance pour optimiser l'efficacité des essais et réduire les coûts opérationnels.
Aperçu du marché italien des solutions cliniques électroniques
Le marché italien des solutions e-cliniques devrait connaître une croissance soutenue au cours de la période de prévision, porté par l'expansion des essais cliniques, l'augmentation des investissements dans les technologies de santé numérique et la participation à des études multinationales. Les plateformes cloud, les solutions de diagnostic informatisé (EDC) et les solutions d'analyse clinique améliorent l'efficacité opérationnelle des laboratoires pharmaceutiques, des CRO et des instituts de recherche universitaires.
Aperçu du marché espagnol des solutions cliniques électroniques
Le marché espagnol des solutions e-cliniques connaît une croissance grâce à l'adoption croissante de plateformes intégrées de gestion des essais cliniques, à l'analyse basée sur l'IA et à l'importance réglementaire accordée à la sécurité des données des patients. L'accent mis sur l'efficacité des opérations cliniques et la collaboration transfrontalière au sein de l'UE soutient la demande du marché, notamment pour les essais de phase II et III.
Part de marché des solutions e-cliniques en Europe
Le secteur européen des solutions e-cliniques est principalement dirigé par des entreprises bien établies, notamment :
- eClinical Solutions LLC (États-Unis)
- Oracle Corporation (États-Unis)
- Anju Software, Inc. (États-Unis)
- Castor EDC (Pays-Bas)
- Signant Health (États-Unis)
- Dassault Systèmes SE (France)
- Medidata Solutions, Inc. (États-Unis)
- Parexel International (MA) Corporation (États-Unis)
- IQVIA (États-Unis)
- Veeva Systems (États-Unis)
- RealTime Software Solutions, LLC (États-Unis)
- Bioclinica (États-Unis)
- CRF Health (États-Unis)
- eClinicalWorks (États-Unis)
- Maxisit (Allemagne)
- Clario (États-Unis)
- Fountayn (États-Unis)
- ICON plc (Irlande)
- Medrio (États-Unis)
Quels sont les développements récents sur le marché européen des solutions e-cliniques ?
- En avril 2025, Veeva Systems a annoncé le lancement prochain de son nouveau système de gestion des essais cliniques Veeva SiteVault CTMS, spécialement conçu pour les centres de recherche. La première version est prévue pour août 2025. Cette avancée est significative car elle offre aux centres de recherche un système intégré et dédié pour gérer les essais, rationalisant ainsi les flux de travail spécifiques à chaque centre et améliorant la collaboration avec les promoteurs.
- En décembre 2024, eClinical Solutions a annoncé une nouvelle collaboration avec Snowflake, une entreprise de cloud de données IA. Ce partenariat établit une intégration bidirectionnelle entre le cloud de données cliniques elluminate d'eClinical et la plateforme Snowflake. Cette collaboration vise à optimiser les échanges de données pour les organisations du secteur des sciences de la vie, en les aidant à gérer et analyser plus efficacement le volume croissant de données d'essais cliniques complexes. Ce partenariat souligne l'importance croissante accordée à la création d'écosystèmes de données fluides sur différentes plateformes.
- En septembre 2024, eClinical Solutions, fournisseur leader de logiciels et services cliniques numériques, a annoncé un investissement majoritaire de GI Partners, une société d'investissement privée. Cette opération stratégique vise à accélérer la croissance de l'entreprise et à améliorer ses produits de données basés sur l'IA et ses services biométriques. Cet investissement illustre une tendance plus large du secteur : les fonds d'investissement privés investissent massivement dans les entreprises de technologie clinique électronique afin de capitaliser sur la demande croissante d'essais cliniques efficaces et axés sur les données.
- En juin 2024, Medidata, filiale de Dassault Systèmes, a annoncé le lancement de Clinical Data Studio. Cette nouvelle plateforme logicielle, optimisée par l'IA, est conçue pour optimiser la gestion des données des essais cliniques. Grâce à l'IA et à l'automatisation, le studio centralise les données d'essais provenant de diverses sources, contribuant ainsi à réduire jusqu'à 80 % les cycles d'évaluation et à améliorer la qualité des données. Ce lancement marque une étape importante dans la transition du secteur vers l'utilisation de l'IA pour moderniser et accélérer les processus liés aux données dans les essais cliniques.
- En février 2021, eClinical Solutions a lancé elluminate CTMS, une plateforme cloud conçue pour accélérer le développement de médicaments en simplifiant les processus d'essais cliniques. Ce système offre un accès aux données en temps réel, des analyses avancées et une collaboration renforcée entre les équipes cliniques.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.