Global Car T Therapy Treatment Market
Taille du marché en milliards USD
TCAC :
% 
 USD
2.44 Billion
USD
6.66 Billion
2024
2032
USD
2.44 Billion
USD
6.66 Billion
2024
2032
| 2025 –2032 | |
| USD 2.44 Billion | |
| USD 6.66 Billion | |
|
|
|
|
Segmentation du marché mondial des thérapies CAR-T, par types (Abecma, Breyanzi, Kymriah, Tecartus, Yescarta et autres), antigènes cibles (CD19, CD20, GD2, CD22, CD30, CD33, HER1, HER2, Meso, Egfrvlll et autres), applications thérapeutiques (leucémie lymphoblastique aiguë, leucémie lymphoïde chronique, leucémie non hodgkinienne, myélome multiple, cancer du pancréas, neuroblastome, cancer du sein, leucémie myéloïde aiguë, carcinome hépatocellulaire, cancer colorectal et autres) - Tendances et prévisions du secteur jusqu'en 2032
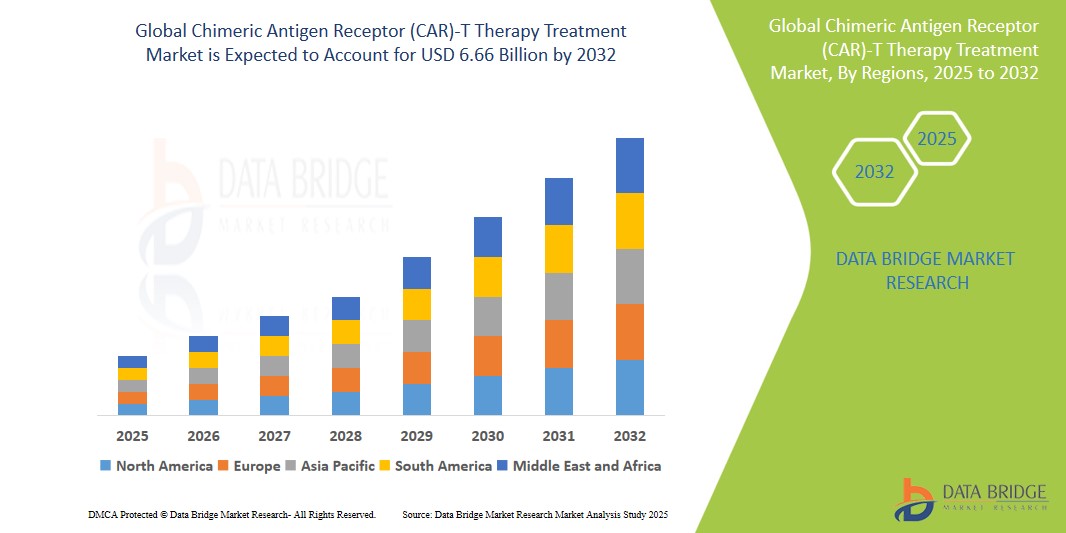
Taille du marché des traitements par thérapie CAR-T
- La taille du marché mondial de la thérapie par cellules T à récepteur antigénique chimérique (CAR) était évaluée à 2,44 milliards de dollars en 2023 et devrait atteindre 5,97 milliards de dollars d'ici 2031, avec un TCAC de 15,3 % au cours de la période de prévision.
- Cette croissance est alimentée par des facteurs tels que la prévalence croissante du cancer, les progrès de l'immunothérapie et l'approbation croissante des thérapies cellulaires CAR-T par les organismes de réglementation.
Analyse du marché des traitements par thérapie CAR-T
- La thérapie par cellules CAR-T est un traitement révolutionnaire contre le cancer qui modifie les lymphocytes T d'un patient afin qu'ils ciblent et détruisent les cellules cancéreuses. Elle a démontré une grande efficacité dans le traitement de certains types de leucémie, de lymphome et de myélome multiple.
- La demande de thérapie par cellules CAR-T est en hausse en raison de l'augmentation de l'incidence des hémopathies malignes et des résultats prometteurs des essais cliniques.
- L'Amérique du Nord devrait dominer le marché de la thérapie cellulaire CAR-T grâce à d'importantes activités de R&D, des dépenses de santé élevées et une adoption précoce des thérapies avancées.
- La région Asie-Pacifique devrait connaître la croissance la plus rapide sur le marché de la thérapie cellulaire CAR-T au cours de la période de prévision, en raison de l'expansion des secteurs de la biotechnologie et de l'augmentation du fardeau du cancer.
- Le segment de la leucémie lymphoblastique aiguë devrait dominer le marché avec une part de marché de 30 %, grâce à une forte réponse au traitement et aux développements cliniques en cours. Comptant parmi les premières indications approuvées pour la thérapie CAR-T, elle continue de stimuler la croissance du marché.
Portée du rapport et segmentation du marché des traitements par thérapie CAR-T (récepteur antigénique chimérique)
|
Attributs |
Principaux enseignements du marché des traitements par thérapie CAR-T |
|
Segments couverts |
|
|
Pays couverts |
Amérique du Nord
Europe
Asie-Pacifique
Moyen-Orient et Afrique
Amérique du Sud
|
|
Acteurs clés du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
Outre les informations sur les scénarios de marché tels que la valeur du marché, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché élaborés par Data Bridge Market Research comprennent également une analyse des importations et des exportations, un aperçu de la capacité de production, une analyse de la consommation de production, une analyse des tendances des prix, un scénario de changement climatique, une analyse de la chaîne d'approvisionnement, une analyse de la chaîne de valeur, un aperçu des matières premières/consommables, les critères de sélection des fournisseurs, une analyse PESTLE, une analyse de Porter et le cadre réglementaire. |
Tendances du marché des traitements par thérapie CAR-T
« Thérapies CAR-T de nouvelle génération et solutions prêtes à l’emploi (allogéniques) »
- Une tendance majeure dans le domaine des thérapies cellulaires CAR-T est l'émergence des thérapies CAR-T de nouvelle génération et le développement de solutions CAR-T allogéniques prêtes à l'emploi, visant à surmonter les limitations des produits CAR-T autologues traditionnels.
- Ces innovations visent à améliorer l'efficacité de la production, à réduire les coûts des traitements et à garantir un accès plus rapide aux soins pour les patients en éliminant la nécessité de prélever et de modifier les propres lymphocytes T du patient.
- Par exemple, les thérapies CAR-T allogéniques, telles que celles développées par Allogene Therapeutics et Precision BioSciences, utilisent des technologies d'édition génique pour produire des cellules CAR-T universelles à partir de donneurs sains, offrant ainsi la possibilité de traitements à grande échelle et facilement accessibles.
- Ces avancées sont sur le point de transformer l'immunothérapie du cancer, en réduisant le délai d'accès au traitement, en améliorant l'accessibilité et en favorisant l'expansion de la thérapie CAR-T à des indications et à des populations de patients plus larges.
Dynamique du marché des traitements par thérapie CAR-T
Conducteur
« Augmentation de l’incidence du cancer et grande efficacité des cellules CAR-T dans les hémopathies malignes »
- Le fardeau croissant du cancer à l'échelle mondiale, en particulier des hémopathies malignes comme la leucémie, le lymphome et le myélome multiple, est un facteur clé qui stimule la demande de thérapie par cellules CAR-T.
- Les thérapies CAR-T offrent une grande efficacité, plusieurs produits approuvés par la FDA démontrant des taux de rémission élevés chez les patients n'ayant pas répondu aux traitements conventionnels.
- Par exemple, selon le Centre international de recherche sur le cancer (CIRC), en 2022, environ 20 millions de nouveaux cas de cancer ont été diagnostiqués dans le monde, les cancers du sang représentant une part importante de ces cas. La prévalence croissante des cancers résistants aux traitements accentue le besoin d'options thérapeutiques avancées comme la thérapie CAR-T.
- Grâce aux progrès constants réalisés dans la conception des CAR, la sélection des antigènes cibles et l'administration du traitement, l'efficacité et la sécurité de la thérapie CAR-T continuent de s'améliorer, stimulant ainsi la croissance du marché.
Opportunité
« Élargissement des indications aux tumeurs solides et aux lignes de traitement plus précoces »
- L'une des perspectives les plus prometteuses réside dans l'extension de la thérapie par cellules CAR-T au-delà des hémopathies malignes, aux tumeurs solides, qui constituent la majorité des cas de cancer dans le monde.
- Les innovations en matière de modulation du microenvironnement tumoral, de CAR à double ciblage et de CAR-T blindés permettent aux cellules CAR-T de mieux infiltrer et de persister dans les tumeurs solides.
- De plus, les organismes de réglementation et les chercheurs étudient l'utilisation de la thérapie CAR-T à des stades plus précoces du traitement, ce qui pourrait élargir l'admissibilité des patients et améliorer les résultats.
- Par exemple, en mars 2024, des chercheurs du National Cancer Institute (NCI) ont lancé des essais de phase I pour les thérapies CAR-T ciblant le cancer du sein HER2-positif et le glioblastome EGFR-positif, marquant un tournant vers les applications aux tumeurs solides.
- Ces avancées pourraient considérablement élargir le champ d'application commercial des thérapies CAR-T et les positionner comme une option de première ou de deuxième ligne dans un plus large éventail de cancers.
Retenue/Défi
« Coûts de traitement élevés et processus de fabrication complexes »
- L'un des principaux obstacles à l'adoption généralisée de la thérapie CAR-T réside dans son coût élevé et son processus de fabrication complexe et individualisé, qui consiste à extraire, modifier et réinjecter les propres cellules T du patient.
- Les coûts des traitements dépassent souvent des centaines de milliers de dollars par patient, créant ainsi d'importants obstacles financiers pour les patients et les payeurs, et limitant l'accès aux soins dans les pays à revenu faible et intermédiaire.
- Par exemple, en octobre 2024, une étude publiée dans Health Affairs estimait le coût total moyen de la thérapie CAR-T (hospitalisation et soins de soutien inclus) aux États-Unis à plus de 500 000 dollars par patient, faisant de l’accessibilité financière une préoccupation majeure pour les systèmes de santé.
- Par conséquent, de telles limitations peuvent entraîner des disparités dans la qualité des soins et l'accès aux interventions chirurgicales de pointe, freinant ainsi la croissance globale du marché.
Portée du marché des traitements par thérapie CAR-T
Le marché est segmenté en fonction des types, de l'antigène cible et de l'application thérapeutique.
|
Segmentation |
Sous-segmentation |
|
Par types |
|
|
Par antigène cible |
|
|
Par application thérapeutique |
|
En 2025, le segment de la leucémie lymphoblastique aiguë (LLA) devrait dominer le marché en détenant la plus grande part du segment des applications thérapeutiques.
Le segment de la leucémie lymphoblastique aiguë (LLA) devrait dominer le marché des thérapies CAR-T en 2025, représentant la plus grande part de marché, soit environ 30 %. Cette position dominante s'explique par l'approbation rapide et le succès clinique des thérapies CAR-T, telles que Kymriah et Tecartus, pour le traitement des LLA en rechute ou réfractaires. Grâce à ses taux de réponse élevés et à son potentiel vital, la thérapie CAR-T s'impose comme le traitement de référence pour les patients ne répondant pas aux traitements conventionnels. L'incidence croissante de la LLA, notamment chez les enfants, ainsi que les progrès cliniques constants, devraient consolider la position de leader de ce segment.
Le segment de l'antigène cible CD19 devrait dominer le marché avec la plus grande part du segment des antigènes cibles.
Le segment ciblant l'antigène CD19 devrait représenter la plus grande part de marché (48,6 %) en 2025 au sein du marché des thérapies CAR-T. Le CD19 est l'antigène le plus fréquemment ciblé en raison de sa forte expression dans les hémopathies malignes à cellules B, telles que la leucémie lymphoblastique aiguë, le lymphome non hodgkinien et la leucémie lymphoïde chronique. Plusieurs thérapies CAR-T approuvées par la FDA, notamment Kymriah, Yescarta et Breyanzi, sont spécifiques du CD19 et ont démontré une efficacité clinique significative. Les essais cliniques en cours explorant le CD19 dans le cadre de thérapies combinées et de nouvelles indications devraient permettre à ce segment de conserver sa position dominante tout au long de la période de prévision.
Analyse régionale du marché des traitements par thérapie CAR-T
« L’Amérique du Nord détient la plus grande part du marché des traitements par thérapie CAR-T (récepteur antigénique chimérique) »
- L'Amérique du Nord domine le marché de la thérapie cellulaire CAR-T, grâce à une infrastructure de recherche clinique solide, à l'adoption précoce d'immunothérapies innovantes et à un cadre réglementaire robuste facilitant les approbations de thérapies cellulaires avancées.
- Les États-Unis sont en tête dans la région avec une forte concentration de thérapies CAR-T approuvées, notamment Kymriah, Yescarta et Breyanzi, qui sont largement accessibles dans les centres de traitement du cancer spécialisés.
- Des politiques de remboursement favorables, l'augmentation de l'incidence du cancer et les initiatives gouvernementales visant à promouvoir l'oncologie de précision contribuent de manière significative à l'expansion du marché.
- En outre, la présence d'entreprises de biotechnologie de premier plan, les essais cliniques en cours pour de nouvelles indications et les investissements dans les installations de fabrication de thérapies cellulaires renforcent le leadership de la région dans le paysage mondial de la thérapie CAR-T.
« La région Asie-Pacifique devrait enregistrer le taux de croissance annuel composé (TCAC) le plus élevé sur le marché des traitements par thérapie CAR-T (récepteur antigénique chimérique). »
- La région Asie-Pacifique devrait connaître le taux de croissance le plus élevé sur le marché de la thérapie cellulaire CAR-T, alimenté par le développement des infrastructures de santé, la prévalence croissante du cancer et l'augmentation des investissements dans l'innovation biotechnologique.
- Des pays comme la Chine, le Japon, la Corée du Sud et l'Inde émergent comme des marchés clés grâce à l'adoption croissante des traitements personnalisés contre le cancer et au soutien gouvernemental à la recherche clinique et au développement de la thérapie cellulaire.
- La Chine, en particulier, progresse rapidement dans le domaine des cellules CAR-T, avec un grand nombre d'essais cliniques et d'entreprises de biotechnologie nationales lançant des thérapies compétitives ciblant les antigènes CD19, CD22 et BCMA.
- L'organisme de réglementation japonais a adopté des procédures d'approbation accélérées pour les thérapies régénératives et avancées, contribuant ainsi à accélérer l'accès aux traitements CAR-T.
- L'Inde connaît une demande croissante de thérapie CAR-T, soutenue par des collaborations universitaires et des initiatives visant à localiser la production et à réduire les coûts de traitement. Cette dynamique régionale devrait contribuer de manière significative à la croissance du marché mondial au cours de la période prévisionnelle.
Part de marché des traitements par thérapie CAR-T (récepteur antigénique chimérique)
L'analyse concurrentielle du marché fournit des informations détaillées par concurrent. Ces informations comprennent un aperçu de l'entreprise, ses données financières, son chiffre d'affaires, son potentiel de marché, ses investissements en recherche et développement, ses initiatives sur de nouveaux marchés, sa présence mondiale, ses sites et installations de production, ses capacités de production, ses forces et faiblesses, ses lancements de produits, l'étendue de sa gamme de produits et sa position dominante sur le marché. Les données présentées ci-dessus concernent uniquement les activités principales des entreprises liées au marché.
Les principaux acteurs du marché sont :
- Autolus Therapeutics (Royaume-Uni)
- CARsgen Therapeutics Holdings Limited (Royaume-Uni)
- Société Bristol-Myers Squibb (États-Unis)
- Sorrento Therapeutics, Inc. (États-Unis)
- bluebird bio, Inc. (États-Unis)
- Eureka Therapeutics Inc. (États-Unis)
- Groupe Avacta plc (Royaume-Uni)
- Cibus Inc. (France)
- Celyad Oncology SA (Belgique)
- Fortress Biotech, Inc. (États-Unis)
- Gilead Sciences, Inc. (États-Unis)
- Novartis AG (Suisse)
- Alaunos Therapeutics, Inc. (États-Unis)
- Poseida Therapeutics, Inc. (États-Unis)
Dernières évolutions du marché mondial des traitements par thérapie CAR-T
- En décembre 2023, Max Healthcare a introduit avec succès la thérapie par cellules CAR-T dans la région de Delhi-NCR, marquant une avancée significative dans les options de traitement du cancer. Cette thérapie innovante, développée en partenariat avec ImmunoACT, est spécifiquement conçue pour combattre les lymphomes et les leucémies, offrant un nouvel espoir aux patients luttant contre ces maladies complexes.
- En décembre 2022, CARsgen Therapeutics Co., Ltd. s'est associée à l'Institut du cancer de Shanghai pour développer une nouvelle technologie qui améliore considérablement l'efficacité antitumorale des lymphocytes T. Leur équipe de recherche a découvert que les lymphocytes T CAR modifiés pour surexprimer Runx3 présentaient une activité antitumorale soutenue et un meilleur contrôle tumoral que les thérapies classiques par lymphocytes T à récepteur antigénique chimérique.
- En novembre 2022, Caribou Biosciences, Inc. a annoncé que son traitement allogénique par cellules CAR-T anti-CD19, CB-010, avait reçu la désignation de thérapie avancée de médecine régénérative (RMAT) de la Food and Drug Administration (FDA) américaine pour le lymphome à grandes cellules B (LBCL) récidivant ou réfractaire, ainsi que la désignation de procédure accélérée pour le lymphome non hodgkinien à cellules B récidivant ou réfractaire.
- En juin 2022, l’Université d’Ottawa a présenté des résultats prometteurs de l’essai clinique CLIC-01 (Immunothérapies contre le cancer menées au Canada), qui portait sur l’une des premières thérapies cellulaires CAR-T contre le cancer développées au Canada. Cette thérapie se caractérise par un procédé de fabrication unique qui pourrait permettre d’offrir des options de traitement plus abordables et plus équitables.
- En novembre 2021, le conseil d'administration du California Institute for Regenerative Medicine a approuvé une subvention de 4,1 millions de dollars américains pour soutenir le développement d'une thérapie innovante par cellules T à récepteur antigénique chimérique (CAR-T) mise au point par des scientifiques de la faculté de médecine de l'Université de Californie à San Diego. Cette subvention vise à faciliter la transition de ce traitement prometteur contre le cancer du laboratoire à la pratique clinique.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Table des matières
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 EPIDEMIOLOGY
2.2.12 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.13 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3 MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4 EXECUTIVE SUMMARY
5 PREMIUM INSIGHTS
5.1 PESTEL ANALYSIS
5.2 PORTER’S FIVE FORCES MODEL
6 INDUSTRY INSIGHTS
6.1 PATENT ANALYSIS
6.1.1 PATENT LANDSCAPE
6.1.2 USPTO NUMBER
6.1.3 PATENT EXPIRY
6.1.4 EPIO NUMBER
6.1.5 PATENT STRENGTH AND QUALITY
6.1.6 PATENT CLAIMS
6.1.7 PATENT CITATIONS
6.1.8 PATENT LITIGATION AND LICENSING
6.1.9 FILE OF PATENT
6.1.10 PATENT RECEIVED CONTRIES
6.1.11 TECHNOLOGY BACKGROUND
6.2 DRUG TREATMENT RATE BY MATURED MARKETS
6.3 DEMOGRAPHIC TRENDS: IMPACTS ON ALL INCIDENCE RATES
6.4 PATIENT FLOW DIAGRAM
6.5 KEY PRICING STRATEGIES
6.6 KEY PATIENT ENROLLMENT STRATEGIES
6.7 INTERVIEWS WITH SPECIALIST
6.8 OTHER KOL SNAPSHOTS
7 EPIDEMIOLOGY
7.1 INCIDENCE OF ALL BY GENDER
7.1.1 PREVALENCE OF B-CELL ACUTE LYMPHOBLASTIC LEUKEMIA (ALL)
7.1.2 PREVALENCE OF B-CELL NON-HODGKIN LYMPHOMA (NHL)
7.1.3 PREVALENCE OF FOLLICULAR LYMPHOMA
7.1.4 PREVALENCE OF MANTLE CELL LYMPHOMA (MCL)
7.1.5 PREVALENCE OF MULTIPLE MYELOMA
7.2 TREATMENT RATE
7.3 MORTALITY RATE
7.4 PATIENT TREATMENT SUCCESS RATES
8 MERGERS AND ACQUISITION
8.1 LICENSING
8.2 COMMERCIALIZATION AGREEMENTS
9 REGULATORY FRAMEWORK
9.1 REGULATORY APPROVAL PROCESS
9.2 GEOGRAPHIES’ EASE OF REGULATORY APPROVAL
9.3 REGULATORY APPROVAL PATHWAYS
9.4 LICENSING AND REGISTRATION
9.5 POST-MARKETING SURVEILLANCE
9.6 GOOD MANUFACTURING PRACTICES (GMPS) GUIDELINES
10 PIPELINE ANALYSIS
10.1 CLINICAL TRIALS AND PHASE ANALYSIS
10.2 DRUG THERAPY PIPELINE
10.3 PHASE III CANDIDATES
10.4 PHASE II CANDIDATES
10.5 PHASE I CANDIDATES
10.6 OTHERS (PRE-CLINICAL AND RESEARCH)
TABLE 1 GLOBAL CLINICAL TRIAL MARKET FOR XX
Company Name Therapeutic Area
XX XX
XX XX
XX XX
XX XX
XX XX
XX XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 2 DISTRIBUTION OF PRODUCTS AND PROJECTS BY PHASE
Phase Number of Projects
Preclinical/Research Projects XX
Clinical Development XX
Phase I XX
Phase II XX
Phase III XX
U.S. Filed/Approved But Not Yet Marketed XX
Total XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 3 DISTRIBUTION OF PROJECTS BY THERAPEUTIC AREA AND PHASE
Therapeutic Area Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 4 DISTRIBUTION OF PROJECTS BY SCIENTIFIC APPROACH AND PHASE
Technology Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
FIGURE 1 TOP ENTITIES BASED ON R&D GLANCE FOR XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
11 MARKETED DRUG ANALYSIS
11.1 DRUG
11.1.1 BRAND NAME
11.1.2 GENERICS NAME
11.2 THERAPEUTIC INDICTION
11.3 PHARMACOLOGICAL CLASS OF THE DRUG
11.4 DRUG PRIMARY INDICATION
11.5 MARKET STATUS
11.6 MEDICATION TYPE
11.7 DRUG DOSAGES FORM
11.8 DOSAGES AVAILABILITY
11.9 DRUG ROUTE OF ADMINISTRATION
11.1 DOSING FREQUENCY
11.11 DRUG INSIGHT
11.12 AN OVERVIEW OF THE DRUG DEVELOPMENT ACTIVITIES SUCH AS REGULATORY MILSTONE, SAFETY DATA AND EFFICACY DATA, MARKET EXCLUSIVITY DATA.
11.12.1 FORECAST MARKET OUTLOOK
11.12.2 CROSS COMPETITION
11.12.3 THERAPEUTIC PORTFOLIO
11.12.4 CURRENT DEVELOPMENT SCENARIO
12 MARKET ACCESS
12.1 10-YEAR MARKET FORECAST
12.2 CLINICAL TRIAL RECENT UPDATES
12.3 ANNUAL NEW FDA APPROVED DRUGS
12.4 DRUGS MANUFACTURER AND DEALS
12.5 MAJOR DRUG UPTAKE
12.6 CURRENT TREATMENT PRACTICES
12.7 IMPACT OF UPCOMING THERAPY
13 R & D ANALYSIS
13.1 COMPARATIVE ANALYSIS
13.2 DRUG DEVELOPMENTAL LANDSCAPE
13.3 IN-DEPTH INSIGHTS ON REGULATORY MILESTONES
13.4 THERAPEUTIC ASSESSMENT
13.5 ASSET-BASED COLLABORATIONS AND PARTNERSHIPS
14 MARKET OVERVIEW
14.1 DRIVERS
14.2 RESTRAINTS
14.3 OPPORTUNITIES
14.4 CHALLENGES
15 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY TARGET INDICATION
15.1 OVERVIEW
15.2 B-CELL ACUTE LYMPHOBLASTIC LEUKEMIA (ALL)
15.3 B-CELL NON-HODGKIN LYMPHOMA (NHL)
15.4 FOLLICULAR LYMPHOMA
15.5 MANTLE CELL LYMPHOMA (MCL)
15.6 MULTIPLE MYELOMA
15.7 OTHERS
16 GLOBAL
16.1 OVERVIEW
16.2 AUTOLOGOUS CAR-T CELLS
16.3 ALLOGENEIC CAR-T CELLS
17 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY TARGET ANTIGEN
17.1 OVERVIEW
17.2 CD19
17.2.1 TISAGENLECLEUCEL
17.2.1.1. MARKET VALUE (USD MN)
17.2.1.2. MARKET VOLUME (SU)
17.2.1.3. AVERAGE SELLING PRICE (USD)
17.2.2 AXIXABTAGENE CILOLEUCEL
17.2.2.1. MARKET VALUE (USD MN)
17.2.2.2. MARKET VOLUME (SU)
17.2.2.3. AVERAGE SELLING PRICE (USD)
17.2.3 BREXUCABTAGENE AUTOLLEUCEL
17.2.3.1. MARKET VALUE (USD MN)
17.2.3.2. MARKET VOLUME (SU)
17.2.3.3. AVERAGE SELLING PRICE (USD)
17.2.4 LISOCABTAGENE MARALEUCEL
17.2.4.1. MARKET VALUE (USD MN)
17.2.4.2. MARKET VOLUME (SU)
17.2.4.3. AVERAGE SELLING PRICE (USD)
17.2.5 OTHERS
17.3 BCMA
17.3.1 IDECABTAGENE VICLEUCEL
17.3.1.1. MARKET VALUE (USD MN)
17.3.1.2. MARKET VOLUME (SU)
17.3.1.3. AVERAGE SELLING PRICE (USD)
17.3.2 CILTACABTAGENE AUTOLEUCEL
17.3.2.1. MARKET VALUE (USD MN)
17.3.2.2. MARKET VOLUME (SU)
17.3.2.3. AVERAGE SELLING PRICE (USD)
17.3.3 OTHERS
17.4 OTHERS
18 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY AGE GROUP
18.1 OVERVIEW
18.2 CHILDREN (0-15)
18.3 ADULTS (16- 64)
18.4 SENIORS (65 AND ABOVE)
19 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY GENDER
19.1 OVERVIEW
19.2 MALE
19.3 FEMALE
20 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY END USER
20.1 OVERVIEW
20.2 HOSPITAL
20.2.1 PRIVATE
20.2.2 PUBLIC
20.3 SPECIALTY CLINICS
20.4 RESEARCH INSTITUTES
20.5 CANCER INSTITUTES
20.6 PHARMACEUTICAL & BIOTECHNOLOGY COMPANIES
20.7 OTHERS
21 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY DISTRIBUTION CHANNEL
21.1 OVERVIEW
21.2 DIRECT SALE
21.3 RETAIL SALES
21.4 OTHERS
22 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, COMPANY LANDSCAPE
22.1 COMPANY SHARE ANALYSIS: GLOBAL
22.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
22.3 COMPANY SHARE ANALYSIS: EUROPE
22.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
22.5 MERGERS & ACQUISITIONS
22.6 NEW PRODUCT DEVELOPMENT & APPROVALS
22.7 EXPANSIONS
22.8 REGULATORY CHANGES
22.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
23 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY GEOGRAPHY
GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
23.1 NORTH AMERICA
23.1.1 U.S.
23.1.2 CANADA
23.1.3 MEXICO
23.2 EUROPE
23.2.1 GERMANY
23.2.2 U.K.
23.2.3 ITALY
23.2.4 FRANCE
23.2.5 SPAIN
23.2.6 RUSSIA
23.2.7 SWITZERLAND
23.2.8 TURKEY
23.2.9 BELGIUM
23.2.10 NETHERLANDS
23.2.11 DENMARK
23.2.12 SWEDEN
23.2.13 POLAND
23.2.14 NORWAY
23.2.15 FINLAND
23.2.16 REST OF EUROPE
23.3 ASIA-PACIFIC
23.3.1 JAPAN
23.3.2 CHINA
23.3.3 SOUTH KOREA
23.3.4 INDIA
23.3.5 SINGAPORE
23.3.6 THAILAND
23.3.7 INDONESIA
23.3.8 MALAYSIA
23.3.9 PHILIPPINES
23.3.10 AUSTRALIA
23.3.11 NEW ZEALAND
23.3.12 VIETNAM
23.3.13 TAIWAN
23.3.14 REST OF ASIA-PACIFIC
23.4 SOUTH AMERICA
23.4.1 BRAZIL
23.4.2 ARGENTINA
23.4.3 REST OF SOUTH AMERICA
23.5 MIDDLE EAST AND AFRICA
23.5.1 SOUTH AFRICA
23.5.2 EGYPT
23.5.3 BAHRAIN
23.5.4 UNITED ARAB EMIRATES
23.5.5 KUWAIT
23.5.6 OMAN
23.5.7 QATAR
23.5.8 SAUDI ARABIA
23.5.9 REST OF MIDDLE EAST AND AFRICA
23.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
24 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, SWOT AND DBMR ANALYSIS
25 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, COMPANY PROFILE
25.1 NOVARTIS AG
25.1.1 COMPANY OVERVIEW
25.1.2 REVENUE ANALYSIS
25.1.3 GEOGRAPHIC PRESENCE
25.1.4 PRODUCT PORTFOLIO
25.1.5 RECENT DEVELOPMENTS
25.2 KITE PHARMA
25.2.1 COMPANY OVERVIEW
25.2.2 REVENUE ANALYSIS
25.2.3 GEOGRAPHIC PRESENCE
25.2.4 PRODUCT PORTFOLIO
25.2.5 RECENT DEVELOPMENTS
25.3 JUNO THERAPTICS
25.3.1 COMPANY OVERVIEW
25.3.2 REVENUE ANALYSIS
25.3.3 GEOGRAPHIC PRESENCE
25.3.4 PRODUCT PORTFOLIO
25.3.5 RECENT DEVELOPMENTS
25.4 BRISTOL MYERS SQUIBB
25.4.1 COMPANY OVERVIEW
25.4.2 REVENUE ANALYSIS
25.4.3 GEOGRAPHIC PRESENCE
25.4.4 PRODUCT PORTFOLIO
25.4.5 RECENT DEVELOPMENTS
25.5 LEGEND BIOTECH INC
25.5.1 COMPANY OVERVIEW
25.5.2 REVENUE ANALYSIS
25.5.3 GEOGRAPHIC PRESENCE
25.5.4 PRODUCT PORTFOLIO
25.5.5 RECENT DEVELOPMENTS
25.6 AMMGEN, INC
25.6.1 COMPANY OVERVIEW
25.6.2 REVENUE ANALYSIS
25.6.3 GEOGRAPHIC PRESENCE
25.6.4 PRODUCT PORTFOLIO
25.6.5 RECENT DEVELOPMENTS
25.7 SORRENTO THERAPUTICS, INC.
25.7.1 COMPANY OVERVIEW
25.7.2 REVENUE ANALYSIS
25.7.3 GEOGRAPHIC PRESENCE
25.7.4 PRODUCT PORTFOLIO
25.7.5 RECENT DEVELOPMENTS
25.8 GILEAD SCIENCE
25.8.1 COMPANY OVERVIEW
25.8.2 REVENUE ANALYSIS
25.8.3 GEOGRAPHIC PRESENCE
25.8.4 PRODUCT PORTFOLIO
25.8.5 RECENT DEVELOPMENTS
25.9 BLUE BIRD BIO, INC.
25.9.1 COMPANY OVERVIEW
25.9.2 REVENUE ANALYSIS
25.9.3 GEOGRAPHIC PRESENCE
25.9.4 PRODUCT PORTFOLIO
25.9.5 RECENT DEVELOPMENTS
25.1 IMMUN THERAPUTICS, INC
25.10.1 COMPANY OVERVIEW
25.10.2 REVENUE ANALYSIS
25.10.3 GEOGRAPHIC PRESENCE
25.10.4 PRODUCT PORTFOLIO
25.10.5 RECENT DEVELOPMENTS
25.11 BELLICUM PARMACEUTICALS, INC.
25.11.1 COMPANY OVERVIEW
25.11.2 REVENUE ANALYSIS
25.11.3 GEOGRAPHIC PRESENCE
25.11.4 PRODUCT PORTFOLIO
25.11.5 RECENT DEVELOPMENTS
25.12 PFIZER, INC.
25.12.1 COMPANY OVERVIEW
25.12.2 REVENUE ANALYSIS
25.12.3 GEOGRAPHIC PRESENCE
25.12.4 PRODUCT PORTFOLIO
25.12.5 RECENT DEVELOPMENTS
25.13 ELI LILLY AND COMPANY
25.13.1 COMPANY OVERVIEW
25.13.2 REVENUE ANALYSIS
25.13.3 GEOGRAPHIC PRESENCE
25.13.4 PRODUCT PORTFOLIO
25.13.5 RECENT DEVELOPMENTS
25.14 JW THERAPEUTICS
25.14.1 COMPANY OVERVIEW
25.14.2 REVENUE ANALYSIS
25.14.3 GEOGRAPHIC PRESENCE
25.14.4 PRODUCT PORTFOLIO
25.14.5 RECENT DEVELOPMENTS
25.15 FORTRESS BIOTECH, INC.
25.15.1 COMPANY OVERVIEW
25.15.2 REVENUE ANALYSIS
25.15.3 GEOGRAPHIC PRESENCE
25.15.4 PRODUCT PORTFOLIO
25.15.5 RECENT DEVELOPMENTS
25.16 CARTESIAN THERAPEUTICS, INC.
25.16.1 COMPANY OVERVIEW
25.16.2 REVENUE ANALYSIS
25.16.3 GEOGRAPHIC PRESENCE
25.16.4 PRODUCT PORTFOLIO
25.16.5 RECENT DEVELOPMENTS
25.17 CASI PHARMACEUTICALS
25.17.1 COMPANY OVERVIEW
25.17.2 REVENUE ANALYSIS
25.17.3 GEOGRAPHIC PRESENCE
25.17.4 PRODUCT PORTFOLIO
25.17.5 RECENT DEVELOPMENTS
25.18 POSEIDA THERAPEUTICS, INC.
25.18.1 COMPANY OVERVIEW
25.18.2 REVENUE ANALYSIS
25.18.3 GEOGRAPHIC PRESENCE
25.18.4 PRODUCT PORTFOLIO
25.18.5 RECENT DEVELOPMENTS
25.19 AUTOLUS THERAPEUTICS
25.19.1 COMPANY OVERVIEW
25.19.2 REVENUE ANALYSIS
25.19.3 GEOGRAPHIC PRESENCE
25.19.4 PRODUCT PORTFOLIO
25.19.5 RECENT DEVELOPMENTS
25.2 EUREKA THERAPEUTICS
25.20.1 COMPANY OVERVIEW
25.20.2 REVENUE ANALYSIS
25.20.3 GEOGRAPHIC PRESENCE
25.20.4 PRODUCT PORTFOLIO
25.20.5 RECENT DEVELOPMENTS
25.21 AURORA BIOPHARMA
25.21.1 COMPANY OVERVIEW
25.21.2 REVENUE ANALYSIS
25.21.3 GEOGRAPHIC PRESENCE
25.21.4 PRODUCT PORTFOLIO
25.21.5 RECENT DEVELOPMENTS
25.22 IMMUNOACT
25.22.1 COMPANY OVERVIEW
25.22.2 REVENUE ANALYSIS
25.22.3 GEOGRAPHIC PRESENCE
25.22.4 PRODUCT PORTFOLIO
25.22.5 RECENT DEVELOPMENTS
25.23 FERRING PHARMACEUTICALS A/S
25.23.1 COMPANY OVERVIEW
25.23.2 REVENUE ANALYSIS
25.23.3 GEOGRAPHIC PRESENCE
25.23.4 PRODUCT PORTFOLIO
25.23.5 RECENT DEVELOPMENTS
25.24 JANSSEN BIOTECH, INC.
25.24.1 COMPANY OVERVIEW
25.24.2 REVENUE ANALYSIS
25.24.3 GEOGRAPHIC PRESENCE
25.24.4 PRODUCT PORTFOLIO
25.24.5 RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
26 RELATED REPORTS
27 CONCLUSION
28 QUESTIONNAIRE
29 ABOUT DATA BRIDGE MARKET RESEARCH
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.