Global Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Taille du marché en milliards USD
TCAC :
% 
 USD
543.06 Million
USD
1,593.17 Million
2024
2032
USD
543.06 Million
USD
1,593.17 Million
2024
2032
| 2025 –2032 | |
| USD 543.06 Million | |
| USD 1,593.17 Million | |
|
|
|
|
Évaluation électronique des résultats cliniques (eCOA) mondiale pour la segmentation du marché des contenus sous licence, par produit (solutions sur site, solutions cloud et solutions web), approche (évaluation des résultats rapportés par les cliniciens (ClinRO), évaluation des résultats rapportés par les patients (PRO), évaluation des résultats rapportés par les observateurs (ObsRO) et évaluation des résultats de performance (PerfO)), utilisateur final (prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements universitaires), plateforme (organismes de recherche sous contrat, sociétés pharmaceutiques et biopharmaceutiques, fabricants de dispositifs médicaux, hôpitaux et laboratoires cliniques, sociétés de services de conseil, recherche et universités, et autres) - Tendances et prévisions du secteur jusqu'en 2032
Évaluation électronique des résultats cliniques (eCOA) pour le marché des contenus sous licence
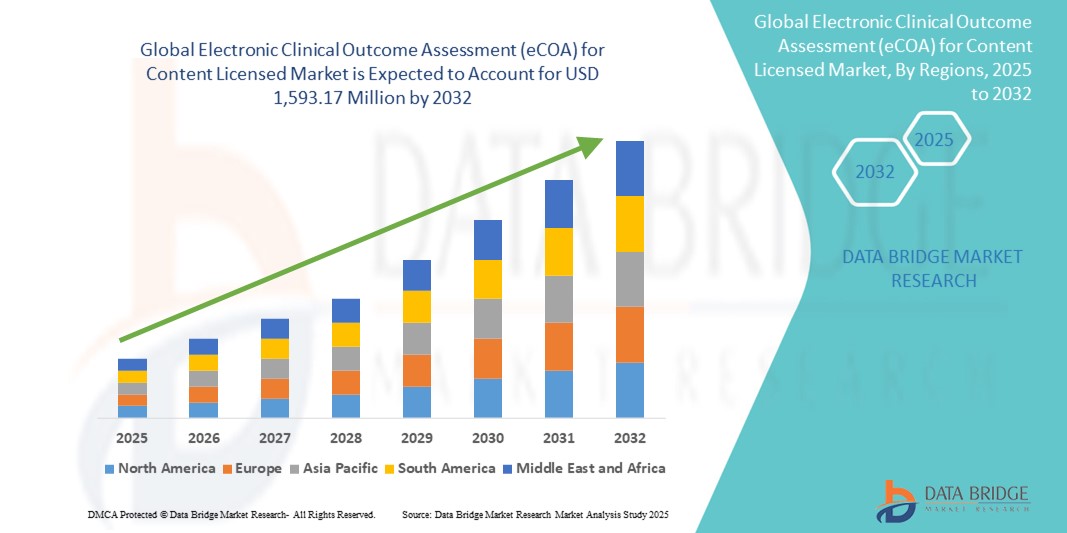
- L'évaluation mondiale des résultats cliniques électroniques (eCOA) pour la taille du marché des contenus sous licence a été évaluée à 543,06 millions USD en 2024 et devrait atteindre 1 593,17 millions USD d'ici 2032 , à un TCAC de 14,40 % au cours de la période de prévision.
- La croissance du marché est largement alimentée par la demande croissante de transformation numérique dans les essais cliniques et par l'importance croissante accordée à la collecte de données en temps réel et centrée sur le patient, qui améliore la qualité et la conformité des essais.
- De plus, le soutien réglementaire croissant et l'adoption par l'industrie pharmaceutique de contenus eCOA standardisés et validés positionnent les solutions eCOA sous licence comme la méthode privilégiée pour la saisie des critères d'évaluation cliniques. Ces facteurs convergents accélèrent l'adoption de ces outils, stimulant ainsi considérablement la croissance du secteur.
Évaluation électronique des résultats cliniques (eCOA) pour l'analyse de marché sous licence de contenu
- Les solutions eCOA sous licence, qui capturent numériquement les résultats rapportés par les patients, les cliniciens et les observateurs, deviennent des outils essentiels dans la recherche clinique moderne en raison de leur précision accrue des données, de leur accès en temps réel et de leur compatibilité avec les modèles d'essais décentralisés.
- La demande croissante de contenu eCOA sous licence est principalement alimentée par la complexité croissante des essais cliniques, l'accent réglementaire mis sur les méthodes de collecte de données standardisées et validées et l'adoption croissante de plateformes de santé numériques par les sociétés pharmaceutiques et biotechnologiques.
- L'Amérique du Nord a dominé le marché de l'évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence avec la plus grande part de revenus de 46,8 % en 2024, attribuée à une infrastructure réglementaire solide, à l'adoption précoce des technologies cliniques numériques et à la présence d'importantes organisations de recherche clinique et de fournisseurs de solutions eCOA.
- L'Asie-Pacifique devrait être la région connaissant la croissance la plus rapide sur le marché de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence au cours de la période de prévision, en raison de l'expansion des activités de recherche clinique, de l'harmonisation réglementaire et de l'accent croissant mis sur la collecte de données centrée sur le patient.
- Le segment de l'évaluation des résultats rapportés par les patients (PRO) a dominé le marché de l'évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence avec une part de 50,2 % en 2024, grâce à son rôle essentiel dans l'évaluation de l'efficacité du traitement et du bien-être des patients, ainsi qu'à l'importance accrue accordée à la capture des commentaires directs des patients dans les protocoles d'essai.
Portée du rapport et évaluation électronique des résultats cliniques (eCOA) pour la segmentation du marché des contenus sous licence
|
Attributs |
Évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence - Informations clés sur le marché |
|
Segments couverts |
|
|
Pays couverts |
Amérique du Nord
Europe
Asie-Pacifique
Moyen-Orient et Afrique
Amérique du Sud
|
|
Acteurs clés du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
Outre les informations sur les scénarios de marché tels que la valeur marchande, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché organisés par Data Bridge Market Research comprennent également une analyse approfondie des experts, une analyse des prix, une analyse de la part de marque, une enquête auprès des consommateurs, une analyse démographique, une analyse de la chaîne d'approvisionnement, une analyse de la chaîne de valeur, un aperçu des matières premières/consommables, des critères de sélection des fournisseurs, une analyse PESTLE, une analyse Porter et un cadre réglementaire. |
Évaluation électronique des résultats cliniques (eCOA) pour les tendances du marché des contenus sous licence
« Normalisation numérique et améliorations induites par l'IA dans les essais cliniques »
- Une tendance majeure et en constante évolution sur le marché mondial des certificats d'autorisation électroniques (eCOA) pour les contenus sous licence est l'intégration de l'intelligence artificielle (IA) et de contenus numériques standardisés pour améliorer la qualité des données, la conformité réglementaire et l'engagement des patients dans les essais cliniques. Cette convergence simplifie la saisie des données et améliore l'efficacité des essais.
- Par exemple, des entreprises comme Medidata Solutions et ERT proposent des solutions eCOA sous licence, optimisées par l'IA, qui permettent un suivi en temps réel des données des patients et des analyses prédictives pour une meilleure prévision des résultats des essais. Les plateformes basées sur l'IA peuvent détecter les anomalies de données, accélérer la revalidation et soutenir des conceptions d'essais adaptatives.
- Le contenu eCOA sous licence garantit que tous les résultats rapportés par les patients, les cliniciens et les observateurs sont conformes aux normes réglementaires et scientifiques, favorisant ainsi la cohérence et la fiabilité des études multinationales. Ces licences de contenu sont de plus en plus souvent associées à des plateformes eCOA avancées pour fournir des solutions clés en main.
- L'intégration aux plateformes de consentement électronique et aux dispositifs portables améliore l'observance du traitement par les patients et allège la charge de travail des centres grâce à l'automatisation des processus de saisie des données. Par exemple, Signant Health permet de relier les mesures PRO sous licence aux données biométriques des dispositifs portables, pour une compréhension plus globale de l'impact du traitement.
- La tendance vers des contenus numérisés et validés au sein de plateformes eCOA compatibles avec l'IA transforme la manière dont les acteurs mènent et gèrent les essais cliniques mondiaux. Par conséquent, des entreprises comme IQVIA et Kayentis investissent dans des bibliothèques de contenus sous licence évolutives et multilingues, intégrées à des plateformes conviviales et optimisées par l'IA.
- La demande de solutions eCOA avec un contenu pré-approuvé et conforme à la réglementation augmente rapidement, car les sponsors et les CRO cherchent à réduire les risques des essais et à améliorer à la fois l'expérience des patients et la précision des données grâce à des outils numériques intelligents.
Évaluation électronique des résultats cliniques (eCOA) pour la dynamique du marché des contenus sous licence
Conducteur
« Exigence réglementaire croissante et transition numérique dans la recherche clinique »
- L'importance croissante accordée à la normalisation des données et à la conformité réglementaire dans les essais cliniques, ainsi qu'à la transformation numérique des processus de recherche clinique, est l'un des principaux moteurs du marché du contenu eCOA sous licence.
- Par exemple, en mars 2024, Clinical Ink a lancé une gamme d'instruments eCOA pré-validés et homologués pour des essais internationaux, simplifiant ainsi le temps de configuration et réduisant les risques réglementaires. Ces initiatives illustrent la volonté du secteur de privilégier des méthodes validées de capture numérique des données.
- Alors que les promoteurs d’essais et les autorités réglementaires accordent la priorité aux résultats centrés sur le patient et à la production de preuves solides, les instruments eCOA sous licence offrent des méthodologies scientifiquement validées qui répondent aux attentes réglementaires, réduisant ainsi les délais d’approbation des essais ou de soumission des données.
- La transition croissante vers des essais cliniques décentralisés et hybrides a également accéléré la demande d'outils numériques garantissant une collecte cohérente des données patients dans diverses zones géographiques et populations. L'intégration de contenus sous licence aux plateformes numériques améliore l'évolutivité et la conformité.
- De plus, l'amélioration de l'accessibilité aux outils eCOA via les appareils mobiles, combinée à des interfaces intuitives et à un support multilingue, favorise l'adoption parmi les participants aux essais mondiaux, contribuant à un plus grand engagement des patients et à une plus grande fiabilité des données.
Retenue/Défi
« Modèles de licences complexes et obstacles à l'intégration »
- L'un des principaux défis liés à l'adoption de contenus eCOA sous licence réside dans la complexité des accords de licence et de leur intégration aux systèmes cliniques. La multiplicité des intervenants, les coûts élevés et les variations réglementaires régionales peuvent retarder ou compliquer la mise en œuvre.
- Par exemple, l'octroi de licences pour certains PRO standardisés tels que l'EQ-5D ou le SF-36 peut impliquer des négociations complexes avec les propriétaires de contenu, en particulier lorsqu'ils sont utilisés dans le cadre d'essais multinationaux, ce qui augmente les délais et les coûts des projets.
- De plus, l'intégration de contenu sous licence dans des plateformes de capture de données électroniques (EDC) ou eSource existantes nécessite souvent un développement ou un middleware personnalisé, ce qui peut entraîner des retards techniques ou une charge opérationnelle accrue.
- Assurer l'interopérabilité entre les instruments eCOA sous licence et les systèmes des promoteurs/CRO reste un obstacle technique, en particulier lors de la gestion de divers appareils, paramètres d'essai et populations de patients.
- Les coûts initiaux élevés pour les bibliothèques de contenu validées et les frais de licence permanents peuvent également décourager l'adoption par les petites entreprises de biotechnologie ou les chercheurs universitaires disposant de budgets limités.
- Surmonter ces obstacles grâce à des cadres de licences unifiés, des modèles de déploiement basés sur le cloud et des outils d'intégration conviviaux sera crucial pour étendre l'utilisation du contenu eCOA sous licence dans la recherche clinique future.
Évaluation électronique des résultats cliniques (eCOA) pour le marché des contenus sous licence
Le marché est segmenté sur la base du produit, de l’approche, de l’utilisateur final et de la plateforme.
- Par produit
En termes de produits, le marché de l'évaluation électronique des résultats cliniques (eCOA) pour les licences de contenu est segmenté en solutions sur site, en solutions cloud et en solutions web. Le segment des solutions cloud a dominé le marché, affichant la plus grande part de chiffre d'affaires en 2024, grâce à son évolutivité, sa facilité de déploiement et sa capacité à prendre en charge des essais cliniques décentralisés et hybrides. Les promoteurs et les CRO privilégient de plus en plus les plateformes eCOA cloud, car elles offrent la capture de données en temps réel, l'accès à distance et une intégration transparente avec d'autres systèmes eClinical, tout en réduisant les coûts d'infrastructure et la complexité informatique.
Le segment des solutions web devrait connaître la croissance la plus rapide entre 2025 et 2032, porté par la pénétration croissante d'Internet, l'expansion des essais cliniques à l'échelle mondiale et la demande de plateformes accessibles par navigateur et nécessitant une configuration minimale. Les outils web d'eCOA offrent un large accès aux patients et aux centres d'essais, quelle que soit la région et le type d'appareil, favorisant ainsi leur adoption dans les études multinationales.
- Par approche
Sur la base de l'approche, le marché de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence est segmenté en évaluation des résultats rapportés par les cliniciens (ClinRO), évaluation des résultats rapportés par les patients (PRO), évaluation des résultats rapportés par les observateurs (ObsRO) et évaluation des résultats de performance (PerfO). Le segment des résultats rapportés par les patients (PRO) a dominé le marché avec la plus grande part de chiffre d'affaires, soit 50,2 % en 2024, les organismes de réglementation exigeant de plus en plus l'inclusion du point de vue des patients dans la recherche clinique. Les instruments PRO sous licence fournissent des méthodes validées et standardisées pour évaluer la qualité de vie, les symptômes et l'impact du traitement du point de vue du patient, contribuant ainsi à des preuves cliniques plus solides et à des soumissions réglementaires plus solides.
Le segment de l'évaluation des résultats de performance (PerfO) devrait connaître la croissance la plus rapide entre 2025 et 2032, en raison de la demande croissante d'évaluations objectives et fonctionnelles dans les essais cliniques. Les outils PerfO collectent des données en temps réel basées sur les tâches effectuées par les patients, souvent à l'aide d'appareils numériques ou de dispositifs portables, permettant ainsi des évaluations d'efficacité et des critères d'évaluation des essais plus précis.
- Par utilisateur final
En fonction de l'utilisateur final, le marché des évaluations électroniques des résultats cliniques (eCOA) pour contenu sous licence est segmenté entre prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements universitaires. Le segment des prestataires de services commerciaux détenait la plus grande part en 2024, grâce à l'utilisation intensive des plateformes d'eCOA par les organismes de recherche sous contrat (CRO), les sociétés de gestion de données et les fournisseurs de technologies. Ces prestataires de services servent d'intermédiaires entre les promoteurs et les sites cliniques, en mettant en œuvre des solutions de contenu sous licence à grande échelle et en garantissant la conformité aux protocoles d'essai et aux normes internationales.
Le segment des établissements universitaires devrait connaître sa croissance la plus rapide entre 2025 et 2032, grâce à l'augmentation des initiatives de recherche universitaires, à un meilleur accès au financement des outils cliniques numériques et à des essais collaboratifs avec des partenaires industriels. L'adoption d'outils eCOA avec contenu sous licence dans les études universitaires favorise une meilleure précision et reproductibilité des données.
- Par plateforme
Sur la base de la plateforme, le marché des évaluations électroniques des résultats cliniques (eCOA) pour les contenus sous licence est segmenté entre les organismes de recherche sous contrat (CRO), les sociétés pharmaceutiques et biopharmaceutiques, les fabricants de dispositifs médicaux, les hôpitaux et laboratoires cliniques, les sociétés de conseil, la recherche et le monde universitaire, entre autres. Le segment des sociétés pharmaceutiques et biopharmaceutiques a dominé le marché en 2024, car ces organisations mènent la majorité des essais cliniques mondiaux et exigent des solutions eCOA validées et conformes à la réglementation pour des résultats centrés sur le patient. Leur investissement dans les contenus sous licence améliore l'efficacité des essais, la cohérence mondiale et l'acceptation réglementaire.
Le segment des organismes de recherche sous contrat (ORC) devrait connaître la croissance la plus rapide entre 2025 et 2032, soutenu par la tendance à l'externalisation du développement clinique. Les ORC adoptent de plus en plus des plateformes eCOA clés en main avec contenu sous licence intégré pour offrir aux promoteurs des services complets de gestion des essais, notamment pour les études multi-pays où la standardisation des mesures de résultats est essentielle.
Évaluation électronique des résultats cliniques (eCOA) pour l'analyse régionale du marché des contenus sous licence
- L'Amérique du Nord a dominé le marché de l'évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence avec la plus grande part de revenus de 46,8 % en 2024, attribuée à une infrastructure réglementaire solide, à l'adoption précoce des technologies cliniques numériques et à la présence d'importantes organisations de recherche clinique et de fournisseurs de solutions eCOA.
- Les parties prenantes de la région, notamment les sociétés pharmaceutiques, les CRO et les établissements universitaires, privilégient l'utilisation de mesures de résultats validées et standardisées pour répondre aux attentes de la FDA et de l'EMA, alimentant ainsi la demande de solutions eCOA sous licence.
- La domination de la région est en outre soutenue par des investissements élevés en R&D, des écosystèmes eClinical avancés et un nombre croissant d'essais décentralisés et hybrides, établissant le contenu eCOA sous licence comme un élément essentiel pour garantir l'exactitude des données, la conformité et l'engagement des patients dans les essais cliniques modernes.
Évaluation électronique des résultats cliniques (eCOA) aux États-Unis pour le contenu sous licence Market Insight
Le marché américain de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence a représenté la plus grande part de revenus en Amérique du Nord en 2024, soit 79,5 %, grâce au leadership du pays en matière d'essais cliniques et au respect réglementaire des mesures de résultats standardisées. L'engagement de la FDA en faveur d'un développement de médicaments centré sur le patient et de la validation des instruments PRO continue d'encourager l'adoption généralisée des outils eCOA sous licence. De plus, la prévalence des essais décentralisés et l'adoption rapide des technologies de santé numérique par les promoteurs et les CRO stimulent encore la demande de plateformes eCOA intégrant des contenus sous licence et conformes à la réglementation.
Évaluation électronique des résultats cliniques (eCOA) pour le marché européen des contenus sous licence
Le marché européen des évaluations électroniques des résultats cliniques (eCOA) pour contenu sous licence devrait connaître une croissance annuelle moyenne (TCAC) substantielle tout au long de la période de prévision, principalement grâce à l'harmonisation réglementaire régionale sous l'égide de l'EMA et à l'augmentation des investissements dans la recherche centrée sur le patient. Le nombre croissant d'essais multinationaux et la demande de contenus PRO et ObsRO multilingues et validés favorisent leur adoption. La tendance à la numérisation de tous les aspects des essais cliniques, y compris le consentement et l'évaluation des résultats, favorise l'expansion du marché dans tous les domaines thérapeutiques et réseaux de recherche clinique.
Évaluation électronique des résultats cliniques (eCOA) au Royaume-Uni pour le contenu sous licence Market Insight
Le marché britannique de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence devrait connaître une croissance annuelle moyenne (TCAC) remarquable au cours de la période de prévision, stimulée par les initiatives de santé numérique soutenues par le NHS et l'accent mis sur la production de données probantes en situation réelle. L'accent mis sur la saisie des résultats des patients dans un format numérique standardisé a encouragé les laboratoires pharmaceutiques et les instituts de recherche à investir dans des instruments eCOA sous licence. De plus, le solide écosystème de recherche universitaire et la participation active aux essais cliniques dans tout le pays favorisent une adoption plus large de l'eCOA.
Évaluation électronique des résultats cliniques (eCOA) en Allemagne pour le contenu sous licence Market Insight
Le marché allemand des évaluations électroniques des résultats cliniques (eCOA) pour les contenus sous licence devrait connaître une croissance annuelle moyenne (TCAC) considérable au cours de la période de prévision, grâce à l'importance accordée par le pays à la conformité réglementaire, à la qualité des données cliniques et à l'innovation dans le domaine de la santé numérique. Les industries pharmaceutique et des technologies médicales allemandes sont parmi les premières à adopter le contenu eCOA validé, notamment dans les essais en oncologie et sur les maladies rares. L'engagement du pays en faveur de la médecine de précision et de la confidentialité des données s'inscrit parfaitement dans le cadre de solutions eCOA sous licence, qui offrent une saisie sécurisée et standardisée des résultats.
Évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence (Asie-Pacifique)
Le marché des évaluations électroniques des résultats cliniques (eCOA) pour contenus sous licence en Asie-Pacifique devrait connaître son taux de croissance annuel composé (TCAC) le plus élevé, soit 23,2 % sur la période de prévision 2025-2032, grâce à l'essor des essais cliniques dans les économies émergentes et à l'augmentation des investissements dans les infrastructures de santé numérique. Des pays comme la Chine, le Japon et l'Inde accélèrent leur adoption grâce à leur participation à des essais mondiaux, à la localisation de contenus sous licence et au besoin croissant de solutions eCOA multilingues et centrées sur le patient.
Évaluation électronique des résultats cliniques (eCOA) au Japon pour le contenu sous licence Market Insight
Au Japon, le marché des évaluations électroniques des résultats cliniques (eCOA) pour les contenus sous licence prend de l'ampleur grâce à l'importance accordée par le pays à l'innovation en matière de santé, aux soins aux personnes âgées et à une surveillance réglementaire rigoureuse. Les entreprises pharmaceutiques japonaises adoptent des outils PRO et ClinRO sous licence pour garantir la qualité des données lors des essais cliniques avancés et de la surveillance post-commercialisation. L'intégration des systèmes eCOA à des plateformes eClinical plus larges et à des dispositifs médicaux IoT permet d'améliorer l'engagement des patients et le suivi des résultats.
Évaluation électronique des résultats cliniques (eCOA) en Inde pour le contenu sous licence Market Insight
En 2024, le marché indien de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence représentait la plus grande part de chiffre d'affaires en Asie-Pacifique, grâce au développement du paysage des essais cliniques du pays, à la transformation numérique rapide et à la prestation de services rentable par les CRO. La numérisation des soins de santé soutenue par le gouvernement et l'essor des fournisseurs nationaux de technologies eClinical accélèrent l'adoption d'instruments eCOA sous licence. La population multilingue et la diversité des établissements de santé indiens stimulent également la demande de contenus flexibles et validés, adaptés aux besoins des essais régionaux.
Évaluation électronique des résultats cliniques (eCOA) pour les parts de marché sous licence de contenu
L'évaluation électronique des résultats cliniques (eCOA) pour le secteur des contenus sous licence est principalement menée par des entreprises bien établies, notamment :
- Medidata Solutions, Inc. (États-Unis)
- Signant Health (États-Unis)
- IQVIA Inc. (États-Unis)
- YPrime, Inc. (États-Unis)
- Clario (États-Unis)
- Clinical Ink, Inc. (États-Unis)
- ERT, Inc. (États-Unis)
- Kayentis SAS (France)
- Veeva Systems Inc. (États-Unis)
- Oracle Health Sciences (États-Unis)
- Parexel International Corporation (États-Unis)
- eResearch Technology, Inc (États-Unis)
- ArisGlobal LLC (États-Unis)
- Calice (États-Unis)
- Castor EDC (Pays-Bas)
- Datatrak International, Inc. (États-Unis)
- Medrio, Inc. (États-Unis)
- OpenClinica, LLC (États-Unis)
- Trial By Fire Solutions, LLC (États-Unis)
Quels sont les développements récents dans le domaine de l’évaluation électronique des résultats cliniques (eCOA) pour le marché mondial des contenus sous licence ?
- En mai 2024, Medidata Solutions, filiale de Dassault Systèmes, a lancé une version améliorée de sa plateforme myMedidata, offrant une prise en charge étendue des évaluations des résultats cliniques sous licence dans le cadre d'essais cliniques internationaux. Cette mise à jour inclut des instruments eCOA multilingues et validés, parfaitement intégrés aux données de consentement électronique et portables, simplifiant ainsi l'exécution décentralisée des essais. Ce lancement renforce l'engagement de Medidata à fournir des solutions unifiées et conformes à la réglementation, qui améliorent l'engagement des patients et l'intégrité des données dans tous les domaines thérapeutiques.
- En avril 2024, Signant Health a annoncé l'enrichissement de sa bibliothèque de contenus sous licence grâce à de nouveaux accords avec plusieurs concédants de mesures PRO. Cette initiative permet un déploiement plus rapide des mesures de résultats standardisées au sein de sa plateforme eCOA, notamment pour les études en oncologie et sur le SNC. Cette évolution souligne la stratégie de Signant visant à renforcer ses capacités de collecte de données validées tout en réduisant le temps de préparation des essais internationaux.
- En mars 2024, IQVIA a lancé sa suite eCOA optimisée par l'IA, intégrée aux PRO agréés, afin d'optimiser la collecte de données en recherche clinique et en pratique réelle. La plateforme utilise l'analyse prédictive et des invites patient intelligentes pour améliorer les taux de réponse et minimiser les lacunes de données, reflétant l'accent mis par IQVIA sur l'innovation et l'harmonisation réglementaire dans les essais numériques.
- En février 2024, YPrime s'est associé à plusieurs établissements universitaires pour fournir des solutions eCOA pré-licenciées pour les essais cliniques sur les maladies rares, accélérant ainsi le démarrage des études et améliorant la conformité réglementaire. Cette collaboration permet un accès plus large à des mesures de résultats difficiles à obtenir, soulignant l'engagement d'YPrime à développer les capacités de recherche dans des domaines thérapeutiques mal desservis.
- En janvier 2024, Clinical Ink a lancé une nouvelle plateforme numérique offrant un accès clé en main à des instruments eCOA validés et sous licence, destinés aux essais décentralisés. Conçue pour simplifier le déploiement mondial, la solution inclut des traductions intégrées et un suivi automatisé de la conformité, reflétant ainsi l'objectif de l'entreprise : rendre la mise en œuvre de l'eCOA plus efficace, évolutive et conforme à l'évolution des exigences réglementaires.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.