Global Electronic Trial Master File Etmf Systems Market
Taille du marché en milliards USD
TCAC :
% 
 USD
1.84 Billion
USD
4.85 Billion
2024
2032
USD
1.84 Billion
USD
4.85 Billion
2024
2032
| 2025 –2032 | |
| USD 1.84 Billion | |
| USD 4.85 Billion | |
|
|
|
|
Segmentation du marché mondial des systèmes de dossiers maîtres d'essais cliniques électroniques (eTMF), par composant (services et logiciels), mode de déploiement (eTMF dans le cloud et eTMF sur site), utilisateur final (entreprises pharmaceutiques et biotechnologiques, CRO et autres) - Tendances du secteur et prévisions jusqu'en 2032
Taille du marché des systèmes de dossiers maîtres électroniques d'essais (eTMF)
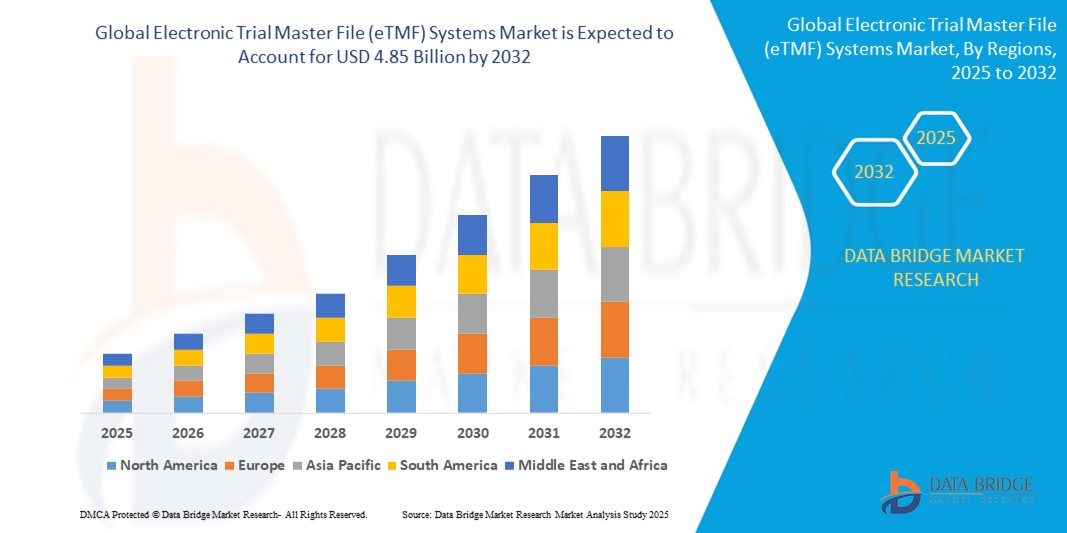
- Le marché mondial des systèmes de dossiers électroniques maîtres de procès (eTMF) était évalué à 1,84 milliard de dollars américains en 2024 et devrait atteindre 4,85 milliards de dollars américains d'ici 2032 , avec un TCAC de 12,90 % au cours de la période de prévision.
- La croissance du marché est largement alimentée par la demande croissante de gestion centralisée des données d'essais cliniques, de conformité réglementaire et d'adoption croissante des plateformes numériques dans la recherche clinique au sein des secteurs pharmaceutique et biotechnologique.
- L'augmentation du nombre d'essais cliniques à l'échelle mondiale, notamment sur les marchés émergents, et la nécessité d'un accès en temps réel aux documents d'essai accélèrent encore l'adoption des systèmes de dossiers maîtres d'essais électroniques (eTMF) par les promoteurs et les organismes de recherche sous contrat.
Analyse du marché des systèmes de dossiers maîtres électroniques d'essais (eTMF)
- Le marché des systèmes de gestion électronique des dossiers de référence des essais cliniques connaît une croissance soutenue, les entreprises pharmaceutiques et biotechnologiques adoptant de plus en plus les solutions numériques pour la gestion des documents cliniques.
- L'augmentation des activités d'essais cliniques et la nécessité de processus de conformité réglementaire efficaces incitent les organisations à passer des systèmes papier aux plateformes cloud.
- L'Amérique du Nord a dominé le marché des systèmes de dossiers maîtres électroniques d'essais cliniques (eTMF) en 2024, avec la plus grande part de revenus (49,5 %). Cette domination s'explique par une forte concentration d'entreprises pharmaceutiques et biotechnologiques, des investissements importants en R&D, une infrastructure informatique de santé bien développée et un nombre croissant d'essais cliniques complexes nécessitant une documentation et une conformité efficaces.
- La région Asie-Pacifique devrait connaître le taux de croissance le plus élevé du marché mondial des systèmes de dossiers électroniques de procès (eTMF), sous l'effet de l'urbanisation croissante, de la hausse des revenus disponibles, des progrès technologiques dans des pays comme la Chine, le Japon et l'Inde, et d'un intérêt grandissant pour les maisons intelligentes, soutenu par les initiatives de numérisation des gouvernements.
- Le segment des services a détenu la plus grande part de revenus de marché en 2024, grâce à des offres essentielles tout au long du cycle de vie du système, notamment la mise en œuvre, la formation, le support technique et la migration des données.
Portée du rapport et segmentation du marché des systèmes de dossiers maîtres d'essais électroniques (eTMF)
|
Attributs |
Systèmes de dossiers maîtres d'essais électroniques (eTMF) : principaux enseignements du marché |
|
Segments couverts |
|
|
Pays couverts |
Amérique du Nord
Europe
Asie-Pacifique
Moyen-Orient et Afrique
Amérique du Sud
|
|
Acteurs clés du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
En plus des informations sur les scénarios de marché tels que la valeur du marché, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché élaborés par Data Bridge Market Research comprennent également une analyse approfondie d'experts, la production et la capacité par entreprise représentées géographiquement, les schémas de réseau des distributeurs et des partenaires, une analyse détaillée et mise à jour des tendances des prix et une analyse des déficits de la chaîne d'approvisionnement et de la demande. |
Tendances du marché des systèmes de dossiers maîtres d'essais électroniques (eTMF)
« L’intégration de l’intelligence artificielle pour l’automatisation des flux de travail »
- L'intelligence artificielle est de plus en plus intégrée aux systèmes de gestion électronique des dossiers de procès afin d'automatiser les tâches répétitives telles que la classification des documents et l'étiquetage des métadonnées.
- Cette tendance améliore l'efficacité et réduit les erreurs manuelles, permettant aux professionnels de la recherche clinique de se concentrer davantage sur les tâches stratégiques et de conformité.
- Par exemple, les plateformes basées sur l'IA peuvent indexer automatiquement les documents d'essais cliniques et signaler les fichiers manquants, garantissant ainsi une plus grande précision et une meilleure conformité réglementaire.
- Des entreprises comme Veeva Systems et Phlexglobal adoptent des capacités d'IA pour rationaliser les processus eTMF et fournir des informations en temps réel sur l'état des essais cliniques.
- Face à l'augmentation des volumes de données cliniques, l'intégration de l'IA devient essentielle pour améliorer la prise de décision et accélérer le cycle de vie des essais cliniques.
Dynamique du marché des systèmes de dossiers maîtres électroniques d'essais (eTMF)
Conducteur
« Évolution vers la numérisation dans la gestion des essais cliniques »
- La transition vers la numérisation favorise l'adoption de systèmes de fichiers maîtres électroniques pour les essais cliniques, à mesure que ces derniers deviennent plus complexes et nécessitent une gestion documentaire plus efficace.
- Ces systèmes offrent un accès centralisé aux documents de procès, permettant une récupération plus rapide, une collaboration en temps réel et un meilleur contrôle des versions entre les équipes.
- Par exemple, de grandes entreprises pharmaceutiques comme Pfizer ont adopté des plateformes numériques de gestion des essais cliniques afin de rationaliser la documentation et de garantir la conformité réglementaire.
- Les systèmes numériques contribuent à réduire les risques liés aux erreurs manuelles, aux pertes de documents et aux retards de soumission, améliorant ainsi la qualité et les délais des procès.
- L'accès à distance et les fonctionnalités de stockage cloud sécurisé rendent ces systèmes essentiels pour les organisations qui cherchent à améliorer leur efficacité opérationnelle et à se conformer aux normes réglementaires internationales.
Retenue/Défi
« Problèmes de sécurité et de conformité des données »
- Les préoccupations liées à la sécurité des données et à la conformité réglementaire demeurent des freins majeurs à l'adoption des systèmes de fichiers maîtres électroniques pour les essais cliniques dans l'ensemble du secteur de la recherche clinique.
- Les données des essais cliniques sont extrêmement sensibles et toute violation peut entraîner de graves conséquences telles que des retards d'essais, des répercussions juridiques et une atteinte à la crédibilité de l'organisation.
- Par exemple, une fuite de données signalée au sein d'un organisme européen de recherche clinique a entraîné des enquêtes réglementaires et des retards dans le calendrier des essais, soulignant les risques encourus.
- Le respect des réglementations internationales en constante évolution, telles que le Règlement général sur la protection des données (RGPD) et la loi HIPAA (Health Insurance Portability and Accountability Act), exige des mises à jour constantes et des protocoles spécifiques à chaque région.
- Les petites et moyennes entreprises sont souvent confrontées à des difficultés pour financer l'infrastructure et l'expertise nécessaires en cybersécurité, ce qui limite leur capacité à migrer pleinement vers des plateformes eTMF basées sur le cloud.
Étendue du marché des systèmes de dossiers maîtres d'essais électroniques (eTMF)
Le marché est segmenté en fonction du composant, du mode de livraison et de l'utilisateur final.
- Par composant
Le marché des systèmes eTMF est segmenté, selon les composants, en services et logiciels. Le segment des services a représenté la plus grande part de revenus en 2024, grâce à des offres essentielles couvrant l'ensemble du cycle de vie du système, notamment la mise en œuvre, la formation, le support technique et la migration des données.
Le segment des logiciels devrait connaître le taux de croissance le plus rapide entre 2025 et 2032, les organisations adoptant de plus en plus des plateformes eTMF dédiées à la gestion centralisée des documents et à la conformité réglementaire.
- Par mode de livraison
Selon le mode de déploiement, le marché des systèmes eTMF se divise en eTMF cloud et eTMF sur site. Le segment eTMF cloud détenait la plus grande part de revenus en 2024, grâce à une accessibilité, une flexibilité, une rentabilité et une évolutivité accrues.
Le segment eTMF sur site devrait connaître le taux de croissance le plus rapide entre 2025 et 2032 et reste pertinent pour les organisations qui privilégient un contrôle total sur la sécurité des données et l'infrastructure, souvent en raison de politiques réglementaires ou informatiques internes spécifiques.
- Par l'utilisateur final
Selon l'utilisateur final, le marché des systèmes eTMF se divise en trois segments : les entreprises pharmaceutiques et biotechnologiques, les CRO et autres. Le segment des entreprises pharmaceutiques et biotechnologiques détenait la plus grande part de revenus en 2024, sous l'effet de la complexité croissante des essais cliniques, de la mondialisation et du durcissement des exigences réglementaires.
Les organismes de recherche sous contrat (CRO) devraient connaître le taux de croissance le plus rapide entre 2025 et 2032, car ils utilisent de plus en plus les systèmes eTMF pour gérer efficacement divers essais pour différents commanditaires.
Analyse régionale du marché des systèmes de dossiers maîtres électroniques d'essais cliniques (eTMF)
- L'Amérique du Nord a dominé le marché des systèmes de dossiers maîtres électroniques d'essais cliniques (eTMF) en 2024, avec la plus grande part de revenus (49,5 %). Cette domination s'explique par une forte concentration d'entreprises pharmaceutiques et biotechnologiques, des investissements importants en R&D, une infrastructure informatique de santé bien développée et un nombre croissant d'essais cliniques complexes nécessitant une documentation et une conformité efficaces.
- Un environnement réglementaire rigoureux et l'accent mis sur l'intégrité des données incitent à développer des solutions eTMF robustes et conformes aux exigences de la FDA et des autres autorités sanitaires.
- L'adoption massive des technologies cloud avancées et des initiatives de transformation numérique au sein des organismes de recherche clinique accélère encore la mise en œuvre et l'utilisation du système eTMF.
Analyse du marché américain des systèmes de dossiers maîtres d'essais électroniques (eTMF)
En 2024, le marché américain des systèmes eTMF représentait 81 % des revenus en Amérique du Nord, porté par des exigences réglementaires strictes, la complexité et le volume croissants des données d'essais cliniques, ainsi qu'une forte priorité accordée à la préparation aux audits. L'adoption massive des solutions cloud et le soutien gouvernemental à la recherche et au développement dans le secteur de la santé contribuent également à l'expansion de ce marché.
Analyse du marché européen des systèmes de dossiers maîtres d'essais électroniques (eTMF)
Le marché européen devrait connaître la croissance la plus rapide entre 2025 et 2032, portée par la demande croissante de solutions cloud, la nécessité d'améliorer le partage des données et la collaboration entre les acteurs, ainsi que par l'évolution des réglementations. La région bénéficie également d'une forte orientation vers l'innovation et la transformation numérique dans le secteur des sciences de la vie.
Analyse du marché britannique des systèmes de dossiers maîtres d'essais électroniques (eTMF)
Le marché britannique des systèmes eTMF devrait connaître la croissance la plus rapide entre 2025 et 2032, portée par le nombre croissant d'essais cliniques, notamment grâce à l'importance accrue accordée aux essais décentralisés et virtuels. La vigueur du secteur pharmaceutique britannique et une approche proactive en matière de santé numérique contribuent également à cette croissance.
Analyse du marché allemand des systèmes de dossiers maîtres d'essais électroniques (eTMF)
Le marché allemand des systèmes eTMF devrait connaître la croissance la plus rapide entre 2025 et 2032, portée par une sensibilisation accrue à la sécurité numérique, des exigences réglementaires strictes et une demande de solutions technologiques de pointe au sein de son secteur pharmaceutique performant. L'accent mis par l'Allemagne sur l'innovation et sa solide base industrielle favorisent également l'adoption des systèmes eTMF.
Analyse du marché des systèmes de dossiers maîtres d'essais électroniques (eTMF) en Asie-Pacifique
Le marché des systèmes eTMF en Asie-Pacifique devrait connaître la croissance la plus rapide entre 2025 et 2032, sous l'effet de l'urbanisation croissante, de la hausse des revenus disponibles et des progrès technologiques significatifs réalisés dans des pays comme la Chine, le Japon et l'Inde. L'intérêt grandissant de la région pour les pratiques cliniques intelligentes, soutenu par les initiatives gouvernementales en faveur de la numérisation, favorise l'adoption des systèmes eTMF.
Analyse du marché japonais des systèmes de fichiers maîtres d'essais électroniques (eTMF)
Le marché japonais des systèmes eTMF devrait connaître la croissance la plus rapide entre 2025 et 2032, grâce à la culture de pointe du pays en matière de technologies, à son urbanisation rapide et à l'importance croissante accordée à l'intégrité des données et à la conformité réglementaire. La sécurité et l'efficacité sont des critères essentiels pour ce marché, dont l'adoption est stimulée par le nombre croissant d'essais cliniques et l'intégration de l'eTMF à d'autres solutions cliniques numériques.
Analyse du marché des systèmes de fichiers maîtres d'essais électroniques (eTMF) en Chine
En 2024, le marché chinois des systèmes eTMF représentait la plus grande part de revenus en Asie-Pacifique, grâce à l'essor de la classe moyenne, à l'urbanisation rapide et au fort taux d'adoption des technologies dans le secteur de la santé. La Chine constitue un pôle majeur de la recherche clinique, et la vigueur de ses fabricants nationaux ainsi que le soutien gouvernemental à la transformation numérique favorisent l'adoption des systèmes eTMF dans les milieux résidentiels, commerciaux et de recherche.
Part de marché des systèmes de dossiers maîtres électroniques d'essais (eTMF)
Le secteur des systèmes de dossiers électroniques de procès (eTMF) est principalement dominé par des entreprises bien établies, notamment :
- IQVIA Inc. (États-Unis)
- Développement de médicaments Labcorp (États-Unis)
- TransPerfect (États-Unis)
- Oracle (États-Unis)
- Phlexglobal (États-Unis)
- SureClinical Inc. (États-Unis)
- Aurea, Inc. (États-Unis)
- Veeva Systems (États-Unis)
- MasterControl Solutions, Inc. (États-Unis)
- Clinevo Technologies (Inde)
- Fondation Mayo pour l'éducation et la recherche médicales (MFMER) (États-Unis)
- Montrium Inc. (États-Unis)
- NCGD Inc. (États-Unis)
- PharmaVigilance (États-Unis)
Dernières évolutions du marché mondial des systèmes de dossiers maîtres de procès électroniques (eTMF)
- En février 2023, Vial a collaboré avec Egnyte pour intégrer la solution eTMF d'Egnyte à sa plateforme. L'objectif est de rationaliser le traitement des documents et des données, de garantir la conformité à la norme 21 CFR Part 11 et de renforcer la préparation aux audits pour les entreprises des sciences de la vie, améliorant ainsi l'efficacité et le respect des réglementations dans les essais cliniques.
- En septembre 2022, Montrium a lancé des services et des formations TMF animés par des experts. Cette initiative vise à renforcer les équipes opérationnelles cliniques et TMF tout au long du processus de développement clinique, en leur fournissant le soutien et les connaissances essentiels pour optimiser la gestion des essais et l'intégrité des données sur le marché.
- En juin 2022, Anju Software Inc. a lancé eTMF Master, un nouveau logiciel eTMF basé sur le cloud. Cette solution facilite la collaboration entre les promoteurs, les CRO et les centres d'essais cliniques pour une gestion efficace et sécurisée du contenu des essais cliniques, tout en respectant les normes réglementaires. Elle permet ainsi d'accélérer les flux de travail et d'améliorer la conformité globale dans la recherche clinique.
- En avril 2021, Phlexglobal a annoncé sa solution d'analyse de la qualité des TMF. Destinée aux entreprises pharmaceutiques, notamment aux leaders mondiaux, cette solution permet d'évaluer et de minimiser les risques réglementaires lors des fusions-acquisitions, améliorant ainsi considérablement la préparation aux inspections et garantissant la qualité des données sur l'ensemble du marché.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Table des matières
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 MARKET GUIDE
2.2.4 COMAPANY MARKET SHARE ANALYSIS
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 STANDARDS OF MEASUREMENT
2.2.8 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.9 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3 MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4 EXECUTIVE SUMMARY
5 PREMIUM INSIGHT
5.1 PORTERS FIVE FORCES
5.2 REGULATORY STANDARDS
5.3 TECHNOLOGICAL TRENDS
5.4 PATENT ANALYSIS
5.5 CASE STUDY
5.6 VALUE CHAIN ANALYSIS
5.7 COMPANY COMPARITIVE ANALYSIS
5.8 PRICING ANALYSIS
6 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY OFFERING
6.1 OVERVIEW
6.2 SOFTWARE
6.3 SERVICES
6.3.1 PROFESSIONAL SERVICES
6.3.1.1. TRAINING AND CONSULTING
6.3.1.2. IMPLEMENTATION
6.3.1.3. SUPPORT AND MAINTENANCE
6.3.2 MANAGED SERVICES
7 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY LEVEL OF DOCUMENTS
7.1 OVERVIEW
7.2 STUDY LEVEL DOCUMENTS
7.3 COUNTRY LEVEL DOCUMENTS
7.4 SITE LEVEL DOCUMENTS
8 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY OPERATING SYSTEM
8.1 OVERVIEW
8.2 WINDOWS
8.3 LINUX
8.4 MAC
8.5 MOBILE
8.5.1 ANDROID
8.5.2 IPHONE
8.5.3 IPAD
9 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY DEPLOYMENT MODE
9.1 OVERVIEW
9.2 ON PREMISES
9.3 CLOUD
9.3.1 PUBLIC
9.3.2 PRIVATE
9.3.3 HYBRID
10 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY FUNCTIONALITY
10.1 OVERVIEW
10.2 COMPREHENSIVE SECURITY
10.3 DOCUMENT UPLOADING/CREATION
10.4 AUDITING
10.5 METADATA
10.6 DOCUMENT CLASSIFICATION AND INDEXING
10.7 DOCUMENT STORAGE
10.8 DATA CAPTURING
10.9 SEARCH AND RETRIEVAL
10.1 OTHERS
11 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY PRICING MODEL
11.1 OVERVIEW
11.2 FREE
11.3 SUBSCRIPTION BASED
11.3.1 ANNUAL SUBSCRIPTION
11.3.2 MONTHLY SUBSCRIPTION
12 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY END USER
12.1 OVERVIEW
12.2 BIOTECH & PHARMA COMPANIES
12.2.1 BY OFFERING
12.2.1.1. SOFTWARE
12.2.1.2. SERVICES
12.2.1.2.1. PROFESSIONAL SERVICES
12.2.1.2.1.1 TRAINING AND CONSULTING
12.2.1.2.1.2 IMPLEMENTATION
12.2.1.2.1.3 SUPPORT AND MAINTENANCE
12.2.1.2.2. MANAGED SERVICES
12.3 CONTRACT RESEARCH ORGANIZATIONS
12.3.1 BY OFFERING
12.3.1.1. SOFTWARE
12.3.1.2. SERVICES
12.3.1.2.1. PROFESSIONAL SERVICES
12.3.1.2.1.1 TRAINING AND CONSULTING
12.3.1.2.1.2 IMPLEMENTATION
12.3.1.2.1.3 SUPPORT AND MAINTENANCE
12.3.1.2.2. MANAGED SERVICES
12.4 SPONSORS
12.4.1 BY OFFERING
12.4.1.1. SOFTWARE
12.4.1.2. SERVICES
12.4.1.2.1. PROFESSIONAL SERVICES
12.4.1.2.1.1 TRAINING AND CONSULTING
12.4.1.2.1.2 IMPLEMENTATION
12.4.1.2.1.3 SUPPORT AND MAINTENANCE
12.4.1.2.2. MANAGED SERVICES
12.5 OTHERS
13 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, BY GEOGRAPHY
13.1 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
13.1.1 NORTH AMERICA
13.1.1.1. U.S.
13.1.1.2. CANADA
13.1.1.3. MEXICO
13.1.2 EUROPE
13.1.2.1. GERMANY
13.1.2.2. FRANCE
13.1.2.3. U.K.
13.1.2.4. ITALY
13.1.2.5. SPAIN
13.1.2.6. RUSSIA
13.1.2.7. TURKEY
13.1.2.8. BELGIUM
13.1.2.9. NETHERLANDS
13.1.2.10. NORWAY
13.1.2.11. FINLAND
13.1.2.12. SWITZERLAND
13.1.2.13. DENMARK
13.1.2.14. SWEDEN
13.1.2.15. POLAND
13.1.2.16. REST OF EUROPE
13.1.3 ASIA PACIFIC
13.1.3.1. JAPAN
13.1.3.2. CHINA
13.1.3.3. SOUTH KOREA
13.1.3.4. INDIA
13.1.3.5. AUSTRALIA
13.1.3.6. NEW ZEALAND
13.1.3.7. SINGAPORE
13.1.3.8. THAILAND
13.1.3.9. MALAYSIA
13.1.3.10. INDONESIA
13.1.3.11. PHILIPPINES
13.1.3.12. TAIWAN
13.1.3.13. VIETNAM
13.1.3.14. REST OF ASIA PACIFIC
13.1.4 SOUTH AMERICA
13.1.4.1. BRAZIL
13.1.4.2. ARGENTINA
13.1.4.3. REST OF SOUTH AMERICA
13.1.5 MIDDLE EAST AND AFRICA
13.1.5.1. SOUTH AFRICA
13.1.5.2. EGYPT
13.1.5.3. SAUDI ARABIA
13.1.5.4. U.A.E
13.1.5.5. OMAN
13.1.5.6. BAHRAIN
13.1.5.7. ISRAEL
13.1.5.8. KUWAIT
13.1.5.9. QATAR
13.1.5.10. REST OF MIDDLE EAST AND AFRICA
13.2 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
14 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET,COMPANY LANDSCAPE
14.1 COMPANY SHARE ANALYSIS: GLOBAL
14.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
14.3 COMPANY SHARE ANALYSIS: EUROPE
14.4 COMPANY SHARE ANALYSIS: ASIA PACIFIC
14.5 MERGERS & ACQUISITIONS
14.6 NEW PRODUCT DEVELOPMENT AND APPROVALS
14.7 EXPANSIONS
14.8 REGULATORY CHANGES
14.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
15 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, SWOT & DBMR ANALYSIS
16 GLOBAL ELECTRONIC TRIAL MASTER FILE (ETMF) SYSTEMS MARKET, COMPANY PROFILE
16.1 ADLIB
16.1.1 COMPANY SNAPSHOT
16.1.2 REVENUE ANALYSIS
16.1.3 GEOGRAPHIC PRESENCE
16.1.4 PRODUCT PORTFOLIO
16.1.5 RECENT DEVELOPMENT
16.2 VEEVA MEDTECH(VEEVA SYSTEMS, INC)
16.2.1 COMPANY SNAPSHOT
16.2.2 REVENUE ANALYSIS
16.2.3 GEOGRAPHIC PRESENCE
16.2.4 PRODUCT PORTFOLIO
16.2.5 RECENT DEVELOPMENT
16.3 TRIAL INTERACTIVE
16.3.1 COMPANY SNAPSHOT
16.3.2 REVENUE ANALYSIS
16.3.3 GEOGRAPHIC PRESENCE
16.3.4 PRODUCT PORTFOLIO
16.3.5 RECENT DEVELOPMENT
16.4 MEDIDATA ( DASSAULT SYSTEMES)
16.4.1 COMPANY SNAPSHOT
16.4.2 REVENUE ANALYSIS
16.4.3 GEOGRAPHIC PRESENCE
16.4.4 PRODUCT PORTFOLIO
16.4.5 RECENT DEVELOPMENT
16.5 OCTALSOFT (GLORANT, LLC)
16.5.1 COMPANY SNAPSHOT
16.5.2 REVENUE ANALYSIS
16.5.3 GEOGRAPHIC PRESENCE
16.5.4 PRODUCT PORTFOLIO
16.5.5 RECENT DEVELOPMENT
16.6 MASTERCONTROL SOLUTIONS, INC
16.6.1 COMPANY SNAPSHOT
16.6.2 REVENUE ANALYSIS
16.6.3 GEOGRAPHIC PRESENCE
16.6.4 PRODUCT PORTFOLIO
16.6.5 RECENT DEVELOPMENT
16.7 IQVIA INC
16.7.1 COMPANY SNAPSHOT
16.7.2 REVENUE ANALYSIS
16.7.3 GEOGRAPHIC PRESENCE
16.7.4 PRODUCT PORTFOLIO
16.7.5 RECENT DEVELOPMENT
16.8 CLOUDBYZ
16.8.1 COMPANY SNAPSHOT
16.8.2 REVENUE ANALYSIS
16.8.3 GEOGRAPHIC PRESENCE
16.8.4 PRODUCT PORTFOLIO
16.8.5 RECENT DEVELOPMENT
16.9 CLINEVO TECHNOLOGIES
16.9.1 COMPANY SNAPSHOT
16.9.2 REVENUE ANALYSIS
16.9.3 GEOGRAPHIC PRESENCE
16.9.4 PRODUCT PORTFOLIO
16.9.5 RECENT DEVELOPMENT
16.1 FLORENCE HEALTHCARE
16.10.1 COMPANY SNAPSHOT
16.10.2 REVENUE ANALYSIS
16.10.3 GEOGRAPHIC PRESENCE
16.10.4 PRODUCT PORTFOLIO
16.10.5 RECENT DEVELOPMENT
16.11 ORACLE
16.11.1 COMPANY SNAPSHOT
16.11.2 REVENUE ANALYSIS
16.11.3 GEOGRAPHIC PRESENCE
16.11.4 PRODUCT PORTFOLIO
16.11.5 RECENT DEVELOPMENT
16.12 ARISGLOBAL LLC
16.12.1 COMPANY SNAPSHOT
16.12.2 REVENUE ANALYSIS
16.12.3 GEOGRAPHIC PRESENCE
16.12.4 PRODUCT PORTFOLIO
16.12.5 RECENT DEVELOPMENT
16.13 MONTRIUM INC
16.13.1 COMPANY SNAPSHOT
16.13.2 REVENUE ANALYSIS
16.13.3 GEOGRAPHIC PRESENCE
16.13.4 PRODUCT PORTFOLIO
16.13.5 RECENT DEVELOPMENT
16.14 CRUCIAL DATA SOLUTIONS
16.14.1 COMPANY SNAPSHOT
16.14.2 REVENUE ANALYSIS
16.14.3 GEOGRAPHIC PRESENCE
16.14.4 PRODUCT PORTFOLIO
16.14.5 RECENT DEVELOPMENT
16.15 KEY2COMPLIANCE AB (SYMBIOTEQ)
16.15.1 COMPANY SNAPSHOT
16.15.2 REVENUE ANALYSIS
16.15.3 GEOGRAPHIC PRESENCE
16.15.4 PRODUCT PORTFOLIO
16.15.5 RECENT DEVELOPMENT
16.16 DATARIVER S.R.L
16.16.1 COMPANY SNAPSHOT
16.16.2 REVENUE ANALYSIS
16.16.3 GEOGRAPHIC PRESENCE
16.16.4 PRODUCT PORTFOLIO
16.16.5 RECENT DEVELOPMENT
16.17 ETHICA CRO
16.17.1 COMPANY SNAPSHOT
16.17.2 REVENUE ANALYSIS
16.17.3 GEOGRAPHIC PRESENCE
16.17.4 PRODUCT PORTFOLIO
16.17.5 RECENT DEVELOPMENT
16.18 TRIALL (CLINBLOCKS B.V.)
16.18.1 COMPANY SNAPSHOT
16.18.2 REVENUE ANALYSIS
16.18.3 GEOGRAPHIC PRESENCE
16.18.4 PRODUCT PORTFOLIO
16.18.5 RECENT DEVELOPMENT
16.19 PREMIER CONSULTING
16.19.1 COMPANY SNAPSHOT
16.19.2 REVENUE ANALYSIS
16.19.3 GEOGRAPHIC PRESENCE
16.19.4 PRODUCT PORTFOLIO
16.19.5 RECENT DEVELOPMENT
16.2 PHLEXGLOBAL(A PHARMALEX COMPANY)
16.20.1 COMPANY SNAPSHOT
16.20.2 REVENUE ANALYSIS
16.20.3 GEOGRAPHIC PRESENCE
16.20.4 PRODUCT PORTFOLIO
16.20.5 RECENT DEVELOPMENT
16.21 SURECLINICAL INC.
16.21.1 COMPANY SNAPSHOT
16.21.2 REVENUE ANALYSIS
16.21.3 GEOGRAPHIC PRESENCE
16.21.4 PRODUCT PORTFOLIO
16.21.5 RECENT DEVELOPMENT
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
17 CONCLUSION
18 QUESTIONNAIRE
19 RELATED REPORTS
20 ABOUT DATA BRIDGE MARKET RESEARCH
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.