Global Medical Device Engineering Market
Taille du marché en milliards USD
TCAC :
% 
 USD
7.66 Billion
USD
11.83 Billion
2024
2032
USD
7.66 Billion
USD
11.83 Billion
2024
2032
| 2025 –2032 | |
| USD 7.66 Billion | |
| USD 11.83 Billion | |
|
|
|
|
Global Medical Device Engineering Market Segmentation, By Service Type (Product Innovation & Design/Industrial Design Services, Prototyping Services, Electronics Engineering Services, Software Development & Testing Services, Connectivity And Mobility Services, Cybersecurity Services, Product Testing Services, Regulatory Consulting Services, Product Support & Maintenance Services), Device Type (Diagnostic Imaging Equipment, Surgical Equipment, Patient Monitoring Devices & Life Support Devices, Medical Lasers, IVD Devices, Other Medical Devices) – Industry Trends and Forecast to 2032
Medical Device Engineering Market Analysis
The medical device engineering market is experiencing robust growth, driven by advancements in healthcare technology, increased investment in R&D, and rising demand for innovative medical solutions. With a market size projected to grow at a CAGR of over 5.8%, the industry benefits from the development of minimally invasive devices, wearable health technologies, and diagnostic tools powered by AI and IoT. Key factors influencing this growth include the aging global population and the rising prevalence of chronic diseases, which necessitate advanced medical devices for effective management. Regulatory changes, such as the EU's MDR (Medical Device Regulation) and stringent FDA requirements, are driving companies to invest in high-quality engineering solutions to ensure compliance and safety. Technological advancements, including 3D printing, robotics, and smart materials, are reshaping medical device engineering. These innovations enable faster prototyping, cost efficiency, and enhanced device functionality. The Asia-Pacific region is emerging as a significant contributor, driven by lower manufacturing costs and a growing healthcare infrastructure. Challenges like high R&D costs and regulatory hurdles remain, but the demand for cutting-edge medical devices in diagnostics, treatment, and monitoring systems ensures a positive trajectory for the industry. The integration of digital health solutions will further propel this market.
Medical Device Engineering Market Size
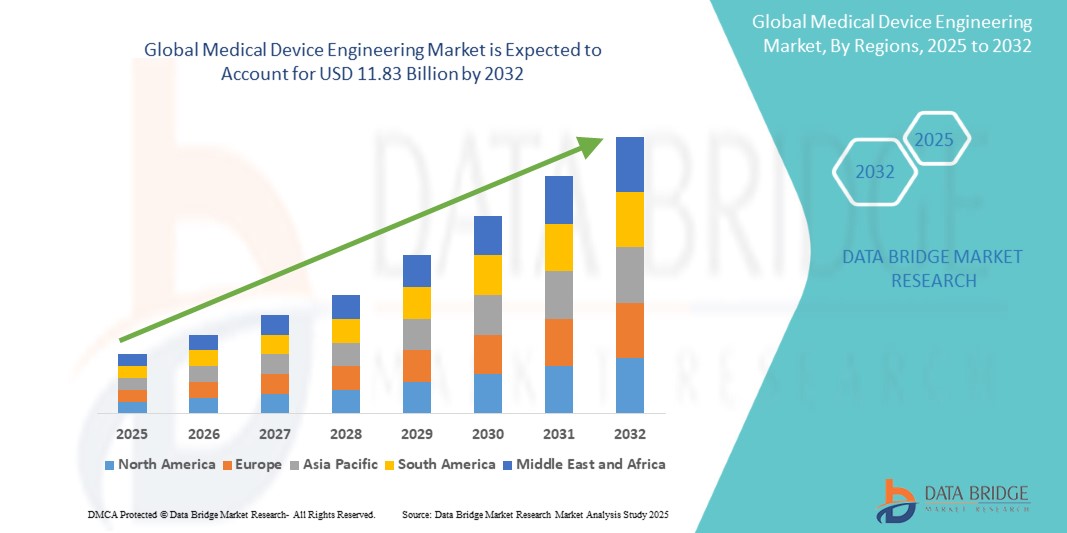
Global medical device engineering market size was valued at USD 7.66 billion in 2024 and is projected to reach USD 11.83 billion by 2032, with a CAGR of 5.8% during the forecast period of 2025 to 2032. In addition to the insights on market scenarios such as market value, growth rate, segmentation, geographical coverage, and major players, the market reports curated by the Data Bridge Market Research also include depth expert analysis, patient epidemiology, pipeline analysis, pricing analysis, and regulatory framework.
Medical Device Engineering Market Trends
“Artificial Intelligence (AI) and Machine Learning (ML) Integration in Medical Devices”
One of the most transformative trends in medical device engineering market is the integration of Artificial Intelligence (AI) and Machine Learning (ML) capabilities. AI and ML are enabling medical devices to perform more advanced functions such as diagnostics, data analysis, and personalized treatment recommendations, which are paving the way for a new generation of “smart” medical devices
AI-driven medical devices can analyze complex datasets and identify patterns that may not be apparent to human operators. For instance, AI algorithms embedded in imaging devices such as MRI and CT scanners help radiologists detect abnormalities such as tumors, fractures, or blood clots more accurately and at an earlier stage. This is helping healthcare providers make quicker and more accurate diagnoses, leading to better patient outcomes. AI-enabled devices can create individualized treatment plans by analyzing a patient’s unique physiological data, medical history, and genetic information. This is particularly valuable in fields like oncology, where treatments can be tailored to the specific genetic profile of a patient’s tumor, improving the effectiveness of therapies.
Report Scope and Medical Device Engineering Market Segmentation
|
Attributes |
Agriculture Rollers Key Market Insights |
|
Segments Covered |
|
|
Countries Covered |
U.S., Canada, Mexico, Germany, France, U.K., Netherlands, Switzerland, Belgium, Russia, Italy, Spain, Turkey, Rest of Europe, China, Japan, India, South Korea, Singapore, Malaysia, Australia, Thailand, Indonesia, Philippines, Rest of Asia-Pacific, Saudi Arabia, U.A.E., South Africa, Egypt, Israel, Rest of Middle East and Africa, Brazil, Argentina, Rest of South America |
|
Key Market Players |
L&T Technology Services Limited (Inde), Infosys Limited (Inde), HCL Technologies Limited (Inde), Cyient (Inde), Wipro (Inde), Tech Mahindra Limited (Inde), TATA Consultancy Services Limited (Inde), FLEX LTD (États-Unis), Capgemini (France), Embien Technologies India Pvt Ltd. (Inde), Alten Group (France), Accenture (Irlande), Consonance (Pologne), Althea Group (États-Unis), MED INSTITUTE (États-Unis), Saraca Solutions Private Limited (Inde), Nemedio Inc. (États-Unis), Sternum (Israël), Medcrypt (États-Unis), MCRA, LLC (États-Unis), North American Science Associates, LLC (États-Unis), MedQtech (Suède), Veranex (États-Unis), Ontogen Medtech LLC (États-Unis), Seisa Media (États-Unis) et Simplexity Product Development (États-Unis). |
|
Opportunités de marché |
|
|
Ensembles d'informations sur les données à valeur ajoutée |
Outre les informations sur les scénarios de marché tels que la valeur marchande, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché organisés par Data Bridge Market Research comprennent également une analyse approfondie des experts, une épidémiologie des patients, une analyse du pipeline, une analyse des prix et un cadre réglementaire. |
Définition du marché de l'ingénierie des dispositifs médicaux
L'ingénierie des dispositifs médicaux est un domaine multidisciplinaire axé sur la conception, le développement et la fabrication de dispositifs utilisés à des fins médicales, telles que le diagnostic, le traitement, la surveillance ou la prévention des maladies. Elle intègre les principes de l'ingénierie mécanique, électrique, logicielle et biomédicale pour créer des dispositifs innovants et fiables, allant des moniteurs de santé portables et des systèmes d'imagerie aux outils chirurgicaux et prothèses mini-invasifs. Ce domaine met l'accent sur le respect de normes réglementaires strictes, la sécurité et la conception centrée sur l'utilisateur pour garantir l'efficacité et le confort du patient. Les progrès de la science des matériaux, de la robotique et des technologies de santé numérique, comme l'IA et l'IoT, remodèlent l'ingénierie des dispositifs médicaux pour améliorer les résultats des soins de santé.
Dynamique du marché de l'ingénierie des dispositifs médicaux
Conducteurs
- Prévalence croissante des maladies chroniques
La prévalence croissante des maladies chroniques telles que les maladies cardiovasculaires, le diabète, le cancer et les troubles respiratoires est un facteur majeur de l'évolution du marché de l'ingénierie des dispositifs médicaux. Les maladies chroniques sont des affections à long terme, souvent liées au mode de vie, qui nécessitent une surveillance, une gestion et un traitement continus. À mesure que ces maladies deviennent plus courantes en raison de facteurs tels que le vieillissement de la population, l'urbanisation et la sédentarité, il existe un besoin croissant de dispositifs médicaux pouvant aider au diagnostic, à la surveillance et au traitement. Des affections telles que le diabète et les maladies cardiovasculaires nécessitent une surveillance constante. Des appareils tels que les glucomètres, les moniteurs de fréquence cardiaque et même les ECG portables sont devenus essentiels pour les patients, permettant un suivi de la santé en temps réel et une réponse rapide aux événements indésirables.
Par exemple, selon le rapport 2021 de la Fédération internationale du diabète (FID), 10,5 % de la population adulte (20-79 ans) souffre de diabète, et près de la moitié d’entre eux ignorent qu’ils en sont atteints. D’ici 2045, les projections de la FID montrent qu’un adulte sur huit, soit environ 783 millions de personnes, vivra avec le diabète, soit une augmentation de 46 %.
La demande de dispositifs médicaux utilisés dans la gestion des maladies chroniques a conduit à des innovations dans le domaine des dispositifs portables, conviviaux et économiques, rendant les soins de santé plus accessibles. Par exemple, le développement d'appareils connectés qui transmettent des données aux prestataires de soins de santé en temps réel contribue à la gestion des maladies chroniques au niveau du patient et du système. Cette tendance devrait s'accentuer, contribuant de manière significative à la croissance du marché de l'ingénierie des dispositifs médicaux.
- Progrès technologiques dans les dispositifs médicaux
L’innovation technologique rapide est un puissant moteur sur le marché de l’ingénierie des dispositifs médicaux, remodelant les dispositifs et améliorant leurs capacités. Les progrès dans des domaines tels que l’intelligence artificielle, la robotique, l’impression 3D et les matériaux biocompatibles permettent le développement de dispositifs médicaux sophistiqués qui offrent une plus grande précision, une plus grande automatisation et une plus grande adaptabilité aux besoins individuels des patients. L’adoption de ces technologies avancées permet au marché des dispositifs médicaux de répondre à la demande croissante de solutions plus efficaces, efficientes et centrées sur le patient. Les entreprises qui investissent dans ces technologies sont prêtes à conquérir des parts de marché en proposant des dispositifs innovants plus faciles à utiliser pour les cliniciens et offrant des avantages cliniques améliorés. Par exemple, Philips exploite l’IA dans ses appareils d’imagerie diagnostique, tels que l’IntelliSpace AI Workflow Suite. Cette plateforme utilise l’IA pour améliorer la qualité de l’imagerie, accélérer les flux de travail de diagnostic et aider à un diagnostic plus précoce et plus précis. Elle est conçue pour que les radiologues rationalisent les opérations d’imagerie et offrent de meilleurs résultats pour les patients. Alors que les systèmes de santé du monde entier adoptent de plus en plus ces solutions avancées, le marché de l’ingénierie des dispositifs médicaux devrait connaître une forte croissance tirée par les progrès technologiques.
Opportunités
- Expansion des dispositifs portables et de surveillance à distance
Avec l'essor de la télémédecine et la demande de gestion proactive de la santé, les appareils de surveillance portables et à distance présentent une opportunité substantielle sur le marché de l'ingénierie des dispositifs médicaux. Ces appareils, notamment les montres intelligentes, les moniteurs de glucose en continu et les moniteurs cardiaques, permettent une surveillance de la santé en temps réel en dehors des contextes cliniques traditionnels. La capacité de suivre les signes vitaux tels que la fréquence cardiaque, les niveaux d'oxygène et la glycémie fournit des données continues sur les patients et permet aux individus de gérer leur santé plus efficacement. Les appareils portables offrent une valeur immense aux patients qui gèrent des maladies chroniques comme le diabète, l'hypertension et les maladies cardiaques. Avec une sensibilisation croissante aux soins de santé préventifs et des investissements croissants dans les technologies portables, ce segment devrait connaître une croissance significative. Selon une étude de marché, le segment des appareils médicaux portables devrait croître à un TCAC élevé au cours de la prochaine décennie, contribuant fortement à l'expansion globale du marché des appareils médicaux.
Par exemple, en août 2024, Dexcom a annoncé que son nouveau moniteur de glucose continu en vente libre Stelo est officiellement disponible à l'achat aux États-Unis. Le système de biocapteur de glucose Stelo est un moniteur de glucose continu intégré (iCGM) en vente libre (OTC) destiné à mesurer, enregistrer, analyser et afficher en continu les valeurs de glucose chez les personnes de 18 ans et plus qui ne sont pas sous insuline. Le système de biocapteur de glucose Stelo permet de détecter les taux de glucose normaux (euglycémiques) et bas ou élevés (dysglycémiques). Le système de biocapteur de glucose Stelo peut également aider l'utilisateur à mieux comprendre comment les modifications du mode de vie et du comportement, y compris le régime alimentaire et l'exercice, ont un impact sur l'excursion glycémique. Ainsi, l'augmentation de la disponibilité des appareils de surveillance portables et à distance devrait stimuler la croissance du marché au cours de la période de prévision.
- Demande croissante de dispositifs chirurgicaux mini-invasifs
L’évolution vers des procédures mini-invasives présente une autre opportunité importante pour l’ingénierie des dispositifs médicaux. Les dispositifs chirurgicaux mini-invasifs (MIS), notamment les instruments laparoscopiques, les outils de chirurgie assistée par robot et les dispositifs endoscopiques, réduisent le temps de récupération, provoquent moins de traumatismes et minimisent les complications postopératoires. Le marché des dispositifs MIS se développe à mesure que les patients et les prestataires de soins de santé recherchent des options qui raccourcissent les séjours à l’hôpital et améliorent les résultats pour les patients. Les techniques MIS impliquent des incisions plus petites, ce qui réduit le risque d’infection, de douleur et de cicatrices. La chirurgie assistée par robot, par exemple, permet une plus grande précision dans les procédures complexes telles que les chirurgies cardiaques et orthopédiques, améliorant ainsi les résultats et les temps de récupération.
Cette tendance est renforcée par les avancées technologiques dans les domaines de la robotique, de l'imagerie et des outils chirurgicaux. Le marché des dispositifs MIS devrait connaître une forte croissance, les projections indiquant une forte demande, en particulier dans les applications orthopédiques, cardiovasculaires et gastro-intestinales. L'opportunité est également renforcée par une population vieillissante qui nécessite souvent des interventions chirurgicales pour des maladies chroniques, que les techniques MIS peuvent traiter avec moins de complications et des récupérations plus rapides. Par exemple, le système Mako de Stryker est une plate-forme assistée par robot qui permet aux chirurgiens orthopédistes d'effectuer des chirurgies de remplacement du genou et de la hanche précises et peu invasives. Le système Mako intègre l'imagerie 3D et des bras robotisés, ce qui permet une précision améliorée et une planification chirurgicale spécifique au patient. L'introduction de ce type d'appareils stimule la croissance du marché au cours de la période de prévision.
Contraintes/Défis
- Conformité réglementaire et retards d'approbation
L’un des plus grands défis auxquels est confrontée l’industrie de l’ingénierie des dispositifs médicaux est de s’y retrouver dans des exigences réglementaires complexes et strictes. Pour obtenir l’approbation réglementaire, les dispositifs médicaux doivent subir des tests rigoureux et des essais cliniques pour démontrer leur sécurité et leur efficacité. Ce processus peut être long et coûteux, entraînant souvent des retards dans le lancement des produits et leur mise sur le marché. De plus, le paysage réglementaire évolue constamment, avec l’introduction de nouvelles réglementations et normes. Cela peut créer des défis supplémentaires pour les fabricants, qui doivent se tenir au courant des dernières exigences et adapter leurs produits en conséquence.
En outre, le paysage réglementaire peut varier considérablement d’un pays à l’autre. Obtenir des autorisations sur plusieurs marchés peut s’avérer un processus complexe et coûteux. Cela peut entraver la distribution mondiale des dispositifs médicaux et limiter l’accès au marché.
- Coûts initiaux élevés des dispositifs médicaux
Le coût élevé des dispositifs médicaux constitue un obstacle majeur à la croissance du marché de l’ingénierie des dispositifs médicaux. Des matériaux coûteux, des processus de fabrication complexes et des exigences réglementaires strictes contribuent au coût global de ces dispositifs. Par conséquent, les prestataires de soins de santé, en particulier dans les pays en développement, peuvent avoir du mal à se permettre des technologies médicales avancées, ce qui limite leur adoption par le marché. En outre, les prix élevés peuvent décourager l’innovation des petites entreprises qui n’ont pas les ressources financières nécessaires pour investir dans la R&D et se conformer aux normes réglementaires. Cela limite l’accessibilité et l’évolutivité des nouvelles technologies.
Par exemple, selon l’American Council on Science and Health, le coût des dispositifs médicaux est rarement évoqué. Il représente environ 5 % des dépenses de santé, soit environ 120 milliards de dollars en 2017. Par conséquent, le coût élevé des dispositifs médicaux freine la croissance du marché de l’ingénierie des dispositifs médicaux.
Champ d'application du marché de l'ingénierie des dispositifs médicaux
Le marché est segmenté en fonction du type de service et du type d'appareil. La croissance de ces segments vous aidera à analyser les segments de faible croissance dans les industries et à fournir aux utilisateurs un aperçu précieux du marché et des informations sur le marché pour les aider à prendre des décisions stratégiques pour identifier les principales applications du marché.
Type de service
- Innovation et conception de produits/Services de conception industrielle
- Services de prototypage
- Services d'ingénierie électronique
- Services de développement et de test de logiciels
- Services de connectivité et de mobilité
- Services de cybersécurité
- Services de test de produits
- Services de consultation en matière de réglementation
- Service d'assistance et de maintenance des produits
Type d'appareil
- Équipement d'imagerie diagnostique
- Équipement chirurgical
- Dispositifs de surveillance des patients et dispositifs de maintien des fonctions vitales
- Lasers médicaux
- Dispositifs de diagnostic in vitro (DIV)
- Autres dispositifs médicaux
Analyse régionale du marché de l'ingénierie des dispositifs médicaux
Le marché est analysé et des informations sur la taille et les tendances du marché sont fournies par pays, type d'appareil, type de service comme référencé ci-dessus.
Les pays couverts sur le marché sont les États-Unis, le Canada, le Mexique, l'Allemagne, la France, le Royaume-Uni, les Pays-Bas, la Suisse, la Belgique, la Russie, l'Italie, l'Espagne, la Turquie, le reste de l'Europe, la Chine, le Japon, l'Inde, la Corée du Sud, Singapour, la Malaisie, l'Australie, la Thaïlande, l'Indonésie, les Philippines, le reste de l'Asie-Pacifique, l'Arabie saoudite, les Émirats arabes unis, l'Afrique du Sud, l'Égypte, Israël, le reste du Moyen-Orient et de l'Afrique, le Brésil, l'Argentine et le reste de l'Amérique du Sud.
L'Amérique du Nord devrait dominer le marché en raison des progrès réalisés dans le domaine des technologies des dispositifs médicaux, des dépenses de santé élevées et de la présence d'acteurs clés. De plus, le coût élevé des dispositifs médicaux et le taux d'adoption élevé des dispositifs médicaux devraient encore alimenter la croissance du marché.
L'Asie-Pacifique devrait connaître la croissance la plus rapide en raison de la croissance rapide de la population de la région. Les initiatives et investissements gouvernementaux visant à moderniser le secteur de la santé, ainsi que la sensibilisation accrue de la population aux avantages des dispositifs médicaux avancés, et l'augmentation de l'activité des start-ups dans le domaine des dispositifs médicaux contribuent à l'expansion du marché.
La section pays du rapport fournit également des facteurs d'impact sur les marchés individuels et des changements de réglementation sur le marché national qui ont un impact sur les tendances actuelles et futures du marché. Des points de données tels que l'analyse de la chaîne de valeur en aval et en amont, les tendances techniques et l'analyse des cinq forces de Porter, les études de cas sont quelques-uns des indicateurs utilisés pour prévoir le scénario de marché pour les différents pays. En outre, la présence et la disponibilité des marques mondiales et les défis auxquels elles sont confrontées en raison de la concurrence importante ou rare des marques locales et nationales, l'impact des tarifs nationaux et les routes commerciales sont pris en compte tout en fournissant une analyse prévisionnelle des données nationales.
Part de marché de l'ingénierie des dispositifs médicaux
Le paysage concurrentiel du marché fournit des détails par concurrent. Les détails inclus sont la présentation de l'entreprise, les finances de l'entreprise, les revenus générés, le potentiel du marché, les investissements dans la recherche et le développement, les nouvelles initiatives du marché, la présence mondiale, les sites et installations de production, les capacités de production, les forces et les faiblesses de l'entreprise, le lancement du produit, la largeur et l'étendue du produit, la domination des applications. Les points de données ci-dessus fournis ne concernent que l'orientation des entreprises par rapport au marché.
Les leaders du marché de l'ingénierie des dispositifs médicaux opérant sur le marché sont :
- L&T Technology Services Limited (Inde)
- Infosys Limited (Inde)
- HCL Technologies Limited (Inde)
- Cyient (Inde)
- Wipro (Inde)
- Tech Mahindra Limited (Inde)
- TATA Consultancy Services Limited (Inde)
- FLEX LTD (États-Unis)
- Capgemini (France)
- Embien Technologies India Pvt Ltd. (Inde)
- Groupe Alten (France)
- Accenture (Irlande)
- Consonance (Pologne)
- Groupe Althea (États-Unis)
- INSTITUT MEDICAL (USA)
- Saraca Solutions Private Limited (Inde)
- Nemedio Inc. (États-Unis)
- Sternum (Israël)
- Medcrypt (États-Unis)
- MCRA, LLC (États-Unis)
- North American Science Associates, LLC (États-Unis)
- MedQtech (Suède)
- Veranex (États-Unis)
- Ontogen Medtech LLC (États-Unis)
- Seisa Media (États-Unis)
- Développement de produits Simplexity (États-Unis)
Dernières évolutions du marché de l'ingénierie des dispositifs médicaux
- En novembre 2023, L&T Technology Services Limited (LTTS) (Inde) s'est associé à NVIDIA Corporation (États-Unis) pour développer des architectures définies par logiciel pour les dispositifs médicaux, en particulier pour l'endoscopie, visant à améliorer la qualité de l'image et l'évolutivité du produit.
- En octobre 2023, Alten Group (France) a acquis East Japan Institute of Technology Co., Ltd. (Japon). Cette acquisition s'inscrit dans la stratégie d'Alten visant à renforcer ses capacités d'ingénierie au Japon et à atteindre une présence significative sur le marché, en s'affirmant comme un fournisseur de services d'ingénierie de premier plan dans la région
- En janvier 2022, HCL Technologies Limited (Inde) a acquis Starschema (États-Unis), une opération qui renforce les capacités d'ingénierie numérique de HCL, en particulier dans l'ingénierie de données, et élargit son empreinte en Europe centrale et orientale.
- En septembre 2024, Vision Engineering, concepteur, fabricant et exportateur britannique de microscopes et de systèmes de mesure ergonomiques, a lancé OPTA, un produit d'entrée de gamme économique pour sa technologie brevetée de microscope stéréo optique. Disponible pour moins de 1 200 $, avec un choix de trois supports et deux objectifs, OPTA redéfinit le point d'entrée pour que les utilisateurs bénéficient de la qualité d'image, de la conception ergonomique et de la facilité d'utilisation de Vision Engineering. Ce produit vise à améliorer la qualité de l'image et l'ergonomie, rendant la microscopie avancée plus accessible. Le lancement de ce type d'appareils stimule la croissance du marché de l'ingénierie des dispositifs médicaux
- In June 2022, Siemens Healthineers introduces Symbia Pro.specta, a single photon emission computed tomography/computed tomography (SPECT/CT) system with CE mark and Food and Drug Administration (FDA) clearance that has advanced SPECT and CT imaging technologies. Capabilities include a low-dose CT of up to 64 slices for impressive detail, automatic SPECT motion correction for additional image clarity, and an intuitive and automated workflow to guide the user through the entire decision-making process of the examination
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Table des matières
1. INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL MEDICAL DEVICE ENGINEERING MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2. MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL MEDICAL DEVICE ENGINEERING MARKETSIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.12 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL MEDICAL DEVICE ENGINEERING MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3. MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4. EXECUTIVE SUMMARY
5. PREMIUM INSIGHTS
5.1 PESTEL ANALYSIS
5.2 PORTER’S FIVE FORCES MODEL
6. INDUSTRY INSIGHTS
6.1 MICRO AND MACRO ECONOMIC FACTORS
6.2 PENETRATION AND GROWTH PROSPECT MAPPING
6.3 KEY PRICING STRATEGIES
6.4 INTERVIEWS WITH SPECIALIST
6.5 ANALYIS AND RECOMMENDATION
7. INTELLECTUAL PROPERTY (IP) PORTFOLIO
7.1 PATENT QUALITY AND STRENGTH
7.2 PATENT FAMILIES
7.3 LICENSING AND COLLABORATIONS
7.4 COMPETITIVE LANDSCAPE
7.5 IP STRATEGY AND MANAGEMENT
7.6 OTHER
8. COST ANALYSIS BREAKDOWN
9. TECHNONLOGY ROADMAP
10. INNOVATION TRACKER AND STRATEGIC ANALYSIS
10.1 MAJOR DEALS AND STRATEGIC ALLIANCES ANALYSIS
10.1.1 JOINT VENTURES
10.1.2 MERGERS AND ACQUISITIONS
10.1.3 LICENSING AND PARTNERSHIP
10.1.4 TECHNOLOGY COLLABORATIONS
10.1.5 STRATEGIC DIVESTMENTS
10.2 NUMBER OF PRODUCTS IN DEVELOPMENT
10.3 STAGE OF DEVELOPMENT
10.4 TIMELINES AND MILESTONES
10.5 INNOVATION STRATEGIES AND METHODOLOGIES
10.6 RISK ASSESSMENT AND MITIGATION
10.7 FUTURE OUTLOOK
11. REGULATORY COMPLIANCE
11.1 REGULATORY AUTHORITIES
11.2 REGULATORY CLASSIFICATIONS
11.2.1 CLASS I
11.2.2 CLASS II
11.2.3 CLASS III
11.3 REGULATORY SUBMISSIONS
11.4 INTERNATIONAL HARMONIZATION
11.5 COMPLIANCE AND QUALITY MANAGEMENT SYSTEMS
11.6 REGULATORY CHALLENGES AND STRATEGIES
12. REIMBURSEMENT FRAMEWORK
13. OPPUTUNITY MAP ANALYSIS
14. VALUE CHAIN ANALYSIS
15. HEALTHCARE ECONOMY
15.1 HEALTHCARE EXPENDITURE
15.2 CAPITAL EXPENDITURE
15.3 CAPEX TRENDS
15.4 CAPEX ALLOCATION
15.5 FUNDING SOURCES
15.6 INDUSTRY BENCHMARKS
15.7 GDP RATION IN OVERALL GDP
15.8 HEALTHCARE SYSTEM STRUCTURE
15.9 GOVERNMENT POLICIES
15.10 ECONOMIC DEVELOPMENT
16. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY SERVICE TYPE
16.1 OVERVIEW
16.2 PRODUCT DESIGN & DEVELOPMENT
16.2.1 CONCEPTUALIZATION & IDEATION
16.2.2 INDUSTRIAL & MECHANICAL DESIGN
16.2.3 USER-CENTERED DESIGN (UCD) & ERGONOMICS
16.2.4 MATERIALS & COMPONENT SELECTION
16.2.5 FINITE ELEMENT ANALYSIS (FEA) & SIMULATION
16.2.6 DESIGN FOR MANUFACTURING (DFM)
16.3 PROTOTYPING & TESTING
16.3.1 RAPID PROTOTYPING (3D PRINTING, CNC, INJECTION MOLDING)
16.3.2 MECHANICAL, ELECTRICAL & THERMAL TESTING
16.3.3 PRECLINICAL TESTING & VALIDATION
16.3.4 BIOCOMPATIBILITY & TOXICITY TESTING
16.3.5 FAILURE MODE & EFFECTS ANALYSIS (FMEA)
16.4 MANUFACTURING & SUPPLY CHAIN MANAGEMENT
16.4.1 CONTRACT MANUFACTURING (OEM & ODM)
16.4.2 COMPONENT SOURCING & SUPPLY CHAIN OPTIMIZATION
16.4.3 CLEANROOM & STERILE MANUFACTURING
16.4.4 LEAN MANUFACTURING & SIX SIGMA PRACTICES
16.4.5 QUALITY CONTROL & ASSURANCE (ISO 13485, GMP)
16.5 REGULATORY COMPLIANCE & CONSULTING
16.5.1 RISK MANAGEMENT & SAFETY ASSESSMENTS
16.5.2 CLINICAL & REGULATORY STRATEGY CONSULTING
16.5.3 REGULATORY SUBMISSIONS (FDA, CE MARKING, ISO CERTIFICATION)
16.5.4 POST-MARKET SURVEILLANCE & COMPLIANCE AUDITS
16.5.5 LEGAL & ETHICAL CONSIDERATIONS
16.6 EMBEDDED SYSTEMS & SOFTWARE DEVELOPMENT
16.7 OTHER
17. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY DEVICE TYPE
17.1 OVERVIEW
(NOTE: MARKET VALUE, VOLUME AND ASP ANALYSIS WOULD BE PROVIDED FOR ALL SEGMENTS AND SUB-SEGMENTS OF PRODUCT)
17.2 DIAGNOSTIC DEVICES
17.2.1 IMAGING SYSTEMS
17.2.1.1. MAGNETIC RESONANCE IMAGING (MRI)
17.2.1.1.1. OPEN MRI
17.2.1.1.2. CLOSED MRI
17.2.1.2. COMPUTED TOMOGRAPHY (CT) SCANNERS
17.2.1.2.1. LOW-SLICE CT (1-16 SLICES)
17.2.1.2.2. MID-SLICE CT (32-64 SLICES)
17.2.1.2.3. HIGH-SLICE CT (128+ SLICES)
17.2.1.2.4. CONE BEAM CT (CBCT)
17.2.1.2.5. SPECTRAL CT
17.2.1.3. ULTRASOUND DEVICES
17.2.1.3.1. 2D ULTRASOUND
17.2.1.3.2. 3D/4D ULTRASOUND
17.2.1.3.3. DOPPLER ULTRASOUND
17.2.1.3.4. PORTABLE & HANDHELD ULTRASOUND
17.2.1.3.5. HIGH-INTENSITY FOCUSED ULTRASOUND (HIFU)
17.2.1.4. X-RAY SYSTEMS
17.2.1.4.1. ANALOG X-RAY
17.2.1.4.2. DIGITAL RADIOGRAPHY (DR)
17.2.1.4.3. COMPUTED RADIOGRAPHY (CR)
17.2.1.4.4. FLUOROSCOPY SYSTEMS
17.2.1.5. POSITRON EMISSION TOMOGRAPHY (PET) SCANNERS
17.2.1.5.1. PET-CT SYSTEMS
17.2.1.5.2. PET-MRI SYSTEMS
17.2.1.5.3. STANDALONE PET SCANNERS
17.2.2 IN-VITRO DIAGNOSTIC (IVD) EQUIPMENT
17.2.2.1. MOLECULAR DIAGNOSTICS
17.2.2.1.1. POLYMERASE CHAIN REACTION (PCR)
17.2.2.1.2. NEXT-GENERATION SEQUENCING (NGS)
17.2.2.1.3. DNA MICROARRAYS
17.2.2.1.4. ISOTHERMAL NUCLEIC ACID AMPLIFICATION
17.2.2.2. IMMUNOASSAYS
17.2.2.2.1. ENZYME-LINKED IMMUNOSORBENT ASSAY (ELISA)
17.2.2.2.2. CHEMILUMINESCENCE IMMUNOASSAY (CLIA)
17.2.2.2.3. RADIOIMMUNOASSAY (RIA)
17.2.2.3. HEMATOLOGY ANALYZERS
17.2.2.3.1. 3-PART HEMATOLOGY ANALYZERS
17.2.2.3.2. 5-PART HEMATOLOGY ANALYZERS
17.2.2.3.3. POINT-OF-CARE HEMATOLOGY DEVICES
17.2.2.4. POINT-OF-CARE TESTING DEVICES
17.2.2.4.1. GLUCOSE MONITORING SYSTEMS
17.2.2.4.2. RAPID ANTIGEN/ANTIBODY TESTS
17.2.2.4.3. HOME PREGNANCY & FERTILITY KITS
17.2.2.4.4. INFECTIOUS DISEASE RAPID TESTS
17.3 THERAPEUTIC DEVICES
17.3.1 SURGICAL INSTRUMENTS & ROBOTICS
17.3.1.1. MINIMALLY INVASIVE SURGERY (MIS) DEVICES
17.3.1.1.1. LAPAROSCOPIC INSTRUMENTS
17.3.1.1.2. ENDOSCOPIC INSTRUMENTS
17.3.1.1.3. ARTHROSCOPIC DEVICES
17.3.1.1.4. ROBOTIC-ASSISTED MIS SYSTEMS
17.3.1.2. ROBOT-ASSISTED SURGERY (RAS) SYSTEMS
17.3.1.2.1. ORTHOPEDIC SURGERY ROBOTS
17.3.1.2.2. NEUROSURGERY ROBOTS
17.3.1.2.3. UROLOGY & GYNECOLOGY SURGERY ROBOTS
17.3.2 IMPLANTABLE MEDICAL DEVICES
17.3.2.1. ORTHOPEDIC IMPLANTS
17.3.2.1.1. HIP IMPLANTS
17.3.2.1.2. KNEE IMPLANTS
17.3.2.1.3. SPINAL IMPLANTS
17.3.2.1.4. TRAUMA FIXATION DEVICES
17.3.2.2. CARDIOVASCULAR IMPLANTS
17.3.2.2.1. PACEMAKERS
17.3.2.2.2. IMPLANTABLE CARDIOVERTER DEFIBRILLATORS (ICDS)
17.3.2.2.3. HEART VALVES
17.3.2.2.4. CORONARY & PERIPHERAL STENTS
17.3.2.3. NEUROSTIMULATION DEVICES
17.3.2.3.1. DEEP BRAIN STIMULATORS (DBS)
17.3.2.3.2. SPINAL CORD STIMULATORS (SCS)
17.3.2.3.3. VAGUS NERVE STIMULATORS (VNS)
17.3.2.3.4. SACRAL NERVE STIMULATORS
17.3.2.4. COCHLEAR & AUDITORY IMPLANTS
17.3.2.4.1. COCHLEAR IMPLANTS
17.3.2.4.2. BONE-ANCHORED HEARING AIDS (BAHA)
17.3.3 DRUG DELIVERY SYSTEMS
17.3.3.1. SMART INFUSION PUMPS
17.3.3.1.1. LARGE VOLUME PUMPS (LVP)
17.3.3.1.2. SYRINGE INFUSION PUMPS
17.3.3.1.3. PATIENT-CONTROLLED ANALGESIA (PCA) PUMPS
17.3.3.1.4. INSULIN PUMPS
17.3.3.2. SMART INHALERS
17.3.3.2.1. METERED-DOSE INHALERS (MDIS)
17.3.3.2.2. DRY POWDER INHALERS (DPIS)
17.3.3.2.3. NEBULIZERS
17.4 PATIENT MONITORING DEVICES
17.4.1 WEARABLE MEDICAL DEVICES
17.4.1.1. SMARTWATCHES & FITNESS TRACKERS
17.4.1.1.1. HEART RATE MONITORING
17.4.1.1.2. BLOOD OXYGEN (SPO2) MONITORING
17.4.1.1.3. ECG MONITORING
17.4.1.2. CONTINUOUS GLUCOSE MONITORS (CGM)
17.4.1.2.1. REAL-TIME CGM (RTCGM)
17.4.1.2.2. INTERMITTENTLY SCANNED CGM (ISCGM)
17.4.2 REMOTE PATIENT MONITORING (RPM) SYSTEMS
17.4.2.1. CARDIAC MONITORING DEVICES
17.4.2.1.1. HOLTER MONITORS
17.4.2.1.2. IMPLANTABLE LOOP RECORDERS
17.4.2.1.3. WIRELESS ECG
17.4.2.2. RESPIRATORY MONITORING DEVICES
17.4.2.2.1. PULSE OXIMETERS
17.4.2.2.2. CAPNOGRAPHY SYSTEMS
17.4.2.3. NEUROLOGICAL MONITORING DEVICES
17.4.2.3.1. EEG MONITORS
17.4.2.3.2. ELECTROMYOGRAPHY (EMG) DEVICES
17.5 HEALTHCARE IT & DIGITAL HEALTH SOLUTIONS
17.5.1 TELEMEDICINE PLATFORMS
17.5.1.1. VIDEO CONSULTATION PLATFORMS
17.5.1.1.1. GENERAL TELECONSULTATION
17.5.1.1.2. TELEPSYCHIATRY
17.5.1.1.3. TELEDERMATOLOGY
17.5.1.1.4. TELENEUROLOGY
17.5.1.2. REMOTE PATIENT MANAGEMENT SYSTEMS
17.5.1.2.1. MOBILE HEALTH APPS
17.5.1.2.2. AI-BASED SYMPTOM CHECKERS
17.5.2 ELECTRONIC HEALTH RECORDS (EHR)
17.5.2.1. CLOUD-BASED EHR
17.5.2.2. ON-PREMISE EHR
17.5.2.3. AI-DRIVEN EHR SYSTEMS
17.5.3 AI-BASED DIAGNOSTIC & DECISION-SUPPORT TOOLS
17.5.3.1. AI IN RADIOLOGY & IMAGING
17.5.3.2. AI IN PATHOLOGY
17.5.3.3. AI FOR HISTOPATHOLOGICAL IMAGE ANALYSIS
17.5.3.4. AUTOMATED CYTOLOGY ANALYSIS
17.6 OTHERS
18. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY APPLICATION
18.1 OVERVIEW
18.2 CARDIOVASCULAR
18.3 ORTHOPEDICS
18.4 NEUROLOGY
18.5 ONCOLOGY
18.6 RESPIRATORY
18.7 GENERAL SURGERY
18.8 OPHTHALMOLOGY
18.9 DENTAL
18.10 OTHERS
19. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY END USER
19.1 OVERVIEW
19.2 MEDICAL DEVICE MANUFACTURERS
19.3 CONTRACT MANUFACTURING ORGANIZATIONS (CMOS) & CONTRACT DEVELOPMENT AND MANUFACTURING ORGANIZATIONS (CDMOS)
19.4 HOSPITALS & HEALTHCARE PROVIDERS
19.5 REMOTE PATIENT MONITORING PROVIDERS
19.6 REGULATORY & COMPLIANCE BODIES
19.7 OTHERS
20. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY COUNTRY
GLOBAL MEDICAL DEVICE ENGINEERING MARKET (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
20.1 NORTH AMERICA
20.1.1 U.S.
20.1.2 CANADA
20.1.3 MEXICO
20.2 EUROPE
20.2.1 GERMANY
20.2.2 U.K.
20.2.3 ITALY
20.2.4 FRANCE
20.2.5 SPAIN
20.2.6 RUSSIA
20.2.7 SWITZERLAND
20.2.8 TURKEY
20.2.9 BELGIUM
20.2.10 NETHERLANDS
20.2.11 DENMARK
20.2.12 SWEDEN
20.2.13 POLAND
20.2.14 NORWAY
20.2.15 FINLAND
20.2.16 REST OF EUROPE
20.3 ASIA-PACIFIC
20.3.1 JAPAN
20.3.2 CHINA
20.3.3 SOUTH KOREA
20.3.4 INDIA
20.3.5 SINGAPORE
20.3.6 THAILAND
20.3.7 INDONESIA
20.3.8 MALAYSIA
20.3.9 PHILIPPINES
20.3.10 AUSTRALIA
20.3.11 NEW ZEALAND
20.3.12 VIETNAM
20.3.13 TAIWAN
20.3.14 REST OF ASIA-PACIFIC
20.4 SOUTH AMERICA
20.4.1 BRAZIL
20.4.2 ARGENTINA
20.4.3 REST OF SOUTH AMERICA
20.5 MIDDLE EAST AND AFRICA
20.5.1 SOUTH AFRICA
20.5.2 EGYPT
20.5.3 BAHRAIN
20.5.4 UNITED ARAB EMIRATES
20.5.5 KUWAIT
20.5.6 OMAN
20.5.7 QATAR
20.5.8 SAUDI ARABIA
20.5.9 REST OF MEA
20.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
21. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, SWOT AND DBMR ANALYSIS
22. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, COMPANY PROFILE
22.1 3M HEALTH CARE
22.1.1 COMPANY OVERVIEW
22.1.2 REVENUE ANALYSIS
22.1.3 GEOGRAPHIC PRESENCE
22.1.4 PRODUCT PORTFOLIO
22.1.5 RECENT DEVELOPMENTS
22.2 ABBOTT LABORATORIES
22.2.1 COMPANY OVERVIEW
22.2.2 REVENUE ANALYSIS
22.2.3 GEOGRAPHIC PRESENCE
22.2.4 PRODUCT PORTFOLIO
22.2.5 RECENT DEVELOPMENTS
22.3 BAXTER INTERNATIONAL
22.3.1 COMPANY OVERVIEW
22.3.2 REVENUE ANALYSIS
22.3.3 GEOGRAPHIC PRESENCE
22.3.4 PRODUCT PORTFOLIO
22.3.5 RECENT DEVELOPMENTS
22.4 BECTON DICKINSON COMPANY
22.4.1 COMPANY OVERVIEW
22.4.2 REVENUE ANALYSIS
22.4.3 GEOGRAPHIC PRESENCE
22.4.4 PRODUCT PORTFOLIO
22.4.5 RECENT DEVELOPMENTS
22.5 BOSTON SCIENTIFIC CORPORATION
22.5.1 COMPANY OVERVIEW
22.5.2 REVENUE ANALYSIS
22.5.3 GEOGRAPHIC PRESENCE
22.5.4 PRODUCT PORTFOLIO
22.5.5 RECENT DEVELOPMENTS
22.6 CANON MEDICAL SYSTEMS CORPORATION
22.6.1 COMPANY OVERVIEW
22.6.2 REVENUE ANALYSIS
22.6.3 GEOGRAPHIC PRESENCE
22.6.4 PRODUCT PORTFOLIO
22.6.5 RECENT DEVELOPMENTS
22.7 CARDINAL HEALTH
22.7.1 COMPANY OVERVIEW
22.7.2 REVENUE ANALYSIS
22.7.3 GEOGRAPHIC PRESENCE
22.7.4 PRODUCT PORTFOLIO
22.7.5 RECENT DEVELOPMENTS
22.8 DANAHER CORPORATION
22.8.1 COMPANY OVERVIEW
22.8.2 REVENUE ANALYSIS
22.8.3 GEOGRAPHIC PRESENCE
22.8.4 PRODUCT PORTFOLIO
22.8.5 RECENT DEVELOPMENTS
22.9 FRESENIUS MEDICAL CARE
22.9.1 COMPANY OVERVIEW
22.9.2 REVENUE ANALYSIS
22.9.3 GEOGRAPHIC PRESENCE
22.9.4 PRODUCT PORTFOLIO
22.9.5 RECENT DEVELOPMENTS
22.10 GE HEALTHCARE
22.10.1 COMPANY OVERVIEW
22.10.2 REVENUE ANALYSIS
22.10.3 GEOGRAPHIC PRESENCE
22.10.4 PRODUCT PORTFOLIO
22.10.5 RECENT DEVELOPMENTS
22.11 HOLOGIC, INC.
22.11.1 COMPANY OVERVIEW
22.11.2 REVENUE ANALYSIS
22.11.3 GEOGRAPHIC PRESENCE
22.11.4 PRODUCT PORTFOLIO
22.11.5 RECENT DEVELOPMENTS
22.12 INTUITIVE SURGICAL
22.12.1 COMPANY OVERVIEW
22.12.2 REVENUE ANALYSIS
22.12.3 GEOGRAPHIC PRESENCE
22.12.4 PRODUCT PORTFOLIO
22.12.5 RECENT DEVELOPMENTS
22.13 JOHNSON & JOHNSON
22.13.1 COMPANY OVERVIEW
22.13.2 REVENUE ANALYSIS
22.13.3 GEOGRAPHIC PRESENCE
22.13.4 PRODUCT PORTFOLIO
22.13.5 RECENT DEVELOPMENTS
22.14 MEDTRONIC PLC
22.14.1 COMPANY OVERVIEW
22.14.2 REVENUE ANALYSIS
22.14.3 GEOGRAPHIC PRESENCE
22.14.4 PRODUCT PORTFOLIO
22.14.5 RECENT DEVELOPMENTS
22.15 PHILIPS HEALTHCARE
22.15.1 COMPANY OVERVIEW
22.15.2 REVENUE ANALYSIS
22.15.3 GEOGRAPHIC PRESENCE
22.15.4 PRODUCT PORTFOLIO
22.15.5 RECENT DEVELOPMENTS
22.16 RESMED INC.
22.16.1 COMPANY OVERVIEW
22.16.2 REVENUE ANALYSIS
22.16.3 GEOGRAPHIC PRESENCE
22.16.4 PRODUCT PORTFOLIO
22.16.5 RECENT DEVELOPMENTS
22.17 ROCHE DIAGNOSTICS INTERNATIONAL LTD
22.17.1 COMPANY OVERVIEW
22.17.2 REVENUE ANALYSIS
22.17.3 GEOGRAPHIC PRESENCE
22.17.4 PRODUCT PORTFOLIO
22.17.5 RECENT DEVELOPMENTS
22.18 SIEMENS HEALTHINEERS AG
22.18.1 COMPANY OVERVIEW
22.18.2 REVENUE ANALYSIS
22.18.3 GEOGRAPHIC PRESENCE
22.18.4 PRODUCT PORTFOLIO
22.18.5 RECENT DEVELOPMENTS
22.19 SMITH & NEPHEW PLC.
22.19.1 COMPANY OVERVIEW
22.19.2 REVENUE ANALYSIS
22.19.3 GEOGRAPHIC PRESENCE
22.19.4 PRODUCT PORTFOLIO
22.19.5 RECENT DEVELOPMENTS
22.20 STRYKER CORPORATION
22.20.1 COMPANY OVERVIEW
22.20.2 REVENUE ANALYSIS
22.20.3 GEOGRAPHIC PRESENCE
22.20.4 PRODUCT PORTFOLIO
22.20.5 RECENT DEVELOPMENTS
22.21 TERUMO CORPORATION
22.21.1 COMPANY OVERVIEW
22.21.2 REVENUE ANALYSIS
22.21.3 GEOGRAPHIC PRESENCE
22.21.4 PRODUCT PORTFOLIO
22.21.5 RECENT DEVELOPMENTS
22.22 THERMO FISHER SCIENTIFIC, INC.
22.22.1 COMPANY OVERVIEW
22.22.2 REVENUE ANALYSIS
22.22.3 GEOGRAPHIC PRESENCE
22.22.4 PRODUCT PORTFOLIO
22.22.5 RECENT DEVELOPMENTS
22.23 ZIMMER BIOMET HOLDINGS, INC.
22.23.1 COMPANY OVERVIEW
22.23.2 REVENUE ANALYSIS
22.23.3 GEOGRAPHIC PRESENCE
22.23.4 PRODUCT PORTFOLIO
22.23.5 RECENT DEVELOPMENTS
22.24 FLEX HEALTH SOLUTIONS
22.24.1 COMPANY OVERVIEW
22.24.2 REVENUE ANALYSIS
22.24.3 GEOGRAPHIC PRESENCE
22.24.4 PRODUCT PORTFOLIO
22.24.5 RECENT DEVELOPMENTS
22.25 JABIL HEALTHCARE
22.25.1 COMPANY OVERVIEW
22.25.2 REVENUE ANALYSIS
22.25.3 GEOGRAPHIC PRESENCE
22.25.4 PRODUCT PORTFOLIO
22.25.5 RECENT DEVELOPMENTS
22.26 SANMINA CORPORATION
22.26.1 COMPANY OVERVIEW
22.26.2 REVENUE ANALYSIS
22.26.3 GEOGRAPHIC PRESENCE
22.26.4 PRODUCT PORTFOLIO
22.26.5 RECENT DEVELOPMENTS
22.27 CELESTICA HEALTHTECH
22.27.1 COMPANY OVERVIEW
22.27.2 REVENUE ANALYSIS
22.27.3 GEOGRAPHIC PRESENCE
22.27.4 PRODUCT PORTFOLIO
22.27.5 RECENT DEVELOPMENTS
22.28 INTEGER HOLDINGS CORPORATION
22.28.1 COMPANY OVERVIEW
22.28.2 REVENUE ANALYSIS
22.28.3 GEOGRAPHIC PRESENCE
22.28.4 PRODUCT PORTFOLIO
22.28.5 RECENT DEVELOPMENTS
RECENT DEVELOPMENTS NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST RELATED REPORTS
23. RELATED REPORTS
24. CONCLUSION
25. QUESTIONNAIRE
26. ABOUT DATA BRIDGE MARKET RESEARCH
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.