Marché des tests de dispositifs médicaux en Amérique du Nord, par type de service (services de test, services d'inspection et services de certification), type de test (tests physiques, tests chimiques/biologiques, tests de cybersécurité, tests de microbiologie et de stérilité, et autres), phase (préclinique et clinique), type d'approvisionnement (interne et externalisé), classe de dispositif (classe I, classe II et classe III), produit (dispositif médical implantable actif, dispositif médical actif, dispositif médical non actif, dispositif médical de diagnostic in vitro, dispositif médical ophtalmique, dispositif médical orthopédique et dentaire, dispositif médical vasculaire, et autres) - Tendances et prévisions de l'industrie jusqu'en 2030.
Analyse et perspectives du marché des tests de dispositifs médicaux en Amérique du Nord
Les dispositifs médicaux sont essentiels car ils ont un impact direct sur la vie humaine. Les fabricants de dispositifs médicaux suivent les meilleures pratiques en matière de tests, de vérification et de validation pour garantir la qualité et la fiabilité des équipements médicaux afin de fournir des services de santé sûrs et efficaces aux patients. Il existe un aperçu de haut niveau de la mise en œuvre des stratégies de test des dispositifs médicaux. De nombreux organismes de réglementation et de conformité régissent les dispositifs médicaux. D'autre part, les utilisateurs finaux attendent des performances, une efficacité et une sécurité exceptionnelles de l'appareil qu'ils utilisent. Cela oblige les fabricants de dispositifs médicaux à créer et à déployer des stratégies de test qui fonctionnent tout au long du cycle de développement, du concept et de la conception à la production.
Le besoin croissant de vérification et de validation des dispositifs médicaux à l'échelle mondiale a stimulé la croissance du marché. Certains des principaux acteurs du marché se concentrent fortement sur divers lancements et approbations de services au cours de cette période cruciale. En outre, la demande croissante de tests in vitro contribue également à la demande croissante de tests de dispositifs médicaux. Le marché nord-américain des tests de dispositifs médicaux connaît une croissance au cours de l'année de prévision en raison de l'augmentation du nombre d'acteurs du marché et de la disponibilité de services avancés.
Toutefois, les obstacles au développement local des dispositifs médicaux et le coût élevé des dispositifs médicaux pourraient entraver la croissance du marché des tests de dispositifs médicaux en Amérique du Nord au cours de la période de prévision.
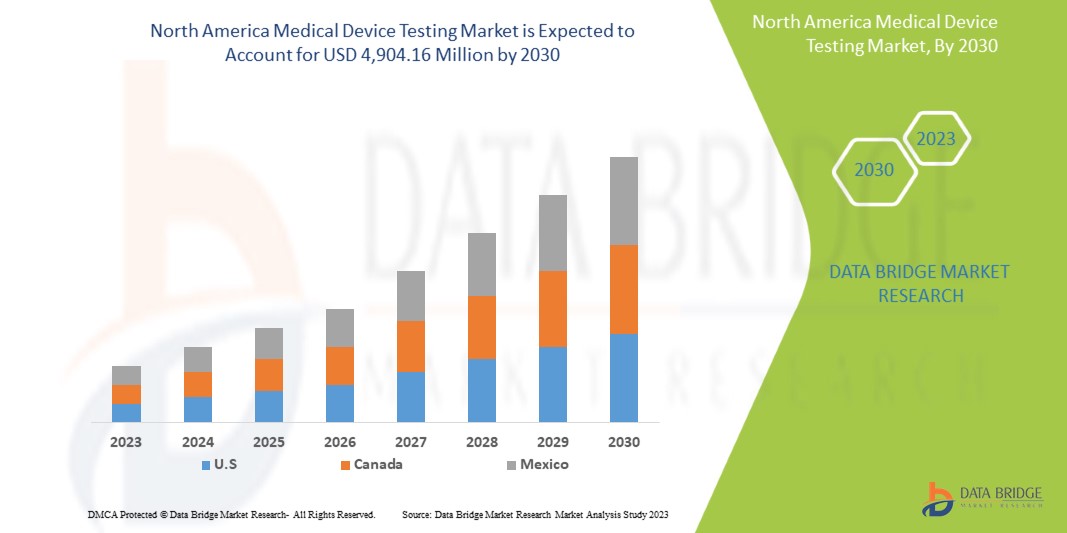
Data Bridge Market Research analyse que le marché nord-américain des tests de dispositifs médicaux devrait atteindre la valeur de 4 904,16 millions USD d'ici 2030, à un TCAC de 12,0 % au cours de la période de prévision.
|
Rapport métrique |
Détails |
|
Période de prévision |
2023 à 2030 |
|
Année de base |
2022 |
|
Années historiques |
2021 (personnalisable de 2015 à 2020) |
|
Unités quantitatives |
Chiffre d'affaires en millions USD |
|
Segments couverts |
Type de service (services de test, service d'inspection et services de certification), type de test (tests physiques, tests chimiques/biologiques, tests de cybersécurité, tests de microbiologie et tests de stérilité , et autres), phase (préclinique et clinique), type d'approvisionnement (interne et externalisé), classe de dispositif (classe I, classe II et classe III), produit (dispositif médical implantable actif, dispositif médical actif, dispositif médical non actif, dispositif médical de diagnostic in vitro, dispositif médical ophtalmique, dispositif médical orthopédique et dentaire, dispositif médical vasculaire et autres) |
|
Pays couverts |
États-Unis, Canada et Mexique |
|
Acteurs du marché couverts |
Intertek Group plc, SGS SA, Bureau Veritas, TUV SUD, TUV Rheinland, Pace, Charles River Laboratories., Biomedical Device Labs, UL LLC, North American Science Associates, LLC, WuXi AppTec, NSF., Laboratory Corporation of America Holdings, Eurofins Scientific, NELSON LABORATORIES, LLC- UNE SOCIÉTÉ SOTERA HEALTH, Gateway Analytical., Element Materials Technology, Hohenstein, Cigniti, Q Laboratories et IMR Test Labs, entre autres |
Définition du marché
Les tests des dispositifs médicaux sont le processus qui permet de démontrer que le dispositif est utilisé de manière fiable et sûre. Lors du développement de nouveaux produits, des tests de validation de conception approfondis sont appliqués. Cela comprend des tests de performance, de toxicité, d'analyse chimique et parfois des tests sur les facteurs humains ou même des tests cliniques. Les tests d'assurance qualité continus sont généralement plus limités. Cela comprend généralement des contrôles dimensionnels, certains tests fonctionnels et la vérification de l'emballage. Différents types de services de tests médicaux sont disponibles sur le marché, tels que des services d'inspection, des services de certification et autres.
Dynamique du marché des tests de dispositifs médicaux en Amérique du Nord
Cette section traite de la compréhension des moteurs, des avantages, des opportunités, des contraintes et des défis du marché. Tout cela est discuté en détail ci-dessous :
Conducteurs
- Besoin croissant de vérification et de validation des dispositifs médicaux
Les tests des dispositifs médicaux sont le processus qui permet de démontrer que l'appareil réalisera un diagnostic et un traitement de manière fiable et sûre. La demande de dispositifs médicaux est en constante augmentation en raison de la forte prévalence de diverses maladies observées dans diverses régions du monde.
Les méthodes de vérification et de validation sont largement utilisées dans le secteur de la santé. En général, la vérification est la phase de développement d'un produit pour savoir s'il est conforme aux exigences spécifiées, tandis que la validation vérifie si l'utilisation prévue a été respectée et, par conséquent, si les spécifications d'utilisabilité sont respectées. Les types de vérification et de validation les plus courants pour les dispositifs médicaux sont la vérification et la validation de la conception, des processus et des logiciels.
Les dispositifs médicaux deviennent également plus petits et plus complexes dans leur conception grâce à l'utilisation de plastiques techniques de pointe. Cela rend le processus de validation et de vérification (V&V) d'autant plus important. Il en résulte une meilleure répétabilité, moins d'erreurs, moins de retouches et de reconceptions, un délai de mise sur le marché plus rapide, une compétitivité améliorée et des coûts de production réduits. En outre, l'augmentation des normes et des réglementations concernant les services de validation et de vérification des dispositifs médicaux devrait stimuler la croissance du marché des tests de dispositifs médicaux.
- Demande croissante de tests in vitro
Les diagnostics in vitro (DIV) sont des tests effectués sur des échantillons tels que du sang ou des tissus prélevés sur le corps humain. Les diagnostics in vitro peuvent détecter des maladies ou d'autres affections et peuvent être utilisés pour surveiller l'état de santé général d'une personne afin de contribuer à guérir, traiter ou prévenir des maladies.
Les tests in vitro sont utilisés pour détecter diverses maladies, telles que les infections par le VIH, le paludisme et l'hépatite, entre autres. La prévalence de ces maladies augmente rapidement dans le monde entier, ce qui entraîne une demande croissante de tests in vitro et de divers dispositifs médicaux. Les dispositifs médicaux étant devenus largement disponibles pour diverses maladies en raison de la fabrication rapide des entreprises de tests médicaux, il s'agit d'un facteur majeur de croissance du marché.
Opportunités
- Hausse des dépenses de santé
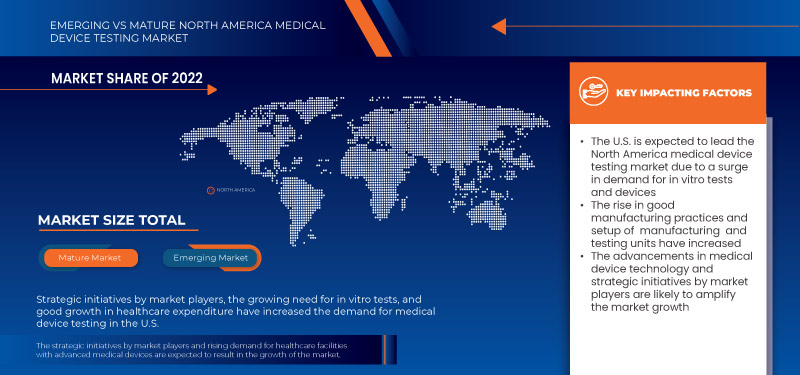
Les dépenses de santé ont augmenté dans le monde entier en raison de l'augmentation du revenu disponible dans divers pays. De plus, pour répondre aux besoins de la population, les organismes gouvernementaux et les organisations de santé prennent des initiatives pour accélérer les dépenses de santé. L'augmentation des dépenses de santé aide simultanément les établissements de santé à améliorer leurs installations de traitement pour divers troubles dans les pays.
L'augmentation des dépenses de santé est également bénéfique pour la croissance économique et la croissance du secteur de la santé. Elle est particulièrement fructueuse car elle affecte considérablement le développement de produits médicaux meilleurs et plus avancés. Par conséquent, l'augmentation des dépenses de santé constitue une opportunité plus importante pour la croissance du marché des tests de dispositifs médicaux en Amérique du Nord.
- Développement de l'IA et de l'IoT dans divers dispositifs médicaux
L’intelligence artificielle (IA) est une technologie puissante et en constante évolution qui a le potentiel d’améliorer les capacités dans une multitude de secteurs. Les dispositifs médicaux dotés d’intelligence artificielle promettent de révolutionner le secteur de la santé, en aidant les professionnels de la santé à diagnostiquer et à traiter leurs patients de manière plus précise et plus efficace et à améliorer leurs soins globaux. Outre ses avantages, l’intelligence artificielle des dispositifs médicaux est également confrontée à des défis, notamment la nécessité d’une réglementation pour suivre le rythme des avancées technologiques.
Ainsi, le marché nord-américain des tests de dispositifs médicaux connaît une série de développements dans la combinaison médicament-dispositif, la médecine personnalisée et l'adaptation élevée de divers dispositifs médicaux portables et portables. La mise en œuvre d'avancées technologiques telles que l'IoT et l'intelligence artificielle dans divers appareils est un paramètre de croissance clé pour le marché mondial des services de test de dispositifs médicaux, créant une énorme opportunité.
Défis / contraintes
- Forte concurrence dans le secteur des technologies médicales
De nombreuses entreprises mondiales sont confrontées à une concurrence importante de la part de nombreuses entreprises, notamment de grandes entreprises de fabrication de dispositifs médicaux proposant de multiples gammes de produits. Plusieurs acteurs disposent de ressources financières et marketing plus importantes que d'autres. La concurrence courante dans le domaine des soins de santé implique divers éléments tels que le prix, la qualité, la commodité et le nom de marque. La concurrence peut également être basée sur les nouvelles technologies et l'innovation. En général, la concurrence réduit les inefficacités qui, autrement, entraîneraient des coûts de production élevés, qui sont finalement répercutés sur les consommateurs par les coûts élevés des soins de santé et de la prestation. Les produits sur le marché sont commercialisés en fonction des spécifications du produit, de la cohérence du produit, de l'approvisionnement et du prix. Les consommateurs bénéficient toutefois d'une concurrence qui offre des récompenses pour les mises à niveau continues des produits et facilite un degré plus élevé d'efficacité des services parmi les acteurs du secteur. La capacité de l'entreprise à être compétitive sur le marché est également affectée par l'évolution des préférences et des exigences des consommateurs, comme la demande croissante de dispositifs médicaux plus respectueux de l'environnement qui peuvent être facilement jetés sans nuire à l'environnement et les produits dotés de capacités numériques. Cela montre une forte concurrence sur le marché, ce qui constitue un défi majeur pour le marché.
- Obstacles au développement local des dispositifs médicaux
Si la promotion des normes et le contrôle des dispositifs médicaux sont essentiels, une réglementation excessive, notamment dans le contexte national, peut également constituer un obstacle à l’innovation locale de ces dispositifs.
Elle peut potentiellement entraver l’innovation nationale en soumettant les nouvelles technologies à une procédure d’octroi de licences longue et coûteuse, ce qui augmente par la suite le coût et le temps que les fabricants locaux doivent consacrer au développement de nouveaux équipements médicaux, en plus du coût de fabrication de ces derniers. Quelques produits, qui ont une valeur significative pour les pays à faible revenu, peuvent être retirés du marché en raison des risques perçus associés à leur utilisation.
Divers facteurs, tels que les procédures d'octroi de licences, le coût de l'équipement médical et diverses autres réglementations relatives à la production de dispositifs médicaux auxquelles sont confrontés les fabricants de développement locaux, peuvent tous entraver la croissance du marché des tests de dispositifs médicaux.
Développements récents
- En avril 2021, TÜV SÜD a annoncé sa présence au Medtec LIVE pour démontrer sa capacité à être un guichet unique pour les tests de dispositifs médicaux. Les services de l'entreprise couvrent les tests de sécurité électrique et fonctionnelle, de cybersécurité et de logiciels, de CEM et de biocompatibilité. Les experts de TÜV SÜD ont participé au programme du salon et du congrès en ligne avec diverses conférences, un live hack et un pitch éclair.
- En juin 2020, Intertek a annoncé l'extension de ses services d'équipements de protection individuelle pour inclure les tests de pré-certification des respirateurs N95 conformément aux exigences fixées par le National Institute for Occupational Safety and Health (NIOSH). Les nouveaux services sont le résultat de l'accréditation réussie aux protocoles de test standard du NIOSH, conformément à la norme ISO 17025. Avec ces nouveaux services, Intertek élargit ses solutions et ses ressources pour soutenir ses clients et la communauté mondiale pendant la pandémie de COVID-19.
Portée du marché des tests de dispositifs médicaux en Amérique du Nord
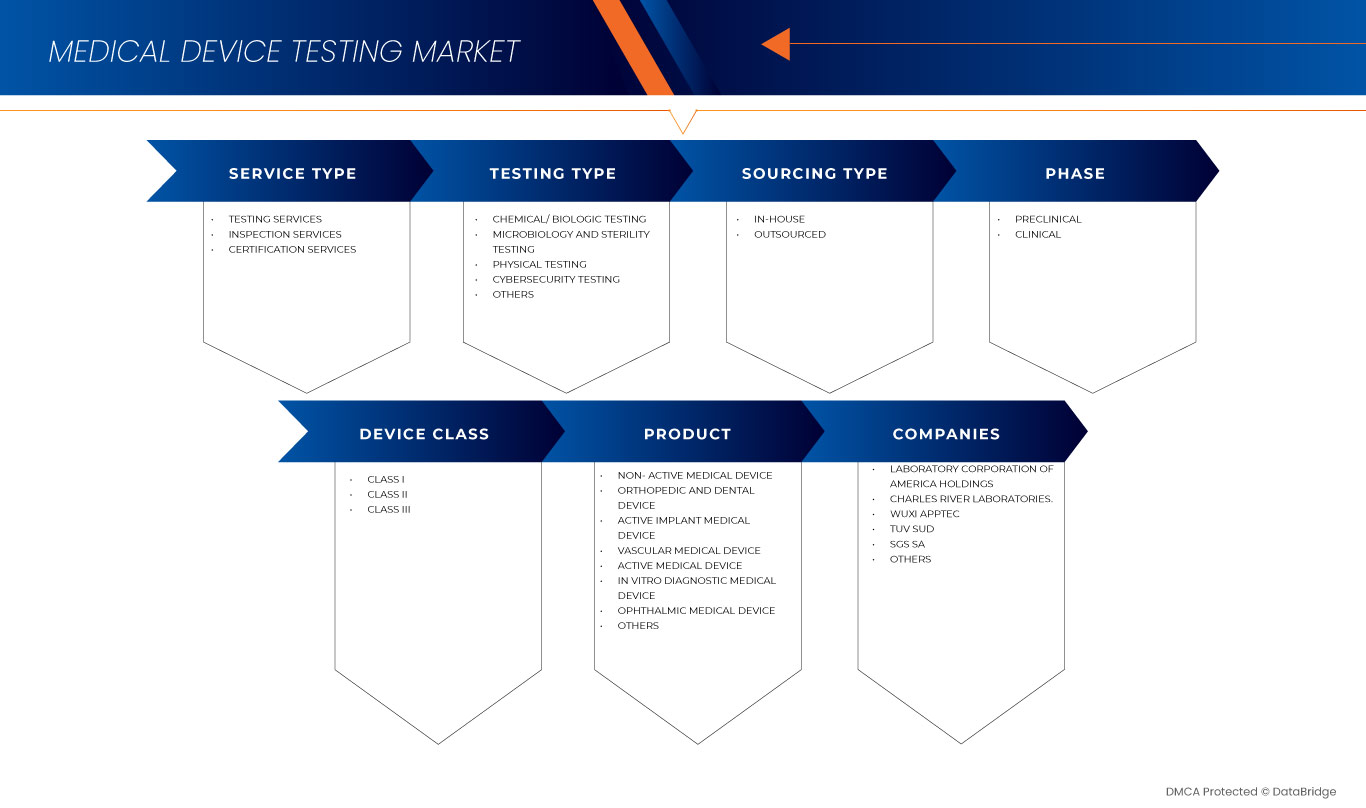
Le marché nord-américain des tests de dispositifs médicaux est segmenté en type de service, type de test, phase, type d'approvisionnement, classe de dispositifs et produit. La croissance entre les segments vous aide à analyser les niches de croissance et les stratégies pour aborder le marché et déterminer vos principaux domaines d'application et la différence entre vos marchés cibles.
Type de service
- Services de test
- Services d'inspection
- Services de certification
Sur la base du type de service, le marché nord-américain des tests de dispositifs médicaux est segmenté en services de test, services d'inspection et services de certification.
Type de test
- Tests physiques
- Tests chimiques/biologiques
- Tests de cybersécurité
- Microbiologie et tests de stérilité
- Autres
Sur la base du type de test, le marché nord-américain des tests de dispositifs médicaux est segmenté en tests physiques, tests chimiques/biologiques, tests de cybersécurité, tests de microbiologie et de stérilité, et autres.
Phase
- Préclinique
- Clinique
Sur la base de la phase, le marché nord-américain des tests de dispositifs médicaux est segmenté en préclinique et clinique.
Type d'approvisionnement
- En interne
- Externalisé
Sur la base du type d'approvisionnement, le marché nord-américain des tests de dispositifs médicaux est segmenté en interne et en externalisé.
Classe d'appareil
- Classe I
- Classe II
- Classe III
Sur la base de la classe d'appareil, le marché nord-américain des tests d'appareils médicaux est segmenté en classe I, classe II et classe III.
Produit
- Dispositif médical implantable actif
- Dispositif médical actif
- Dispositif médical non actif
- Dispositif médical de diagnostic in vitro
- Dispositif médical ophtalmique
- Dispositif médical orthopédique et dentaire
- Dispositif médical vasculaire
- Autres
Sur la base du produit, le marché nord-américain des tests de dispositifs médicaux est segmenté en dispositif médical implantable actif, dispositif médical actif, dispositif médical non actif, dispositif médical de diagnostic in vitro, dispositif médical ophtalmique, dispositif médical orthopédique et dentaire, dispositif médical vasculaire et autres.
Analyse/perspectives régionales du marché des tests de dispositifs médicaux en Amérique du Nord
Le marché nord-américain des tests de dispositifs médicaux est segmenté en type de service, type de test, phase, type d'approvisionnement, classe d'appareil et produit.
Les pays couverts dans ce rapport de marché sont les États-Unis, le Canada et le Mexique.
Les États-Unis devraient dominer le marché en raison de la forte prévalence des tests de dispositifs médicaux dans la région et de l’augmentation des dépenses de santé.
La section par pays du rapport fournit également des facteurs individuels ayant un impact sur le marché et des changements dans la réglementation sur le marché national qui ont un impact sur les tendances actuelles et futures du marché. Des points de données tels que les nouvelles ventes, les ventes de remplacement, la démographie du pays, les actes réglementaires et les tarifs d'importation et d'exportation sont quelques-uns des principaux indicateurs utilisés pour prévoir le scénario du marché pour les différents pays. En outre, la présence et la disponibilité des marques européennes et les défis auxquels elles sont confrontées en raison de la concurrence importante ou rare des marques locales et nationales, ainsi que l'impact des canaux de vente sont pris en compte lors de l'analyse prévisionnelle des données nationales.
Analyse du paysage concurrentiel et des parts de marché des tests de dispositifs médicaux en Amérique du Nord
Le paysage concurrentiel du marché des tests de dispositifs médicaux en Amérique du Nord fournit des détails par concurrent. Les détails inclus sont la présentation de l'entreprise, les finances de l'entreprise, les revenus générés, le potentiel du marché, les investissements en R&D, les nouvelles initiatives du marché, les sites et installations de production, les forces et les faiblesses de l'entreprise, le lancement de produits, les pipelines d'essais de produits, les approbations de produits, les brevets, la largeur et la portée du produit, la domination des applications, la courbe de survie technologique. Les points de données ci-dessus fournis ne concernent que l'orientation de l'entreprise vers le marché des tests de dispositifs médicaux en Amérique du Nord.
Français Certains des principaux acteurs opérant sur le marché des tests de dispositifs médicaux en Amérique du Nord sont Intertek Group plc, SGS SA, Bureau Veritas, TUV SUD, TUV Rheinland, Pace, Charles River Laboratories., Biomedical Device Labs, UL LLC, North American Science Associates, LLC, WuXi AppTec, NSF., Laboratory Corporation of America Holdings, Eurofins Scientific, NELSON LABORATORIES, LLC- A SOTERA HEALTH COMPANY, Gateway Analytical., Element Materials Technology, Hohenstein, Cigniti, Q Laboratories et IMR Test Labs, entre autres.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Table des matières
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF NORTH AMERICA MEDICAL DEVICE TESTING MARKET
1.4 LIMITATIONS
1.5 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 MARKETS COVERED
2.2 GEOGRAPHICAL SCOPE
2.3 YEARS CONSIDERED FOR THE STUDY
2.4 CURRENCY AND PRICING
2.5 DBMR TRIPOD DATA VALIDATION MODEL
2.6 MULTIVARIATE MODELLING
2.7 SERVICE TYPE LIFELINE CURVE
2.8 PRIMARY INTERVIEWS WITH KEY OPINION LEADERS
2.9 DBMR MARKET POSITION GRID
2.1 MARKET TESTING TYPE COVERAGE GRID
2.11 VENDOR SHARE ANALYSIS
2.12 SECONDARY SOURCES
2.13 ASSUMPTIONS
3 EXECUTIVE SUMMARY
4 PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTER'S FIVE FORCES
5 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: REGULATIONS
6 MARKET OVERVIEW
6.1 DRIVERS
6.1.1 RISING NEED FOR VERIFICATION VALIDATION OF MEDICAL DEVICES
6.1.2 INCREASING DEMAND FOR IN-VITRO TESTS
6.1.3 ESCALATION IN INNOVATION AND TECHNOLOGIES
6.2 RESTRAINTS
6.2.1 BARRIERS TO THE LOCAL DEVELOPMENT OF MEDICAL DEVICES
6.2.2 HIGH COST OF MEDICAL DEVICES
6.3 OPPORTUNITIES
6.3.1 RISE IN HEALTHCARE EXPENDITURE
6.3.2 DEVELOPMENT IN AI AND IOT IN VARIOUS MEDICAL DEVICES
6.3.3 STRATEGIC INITIATIVES OF KEY PLAYERS
6.4 CHALLENGES
6.4.1 HIGH COMPETITION IN MEDICAL TECHNOLOGY INDUSTRY
6.4.2 LONG LEAD TIME FOR OVERSEAS QUALIFICATION
7 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY SERVICE TYPE
7.1 OVERVIEW
7.2 TESTING SERVICES
7.3 INSPECTION SERVICES
7.4 CERTIFICATION SERVICES
8 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE
8.1 OVERVIEW
8.2 CHEMICAL/BIOLOGICAL TESTING
8.3 MICROBIOLOGY AND STERILITY TESTING
8.3.1 STERILITY TEST & VALIDATION
8.3.2 BIO BURDEN DETERMINATION
8.3.3 ANTIMICROBIAL ACTIVITY TESTING
8.3.4 PYROGEN & ENDOTOXIN TESTING
8.3.5 OTHERS
8.4 PHYSICAL TESTING
8.4.1 ELECTRICAL SAFETY TESTING
8.4.2 FUNCTIONAL SAFETY TESTING
8.4.3 EMC TESTING
8.4.4 ENVIRONMENTAL TESTING
8.4.5 OTHERS
8.5 CYBERSECURITY TESTING
8.6 OTHERS
9 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY PHASE
9.1 OVERVIEW
9.2 PRECLINICAL
9.3 CLINICAL
10 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY SOURCING TYPE
10.1 OVERVIEW
10.2 OUTSOURCED
10.3 IN-HOUSE
11 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY DEVICE CLASS
11.1 OVERVIEW
11.2 CLASS I
11.3 CLASS III
11.4 CLASS II
12 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY PRODUCT
12.1 OVERVIEW
12.2 NON-ACTIVE MEDICAL DEVICE
12.3 ORTHOPEDIC AND DENTAL MEDICAL DEVICE
12.4 ACTIVE IMPLANT MEDICAL DEVICE
12.5 VASCULAR MEDICAL DEVICE
12.6 ACTIVE MEDICAL DEVICE
12.7 IN-VITRO DIAGNOSTICS MEDICAL DEVICE
12.8 OPTHALMIC MEDICAL DEVICE
12.9 OTHERS
13 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY GEOGRAPHY
13.1 NORTH AMERICA
13.1.1 U.S.
13.1.2 CANADA
13.1.3 MEXICO
14 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: COMPANY LANDSCAPE
14.1 COMPANY SHARE ANALYSIS: NORTH AMERICA
15 SWOT ANALYSIS
16 COMPANY PROFILE
16.1 LABORATORY CORPORATION OF AMERICA HOLDINGS
16.1.1 COMPANY SNAPSHOT
16.1.2 REVENUE ANALYSIS
16.1.3 COMPANY SHARE ANALYSIS
16.1.4 PRODUCT PORTFOLIO
16.1.5 RECENT DEVELOPMENTS
16.2 CHARLES RIVER LABORATORIES.
16.2.1 COMPANY SNAPSHOT
16.2.2 REVENUE ANALYSIS
16.2.3 COMPANY SHARE ANALYSIS
16.2.4 PRODUCT PORTFOLIO
16.2.5 RECENT DEVELOPMENTS
16.3 TUV SUD
16.3.1 COMPANY SNAPSHOT
16.3.2 REVENUE ANALYSIS
16.3.3 COMPANY SHARE ANALYSIS
16.3.4 PRODUCT PORTFOLIO
16.3.5 RECENT DEVELOPMENTS
16.4 WUXI APPTEC
16.4.1 COMPANY SNAPSHOT
16.4.2 REVENUE ANALYSIS
16.4.3 COMPANY SHARE ANALYSIS
16.4.4 PRODUCT PORTFOLIO
16.4.5 RECENT DEVELOPMENTS
16.5 SGS SA
16.5.1 COMPANY SNAPSHOT
16.5.2 REVENUE ANALYSIS
16.5.3 COMPANY SHARE ANALYSIS
16.5.4 PRODUCT PORTFOLIO
16.5.5 RECENT DEVELOPMENTS
16.6 NORTH AMERICAN SCIENCE ASSOCIATES, LLC
16.6.1 COMPANY SNAPSHOT
16.6.2 PRODUCT PORTFOLIO
16.6.3 RECENT DEVELOPMENTS
16.7 HOHENSTEIN
16.7.1 COMPANY SNAPSHOT
16.7.2 PRODUCT PORTFOLIO
16.7.3 RECENT DEVELOPMENTS
16.8 BIOMEDICAL DEVICE LABS
16.8.1 COMPANY SNAPSHOT
16.8.2 PRODUCT PORTFOLIO
16.8.3 RECENT DEVELOPMENTS
16.9 BUREAU VERITAS
16.9.1 COMPANY SNAPSHOT
16.9.2 REVENUE ANALYSIS
16.9.3 PRODUCT PORTFOLIO
16.9.4 RECENT DEVELOPMENTS
16.1 CIGNITI
16.10.1 COMPANY SNAPSHOT
16.10.2 REVENUE ANALYSIS
16.10.3 PRODUCT PORTFOLIO
16.10.4 RECENT DEVELOPMENTS
16.11 ELEMENT MATERIALS TECHNOLOGY
16.11.1 COMPANY SNAPSHOT
16.11.2 PRODUCT PORTFOLIO
16.11.3 RECENT DEVELOPMENTS
16.12 EUROFINS SCIENTIFIC
16.12.1 COMPANY SNAPSHOT
16.12.2 REVENUE ANALYSIS
16.12.3 PRODUCT PORTFOLIO
16.12.4 RECENT DEVELOPMENTS
16.13 GATEWAY ANALYTICAL.
16.13.1 COMPANY SNAPSHOT
16.13.2 PRODUCT PORTFOLIO
16.13.3 RECENT DEVELOPMENTS
16.14 IMR TEST LABS
16.14.1 COMPANY SNAPSHOT
16.14.2 PRODUCT PORTFOLIO
16.14.3 RECENT DEVELOPMENTS
16.15 INTERTEK GROUP PLC
16.15.1 COMPANY SNAPSHOT
16.15.2 REVENUE ANALYSIS
16.15.3 PRODUCT PORTFOLIO
16.15.4 RECENT DEVELOPMENTS
16.16 NELSON LABORATORIES, LLC- A SOTERA HEALTH COMPANY
16.16.1 COMPANY SNAPSHOT
16.16.2 PRODUCT PORTFOLIO
16.16.3 RECENT DEVELOPMENTS
16.17 NSF.
16.17.1 COMPANY SNAPSHOT
16.17.2 PRODUCT PORTFOLIO
16.17.3 RECENT DEVELOPMENTS
16.18 PACE
16.18.1 COMPANY SNAPSHOT
16.18.2 PRODUCT PORTFOLIO
16.18.3 RECENT DEVELOPMENTS
16.19 Q LABORATORIES
16.19.1 COMPANY SNAPSHOT
16.19.2 PRODUCT PORTFOLIO
16.19.3 RECENT DEVELOPMENTS
16.2 TUV RHEINLAND
16.20.1 COMPANY SNAPSHOT
16.20.2 REVENUE ANALYSIS
16.20.3 PRODUCT PORTFOLIO
16.20.4 RECENT DEVELOPMENTS
16.21 UL LLC
16.21.1 COMPANY SNAPSHOT
16.21.2 PRODUCT PORTFOLIO
16.21.3 RECENT DEVELOPMENTS
17 QUESTIONNAIRE
18 RELATED REPORTS
Liste des tableaux
TABLE 1 FDA REGULATIONS BASED ON DEVICES TYPE
TABLE 2 PRICES OF ESSENTIAL MEDICAL DEVICES
TABLE 3 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY SERVICE TYPE, 2021-2030 (USD MILLION)
TABLE 4 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 5 NORTH AMERICA MICROBIOLOGY AND STERILITY TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 6 NORTH AMERICA PHYSICAL TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 7 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY PHASE, 2021-2030 (USD MILLION)
TABLE 8 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY SOURCING TYPE, 2021-2030 (USD MILLION)
TABLE 9 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY DEVICE CLASS, 2021-2030 (USD MILLION)
TABLE 10 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY PRODUCT, 2021-2030 (USD MILLION)
TABLE 11 NORTH AMERICA MEDICAL DEVICE TESTING MARKET, BY COUNTRY, 2021-2030 (USD MILLION)
TABLE 12 U.S. MEDICAL DEVICE TESTING MARKET, BY SERVICE TYPE, 2021-2030 (USD MILLION)
TABLE 13 U.S. MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 14 U.S. MICROBIOLOGY AND STERILITY TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 15 U.S. PHYSICAL TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 16 U.S. MEDICAL DEVICE TESTING MARKET, BY PHASE, 2021-2030 (USD MILLION)
TABLE 17 U.S. MEDICAL DEVICE TESTING MARKET, BY SOURCING TYPE, 2021-2030 (USD MILLION)
TABLE 18 U.S. MEDICAL DEVICE TESTING MARKET, BY DEVICE CLASS, 2021-2030 (USD MILLION)
TABLE 19 U.S. MEDICAL DEVICE TESTING MARKET, BY PRODUCT, 2021-2030 (USD MILLION)
TABLE 20 CANADA MEDICAL DEVICE TESTING MARKET, BY SERVICE TYPE, 2021-2030 (USD MILLION)
TABLE 21 CANADA MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 22 CANADA MICROBIOLOGY AND STERILITY TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 23 CANADA PHYSICAL TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 24 CANADA MEDICAL DEVICE TESTING MARKET, BY PHASE, 2021-2030 (USD MILLION)
TABLE 25 CANADA MEDICAL DEVICE TESTING MARKET, BY SOURCING TYPE, 2021-2030 (USD MILLION)
TABLE 26 CANADA MEDICAL DEVICE TESTING MARKET, BY DEVICE CLASS, 2021-2030 (USD MILLION)
TABLE 27 CANADA MEDICAL DEVICE TESTING MARKET, BY PRODUCT, 2021-2030 (USD MILLION)
TABLE 28 MEXICO MEDICAL DEVICE TESTING MARKET, BY SERVICE TYPE, 2021-2030 (USD MILLION)
TABLE 29 MEXICO MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 30 MEXICO MICROBIOLOGY AND STERILITY TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 31 MEXICO PHYSICAL TESTING IN MEDICAL DEVICE TESTING MARKET, BY TESTING TYPE, 2021-2030 (USD MILLION)
TABLE 32 MEXICO MEDICAL DEVICE TESTING MARKET, BY PHASE, 2021-2030 (USD MILLION)
TABLE 33 MEXICO MEDICAL DEVICE TESTING MARKET, BY SOURCING TYPE, 2021-2030 (USD MILLION)
TABLE 34 MEXICO MEDICAL DEVICE TESTING MARKET, BY DEVICE CLASS, 2021-2030 (USD MILLION)
TABLE 35 MEXICO MEDICAL DEVICE TESTING MARKET, BY PRODUCT, 2021-2030 (USD MILLION)
Liste des figures
FIGURE 1 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: SEGMENTATION
FIGURE 2 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: DATA TRIANGULATION
FIGURE 3 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: DROC ANALYSIS
FIGURE 4 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: GLOBAL VS REGIONAL MARKET ANALYSIS
FIGURE 5 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: COMPANY RESEARCH ANALYSIS
FIGURE 6 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: INTERVIEW DEMOGRAPHICS
FIGURE 7 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: DBMR MARKET POSITION GRID
FIGURE 8 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: MARKET TESTING TYPE COVERAGE GRID
FIGURE 9 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: VENDOR SHARE ANALYSIS
FIGURE 10 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: SEGMENTATION
FIGURE 11 INCREASING DEMAND FOR IN-VITRO TESTS AND DEVELOPMENT IN AI AND IOT IN VARIOUS MEDICAL DEVICES ARE EXPECTED TO DRIVE THE NORTH AMERICA MEDICAL DEVICE TESTING MARKET IN THE FORECAST PERIOD OF 2023 TO 2030
FIGURE 12 TESTING SERVICES SEGMENT IS EXPECTED TO ACCOUNT FOR THE LARGEST SHARE OF THE NORTH AMERICA MEDICAL DEVICE TESTING MARKET IN 2023 & 2030
FIGURE 13 DRIVERS, RESTRAINTS, OPPORTUNITIES, AND CHALLENGES OF GLOBAL MEDICAL DEVICE TESTING MARKET
FIGURE 14 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SERVICE TYPE, 2022
FIGURE 15 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SERVICE TYPE, 2023-2030 (USD MILLION)
FIGURE 16 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SERVICE TYPE, CAGR (2023-2030)
FIGURE 17 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SERVICE TYPE, LIFELINE CURVE
FIGURE 18 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY TESTING TYPE, 2022
FIGURE 19 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY TESTING TYPE, 2023-2030 (USD MILLION)
FIGURE 20 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY TESTING TYPE, CAGR (2023-2030)
FIGURE 21 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY TESTING TYPE, LIFELINE CURVE
FIGURE 22 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PHASE, 2022
FIGURE 23 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PHASE, 2023-2030 (USD MILLION)
FIGURE 24 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PHASE, CAGR (2023-2030)
FIGURE 25 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PHASE, LIFELINE CURVE
FIGURE 26 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SOURCING TYPE, 2022
FIGURE 27 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SOURCING TYPE, 2023-2030 (USD MILLION)
FIGURE 28 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SOURCING TYPE, CAGR (2023-2030)
FIGURE 29 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SOURCING TYPE, LIFELINE CURVE
FIGURE 30 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY DEVICE CLASS, 2022
FIGURE 31 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY DEVICE CLASS, 2023-2030 (USD MILLION)
FIGURE 32 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY DEVICE CLASS, CAGR (2023-2030)
FIGURE 33 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY DEVICE CLASS, LIFELINE CURVE
FIGURE 34 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PRODUCT, 2022
FIGURE 35 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PRODUCT, 2023-2030 (USD MILLION)
FIGURE 36 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PRODUCT, CAGR (2023-2030)
FIGURE 37 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY PRODUCT, LIFELINE CURVE
FIGURE 38 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: SNAPSHOT (2022)
FIGURE 39 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY COUNTRY (2022)
FIGURE 40 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY COUNTRY (2023 & 2030)
FIGURE 41 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY COUNTRY (2023 & 2030)
FIGURE 42 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: BY SERVICE TYPE (2023-2030)
FIGURE 43 NORTH AMERICA MEDICAL DEVICE TESTING MARKET: COMPANY SHARE 2022 (%)
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.