アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場の規模、シェア、トレンド分析レポート
Market Size in USD Billion
CAGR :
% 
 USD
1.42 Billion
USD
2.65 Billion
2024
2032
USD
1.42 Billion
USD
2.65 Billion
2024
2032
| 2025 –2032 | |
| USD 1.42 Billion | |
| USD 2.65 Billion | |
|
|
|
|
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場のセグメンテーション、タイプ別(ソフトウェアおよびサービス)、製品別(標準形式およびカスタマイズ形式)、機能別(有害事象報告ソフトウェア、医薬品安全性監査ソフトウェア、および問題追跡ソフトウェア)、配信別(オンプレミス配信モードおよびオンデマンド/クラウドベース(SAAS)配信モード)、エンドユーザー別(バイオテクノロジーおよび製薬、開発業務受託機関(CROS)、病院、KPO/BPO、およびヘルスケアプロバイダー)、流通チャネル別(直接販売および小売販売) - 2032年までの業界動向および予測
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場規模
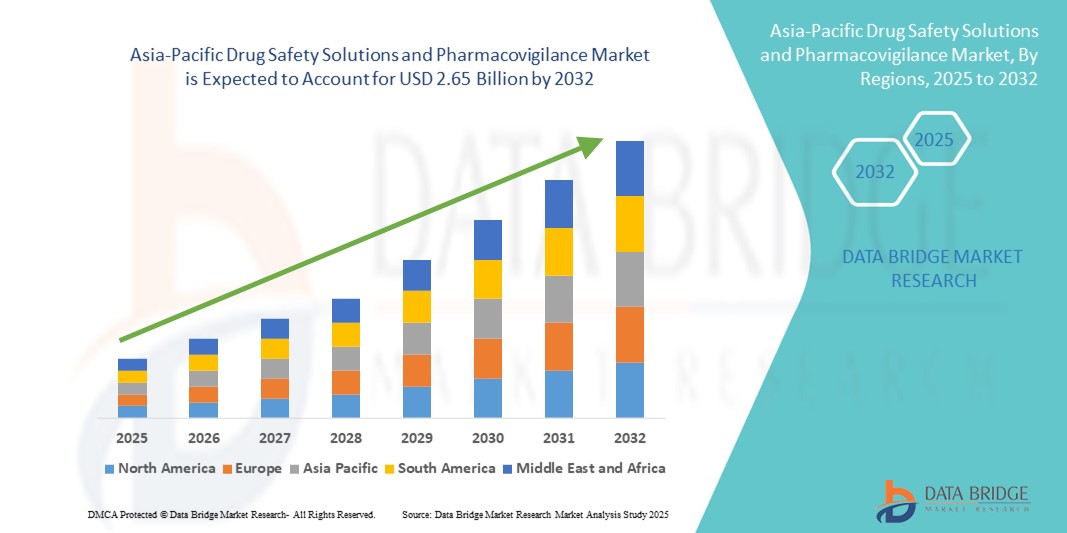
- アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場規模は、2024年に14億2000万米ドルと評価され、予測期間中に8.10%のCAGRで 成長し 、2032年には26億5000万米ドルに達すると予想されています。
- 市場の成長は、医薬品研究開発活動の増加、有害事象報告に関する規制要件の厳格化、および地域のヘルスケアおよびライフサイエンス分野全体にわたる高度な安全性監視ツールの採用拡大によって主に推進されています。
- さらに、リアルタイムの安全性データ分析に対する需要の高まりと、AIを活用した医薬品安全性監視プラットフォームへの投資の増加により、これらのソリューションは薬剤の有効性と患者の安全性を確保するための重要な要素として位置付けられています。これらの要因が相まって、市場での導入が加速し、業界の成長を大きく押し上げています。
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場分析
- 医薬品安全性ソリューションと医薬品安全性監視システムは、医薬品有害反応の検出、評価、予防を可能にし、厳格な規制要件、医薬品開発活動の拡大、リアルタイムの安全性監視の必要性の高まりにより、アジア太平洋地域の製薬およびバイオテクノロジー部門の不可欠な要素になりつつあります。
- これらのソリューションに対する需要の高まりは、主に臨床試験活動の急増、長期投薬を必要とする慢性疾患の増加、医療提供者と製造業者の間で国際的な医薬品安全基準への準拠を重視する傾向の高まりによって促進されています。
- 中国は、急速に拡大する医薬品製造基盤、大規模な患者人口、ヘルスケアのデジタル化への政府の多額の投資、AIを活用した医薬品安全性監視プラットフォームの急速な導入、社内およびアウトソーシングによる安全性監視サービスの著しい成長に支えられ、2024年にはアジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場で36.9%という最大の収益シェアを獲得して優位に立つと予測されています。
- インドは、研究開発投資の増加、規制枠組みの近代化、クラウドベースの安全性データ管理システムの利用増加により、予測期間中にアジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場の中で最も急速に成長すると予想されています。
- このソフトウェアセグメントは、拡張性、自動化機能、および既存の医療ITインフラストラクチャとのシームレスな統合による効率的な有害事象データ処理によって、2024年にアジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場で49.2%のシェアを獲得し、市場をリードしました。
レポートの範囲とアジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場のセグメンテーション
|
属性 |
アジア太平洋地域の医薬品安全性ソリューションと医薬品安全性監視の主要市場洞察 |
|
対象セグメント |
|
|
対象国 |
アジア太平洋
|
|
主要な市場プレーヤー |
|
|
市場機会 |
|
|
付加価値データ情報セット |
データブリッジマーケットリサーチがまとめた市場レポートには、市場価値、成長率、セグメンテーション、地理的範囲、主要プレーヤーなどの市場シナリオに関する洞察に加えて、専門家による詳細な分析、価格設定分析、ブランドシェア分析、消費者調査、人口統計分析、サプライチェーン分析、バリューチェーン分析、原材料/消耗品の概要、ベンダー選択基準、PESTLE分析、ポーター分析、規制の枠組みも含まれています。 |
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場の動向
AI駆動型自動化とクラウドベースの安全プラットフォーム
- アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場において、重要かつ加速しているトレンドとして、クラウドベースのプラットフォームにおける人工知能(AI)と高度な分析技術の導入が進み、有害事象の検出、報告、コンプライアンスの効率化が図られています。こうした統合により、地域全体の安全性業務のスピード、精度、拡張性が向上しています。
- 例えば、Oracle Argus SafetyとArisGlobalのLifeSphere Safetyプラットフォームは、アジア太平洋地域のいくつかの国で導入されており、AIを活用した症例処理、自動信号検出、現地の規制要件に合わせた多言語の有害事象報告機能を提供しています。
- AIの統合により、臨床試験、電子健康記録、患者登録簿から得られる膨大な構造化データと非構造化データを分析することで、予測的な安全性に関する洞察が可能になります。例えば、一部のソリューションでは、機械学習アルゴリズムを用いて、新たな安全性シグナルが重大な公衆衛生問題に発展する前に特定し、予防的な意思決定を改善しています。
- クラウド導入により、契約研究機関(CRO)や医薬品安全性監視アウトソーシングパートナーなど、地理的に分散したチームがシームレスに連携できるようになり、安全なデータ共有と、中国のNMPAやインドのCDSCOなどの当局へのリアルタイムの規制申請が可能になります。
- インテリジェントで自動化され、相互接続された安全管理システムへのこの傾向は、アジア太平洋地域の医薬品安全性監視の状況を再形成し、IQVIAやコグニザントなどの大手プロバイダーが組み込みのコンプライアンスツールを備えたAI対応サービスの提供を拡大するよう促しています。
- アジア太平洋地域の製薬会社、バイオテクノロジー企業、規制当局が患者の安全と業務効率を優先するにつれ、AI、自動化、クラウドアクセスを組み合わせたプラットフォームの需要が急速に高まっています。
アジア太平洋地域の医薬品安全性ソリューションと医薬品安全性監視市場の動向
ドライバ
規制強化と臨床試験の拡大
- アジア太平洋地域における医薬品安全規制の厳格化と臨床試験活動の急増により、高度な医薬品安全性監視ソリューションの需要が高まっています。
- 例えば、2024年2月、中国国家薬品監督管理局(NMPA)は、市販後医薬品安全性モニタリングガイドラインの改訂版を発表し、有害事象報告の迅速化と中央安全性データベースとの統合を義務付けました。こうした措置により、製薬会社は安全性インフラのアップグレードを迫られています。
- 慢性疾患治療薬、生物学的製剤、個別化医療薬の市場参入が増加しており、これらの治療法は長期的な安全性モニタリングを必要とすることが多いため、効率的な有害事象管理の必要性がさらに高まっています。
- さらに、アジア太平洋地域で研究開発拠点を拡大している世界的な製薬企業は、コンプライアンスと市場アクセスを確保するために、現地のCROと提携し、地域固有の安全システムを導入するケースが増えています。
- 規制の執行、患者数の増加、治験ネットワークの拡大により、医薬品安全システムはコンプライアンスと競争優位性の両方を維持するために不可欠となっている。
抑制/挑戦
データプライバシー規制と熟練労働力不足
- 中国の個人情報保護法(PIPL)やインドのデジタル個人データ保護法など、アジア太平洋地域における複雑かつ多様なデータプライバシー法は、国境を越えた医薬品安全性監視データ管理において大きな課題となっています。これらの規制は、多くの場合、データ保管の現地化や厳格な同意取得手続きを義務付けており、運用の複雑さを増しています。
- 例えば、多国籍企業は、各国のデータガバナンスルールを満たすために安全性データベースとワークフローを適応させる必要があり、それが導入を遅らせ、コンプライアンスコストを増加させる可能性があります。
- さらに、アジア太平洋地域の新興市場では、訓練を受けた医薬品安全性監視専門家の不足により、組織が高度な安全性業務を拡大するスピードが制限されています。専門サービスプロバイダーへのアウトソーシングはギャップを埋めるのに役立っていますが、熟練したアナリストと安全性医師の需要は供給を上回り続けています。
- AIを活用した医薬品安全性監視プラットフォームやクラウドベースの安全性ソリューションを導入するには、ソフトウェア、ハードウェア、既存のITインフラとの統合など、多額の先行投資が必要になる場合が多い。小規模な製薬会社や新興バイオテクノロジー企業は予算上の制約に直面し、導入が制限される可能性がある。
- これらの課題を克服するには、人材育成、地域データ標準の調和、そして世界と地域のコンプライアンス要件の両方を満たす柔軟なテクノロジープラットフォームの導入への戦略的な投資が必要となる。
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場の展望
市場は、タイプ、製品、機能、配信モード、エンドユーザー、流通チャネルに基づいてセグメント化されています。
- タイプ別
アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場は、種類別にソフトウェアとサービスに分類されます。ソフトウェアセグメントは、AIを活用した自動化、リアルタイムの有害事象報告、予測分析、既存の医療ITインフラとのシームレスな統合の導入拡大に牽引され、2024年には49.2%という最大の収益シェアで市場を席巻しました。製薬会社やCROは、ファーマコビジランスプロセスの合理化、規制枠組みへのコンプライアンス確保、複数の試験や市販後調査にわたる安全性データのモニタリングのための包括的なダッシュボードの提供といった点から、ソフトウェアソリューションを高く評価しています。
サービス分野は、2025年から2032年にかけて最も高い成長率を示すと予想されています。これは、医薬品安全性監視業務を専門サービスプロバイダーにアウトソーシングする傾向の高まりに支えられています。アウトソーシングにより、企業は運用コストを削減し、高度なスキルを持つ安全性専門家にアクセスし、国内外の規制要件を効率的に遵守できるようになります。サービスには、症例処理、医学的レビュー、シグナル検出、リスク管理、規制申請サポートなどがあり、アジア太平洋地域で事業を拡大する企業からの需要が高まっています。
- 製品別
アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場は、製品ベースで、標準フォーム型とカスタマイズフォーム型のソリューションに分類されます。標準フォーム型は、すぐに導入可能な性質、規制ガイドラインへの準拠、そして迅速な導入が求められる中小規模の製薬企業への適合性により、2024年には市場を席巻しました。標準ソリューションは、事前設定されたワークフロー、有害事象報告用のテンプレート、ICH-GCPなどの国際基準や各国の規制当局への準拠を提供し、導入にかかる時間とコストを削減します。
カスタマイズソリューションセグメントは、予測期間中に最も高い成長率を示すと予想されています。これは、大手製薬会社やバイオテクノロジー企業が、テーラーメイドのワークフロー、既存システムとの統合、高度なレポート形式、そして独自の臨床試験設計や治療領域に合わせた特定の機能を求めることに牽引されているからです。カスタマイズプラットフォームは、柔軟性、強化されたデータ可視化、そして複数国への規制申請に対応した専門的なレポート作成機能を提供し、複雑な医薬品安全性監視のニーズに対応します。
- 機能別
アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場は、機能別に、有害事象報告ソフトウェア、医薬品安全性監査ソフトウェア、および問題追跡ソフトウェアに分類されます。有害事象報告ソフトウェアセグメントは、規制遵守において重要な役割を担い、臨床試験および市販後調査中の有害事象のタイムリーな報告を保証することから、2024年には市場を席巻しました。このソフトウェアは、企業が症例の受付、トリアージ、評価、報告を標準化し、人的ミスを最小限に抑えるのに役立ちます。
医薬品安全性監査および問題追跡ソフトウェア分野は、規制当局による監視の強化、積極的なリスク特定の必要性、そして医薬品開発・商業化における品質保証の高まりを背景に、最も急速な成長が見込まれています。これらのソリューションは、コンプライアンス状況の継続的な監視、安全性プロセスにおけるギャップの特定、そしてフォローアップ活動の構造化された追跡を可能にし、患者の安全性向上と規制リスクの軽減を実現します。
- 配送方法別
アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場は、提供形態に基づいて、オンプレミス型とオンデマンド/クラウドベース(SaaS)型の2つの提供形態に分類されます。2024年には、スケーラブルで安全かつ費用対効果の高いファーマコビジランス業務を実現するクラウドインフラの導入拡大に支えられ、オンデマンド/クラウドベース型セグメントが市場を牽引しました。クラウドプラットフォームは、地理的に分散したチーム間のリアルタイムコラボレーションを可能にし、規制当局への申請を迅速化し、社内IT保守やインフラ投資の必要性を軽減します。
オンプレミス型デリバリーは、予測期間中、特に厳格なデータプライバシーとローカリゼーション要件を持つ組織や地域において、最も急速に成長すると予想されています。オンプレミス型ソリューションは、機密性の高い安全性データに対する高度な管理、社内カスタマイズの実現、現地法へのコンプライアンス対応を可能にするため、複数の管轄区域で事業を展開する大手製薬会社や多国籍企業に適しています。
- エンドユーザー別
アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場は、エンドユーザーに基づいて、バイオテクノロジーおよび医薬品、開発業務受託機関(CRO)、病院、KPO/BPO、および医療提供者に分類されます。2024年には、臨床試験の件数の増加、広範な市販後調査、そして堅牢な安全性監視システムを必要とする厳格な規制遵守義務により、バイオテクノロジーおよび医薬品セグメントが市場を牽引しました。
CROと病院セグメントは、アウトソーシングされた臨床安全性モニタリングの管理、多施設試験のサポート、病院ベースの有害事象報告システムの導入など、ファーマコビジランスソリューションの導入が進むことから、最も急速な成長が見込まれます。専門サービスへの需要の高まりと、アジア太平洋地域における臨床研究活動の拡大が相まって、これらのエンドユーザーによる導入が加速しています。
- 流通チャネル別
アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場は、流通チャネルに基づいて、直接販売と小売販売に分類されます。2024年には、製薬会社、CRO、医療機関との長期契約による継続的なサポート、ソフトウェアアップデート、トレーニング、コンプライアンス支援が牽引する直接販売セグメントが市場を牽引しました。
小売販売セグメントは、特に標準化されたソフトウェアパッケージやクラウドベースのソリューションにおいて、最も高い成長率で成長すると予想されています。これは、小規模企業がオンラインマーケットプレイスや正規代理店を通じて、すぐに導入可能な製品を調達するケースが増えているためです。小売チャネルは、医薬品安全性監視ツールへの費用対効果の高い迅速なアクセスを提供し、新興バイオテクノロジー企業や小規模医療機関における導入拡大を促進します。
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場の地域分析
- 中国は、急速に拡大する医薬品製造基盤、大規模な患者人口、医療デジタル化への多額の政府投資に支えられ、2024年にはアジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場で36.9%という最大の収益シェアを獲得して優位に立つだろう。
- 同地域の製薬会社や医療機関は、リアルタイムの安全性モニタリング、有害事象報告の自動化、そして既存のITインフラとのソフトウェアソリューションのシームレスな統合を高く評価しています。これにより、規制当局への申請の迅速化、積極的なリスク管理、そして患者安全性の向上が実現します。
- デジタルヘルスインフラの促進を目的とした政府の取り組み、研究開発投資の増加、医薬品安全性要件への意識の高まりも、この広範な導入を後押ししています。これらの要因が相まって、アジア太平洋地域におけるバイオテクノロジー企業、製薬企業、CRO、病院、その他の医療提供者にとって、ファーマコビジランスソリューションは重要なツールとしての地位を確立しています。
中国医薬品安全性ソリューション市場洞察
中国の医薬品安全性ソリューションおよびファーマコビジランス市場は、急速に拡大する医薬品製造セクター、膨大な患者数、そして臨床試験活動の増加に支えられ、2024年にはアジア太平洋地域において最大の収益シェア(36.9%)を獲得しました。中国国家薬品監督管理局(NMPA)による規制要件の強化と、AIを活用したファーマコビジランス・プラットフォームの導入が市場の成長を牽引しています。製薬会社とCROは、コンプライアンスの確保と患者安全性の向上のため、リアルタイムの有害事象報告、自動安全性モニタリング、クラウドベースのソリューションを優先的に採用しています。
日本医薬品安全性ソリューション市場インサイト
日本の医薬品安全性ソリューションおよびファーマコビジランス市場は、高度な医療インフラ、規制遵守への注力、そしてデジタルヘルス技術の導入拡大により、勢いを増しています。日本では、臨床試験や市販後調査の管理に、AIを活用したクラウドベースのファーマコビジランス・プラットフォームを活用する企業がますます増えています。患者の安全性への重点と厳格な報告要件が相まって、バイオテクノロジー企業、製薬企業、そして病院における導入が進んでいます。
インドの医薬品安全性ソリューション市場に関する洞察
インドの医薬品安全性ソリューションおよびファーマコビジランス市場は、臨床試験活動の増加、製薬業界の拡大、そしてデジタルヘルスケアシステムを推進する政府の取り組みに牽引され、2024年にはアジア太平洋地域で最も急速に収益が成長する市場の一つとなりました。CROおよびKPOへのファーマコビジランスサービスのアウトソーシングの増加と、費用対効果の高いクラウドベースソリューションの導入拡大が市場の成長を牽引しています。熟練した専門家の豊富な人材プールと、スマートでデータ主導型の安全性モニタリングソリューションへの動きが、市場の成長をさらに後押ししています。
オーストラリアの医薬品安全性ソリューション市場に関する洞察
オーストラリアの医薬品安全性ソリューションおよびファーマコビジランス市場は、バイオテクノロジーおよび医薬品研究活動の拡大、市販後調査への関心の高まり、そしてTGA(医薬品行政局)ガイドラインの遵守に支えられ、着実な成長を遂げています。病院、CRO、医療機関では、有害事象報告の効率化と患者安全性モニタリングの強化を目的として、クラウドベースの安全性プラットフォームとサービスの導入がますます進んでいます。
韓国の医薬品安全性ソリューション市場に関する洞察
韓国の医薬品安全性ソリューションおよびファーマコビジランス市場は、テクノロジーの導入、強力な研究開発投資、そして政府による患者安全への注力に後押しされ、高い年平均成長率(CAGR)で成長すると予想されています。ファーマコビジランスワークフローへのAIと自動化の統合、そして有害事象の電子報告に関する規制の義務化は、製薬会社やCROにおける導入を促進しています。
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場シェア
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視業界は、主に、次のような定評のある企業によって主導されています。
- クリンクエスト グループ BV (オランダ)
- テイクソリューションズリミテッド(インド)
- ウィプロ・リミテッド(インド)
- 復星医薬(中国)
- シノファーム(中国)
- シノバック・バイオテック(中国)
- ALTEOGEN Inc.(韓国)
- ANB Laboratories Co., Ltd.(韓国)
- バイオファームケミカルズ株式会社(タイ)
- ベーリンガーインゲルハイムインターナショナルGmbH(ドイツ)
- アクセンチュア(アイルランド)
- ブリストル・マイヤーズ スクイブ社(米国)
- ラボコープ(米国)
- ICON plc(アイルランド)
- パレクセル・インターナショナル(MA)コーポレーション(米国)
- ユナイテッド・バイオソースLLC(米国)
- コグニザント(米国)
アジア太平洋地域の医薬品安全性ソリューションおよび医薬品安全性監視市場の最近の動向は何ですか?
- セルタ・スクエアは2025年8月、医薬品安全性監視プロセスの自動化と管理のため、包括的な安全性プラットフォームであるOracle Argus Safetyを導入しました。この導入により、アジア太平洋地域全体の製薬企業のコンプライアンス、リスク評価、拡張性が向上することが期待されます。
- 2025年7月、EVERSANAは医薬品安全性ワークフローを効率化するために設計されたAI駆動型ソリューション、EVERSANA ORCHESTRATE PVを発表しました。このプラットフォームは、人工知能を活用して医薬品安全性監視プロセスのスピード、精度、品質を向上させ、アジア太平洋地域における医薬品安全性モニタリングの未来を形作ることを目的としています。
- サザン・スター・リサーチは2025年7月、医薬品安全性プロセスの強化を目的としてOracle Argus Safetyを導入しました。この導入は、研究件数の増加に伴い、臨床能力の向上と、信頼性とコンプライアンスを確保した安全性・医療モニタリングシステムの確保を目指す同社のコミットメントを反映しています。
- 2025年5月、オーストラリア医薬品行政局(TGA)は、国際的な臨床試験および医薬品安全性監視ガイドライン案について一般からの意見を募集しました。この取り組みは、オーストラリアが自国の規制慣行を国際基準に整合させ、医薬品の安全性と有効性を確保するというコミットメントを反映しています。TGAの取り組みは、アジア太平洋地域における臨床試験および市販後調査における協力と調和の強化を目指しています。
- 2021年7月、オーストラリア医薬品行政局(TGA)は「国際連携戦略2021-2025」を発表しました。この戦略は、国際的な規制当局と協力し、よりグローバルに整合した規制枠組みを構築することに重点を置いています。TGAの優先事項には、グローバルな政策整合、市販前および市販後のグローバルモニタリング、そして地域的な規制能力の強化が含まれます。
SKU-
世界初のマーケットインテリジェンスクラウドに関するレポートにオンラインでアクセスする
- インタラクティブなデータ分析ダッシュボード
- 成長の可能性が高い機会のための企業分析ダッシュボード
- カスタマイズとクエリのためのリサーチアナリストアクセス
- インタラクティブなダッシュボードによる競合分析
- 最新ニュース、更新情報、トレンド分析
- 包括的な競合追跡のためのベンチマーク分析のパワーを活用
調査方法
データ収集と基準年分析は、大規模なサンプル サイズのデータ収集モジュールを使用して行われます。この段階では、さまざまなソースと戦略を通じて市場情報または関連データを取得します。過去に取得したすべてのデータを事前に調査および計画することも含まれます。また、さまざまな情報ソース間で見られる情報の不一致の調査も含まれます。市場データは、市場統計モデルと一貫性モデルを使用して分析および推定されます。また、市場シェア分析と主要トレンド分析は、市場レポートの主要な成功要因です。詳細については、アナリストへの電話をリクエストするか、お問い合わせをドロップダウンしてください。
DBMR 調査チームが使用する主要な調査方法は、データ マイニング、データ変数が市場に与える影響の分析、および一次 (業界の専門家) 検証を含むデータ三角測量です。データ モデルには、ベンダー ポジショニング グリッド、市場タイムライン分析、市場概要とガイド、企業ポジショニング グリッド、特許分析、価格分析、企業市場シェア分析、測定基準、グローバルと地域、ベンダー シェア分析が含まれます。調査方法について詳しくは、お問い合わせフォームから当社の業界専門家にご相談ください。
カスタマイズ可能
Data Bridge Market Research は、高度な形成的調査のリーダーです。当社は、既存および新規のお客様に、お客様の目標に合致し、それに適したデータと分析を提供することに誇りを持っています。レポートは、対象ブランドの価格動向分析、追加国の市場理解 (国のリストをお問い合わせください)、臨床試験結果データ、文献レビュー、リファービッシュ市場および製品ベース分析を含めるようにカスタマイズできます。対象競合他社の市場分析は、技術ベースの分析から市場ポートフォリオ戦略まで分析できます。必要な競合他社のデータを、必要な形式とデータ スタイルでいくつでも追加できます。当社のアナリスト チームは、粗い生の Excel ファイル ピボット テーブル (ファクト ブック) でデータを提供したり、レポートで利用可能なデータ セットからプレゼンテーションを作成するお手伝いをしたりすることもできます。