アジア太平洋地域におけるコンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)の規模、シェア、トレンド分析レポート
Market Size in USD Billion
CAGR :
% 
 USD
130.00 Million
USD
403.24 Million
2025
2033
USD
130.00 Million
USD
403.24 Million
2025
2033
| 2026 –2033 | |
| USD 130.00 Million | |
| USD 403.24 Million | |
|
|
|
|
アジア太平洋地域におけるコンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)のセグメンテーション、製品別(オンプレミスソリューション、クラウドベースソリューション、ウェブベースソリューション)、アプローチ別(臨床医報告アウトカム評価(ClinRO)、患者報告アウトカム評価(PRO)、観察者報告アウトカム評価(ObsRO)、パフォーマンスアウトカム評価(PerfO))、エンドユーザー別(商業サービスプロバイダー、病院および移植センター、研究機関、学術機関)、プラットフォーム別(開発業務委託機関、製薬会社およびバイオ医薬品会社、医療機器メーカー、病院および臨床検査機関、コンサルティングサービス会社、研究機関および学術機関、その他) - 2033年までの業界動向と予測
アジア太平洋地域のコンテンツライセンス市場規模における電子臨床アウトカム評価(eCOA)
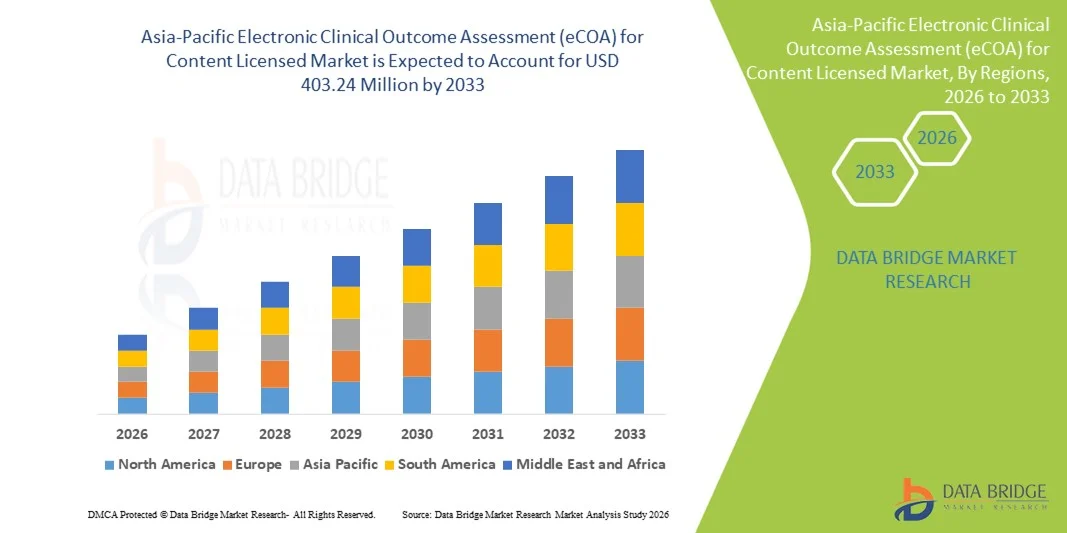
- アジア太平洋地域のコンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の規模は、2025年に1億3,000万米ドルと評価され、予測期間中に15.2%のCAGRで成長し、2033年には4億324万米ドル に達すると予想されています 。
- 市場の成長は、臨床試験におけるデジタルヘルス技術の導入拡大、電子データ収集に対する規制当局の奨励、そして患者中心の遠隔アウトカムモニタリングソリューションに対する需要の高まりによって大きく促進されています。これらの傾向により、臨床研究のスポンサーとCROは、従来の紙ベースの方法からリアルタイムのデジタルアウトカム評価プラットフォームへの移行を迫られています。
- さらに、アジア太平洋地域の主要市場における臨床試験活動の急速な拡大、クラウド/モバイルeCOAプラットフォームへの投資の増加、そしてデータの正確性、コンプライアンス、そしてより広範なeClinicalシステムとの統合への強い関心が、eCOAの導入を加速させています。これらの要因が重なり、eCOAは現代の臨床研究インフラに不可欠な要素として位置づけられ、業界の成長を大きく促進しています。
アジア太平洋地域におけるコンテンツライセンス市場分析のための電子臨床アウトカム評価(eCOA)
- 患者報告アウトカム、臨床医報告アウトカム、観察者報告アウトカムを捕捉するためのデジタルプラットフォームを提供する電子臨床アウトカム評価(eCOA)ソリューションは、データの精度を向上させ、リアルタイムモニタリングを可能にし、より広範なeClinicalシステムとシームレスに統合できるため、製薬業界と医療機器業界の両方の臨床試験で不可欠なツールになりつつあります。
- eCOAの採用拡大は、主に患者中心の臨床試験への注目の高まり、電子データ収集の規制当局による奨励、そしてコンプライアンスとエンゲージメントを強化しながら施設訪問を最小限に抑える遠隔および分散型の試験ソリューションの需要の高まりによって推進されています。
- 2025年のアジア太平洋地域におけるコンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)では、日本が38.5%という最大の収益シェアで市場を席巻しました。その特徴は、先進的なデジタルヘルスケアインフラ、進行中の臨床試験の多さ、そして統合型eCOAプラットフォームを提供する大手テクノロジープロバイダーの存在です。
- 中国は、臨床試験活動の増加、モバイルおよびクラウドベースのプラットフォームへの投資の増加、電子データ収集に対する規制支援の拡大、患者中心のデジタルソリューションの採用の増加により、予測期間中に市場で最も急速に成長する国になると予想されています。
- 患者報告アウトカム(PRO)セグメントは、リアルタイムの患者フィードバックの収集、規制基準への準拠の確保、試験スポンサーへの実用的な洞察の提供という重要な役割により、2025年にアジア太平洋のコンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の45.2%の市場シェアを占め、市場を支配しました。
報告書の範囲とアジア太平洋地域のコンテンツライセンス市場セグメンテーションのための電子臨床アウトカム評価(eCOA)
|
属性 |
アジア太平洋地域の電子臨床アウトカム評価(eCOA)コンテンツライセンスの主要市場インサイト |
|
対象セグメント |
|
|
対象国 |
アジア太平洋
|
|
主要な市場プレーヤー |
|
|
市場機会 |
|
|
付加価値データ情報セット |
データブリッジマーケットリサーチがまとめた市場レポートには、市場価値、成長率、セグメンテーション、地理的範囲、主要プレーヤーなどの市場シナリオに関する洞察に加えて、専門家による詳細な分析、患者の疫学、パイプライン分析、価格分析、規制の枠組みも含まれています。 |
アジア太平洋地域におけるコンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)の動向
患者中心の試験のためのデジタルとモバイルの統合
- アジア太平洋地域のeCOAコンテンツライセンス市場における重要かつ加速的なトレンドは、モバイルデバイス、クラウドプラットフォーム、患者向けアプリの統合であり、患者のエンゲージメントと治験の遵守を強化しながら、臨床結果をリアルタイムで収集することを可能にします。
- 例えば、Medidata eCOA Mobileなどのプラットフォームでは、患者がスマートフォンやタブレットを介してPROと臨床医が報告したアウトカムを提出することができ、シームレスなリモートデータキャプチャとコンプライアンスの向上が可能になります。
- デジタルおよびモバイルプラットフォームを電子医療記録(EHR)やより広範なeClinicalシステムと統合することで、リアルタイムのデータモニタリング、エラー削減、そして効率的な規制報告が可能になります。例えば、スポンサーは患者の反応を即座に追跡し、必要に応じてプロトコルを調整することができます。
- 継続的な患者モニタリングのためのウェアラブルデバイスやセンサーの導入が拡大し、eCOAプラットフォームが補完され、主観的な結果とともに高頻度の客観的なデータを収集できるようになり、患者の健康状態をより総合的に把握できるようになります。
- より統合され、患者に優しく、リアルタイムのデジタルアウトカム評価へのこの傾向は、臨床試験プロセスを根本的に変革しています。例えば、CRF HealthやERTなどの企業は、患者のコンプライアンス向上のために、カスタマイズ可能なインターフェースと自動リマインダーを備えたモバイル対応のeCOAソリューションを開発しています。
- スポンサーが効率的で正確、かつ患者中心のデータ収集を優先するにつれ、デジタル、モバイル、クラウド統合型のeCOAプラットフォームの需要は医薬品試験と医療機器試験の両方で急速に高まっています。
- アジア太平洋諸国の多様な患者層をサポートするため、多言語対応かつ文化に適応したeCOAインターフェースの利用が広がっています。例えば、コンプライアンスとデータ品質の向上のため、プラットフォームには現地語や文化に配慮した質問形式が採用されています。
アジア太平洋地域におけるコンテンツライセンス市場の動向に関する電子臨床アウトカム評価(eCOA)
ドライバ
患者中心型および遠隔臨床試験の需要の高まり
- 患者中心の試験への関心の高まりと、分散型およびハイブリッド型の臨床試験への移行は、アジア太平洋地域のeCOAコンテンツライセンス市場の主要な推進力となっています。
- 例えば、2025年にメドリオはインドと中国での遠隔試験用に設計されたeCOAモジュールをリリースし、スポンサーが頻繁に施設を訪問することなく結果を取得できるようにしました。
- 治験スポンサーは患者の関与とコンプライアンスの向上を目指しており、eCOAプラットフォームはリアルタイムのモニタリング、アラート、リマインダーを提供し、欠落データを削減し、治験全体の品質を向上させます。
- さらに、臨床研究施設全体でデジタル技術やモバイル技術の導入が進むにつれ、eCOAソリューションが好まれる選択肢となり、他のeClinicalツールやデータシステムとのシームレスな統合が可能になっています。
- スマートフォンやタブレットを通じて患者報告アウトカム、臨床医報告アウトカム、観察者報告アウトカムを遠隔で取得する機能は、医薬品試験と医療機器試験の両方で導入を加速させる重要な要素です。
- アジア太平洋地域におけるハイブリッド試験および分散型試験の拡大と、電子データ収集に対する規制当局の奨励の増加が相まって、eCOAソリューションの堅調な成長をさらに後押ししています。
- アジア太平洋地域の臨床試験への多国籍製薬企業による投資の増加により、拡張性と標準化されたeCOAプラットフォームの需要が高まっています。例えば、スポンサーは効率性とコンプライアンスを向上させるために、複数の国にまたがる統合プラットフォームを導入しています。
- データに基づく意思決定と臨床試験のタイムラインの迅速化への関心が高まるにつれ、治験依頼者は即時の分析とレポートを提供するeCOAソリューションの導入を促しています。例えば、リアルタイムダッシュボードを利用することで、治験マネージャーは患者の反応をモニタリングし、プロトコルを積極的に調整することができます。
抑制/挑戦
データプライバシーの懸念と規制遵守のハードル
- 患者データのセキュリティ、プライバシー、規制遵守に関する懸念は、アジア太平洋地域におけるeCOAプラットフォームの普及に大きな課題をもたらしています。
- 例えば、電子医療データ漏洩の注目を集めた報告により、一部のスポンサーや患者は遠隔デジタルデータ収集に慎重になっている。
- 日本の個人情報保護法(APPI)や中国の個人情報保護法(PIPL)などの地域規制への準拠を確保するには、堅牢な暗号化、安全な認証、検証済みのソフトウェアが必要であり、実装が複雑でコストがかかる可能性があります。
- さらに、アジア太平洋諸国間の規制基準や要件の違いにより、プラットフォームの展開と導入が遅れ、追加のローカライズと検証の取り組みが必要になる可能性があります。
- クラウドおよびモバイルのeCOAプラットフォームは利便性と効率性を向上させる一方で、サイバーセキュリティ侵害やコンプライアンス違反のリスクが認識されており、特にITリソースが限られている小規模なスポンサーやCROの間では導入が妨げられる可能性があります。
- 強力なデータセキュリティ対策、規制ガイダンスの遵守、コンプライアンス慣行の明確なコミュニケーションを通じてこれらの課題を克服することは、持続的な市場成長にとって不可欠です。
- アジア太平洋地域の一部の国では、小規模な臨床施設における技術的専門知識やインフラの不足が、高度なeCOAソリューションの導入を遅らせる要因となっています。例えば、クラウドベースまたはモバイルeCOAシステムを効率的に導入するためのITサポートが不足している場合があります。
- 患者のデジタルリテラシーのばらつきも障壁となり得ます。参加者の中には、モバイルやウェブベースのプラットフォームを使いこなすのに苦労する人もいるからです。例えば、スポンサーは、正確かつ完全なデータ収集を確実に行うために、トレーニングや直感的なインターフェースを提供する必要があります。
アジア太平洋コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の範囲
市場は、製品、アプローチ、エンドユーザー、プラットフォームに基づいてセグメント化されています。
- 製品別
製品ベースで、アジア太平洋地域のコンテンツライセンス市場向けeCOAは、オンプレミスソリューション、クラウドベースソリューション、Webベースソリューションに分類されます。クラウドベースソリューションは、柔軟性、拡張性、そして複数施設にまたがる遠隔臨床試験をサポートする能力により、2025年には最大の収益シェアを獲得し、市場を席巻しました。治験依頼者は、個々の施設に大規模なITインフラを必要とせずに、患者報告アウトカム(PRO)、臨床医報告アウトカム(ClinRO)、その他のeCOAデータにリアルタイムでアクセスできるクラウドプラットフォームをますます好んでいます。クラウドベースソリューションは、他のeClinicalシステムとの統合を容易にし、データの矛盾を減らし、分析を加速させます。分散型試験における電子データキャプチャに対する規制当局の承認も、その導入を後押ししています。モバイルデバイス、タブレット、ウェアラブルデバイスをサポートすることで、患者のエンゲージメントとコンプライアンスが向上します。また、クラウドソリューションは、シームレスなソフトウェアアップデートと試験データの一元管理を可能にし、治験依頼者の運用コストを削減します。
ウェブベースのソリューションは、重いソフトウェアのインストールを必要としないブラウザアクセス可能なプラットフォームへの需要の高まりを背景に、2026年から2033年にかけて最も急速な成長が見込まれています。ウェブベースのeCOAツールにより、治験実施施設と患者はインターネット接続があればあらゆるデバイスからデータを入力できるため、分散型試験への参加が容易になります。特に、費用対効果が高く拡張性の高いソリューションを求める学術機関や小規模研究機関にとって、ウェブベースのソリューションは魅力的です。また、ウェブベースのソリューションは、アジア太平洋地域の複数の国にまたがる試験に不可欠な、多言語対応かつ文化に適応したインターフェースもサポートしています。使いやすさ、メンテナンスの容易さ、そして様々なオペレーティングシステムとの互換性が、導入の大きな要因となっています。治験実施施設への訪問とリモートデータ取得を組み合わせたハイブリッド試験の需要が高まっていることも、ウェブベースのソリューションの普及をさらに加速させています。
- アプローチ別
アプローチに基づいて、市場は臨床医報告アウトカム評価(ClinRO)、患者報告アウトカム評価(PRO)、観察者報告アウトカム評価(ObsRO)、およびパフォーマンスアウトカム評価(PerfO)に分類されます。患者中心の臨床試験の重要性の高まりを背景に、患者報告アウトカム評価(PRO)は2025年に45.2%という最大の収益シェアで市場を席巻しました。PROプラットフォームは、患者が症状、生活の質、治療への反応を直接報告することを可能にし、スポンサーに真正でリアルタイムの洞察を提供します。モバイルおよびクラウド対応のPROプラットフォームの採用により、特に分散型試験やハイブリッド試験において、コンプライアンスが強化され、欠落データが減少しました。日本のPMDAや中国のNMPAなどの規制当局は、正確なエンドポイントを得るために電子的なPROデータ収集をますます推奨しています。PROソリューションは、リアルタイムのモニタリングと自動アラートも可能にし、臨床チームが有害事象やコンプライアンス違反に迅速に対応できるようにします。彼らの優位性は、患者のフィードバックが重要となる腫瘍学、神経学、慢性疾患などの治療分野における需要の増加によって支えられています。
観察者報告アウトカム評価(ObsRO)は、2026年から2033年にかけて、特に小児、高齢者、希少疾患の臨床試験において最も急速な成長が見込まれています。ObsROプラットフォームは、患者が自己報告できない場合でも、介護者や試験スタッフが患者のアウトカムを報告できるようにすることで、包括的かつ正確なデータ収集を保証します。遠隔モニタリングやモバイル対応プラットフォームの普及により、ObsROの採用が増加し、観察者がリアルタイムでデータを提出することが容易になりました。また、脆弱な患者集団を試験に含めることの重要性が規制当局によって強調されていることも、ObsROソリューションの普及を後押ししています。臨床試験の複雑化と複数ソースのデータ検証の必要性が、ObsROの普及をさらに促進しています。PROやClinROなどの他のeCOAアプローチとの統合により、データ品質が向上し、スポンサーに包括的な洞察が提供されます。
- エンドユーザー別
エンドユーザーに基づいて、市場は商用サービスプロバイダー、病院および移植センター、研究機関、学術機関に分類されます。商用サービスプロバイダーは、複数のスポンサーと試験にスケーラブルで検証済みのeCOAソリューションを提供する専門知識により、2025年に最大の収益シェアで市場を支配しました。これらのプロバイダーは、ソフトウェアの導入、トレーニング、技術サポート、規制遵守ガイダンスを含むエンドツーエンドのサービスを提供しています。彼らの優位性は、複雑な分散型試験の管理に商用プロバイダーを好む製薬会社とバイオテクノロジー企業の間でアウトソーシングの傾向が高まっていることによってさらに支えられています。クラウドベースの導入とリアルタイムモニタリングサービスは、効率性と患者のコンプライアンスを向上させます。商用サービスプロバイダーは、治療領域、研究規模、地域の規制に合わせてカスタマイズ可能なソリューションも提供しているため、多国籍試験の好ましい選択肢となっています。他のeClinicalプラットフォームと統合できるため、一元的なデータ管理とより迅速な試験タイムラインが保証されます。
学術機関は、アジア太平洋地域の大学や教育病院における臨床研究活動の増加に支えられ、2026年から2033年にかけて最も急速な成長を遂げると予想されています。これらの機関は、研究プロトコル、患者エンゲージメント、そして規制遵守をサポートする、費用対効果が高く柔軟なeCOAソリューションを必要としています。Webベースおよびモバイル対応のeCOAプラットフォームの導入は、多施設共同試験や共同研究への参加を容易にします。学術機関のエンドユーザーは、研究目的でデータの匿名化と安全な共有をサポートするプラットフォームの恩恵も受けます。インド、中国、日本などの国々では、政府による資金援助の増加や臨床研究のデジタル化への取り組みが、これらの導入をさらに加速させています。学術出版物におけるリアルタイムのレポート作成とアウトカム分析のニーズも、このセグメントの成長を牽引しています。
- プラットフォーム別
プラットフォームに基づいて、市場は開発業務受託機関(CRO)、製薬・バイオ医薬品企業、医療機器メーカー、病院・臨床検査室、コンサルティングサービス企業、研究・学術機関、その他に分類されます。開発業務受託機関(CRO)は、集中管理された検証済みのeCOAシステムを用いて、多様な地域にまたがる複数の臨床試験を管理する能力に牽引され、2025年には最大の収益シェアで市場を席巻しました。CROは、システム設定、トレーニング、コンプライアンス監査など、技術的および規制上の複雑な業務をアウトソーシングできるという利点をスポンサーに提供します。CROのクラウドベースのプラットフォームは、臨床結果データへのリアルタイムアクセスを可能にし、モニタリングの改善と意思決定の迅速化を実現します。CROはまた、AIを活用した分析を活用して傾向を特定し、患者のコンプライアンスを監視し、不一致をフラグ付けします。アジア太平洋地域で大規模試験を実施している製薬企業やバイオテクノロジー企業との強力なパートナーシップによって、CROの優位性は強化されています。CRO間で標準化されたeCOAプラットフォームは、複数国への規制申請も容易にします。
製薬会社およびバイオ医薬品会社は、臨床試験の効率化と患者中心のデータ収集の改善を目的として、自社製のeCOAプラットフォームを導入する企業が増えているため、2026年から2033年にかけて最も急速な成長が見込まれています。直接導入することで、スポンサーはデータの整合性とコンプライアンスを維持しながら、サードパーティのサービスプロバイダーへの依存を減らすことができます。この成長は、ハイブリッド型および分散型の試験モデルをサポートするモバイルおよびクラウドベースのソリューションへの投資増加によって促進されています。企業はまた、試験期間の短縮、患者エンゲージメントの強化、電子データ収集に関する規制要件の遵守のために、eCOAプラットフォームを活用しています。EHRや検査データ管理などの他のデジタルシステムとの統合により、製薬会社およびバイオテクノロジー企業におけるeCOAの導入がさらに加速します。
アジア太平洋地域におけるコンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)地域分析
- 2025年のアジア太平洋地域におけるコンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)では、日本が38.5%という最大の収益シェアで市場を席巻しました。その特徴は、先進的なデジタルヘルスケアインフラ、進行中の臨床試験の多さ、そして統合型eCOAプラットフォームを提供する大手テクノロジープロバイダーの存在です。
- 日本のスポンサーと臨床施設は、eCOAプラットフォームが提供する効率性、リアルタイムモニタリング、規制準拠の機能を高く評価しており、患者、臨床医、観察者から報告されたアウトカムを正確かつタイムリーに収集できます。
- この広範な採用は、確立された臨床研究ネットワーク、デジタルヘルス技術に対する政府の支援の増加、分散型およびハイブリッド試験モデルに対する製薬会社およびバイオ医薬品会社の関心の高まりによってさらにサポートされ、eCOAは臨床結果の取得のための優先ソリューションとして確立されています。
日本におけるコンテンツライセンス市場インサイトのための電子臨床アウトカム評価(eCOA)
日本のコンテンツライセンス市場における電子臨床アウトカム評価(eCOA)は、先進的なデジタルヘルスケア基盤、活発な臨床試験活動、そして患者中心の研究への注力により、急成長を遂げています。モバイル対応のPROおよびClinROプラットフォームの導入は、スマート病院やインターネット接続された臨床研究施設の増加を背景に、急速に進んでいます。EHRシステムやより広範なeClinicalプラットフォームとの統合により、リアルタイムモニタリング、規制遵守、そして業務効率が向上しています。また、高齢化が進む日本では、在宅試験と病院試験の両方において、患者フレンドリーで観察者報告アウトカム(ObsRO)ソリューションの需要が高まっています。さらに、治験依頼者はeCOAプラットフォームにおけるAIと分析機能を活用し、データ品質の向上と治験の意思決定の最適化に取り組んでいます。
中国電子臨床アウトカム評価(eCOA)コンテンツライセンス市場インサイト
中国のコンテンツライセンス市場における電子臨床アウトカムアセスメント(eCOA)は、臨床試験の急増、デジタルヘルス導入に対する政府のインセンティブ、モバイルおよびクラウドベースのアウトカムアセスメントプラットフォームの利用増加を背景に、予測期間中にアジア太平洋地域で最も高い成長率を示すと予想されています。治験依頼者は、より広範な患者集団にリーチするために、eCOAソリューションを活用したリアルタイムの患者モニタリングを実施し、分散型試験の実施をますます増やしています。ウェアラブルデバイスやリモートレポートツールとの統合により、データの精度とコンプライアンスが向上しています。この成長は、CROサービスの拡大と、拡張性と費用対効果の高いソリューションを提供する国内プラットフォームプロバイダーによっても支えられています。さらに、電子PRO、ClinRO、ObsROデータの規制当局による承認も、製薬企業やバイオテクノロジー企業による導入を促進しています。
インドにおけるコンテンツライセンス市場インサイトのための電子臨床アウトカム評価(eCOA)
インドのコンテンツライセンス市場向け電子臨床アウトカムアセスメント(eCOA)は、2025年にアジア太平洋地域で最大の収益シェアを占めました。これは、同国の臨床研究アウトソーシング産業の成長、患者のデジタルリテラシーの向上、モバイルヘルス技術の急速な導入によるものです。分散型試験の増加と、手頃な価格で拡張可能なクラウドベースのeCOAプラットフォームの組み合わせにより、病院、学術機関、CROでの導入が広がっています。インドの拡大する臨床試験エコシステムは、電子アウトカムキャプチャに対する規制当局の奨励に支えられ、データ収集の迅速化と患者のコンプライアンス向上を可能にしています。さらに、多国籍スポンサーは、コスト効率と熟練した人員の確保という理由から、複数国にまたがる研究の場としてインドを選択するケースが増えています。患者中心のPROおよびObsROソリューションの導入により、試験の質とリアルタイムモニタリング機能がさらに向上しています。
オーストラリアのコンテンツライセンス市場インサイト向け電子臨床アウトカム評価(eCOA)
オーストラリアのコンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)は、同国の高度な医療インフラ、デジタルヘルス技術の積極的な導入、そして病院や研究機関で実施される臨床試験件数の増加により、着実な成長を遂げています。スポンサーやCROは、オーストラリアが国際基準に準拠した規制を導入しており、PRO、ClinRO、ObsRO、PerfOといった電子プラットフォームの導入が容易なことを高く評価しています。モバイルベースやウェブベースのeCOAソリューションが広く普及していることで、特に分散型試験やハイブリッド試験において、患者のエンゲージメントとコンプライアンスが向上します。電子健康記録(EHR)やその他のデジタルシステムとの統合により、データの精度が向上し、試験管理が効率化されます。さらに、オーストラリアの熟練した臨床従事者と患者中心の研究への重点が、医薬品、バイオ医薬品、医療機器の試験における革新的なeCOAプラットフォームの導入を促進しています。
アジア太平洋地域のコンテンツライセンス市場シェアにおける電子臨床アウトカム評価(eCOA)
アジア太平洋地域のコンテンツライセンス業界向け電子臨床結果評価 (eCOA) は、主に次のような定評ある企業によって主導されています。
- ヴィーヴァシステムズ(米国)
- カイエンティス(フランス)
- シグナント・ヘルス(米国)
- IQVIAホールディングス(米国)
- Clinical Ink, Inc.(米国)
- メディデータソリューションズ(米国)
- eCOA GmbH(ドイツ)
- CRFヘルス(英国)
- Motentia LLC(米国)
- ブラケット・グローバルLLC(米国)
- SHYFT Analytics(米国)
- メドネットソリューションズ(オーストラリア)
- シュアクリニカル(米国)
- レリプサ(米国)
- OpenClinica LLC(米国)
- クラリオ(米国)
- データキューブド・ヘルス(米国)
- フローレンス・ヘルスケア(米国)
- bloqcube(米国)
- リアルタイム・クリニカル(米国)
アジア太平洋地域のコンテンツライセンス市場における電子臨床結果評価 (eCOA) の最近の動向は何ですか?
- 2024年3月、PPD(サーモフィッシャーサイエンティフィック)などの主要な臨床研究サービスプロバイダーは、デジタルおよび分散型試験エコシステムを公開し、データ品質の向上、患者の負担軽減、アジア太平洋地域を含む地域での試験参加の増加を目的としたeCOAを含むデジタルアウトカムキャプチャをサポートするツールと方法論を強調しました。
- 2023年12月、ObvioHealthは、ObvioGo®プラットフォームに統合された革新的な電子臨床アウトカム評価(eCOA)ソリューションの立ち上げを発表しました。これにより、迅速なeCOA作成、患者エンゲージメントの強化、臨床試験の実装タイムラインの最大70%短縮が可能になります。
- 2023年8月、中国国家薬品監督管理局(NMPA)と医薬品審査センター(CDE)は、「患者中心の医薬品臨床試験の実施に関する技術ガイドライン」を発表し、eCOA、eConsent、遠隔データ収集といった電子ツールを臨床試験の実務の近代化に正式に認めました。この規制の明確化は、アジア太平洋地域の試験におけるeCOA技術の活用拡大を支援します。
- 2023年6月、ICON plcはICON Digital Platformのメジャーアップデートを発表しました。このアップデートには、検証済みの評価ライブラリがプリロードされた統合eCOAモジュールが含まれています。このプラットフォームは、従来型試験と分散型試験の両方において、患者エンゲージメント、eConsent、eCOA、リモートデータキャプチャをサポートし、セットアップ時間を短縮し、アウトカムデータの一貫性を向上させます。
- 2023年4月、アルマック・クリニカル・テクノロジーズは、IXRS®3パートナーシップ・ネットワークの立ち上げを発表しました。これにより、バイオ医薬品のスポンサーとCROは、データとeCOAモジュールを含む相互運用可能な臨床技術を共有し、治験実施施設と患者にとってよりシームレスで包括的な治験体験を実現できるようになります。この取り組みは、相互運用性と連携を重視し、治験データの取得を効率化し、複数施設における試験におけるeCOAの統合を強化します。
SKU-
世界初のマーケットインテリジェンスクラウドに関するレポートにオンラインでアクセスする
- インタラクティブなデータ分析ダッシュボード
- 成長の可能性が高い機会のための企業分析ダッシュボード
- カスタマイズとクエリのためのリサーチアナリストアクセス
- インタラクティブなダッシュボードによる競合分析
- 最新ニュース、更新情報、トレンド分析
- 包括的な競合追跡のためのベンチマーク分析のパワーを活用
調査方法
データ収集と基準年分析は、大規模なサンプル サイズのデータ収集モジュールを使用して行われます。この段階では、さまざまなソースと戦略を通じて市場情報または関連データを取得します。過去に取得したすべてのデータを事前に調査および計画することも含まれます。また、さまざまな情報ソース間で見られる情報の不一致の調査も含まれます。市場データは、市場統計モデルと一貫性モデルを使用して分析および推定されます。また、市場シェア分析と主要トレンド分析は、市場レポートの主要な成功要因です。詳細については、アナリストへの電話をリクエストするか、お問い合わせをドロップダウンしてください。
DBMR 調査チームが使用する主要な調査方法は、データ マイニング、データ変数が市場に与える影響の分析、および一次 (業界の専門家) 検証を含むデータ三角測量です。データ モデルには、ベンダー ポジショニング グリッド、市場タイムライン分析、市場概要とガイド、企業ポジショニング グリッド、特許分析、価格分析、企業市場シェア分析、測定基準、グローバルと地域、ベンダー シェア分析が含まれます。調査方法について詳しくは、お問い合わせフォームから当社の業界専門家にご相談ください。
カスタマイズ可能
Data Bridge Market Research は、高度な形成的調査のリーダーです。当社は、既存および新規のお客様に、お客様の目標に合致し、それに適したデータと分析を提供することに誇りを持っています。レポートは、対象ブランドの価格動向分析、追加国の市場理解 (国のリストをお問い合わせください)、臨床試験結果データ、文献レビュー、リファービッシュ市場および製品ベース分析を含めるようにカスタマイズできます。対象競合他社の市場分析は、技術ベースの分析から市場ポートフォリオ戦略まで分析できます。必要な競合他社のデータを、必要な形式とデータ スタイルでいくつでも追加できます。当社のアナリスト チームは、粗い生の Excel ファイル ピボット テーブル (ファクト ブック) でデータを提供したり、レポートで利用可能なデータ セットからプレゼンテーションを作成するお手伝いをしたりすることもできます。