キメラ抗原受容体(CAR)
Market Size in USD Billion
CAGR :
% 
 USD
2.44 Billion
USD
6.66 Billion
2024
2032
USD
2.44 Billion
USD
6.66 Billion
2024
2032
| 2025 –2032 | |
| USD 2.44 Billion | |
| USD 6.66 Billion | |
|
|
|
|
キメラ抗原受容体(CAR)-T療法の世界市場:種類別(Abecma、Breyanzi、Kymriah、Tecartus、Yescartaなど)、標的抗原別(CD19、CD20、GD2、CD22、CD30、CD33、HER1、HER2、Meso、Egfrvllなど)、治療用途別(急性リンパ性白血病、慢性リンパ性白血病、非ホジキン白血病、多発性骨髄腫、膵臓がん、神経芽細胞がん、乳がん、急性骨髄性白血病、肝細胞がん、大腸がんなど) - 2032年までの業界動向と予測
キメラ抗原受容体(CAR)-T療法治療市場規模
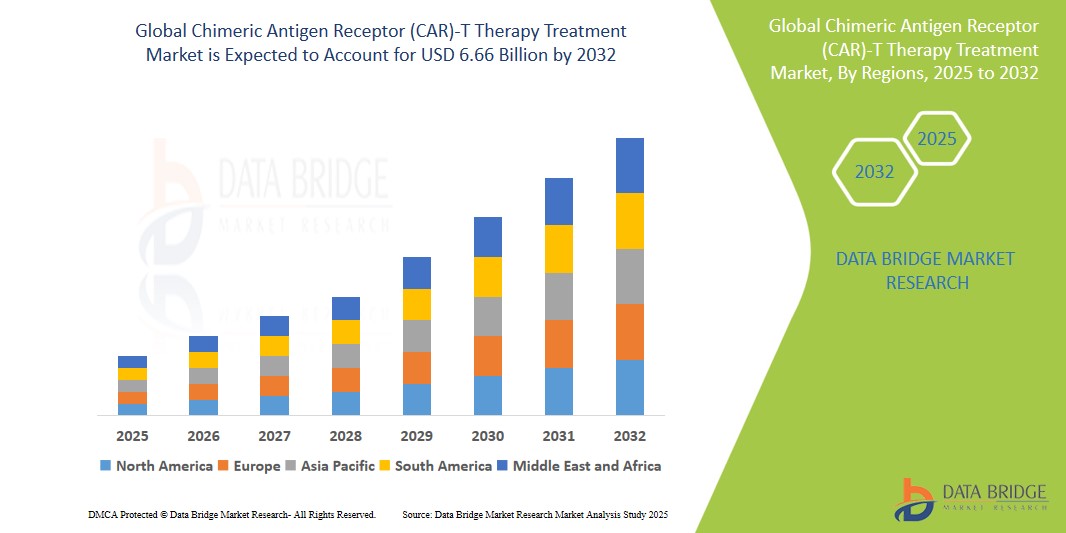
- 世界のキメラ抗原受容体(CAR)-T細胞療法市場規模は、2023年に24億4,000万米ドルと評価され、予測期間中に15.3%のCAGRで成長し、2031年には59億7,000万米ドルに達すると予測されています。
- この成長は、がんの罹患率の増加、免疫療法の進歩、規制当局によるCAR-T細胞療法の承認の増加などの要因によって推進されている。
キメラ抗原受容体(CAR)-T療法治療市場分析
- CAR-T細胞療法は、患者のT細胞を改変し、がん細胞を標的として破壊する画期的ながん治療法です。特定の種類の白血病、リンパ腫、多発性骨髄腫の治療において高い有効性を示しています。
- CAR-T細胞療法の需要は、血液悪性腫瘍の発生率の増加と臨床試験における有望な結果により高まっています。
- 北米は、活発な研究開発活動、高い医療費、先進的治療法の早期導入により、CAR-T細胞療法市場を支配すると予想されている。
- アジア太平洋地域は、バイオテクノロジー分野の拡大とがんの負担の増加により、予測期間中にCAR-T細胞療法市場で最も急速に成長する地域になると予想されています。
- 急性リンパ性白血病セグメントは、治療反応性の高さと進行中の臨床開発により、30%の市場シェアを占め、市場を牽引すると予想されています。CAR-T療法の承認適応症として最初に承認された疾患の一つとして、市場の成長を牽引し続けています。
レポートの範囲とキメラ抗原受容体(CAR)-T療法治療市場のセグメンテーション
|
属性 |
キメラ抗原受容体(CAR)-T療法の主要市場洞察 |
|
対象セグメント |
|
|
対象国 |
北米
ヨーロッパ
アジア太平洋
中東およびアフリカ
南アメリカ
|
|
主要な市場プレーヤー |
|
|
市場機会 |
|
|
付加価値データ情報セット |
データブリッジマーケットリサーチがまとめた市場レポートには、市場価値、成長率、セグメンテーション、地理的範囲、主要プレーヤーなどの市場シナリオに関する洞察に加えて、輸出入分析、生産能力概要、生産消費分析、価格動向分析、気候変動シナリオ、サプライチェーン分析、バリューチェーン分析、原材料/消耗品概要、ベンダー選択基準、PESTLE分析、ポーター分析、規制枠組みも含まれています。 |
キメラ抗原受容体(CAR)-T療法治療市場の動向
「次世代CAR-T療法と既製品(同種異系)ソリューション」
- CAR-T細胞療法の分野における主要なトレンドは、次世代CAR-T療法の出現と、従来の自己CAR-T製品の限界を克服することを目指した既製の(同種)CAR-Tソリューションの開発である。
- これらの革新は、患者自身のT細胞を採取して改変する必要性をなくすことで、製造効率を向上させ、治療費を削減し、患者へのアクセスを迅速化することを目的としている。
- 例えば、アロジェン・セラピューティクスやプレシジョン・バイオサイエンスが開発中の同種CAR-T療法は、遺伝子編集技術を利用して健康なドナーから汎用CAR-T細胞を作製し、拡張可能ですぐに利用できる治療法の可能性を提供している。
- これらの進歩は、がん免疫療法を変革し、治療までの時間を短縮し、アクセス性を高め、より幅広い適応症と患者集団にわたるCAR-T療法の拡大を支援することとなるだろう。
キメラ抗原受容体(CAR)-T療法治療市場の動向
ドライバ
「がん罹患率の上昇と造血器悪性腫瘍におけるCAR-Tの高い有効性」
- がん、特に白血病、リンパ腫、多発性骨髄腫などの造血悪性腫瘍の世界的な負担の増加は、CAR-T細胞療法の需要を牽引する重要な要因です。
- CAR-T療法は高い有効性を示し、FDA承認製品のいくつかは従来の治療に反応しなかった患者において高い寛解率を示している。
- 例えば、国際がん研究機関(IARC)によると、2022年には世界中で約2,000万人が新たにがんと診断され、そのうち血液がんが大きな割合を占めています。治療抵抗性がんの増加は、CAR-Tのような先進的な治療法の必要性を高めています。
- CARの設計、標的抗原の選択、治療の提供における継続的な進歩により、CAR-T療法の有効性と安全性は向上し続け、市場の成長を促進しています。
機会
「固形腫瘍および早期治療ラインへの適応拡大」
- 最も有望な機会の一つは、CAR-T細胞療法を血液悪性腫瘍だけでなく、世界の癌症例の大部分を占める固形腫瘍にまで拡大することである。
- 腫瘍微小環境調節、二重標的CAR、装甲CAR-Tの革新により、CAR-T細胞は固形腫瘍に浸透し、持続することが可能となっている。
- さらに、規制当局と研究者はCAR-T療法をより早期の治療ラインで利用することを検討しており、患者の適格性と治療成績が向上する可能性がある。
- 例えば、2024年3月、国立がん研究所(NCI)の研究者は、HER2陽性乳がんとEGFR陽性神経膠芽腫を標的としたCAR-T療法の第I相試験を開始し、固形腫瘍への応用への移行を示しました。
- これらの開発により、CAR-T療法の商業的範囲が大幅に拡大し、より広範な癌における第一選択薬または第二選択薬として位置付けられる可能性がある。
抑制/挑戦
「高い処理コストと複雑な製造プロセス」
- CAR-T療法の普及を阻む最大の課題の一つは、患者自身のT細胞を抽出、操作、再注入する、高コストで複雑な個別製造プロセスである。
- 治療費は患者1人あたり数十万ドルを超えることが多く、患者と支払者にとって大きな経済的障壁となり、低所得国や中所得国ではアクセスが制限される。
- 例えば、2024年10月にHealth Affairsに掲載された研究では、米国におけるCAR-T療法(入院と支持療法を含む)の平均総費用は患者1人あたり50万ドルを超えると推定されており、医療システムにとって手頃な価格が大きな懸念事項となっている。
- その結果、このような制限により、ケアの質や高度な外科手術へのアクセスに格差が生じ、最終的には市場全体の成長が妨げられる可能性があります。
キメラ抗原受容体(CAR)-T療法治療市場の展望
市場は、タイプ、標的抗原、治療用途に基づいて分類されています。
|
セグメンテーション |
サブセグメンテーション |
|
タイプ別 |
|
|
ターゲット抗原別 |
|
|
治療用途別 |
|
2025年には、急性リンパ性白血病(ALL)セグメントが治療応用セグメントで最大のシェアを占め、市場を支配すると予測されています。
急性リンパ性白血病(ALL)セグメントは、2025年にCAR-T細胞療法市場を牽引し、約30%という最大の市場シェアを占めると予想されています。この優位性は、再発性または難治性ALLの治療薬として、キムリアやテカルタスといったCAR-T療法の早期承認と臨床的成功に起因しています。高い奏効率と救命の可能性を秘めたCAR-T療法は、従来の治療に反応しない患者にとって標準治療となりつつあります。特に小児におけるALLの発症率の増加と、継続的な臨床的進歩により、このセグメントの主導的地位はさらに強化されると予想されます。
CD19標的抗原セグメントは、標的抗原セグメントで最大のシェアを占め、市場を支配すると予想されます。
CD19標的抗原セグメントは、2025年にCAR-T細胞療法市場において48.6%という最大の市場シェアを占めると予測されています。CD19は、急性リンパ性白血病、非ホジキンリンパ腫、慢性リンパ性白血病などのB細胞悪性腫瘍において高い発現を示すことから、最も広く標的とされている抗原です。Kymriah、Yescarta、Breyanziなど、FDA承認済みの複数のCAR-T療法はCD19特異的であり、優れた臨床効果を示しています。現在進行中の試験では、併用療法や新たな適応症におけるCD19の探索が行われており、このセグメントは予測期間を通じて支配的な地位を維持すると予想されます。
キメラ抗原受容体(CAR)-T療法治療市場の地域分析
「北米はキメラ抗原受容体(CAR)-T療法治療市場で最大のシェアを占めている」
- 北米は、強力な臨床研究インフラ、革新的な免疫療法の早期導入、高度な細胞療法の承認を促進する強力な規制枠組みに支えられ、CAR-T 細胞療法市場を支配しています。
- 米国は、キムリア、イエスカルタ、ブレヤンジなどの承認されたCAR-T療法の集中度が高く、専門のがん治療センターで広く利用可能であることで、この地域をリードしています。
- 有利な償還ポリシー、がん発症率の増加、および精密腫瘍学を促進する政府支援の取り組みが、市場拡大に大きく貢献しています。
- さらに、大手バイオテクノロジー企業の存在、新たな適応症の臨床試験の継続、細胞療法製造施設への投資により、この地域は世界のCAR-T療法分野でリーダーシップを強化しています。
「アジア太平洋地域は、キメラ抗原受容体(CAR)-T療法市場において最も高いCAGRを記録すると予測されています」
- アジア太平洋地域は、医療インフラの拡大、がん罹患率の上昇、バイオテクノロジーの革新への投資の増加により、CAR-T細胞療法市場において最も高い成長率を示すことが予想されている。
- 中国、日本、韓国、インドなどの国は、個別化がん治療の導入の増加と臨床研究および細胞治療開発に対する政府の支援により、主要市場として台頭している。
- 特に中国はCAR-T分野で急速に進歩しており、多数の臨床試験が実施され、国内のバイオテクノロジー企業がCD19、CD22、BCMA抗原を標的とした競争力のある治療法を開始している。
- 日本の規制当局は、再生医療および先進医療に対する迅速な承認手続きを導入し、CAR-T治療へのアクセスを加速させている。
- インドでは、学術界との連携や製造の現地化、治療費の削減に向けた取り組みに支えられ、CAR-T療法の需要が高まっています。この地域的な勢いは、予測期間中の世界市場の成長に大きく貢献すると予想されます。
キメラ抗原受容体(CAR)-T療法の市場シェア
市場競争環境は、競合他社ごとの詳細情報を提供します。企業概要、財務状況、収益、市場ポテンシャル、研究開発投資、新規市場への取り組み、グローバルプレゼンス、生産拠点・設備、生産能力、強みと弱み、製品投入、製品群の幅広さ、アプリケーションにおける優位性などの詳細が含まれます。上記のデータは、各社の市場への注力分野にのみ関連しています。
市場で活動する主要なマーケットリーダーは次のとおりです。
- オートラス・セラピューティクス(英国)
- CARsgen Therapeutics Holdings Limited(英国)
- ブリストル・マイヤーズ スクイブ社(米国)
- ソレント・セラピューティクス社(米国)
- ブルーバードバイオ社(米国)
- ユーレカ・セラピューティクス社(米国)
- アヴァクタグループplc(英国)
- Cibus Inc.(フランス)
- Celyad Oncology SA(ベルギー)
- フォートレス・バイオテック社(米国)
- ギリアド・サイエンシズ(米国)
- ノバルティスAG(スイス)
- アラウノス・セラピューティクス社(米国)
- ポセイダ・セラピューティクス社(米国)
キメラ抗原受容体(CAR)-T療法治療市場における世界の最新動向
- 2023年12月、マックス・ヘルスケアはデリー首都圏でCAR-T細胞療法の導入に成功し、がん治療の選択肢を大きく前進させました。ImmunoACTとの提携により開発されたこの革新的な治療法は、リンパ腫と白血病の治療に特化しており、これらの困難な病態と闘う患者に新たな希望をもたらします。
- 2022年12月、CARsgen Therapeutics Co., Ltd.は上海癌研究所と提携し、T細胞の抗腫瘍効果を大幅に高める新技術を開発しました。研究チームは、Runx3を過剰発現するように改変したCAR-T細胞が、従来のキメラ抗原受容体T細胞療法と比較して、持続的な抗腫瘍活性と腫瘍制御の改善を示すことを発見しました。
- 2022年11月、カリブー・バイオサイエンス社は、同社の同種異系抗CD19 CAR-T細胞療法であるCB-010が、再発または難治性の大細胞型B細胞リンパ腫(LBCL)に対する再生医療先進療法(RMAT)指定を米国食品医薬品局(FDA)から取得し、再発または難治性のB細胞性非ホジキンリンパ腫に対するファストトラック指定も取得したと発表した。
- 2022年6月、オタワ大学は、カナダ主導のがん免疫療法-01(CLIC-01)臨床試験の有望な結果を発表しました。この試験は、カナダで初めて開発されたがんに対するCAR-T細胞療法の一つに焦点を当てています。この治療法は独自の製造プロセスを特徴としており、より手頃な価格で公平な治療選択肢につながる可能性があります。
- 2021年11月、カリフォルニア再生医療研究所の理事会は、カリフォルニア大学サンディエゴ校医学部の科学者が開発中の革新的なキメラ抗原受容体T細胞療法の進歩を支援するために410万ドルの助成金を承認し、この有望な癌治療を研究室から臨床実践に移行させるための取り組みを支援しました。
SKU-
世界初のマーケットインテリジェンスクラウドに関するレポートにオンラインでアクセスする
- インタラクティブなデータ分析ダッシュボード
- 成長の可能性が高い機会のための企業分析ダッシュボード
- カスタマイズとクエリのためのリサーチアナリストアクセス
- インタラクティブなダッシュボードによる競合分析
- 最新ニュース、更新情報、トレンド分析
- 包括的な競合追跡のためのベンチマーク分析のパワーを活用
目次
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 EPIDEMIOLOGY
2.2.12 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.13 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3 MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4 EXECUTIVE SUMMARY
5 PREMIUM INSIGHTS
5.1 PESTEL ANALYSIS
5.2 PORTER’S FIVE FORCES MODEL
6 INDUSTRY INSIGHTS
6.1 PATENT ANALYSIS
6.1.1 PATENT LANDSCAPE
6.1.2 USPTO NUMBER
6.1.3 PATENT EXPIRY
6.1.4 EPIO NUMBER
6.1.5 PATENT STRENGTH AND QUALITY
6.1.6 PATENT CLAIMS
6.1.7 PATENT CITATIONS
6.1.8 PATENT LITIGATION AND LICENSING
6.1.9 FILE OF PATENT
6.1.10 PATENT RECEIVED CONTRIES
6.1.11 TECHNOLOGY BACKGROUND
6.2 DRUG TREATMENT RATE BY MATURED MARKETS
6.3 DEMOGRAPHIC TRENDS: IMPACTS ON ALL INCIDENCE RATES
6.4 PATIENT FLOW DIAGRAM
6.5 KEY PRICING STRATEGIES
6.6 KEY PATIENT ENROLLMENT STRATEGIES
6.7 INTERVIEWS WITH SPECIALIST
6.8 OTHER KOL SNAPSHOTS
7 EPIDEMIOLOGY
7.1 INCIDENCE OF ALL BY GENDER
7.1.1 PREVALENCE OF B-CELL ACUTE LYMPHOBLASTIC LEUKEMIA (ALL)
7.1.2 PREVALENCE OF B-CELL NON-HODGKIN LYMPHOMA (NHL)
7.1.3 PREVALENCE OF FOLLICULAR LYMPHOMA
7.1.4 PREVALENCE OF MANTLE CELL LYMPHOMA (MCL)
7.1.5 PREVALENCE OF MULTIPLE MYELOMA
7.2 TREATMENT RATE
7.3 MORTALITY RATE
7.4 PATIENT TREATMENT SUCCESS RATES
8 MERGERS AND ACQUISITION
8.1 LICENSING
8.2 COMMERCIALIZATION AGREEMENTS
9 REGULATORY FRAMEWORK
9.1 REGULATORY APPROVAL PROCESS
9.2 GEOGRAPHIES’ EASE OF REGULATORY APPROVAL
9.3 REGULATORY APPROVAL PATHWAYS
9.4 LICENSING AND REGISTRATION
9.5 POST-MARKETING SURVEILLANCE
9.6 GOOD MANUFACTURING PRACTICES (GMPS) GUIDELINES
10 PIPELINE ANALYSIS
10.1 CLINICAL TRIALS AND PHASE ANALYSIS
10.2 DRUG THERAPY PIPELINE
10.3 PHASE III CANDIDATES
10.4 PHASE II CANDIDATES
10.5 PHASE I CANDIDATES
10.6 OTHERS (PRE-CLINICAL AND RESEARCH)
TABLE 1 GLOBAL CLINICAL TRIAL MARKET FOR XX
Company Name Therapeutic Area
XX XX
XX XX
XX XX
XX XX
XX XX
XX XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 2 DISTRIBUTION OF PRODUCTS AND PROJECTS BY PHASE
Phase Number of Projects
Preclinical/Research Projects XX
Clinical Development XX
Phase I XX
Phase II XX
Phase III XX
U.S. Filed/Approved But Not Yet Marketed XX
Total XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 3 DISTRIBUTION OF PROJECTS BY THERAPEUTIC AREA AND PHASE
Therapeutic Area Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 4 DISTRIBUTION OF PROJECTS BY SCIENTIFIC APPROACH AND PHASE
Technology Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
FIGURE 1 TOP ENTITIES BASED ON R&D GLANCE FOR XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
11 MARKETED DRUG ANALYSIS
11.1 DRUG
11.1.1 BRAND NAME
11.1.2 GENERICS NAME
11.2 THERAPEUTIC INDICTION
11.3 PHARMACOLOGICAL CLASS OF THE DRUG
11.4 DRUG PRIMARY INDICATION
11.5 MARKET STATUS
11.6 MEDICATION TYPE
11.7 DRUG DOSAGES FORM
11.8 DOSAGES AVAILABILITY
11.9 DRUG ROUTE OF ADMINISTRATION
11.1 DOSING FREQUENCY
11.11 DRUG INSIGHT
11.12 AN OVERVIEW OF THE DRUG DEVELOPMENT ACTIVITIES SUCH AS REGULATORY MILSTONE, SAFETY DATA AND EFFICACY DATA, MARKET EXCLUSIVITY DATA.
11.12.1 FORECAST MARKET OUTLOOK
11.12.2 CROSS COMPETITION
11.12.3 THERAPEUTIC PORTFOLIO
11.12.4 CURRENT DEVELOPMENT SCENARIO
12 MARKET ACCESS
12.1 10-YEAR MARKET FORECAST
12.2 CLINICAL TRIAL RECENT UPDATES
12.3 ANNUAL NEW FDA APPROVED DRUGS
12.4 DRUGS MANUFACTURER AND DEALS
12.5 MAJOR DRUG UPTAKE
12.6 CURRENT TREATMENT PRACTICES
12.7 IMPACT OF UPCOMING THERAPY
13 R & D ANALYSIS
13.1 COMPARATIVE ANALYSIS
13.2 DRUG DEVELOPMENTAL LANDSCAPE
13.3 IN-DEPTH INSIGHTS ON REGULATORY MILESTONES
13.4 THERAPEUTIC ASSESSMENT
13.5 ASSET-BASED COLLABORATIONS AND PARTNERSHIPS
14 MARKET OVERVIEW
14.1 DRIVERS
14.2 RESTRAINTS
14.3 OPPORTUNITIES
14.4 CHALLENGES
15 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY TARGET INDICATION
15.1 OVERVIEW
15.2 B-CELL ACUTE LYMPHOBLASTIC LEUKEMIA (ALL)
15.3 B-CELL NON-HODGKIN LYMPHOMA (NHL)
15.4 FOLLICULAR LYMPHOMA
15.5 MANTLE CELL LYMPHOMA (MCL)
15.6 MULTIPLE MYELOMA
15.7 OTHERS
16 GLOBAL
16.1 OVERVIEW
16.2 AUTOLOGOUS CAR-T CELLS
16.3 ALLOGENEIC CAR-T CELLS
17 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY TARGET ANTIGEN
17.1 OVERVIEW
17.2 CD19
17.2.1 TISAGENLECLEUCEL
17.2.1.1. MARKET VALUE (USD MN)
17.2.1.2. MARKET VOLUME (SU)
17.2.1.3. AVERAGE SELLING PRICE (USD)
17.2.2 AXIXABTAGENE CILOLEUCEL
17.2.2.1. MARKET VALUE (USD MN)
17.2.2.2. MARKET VOLUME (SU)
17.2.2.3. AVERAGE SELLING PRICE (USD)
17.2.3 BREXUCABTAGENE AUTOLLEUCEL
17.2.3.1. MARKET VALUE (USD MN)
17.2.3.2. MARKET VOLUME (SU)
17.2.3.3. AVERAGE SELLING PRICE (USD)
17.2.4 LISOCABTAGENE MARALEUCEL
17.2.4.1. MARKET VALUE (USD MN)
17.2.4.2. MARKET VOLUME (SU)
17.2.4.3. AVERAGE SELLING PRICE (USD)
17.2.5 OTHERS
17.3 BCMA
17.3.1 IDECABTAGENE VICLEUCEL
17.3.1.1. MARKET VALUE (USD MN)
17.3.1.2. MARKET VOLUME (SU)
17.3.1.3. AVERAGE SELLING PRICE (USD)
17.3.2 CILTACABTAGENE AUTOLEUCEL
17.3.2.1. MARKET VALUE (USD MN)
17.3.2.2. MARKET VOLUME (SU)
17.3.2.3. AVERAGE SELLING PRICE (USD)
17.3.3 OTHERS
17.4 OTHERS
18 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY AGE GROUP
18.1 OVERVIEW
18.2 CHILDREN (0-15)
18.3 ADULTS (16- 64)
18.4 SENIORS (65 AND ABOVE)
19 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY GENDER
19.1 OVERVIEW
19.2 MALE
19.3 FEMALE
20 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY END USER
20.1 OVERVIEW
20.2 HOSPITAL
20.2.1 PRIVATE
20.2.2 PUBLIC
20.3 SPECIALTY CLINICS
20.4 RESEARCH INSTITUTES
20.5 CANCER INSTITUTES
20.6 PHARMACEUTICAL & BIOTECHNOLOGY COMPANIES
20.7 OTHERS
21 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY DISTRIBUTION CHANNEL
21.1 OVERVIEW
21.2 DIRECT SALE
21.3 RETAIL SALES
21.4 OTHERS
22 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, COMPANY LANDSCAPE
22.1 COMPANY SHARE ANALYSIS: GLOBAL
22.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
22.3 COMPANY SHARE ANALYSIS: EUROPE
22.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
22.5 MERGERS & ACQUISITIONS
22.6 NEW PRODUCT DEVELOPMENT & APPROVALS
22.7 EXPANSIONS
22.8 REGULATORY CHANGES
22.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
23 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY GEOGRAPHY
GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
23.1 NORTH AMERICA
23.1.1 U.S.
23.1.2 CANADA
23.1.3 MEXICO
23.2 EUROPE
23.2.1 GERMANY
23.2.2 U.K.
23.2.3 ITALY
23.2.4 FRANCE
23.2.5 SPAIN
23.2.6 RUSSIA
23.2.7 SWITZERLAND
23.2.8 TURKEY
23.2.9 BELGIUM
23.2.10 NETHERLANDS
23.2.11 DENMARK
23.2.12 SWEDEN
23.2.13 POLAND
23.2.14 NORWAY
23.2.15 FINLAND
23.2.16 REST OF EUROPE
23.3 ASIA-PACIFIC
23.3.1 JAPAN
23.3.2 CHINA
23.3.3 SOUTH KOREA
23.3.4 INDIA
23.3.5 SINGAPORE
23.3.6 THAILAND
23.3.7 INDONESIA
23.3.8 MALAYSIA
23.3.9 PHILIPPINES
23.3.10 AUSTRALIA
23.3.11 NEW ZEALAND
23.3.12 VIETNAM
23.3.13 TAIWAN
23.3.14 REST OF ASIA-PACIFIC
23.4 SOUTH AMERICA
23.4.1 BRAZIL
23.4.2 ARGENTINA
23.4.3 REST OF SOUTH AMERICA
23.5 MIDDLE EAST AND AFRICA
23.5.1 SOUTH AFRICA
23.5.2 EGYPT
23.5.3 BAHRAIN
23.5.4 UNITED ARAB EMIRATES
23.5.5 KUWAIT
23.5.6 OMAN
23.5.7 QATAR
23.5.8 SAUDI ARABIA
23.5.9 REST OF MIDDLE EAST AND AFRICA
23.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
24 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, SWOT AND DBMR ANALYSIS
25 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, COMPANY PROFILE
25.1 NOVARTIS AG
25.1.1 COMPANY OVERVIEW
25.1.2 REVENUE ANALYSIS
25.1.3 GEOGRAPHIC PRESENCE
25.1.4 PRODUCT PORTFOLIO
25.1.5 RECENT DEVELOPMENTS
25.2 KITE PHARMA
25.2.1 COMPANY OVERVIEW
25.2.2 REVENUE ANALYSIS
25.2.3 GEOGRAPHIC PRESENCE
25.2.4 PRODUCT PORTFOLIO
25.2.5 RECENT DEVELOPMENTS
25.3 JUNO THERAPTICS
25.3.1 COMPANY OVERVIEW
25.3.2 REVENUE ANALYSIS
25.3.3 GEOGRAPHIC PRESENCE
25.3.4 PRODUCT PORTFOLIO
25.3.5 RECENT DEVELOPMENTS
25.4 BRISTOL MYERS SQUIBB
25.4.1 COMPANY OVERVIEW
25.4.2 REVENUE ANALYSIS
25.4.3 GEOGRAPHIC PRESENCE
25.4.4 PRODUCT PORTFOLIO
25.4.5 RECENT DEVELOPMENTS
25.5 LEGEND BIOTECH INC
25.5.1 COMPANY OVERVIEW
25.5.2 REVENUE ANALYSIS
25.5.3 GEOGRAPHIC PRESENCE
25.5.4 PRODUCT PORTFOLIO
25.5.5 RECENT DEVELOPMENTS
25.6 AMMGEN, INC
25.6.1 COMPANY OVERVIEW
25.6.2 REVENUE ANALYSIS
25.6.3 GEOGRAPHIC PRESENCE
25.6.4 PRODUCT PORTFOLIO
25.6.5 RECENT DEVELOPMENTS
25.7 SORRENTO THERAPUTICS, INC.
25.7.1 COMPANY OVERVIEW
25.7.2 REVENUE ANALYSIS
25.7.3 GEOGRAPHIC PRESENCE
25.7.4 PRODUCT PORTFOLIO
25.7.5 RECENT DEVELOPMENTS
25.8 GILEAD SCIENCE
25.8.1 COMPANY OVERVIEW
25.8.2 REVENUE ANALYSIS
25.8.3 GEOGRAPHIC PRESENCE
25.8.4 PRODUCT PORTFOLIO
25.8.5 RECENT DEVELOPMENTS
25.9 BLUE BIRD BIO, INC.
25.9.1 COMPANY OVERVIEW
25.9.2 REVENUE ANALYSIS
25.9.3 GEOGRAPHIC PRESENCE
25.9.4 PRODUCT PORTFOLIO
25.9.5 RECENT DEVELOPMENTS
25.1 IMMUN THERAPUTICS, INC
25.10.1 COMPANY OVERVIEW
25.10.2 REVENUE ANALYSIS
25.10.3 GEOGRAPHIC PRESENCE
25.10.4 PRODUCT PORTFOLIO
25.10.5 RECENT DEVELOPMENTS
25.11 BELLICUM PARMACEUTICALS, INC.
25.11.1 COMPANY OVERVIEW
25.11.2 REVENUE ANALYSIS
25.11.3 GEOGRAPHIC PRESENCE
25.11.4 PRODUCT PORTFOLIO
25.11.5 RECENT DEVELOPMENTS
25.12 PFIZER, INC.
25.12.1 COMPANY OVERVIEW
25.12.2 REVENUE ANALYSIS
25.12.3 GEOGRAPHIC PRESENCE
25.12.4 PRODUCT PORTFOLIO
25.12.5 RECENT DEVELOPMENTS
25.13 ELI LILLY AND COMPANY
25.13.1 COMPANY OVERVIEW
25.13.2 REVENUE ANALYSIS
25.13.3 GEOGRAPHIC PRESENCE
25.13.4 PRODUCT PORTFOLIO
25.13.5 RECENT DEVELOPMENTS
25.14 JW THERAPEUTICS
25.14.1 COMPANY OVERVIEW
25.14.2 REVENUE ANALYSIS
25.14.3 GEOGRAPHIC PRESENCE
25.14.4 PRODUCT PORTFOLIO
25.14.5 RECENT DEVELOPMENTS
25.15 FORTRESS BIOTECH, INC.
25.15.1 COMPANY OVERVIEW
25.15.2 REVENUE ANALYSIS
25.15.3 GEOGRAPHIC PRESENCE
25.15.4 PRODUCT PORTFOLIO
25.15.5 RECENT DEVELOPMENTS
25.16 CARTESIAN THERAPEUTICS, INC.
25.16.1 COMPANY OVERVIEW
25.16.2 REVENUE ANALYSIS
25.16.3 GEOGRAPHIC PRESENCE
25.16.4 PRODUCT PORTFOLIO
25.16.5 RECENT DEVELOPMENTS
25.17 CASI PHARMACEUTICALS
25.17.1 COMPANY OVERVIEW
25.17.2 REVENUE ANALYSIS
25.17.3 GEOGRAPHIC PRESENCE
25.17.4 PRODUCT PORTFOLIO
25.17.5 RECENT DEVELOPMENTS
25.18 POSEIDA THERAPEUTICS, INC.
25.18.1 COMPANY OVERVIEW
25.18.2 REVENUE ANALYSIS
25.18.3 GEOGRAPHIC PRESENCE
25.18.4 PRODUCT PORTFOLIO
25.18.5 RECENT DEVELOPMENTS
25.19 AUTOLUS THERAPEUTICS
25.19.1 COMPANY OVERVIEW
25.19.2 REVENUE ANALYSIS
25.19.3 GEOGRAPHIC PRESENCE
25.19.4 PRODUCT PORTFOLIO
25.19.5 RECENT DEVELOPMENTS
25.2 EUREKA THERAPEUTICS
25.20.1 COMPANY OVERVIEW
25.20.2 REVENUE ANALYSIS
25.20.3 GEOGRAPHIC PRESENCE
25.20.4 PRODUCT PORTFOLIO
25.20.5 RECENT DEVELOPMENTS
25.21 AURORA BIOPHARMA
25.21.1 COMPANY OVERVIEW
25.21.2 REVENUE ANALYSIS
25.21.3 GEOGRAPHIC PRESENCE
25.21.4 PRODUCT PORTFOLIO
25.21.5 RECENT DEVELOPMENTS
25.22 IMMUNOACT
25.22.1 COMPANY OVERVIEW
25.22.2 REVENUE ANALYSIS
25.22.3 GEOGRAPHIC PRESENCE
25.22.4 PRODUCT PORTFOLIO
25.22.5 RECENT DEVELOPMENTS
25.23 FERRING PHARMACEUTICALS A/S
25.23.1 COMPANY OVERVIEW
25.23.2 REVENUE ANALYSIS
25.23.3 GEOGRAPHIC PRESENCE
25.23.4 PRODUCT PORTFOLIO
25.23.5 RECENT DEVELOPMENTS
25.24 JANSSEN BIOTECH, INC.
25.24.1 COMPANY OVERVIEW
25.24.2 REVENUE ANALYSIS
25.24.3 GEOGRAPHIC PRESENCE
25.24.4 PRODUCT PORTFOLIO
25.24.5 RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
26 RELATED REPORTS
27 CONCLUSION
28 QUESTIONNAIRE
29 ABOUT DATA BRIDGE MARKET RESEARCH
調査方法
データ収集と基準年分析は、大規模なサンプル サイズのデータ収集モジュールを使用して行われます。この段階では、さまざまなソースと戦略を通じて市場情報または関連データを取得します。過去に取得したすべてのデータを事前に調査および計画することも含まれます。また、さまざまな情報ソース間で見られる情報の不一致の調査も含まれます。市場データは、市場統計モデルと一貫性モデルを使用して分析および推定されます。また、市場シェア分析と主要トレンド分析は、市場レポートの主要な成功要因です。詳細については、アナリストへの電話をリクエストするか、お問い合わせをドロップダウンしてください。
DBMR 調査チームが使用する主要な調査方法は、データ マイニング、データ変数が市場に与える影響の分析、および一次 (業界の専門家) 検証を含むデータ三角測量です。データ モデルには、ベンダー ポジショニング グリッド、市場タイムライン分析、市場概要とガイド、企業ポジショニング グリッド、特許分析、価格分析、企業市場シェア分析、測定基準、グローバルと地域、ベンダー シェア分析が含まれます。調査方法について詳しくは、お問い合わせフォームから当社の業界専門家にご相談ください。
カスタマイズ可能
Data Bridge Market Research は、高度な形成的調査のリーダーです。当社は、既存および新規のお客様に、お客様の目標に合致し、それに適したデータと分析を提供することに誇りを持っています。レポートは、対象ブランドの価格動向分析、追加国の市場理解 (国のリストをお問い合わせください)、臨床試験結果データ、文献レビュー、リファービッシュ市場および製品ベース分析を含めるようにカスタマイズできます。対象競合他社の市場分析は、技術ベースの分析から市場ポートフォリオ戦略まで分析できます。必要な競合他社のデータを、必要な形式とデータ スタイルでいくつでも追加できます。当社のアナリスト チームは、粗い生の Excel ファイル ピボット テーブル (ファクト ブック) でデータを提供したり、レポートで利用可能なデータ セットからプレゼンテーションを作成するお手伝いをしたりすることもできます。