世界の医薬品安全性ソリューションおよび医薬品安全性監視市場の規模、シェア、トレンド分析レポート
Market Size in USD Billion
CAGR :
% 
 USD
9.01 Billion
USD
16.08 Billion
2024
2032
USD
9.01 Billion
USD
16.08 Billion
2024
2032
| 2025 –2032 | |
| USD 9.01 Billion | |
| USD 16.08 Billion | |
|
|
|
|
世界の医薬品安全性ソリューションおよび医薬品安全性監視市場のセグメンテーション、タイプ別(ソフトウェアおよびサービス)、製品別(標準形式およびカスタマイズ形式)、機能別(有害事象報告ソフトウェア、医薬品安全性監査ソフトウェア、および問題追跡ソフトウェア)、配信別(オンプレミス配信モードおよびオンデマンド/クラウドベース(SAAS)配信モード)、エンドユーザー別(バイオテクノロジー および製薬、契約研究機関(CROS)、病院、KPO/BPO、およびヘルスケアプロバイダー)、流通チャネル別(直接販売および小売販売) - 2032年までの業界動向および予測
医薬品安全性ソリューションおよび医薬品安全性監視市場規模
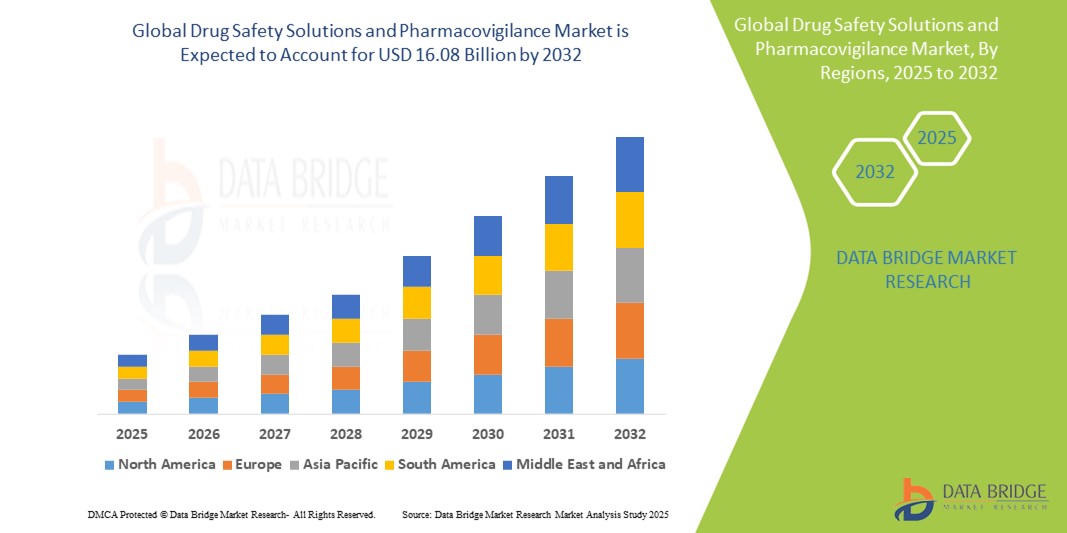
- 世界の医薬品安全性ソリューションおよび医薬品安全性監視市場規模は、2024年に90億1000万米ドルと評価され、予測期間中に7.50%のCAGRで 成長し 、2032年までに160億8000万米ドルに達すると予想されています。
- 市場の成長は、医薬品開発プロセスの複雑化と世界的な臨床試験の急増に大きく牽引されており、医薬品の副作用や患者の安全性データを監視・管理するための堅牢なシステムの必要性が高まっています。これにより、製薬業界およびバイオテクノロジー業界全体で、高度な医薬品安全性ソリューションと医薬品安全性監視技術への依存が高まっています。
- さらに、世界的な保健当局からの規制圧力の高まりと、医薬品リスクに関する国民の意識の高まりにより、安全で自動化され、規制に準拠した安全性監視システムの需要が高まっています。これらの要因が重なり、医薬品安全性ソリューションとファーマコビジランス・プラットフォームの普及が加速し、業界の成長を大きく後押ししています。
医薬品安全性ソリューションと医薬品安全性監視市場分析
- 医薬品安全性ソリューションとファーマコビジランスシステムは、製品ライフサイクル全体を通じて副作用と安全性データをエンドツーエンドで監視するものであり、規制当局の監視強化とリアルタイムのリスク評価の必要性により、臨床段階と市販後段階の両方においてますます重要になっています。これらのシステムは、患者の安全性、規制遵守、そして効果的な薬理学的監視の確保に不可欠です。
- 医薬品安全性ソリューションとファーマコビジランス(医薬品安全性監視)の需要の高まりは、主に世界的な臨床試験の急増、医薬品副作用(ADR)の発生率上昇、そしてファーマコビジランス・プラットフォーム間のデータ統合の重要性の高まりによって促進されています。AI駆動型ツール、クラウドベースの報告システム、自動化技術の導入により、医薬品安全性運用の効率性と精度がさらに向上しています。
- 北米は、厳格なFDA規制、強力な医薬品研究開発エコシステム、高度な安全性監視技術の早期導入を特徴とし、2024年には41.3%という最大の収益シェアで医薬品安全性ソリューションおよび医薬品安全性監視市場を支配しています。
- アジア太平洋地域は、医薬品製造の急速な拡大、臨床研究活動の増加、医療費の増加、および世界的な医薬品安全基準への準拠に向けた政府の取り組みにより、予測期間中に医薬品安全性ソリューションおよび医薬品安全性監視市場で最も急速に成長する地域となり、10.4%のCAGRを記録すると予想されています。
- ソフトウェアセグメントは、医薬品安全性ソリューションおよびファーマコビジランス市場において、2024年には47.6%の市場シェアを占め、市場を牽引するでしょう。これは、集中型データベース、リアルタイムモニタリングダッシュボード、EHRシステムとのシームレスな統合に対する需要の高まりに支えられています。企業が安全性報告におけるコンプライアンスと運用効率の向上を目指す中、拡張性、クラウド対応、AI搭載のソフトウェアプラットフォームへの需要は高まり続けています。
レポートの範囲と医薬品安全性ソリューションおよび医薬品安全性監視市場のセグメンテーション
|
属性 |
医薬品安全性ソリューションと医薬品安全性監視の主要市場洞察 |
|
対象セグメント |
|
|
対象国 |
北米
ヨーロッパ
アジア太平洋
中東およびアフリカ
南アメリカ
|
|
主要な市場プレーヤー |
|
|
市場機会 |
|
|
付加価値データ情報セット |
データブリッジマーケットリサーチがまとめた市場レポートには、市場価値、成長率、セグメンテーション、地理的範囲、主要プレーヤーなどの市場シナリオに関する洞察に加えて、専門家による詳細な分析、価格設定分析、ブランドシェア分析、消費者調査、人口統計分析、サプライチェーン分析、バリューチェーン分析、原材料/消耗品の概要、ベンダー選択基準、PESTLE分析、ポーター分析、規制の枠組みも含まれています。 |
医薬品安全性ソリューションと医薬品安全性監視市場の動向
「自動化とシステム統合による利便性の向上」
- 世界の医薬品安全性ソリューションおよびファーマコビジランス市場において、自動化プラットフォームと規制および臨床データシステムの統合が加速しており、これは重要なトレンドとなっています。この統合により、医薬品バリューチェーン全体における有害事象の検出、症例処理、規制申請が効率化されています。
- 例えば、いくつかの主要な医薬品安全性監視ソフトウェアプロバイダーは現在、臨床試験データベース、電子健康記録(EHR)、EudraVigilanceやFDAのFAERSなどの規制システムと統合された集中型プラットフォームを提供しており、リアルタイムの報告とコンプライアンスを確保しています。
- 自動化により、インテリジェントな症例トリアージ、重複検出、ナラティブ生成などの機能が可能になり、手作業の作業負荷が大幅に軽減され、安全性データの精度が向上します。企業は、日常的なデータ入力と照合にロボティック・プロセス・オートメーション(RPA)を導入するケースが増えています。
- 医薬品安全性システムと、より広範な臨床・商業プラットフォームとのシームレスな統合により、統一された安全性モニタリング環境が実現します。単一のインターフェースを通じて、関係者は複数の市場や製品ラインにわたる製品の安全性、シグナル検出、ベネフィット・リスク評価を追跡できます。
- よりインテリジェントで合理化され、相互接続された医薬品安全性監視業務へのこの傾向は、規制戦略とライフサイクル医薬品安全性管理を再構築しています。組織は、エンドツーエンドの医薬品安全性監視ワークフローをサポートし、グローバルなコンプライアンスを実現するプラットフォームを優先しています。
- 製薬、バイオテクノロジー、CROの各分野では、患者の安全性を高めながら業務効率を最適化することを目指しており、スケーラブルな自動化、リアルタイム統合、高度なデータ分析を提供する医薬品安全性ソリューションの需要が急速に高まっています。
医薬品安全性ソリューションと医薬品安全性監視市場の動向
ドライバ
「医薬品の複雑化と規制圧力の高まりによるニーズの高まり」
- 生物製剤、遺伝子治療、個別化医療を含む医薬品の複雑さが増すにつれ、ライフサイクル全体にわたって医薬品の安全性を監視するための堅牢な医薬品安全性監視システムの需要が高まっています。
- 例えば、医薬品の承認手続きの迅速化と緊急使用許可への世界的な移行により、副作用(ADR)を迅速に特定し管理するためのリアルタイムの安全性監視の重要性が強調されている。
- FDA(米国)、EMA(欧州)、CDSCO(インド)などの規制機関は、厳格な市販後調査とリスク管理計画を義務付けており、製薬会社に高度な医薬品安全性ソリューションへの多額の投資を強いています。
- さらに、世界的な臨床試験の増加と多様な患者集団の関与により、複数の地域と規制枠組みにまたがる高品質のデータ統合と有害事象追跡が求められています。
- クラウドベースの医薬品安全性プラットフォームとAI駆動型シグナル検出ツールは、精度と効率性を向上させ、リアルタイムのデータ分析と潜在的な医薬品リスクの早期特定を可能にするために大規模に導入されています。
- その結果、製薬会社やバイオテクノロジー会社は、コスト効率が高く、拡張性があり、規制に準拠した医薬品安全性サービスを提供する専門ベンダーに医薬品安全性監視機能をアウトソーシングするケースが増えており、市場の成長が加速しています。
抑制/挑戦
「データプライバシーの懸念と熟練労働力の不足」
- 医薬品安全性監視ソリューションの需要が高まっているにもかかわらず、GDPR(欧州)、HIPAA(米国)、インドのDPDP法など、データ保護法が進化している地域では特に、データプライバシーとコンプライアンスに関する懸念が大きな制約となっている。
- 例えば、国境を越えたデータ転送や、アウトソーシングされた医薬品安全性業務における患者の健康情報の取り扱いには、厳格な安全対策と法的明確性が求められ、業務の複雑さや遅延が生じることが多い。
- さらに、特に規制文書の作成、安全性データベースの管理、およびグローバルコンプライアンスの専門知識を持つ熟練した医薬品安全性監視専門家の不足は、市場の拡張性に課題を残し続けています。
- 中小規模の製薬会社は、社内PVチームを維持するための財政的およびインフラ的な負担に悩まされることが多く、その結果、医薬品安全性の実践が断片化または一貫性を欠くことになります。
- さらに状況を複雑にしているのは、言語の壁、国によって異なる有害事象報告基準、そしてレガシーシステムとの統合問題であり、これらはリアルタイムの安全性監視と世界的なデータの調和を妨げている。
- これらの課題に対処するには、強化された業界研修プログラム、より強力な規制協力、そして世界中でコンプライアンスと効果的な医薬品安全性監視の実践を確保するための安全で相互運用可能なプラットフォームの実装が必要です。
医薬品安全性ソリューションと医薬品安全性監視市場の展望
医薬品安全性ソリューションおよび医薬品安全性監視市場は、タイプ、製品、機能、配信、エンドユーザー、流通チャネルに基づいてセグメント化されています。
• タイプ別
医薬品安全性ソリューションおよびファーマコビジランス市場は、種類別にソフトウェアとサービスに分類されます。サービス分野は、2024年には47.6%という最大の収益シェアを占めました。これは、製薬会社における安全性モニタリングと規制遵守のためのアウトソーシングのトレンドの高まりを背景にしています。これらのサービスは多くの場合、カスタマイズ可能で拡張性が高く、既存の製薬会社と新興バイオテクノロジー企業の両方をサポートしています。
ソフトウェアセグメントは、自動化ツール、機械学習ベースの有害事象検出、クラウドベースの医薬品安全性監視プラットフォームの採用増加により、2025年から2032年にかけて11.3%という最速のCAGRを達成すると予想されています。
• 製品別
製品別に見ると、医薬品安全性ソリューションおよびファーマコビジランス市場は、標準形式とカスタマイズ形式の2つに分類されます。多くのエンドユーザーが、基本的な規制報告や安全性分析のための費用対効果が高く、すぐに導入できるソリューションを好むため、標準形式セグメントは2024年には63.1%の収益シェアで市場を席巻しました。
カスタマイズされたフォームセグメントは、企業固有のコンプライアンスワークフロー、治療領域、およびグローバルレポート標準に準拠したカスタマイズされたプラットフォームに対する需要の高まりにより、2025年から2032年にかけて10.1%という最も速いCAGRで成長すると予想されています。
• 機能別
医薬品安全性ソリューションおよびファーマコビジランス市場は、機能に基づいて、有害事象報告ソフトウェア、医薬品安全性監査ソフトウェア、および問題追跡ソフトウェアに分類されます。有害事象報告ソフトウェアセグメントは、すべてのファーマコビジランスプロセスのバックボーンとして機能し、世界中の保健当局の要件を満たすために不可欠であるため、2024年には54.6%という最大の収益シェアを獲得しました。
企業が安全ケースライフサイクルの複雑さを管理し、信号検出の精度を高めるためにリアルタイムの問題解決ツールを求めているため、問題追跡ソフトウェアセグメントは予測期間中に10.9%という最も速いCAGRを記録すると予測されています。
• 配達
医薬品安全性ソリューションおよびファーマコビジランス市場は、提供形態に基づいて、オンプレミス型とオンデマンド/クラウドベース(SaaS)型に分類されます。オンデマンド/クラウドベース型は、拡張性、インフラコストの低さ、そして世界中のファーマコビジランスチームへのリアルタイムアクセスの容易さから、2024年には60.3%の市場シェアでトップに立つと予測されています。
オンプレミス配信セグメントは、採用は減少しているものの、規制が厳しい業務やセキュリティが重要な業務にとって依然として重要です。
• エンドユーザーによる
エンドユーザーに基づいて、医薬品安全性ソリューションおよびファーマコビジランス市場は、バイオテクノロジーおよび製薬企業、開発業務受託機関(CRO)、病院、KPO/BPO、および医療提供者に分類されます。バイオテクノロジーおよび製薬企業セグメントは、医薬品安全性コンプライアンス、市販後調査、および規制当局への申請に直接責任を負うため、2024年には収益シェアの48.9%を占め、市場をリードするでしょう。
CROセグメントは、コスト効率と専門知識へのアクセスを目的とした医薬品安全性監視機能のアウトソーシングの増加により、2025年から2032年にかけて11.7%という最も高いCAGRを達成すると予想されています。
• 流通チャネル別
流通チャネルに基づいて、医薬品安全性ソリューションおよびファーマコビジランス市場は、直接販売と小売販売に分類されます。直接販売セグメントは2024年に71.6%と最大のシェアを占め、カスタマイズされた契約とサポートを必要とするファーマコビジランスソリューション取引の複雑性と高価値性を反映しています。
小売販売セグメントは、中小企業や個々の医療提供者による既成ソフトウェアの購入に牽引されて、緩やかなペースで成長すると予想されます。
医薬品安全性ソリューションおよび医薬品安全性監視市場の地域分析
- 北米は、厳格な規制要件、大手製薬会社の存在、医薬品安全性技術への投資増加により、2024年には医薬品安全性ソリューションおよび医薬品安全性監視市場において41.3%という最大の収益シェアを占める。
- この地域の利害関係者は、FDAおよびカナダ保健省の規制への準拠を保証し、効率的な有害事象報告とリアルタイムの安全性監視を可能にする高度な医薬品安全性監視ソフトウェアとサービスを高く評価しています。
- この広範な導入は、高い技術意識、クラウドベースの配信モデルに対する需要の高まり、患者の安全への強い重点によってさらに支えられており、この地域は製薬、バイオテクノロジー、ヘルスケアの各分野にわたる医薬品安全性ソリューションと医薬品安全性監視の重要な拠点としての地位を確立しています。
米国の医薬品安全性ソリューションと医薬品安全性監視市場の洞察
米国の医薬品安全性ソリューションおよびファーマコビジランス市場は、大手製薬企業の存在とFDAなどの厳格な規制枠組みに牽引され、2024年には北米で最大の収益シェア(78%)を占めました。患者の安全性への関心の高まり、臨床試験の増加、クラウドベースのファーマコビジランスソフトウェアの進歩が市場の成長を牽引しています。さらに、AIを活用した医薬品安全性ツールの導入拡大と堅牢な医療インフラも、この市場の拡大に大きく貢献しています。
欧州医薬品安全性ソリューションおよび医薬品安全性監視市場の洞察
欧州の医薬品安全性ソリューションおよび医薬品安全性監視市場は、EU医薬品安全性指令などの厳格な規制に支えられ、2025年から2032年にかけて高いCAGRで成長すると予想されています。医療費の増加、臨床研究活動の拡大、医薬品安全性対策への意識の高まりは、地域全体での導入を促進しています。ドイツ、フランス、英国は、製薬会社や受託研究機関からの需要が高まっており、特に大きな貢献を果たしています。
英国の医薬品安全性ソリューションと医薬品安全性監視市場の洞察
英国の医薬品安全性ソリューションおよびファーマコビジランス市場は、国内の確立されたライフサイエンスセクターと、医薬品安全性監視強化に向けた政府の取り組みの増加に牽引され、予測期間中に大幅なCAGRで成長すると予測されています。医療データ分析の改善と、医薬品開発業務受託機関(CRO)へのファーマコビジランスのアウトソーシング拡大への重点的な取り組みが、市場の成長をさらに促進しています。
ドイツの医薬品安全性ソリューションと医薬品安全性監視市場の洞察
ドイツの医薬品安全性ソリューションおよびファーマコビジランス市場は、デジタルヘルス技術への投資増加と自動有害事象報告システムの導入拡大に牽引され、予測期間中に注目すべきCAGRで拡大すると予想されています。強力な規制支援と高度な医療インフラが相まって、製薬業界とバイオテクノロジー業界の両業界において、統合ファーマコビジランス・プラットフォームの需要が加速しています。
アジア太平洋地域の医薬品安全性ソリューションと医薬品安全性監視市場の洞察
アジア太平洋地域の医薬品安全性ソリューションおよびファーマコビジランス市場は、急速な都市化、政府の医療改革、そして中国、インド、日本、韓国などの国々における臨床研究活動の拡大を背景に、2025年から2032年にかけて10.4%という最高の年平均成長率(CAGR)を記録すると予測されています。医薬品製造の増加、医薬品安全性に対する意識の高まり、そしてクラウドベースのソリューションの導入拡大が、市場の堅調な拡大に貢献しています。
日本における医薬品安全性ソリューションと医薬品安全性監視市場の洞察
日本の医薬品安全性ソリューションおよびファーマコビジランス市場は、高齢化、高度なヘルスケアエコシステム、そしてAIベースの医薬品安全性モニタリングシステムの導入拡大を背景に、着実に成長しており、年平均成長率(CAGR)14%で成長すると予想されています。ファーマコビジランスと電子医療記録(EHR)の統合、そして強力な規制監督が、市場拡大を支える重要な要因となっています。
中国の医薬品安全性ソリューションと医薬品安全性監視市場の洞察
中国の医薬品安全性ソリューションと医薬品安全性監視は、急成長を遂げる製薬業界、大規模な臨床試験、そして政府による医薬品安全性基準の向上への注力に支えられ、2024年にはアジア太平洋地域最大の収益シェア(35%)を占めると予測されています。スマートヘルスケアインフラの台頭と国内ソフトウェア開発企業の台頭も、中国全土での市場導入を加速させています。
医薬品安全性ソリューションと医薬品安全性監視の市場シェア
医薬品安全性ソリューションおよび医薬品安全性監視業界は、主に、次のような定評のある企業によって主導されています。
- サーモフィッシャーサイエンティフィック社(米国)
- C3i(米国)
- 世界的な臨床試験(米国)
- クラリオ(米国)
- ユナイテッド・バイオソースLLC(米国)
- エンノフ(香港)
- AB Cube SAS(フランス)
- ラボコープ(米国)
- アクセンチュア(アイルランド)
- ICON plc(米国)
- エルゴメッドグループ(英国)
- IQVIA(米国)
- ジェンパクト(米国)
- コグニザント(米国)
- パレクセル・インターナショナル(MA)コーポレーション(米国)
- アリスグローバル(米国)
世界の医薬品安全性ソリューションおよび医薬品安全性監視市場の最新動向
- 2025年5月、臨床研究とデータ分析の世界的リーダーであるIQVIAは、有害事象報告の効率化と世界中の医薬品安全性モニタリングの改善を目的とした、強化されたファーマコビジランス・プラットフォームの導入を発表しました。このプラットフォームは、高度な分析とリアルタイムのデータ統合を活用し、より迅速な洞察を提供することで、医療提供者と製薬会社が情報に基づいた安全性に関する意思決定を行うことを可能にします。このイノベーションは、医薬品の安全性と規制遵守の向上に向けたIQVIAのコミットメントを改めて示すものです。
- 2025年4月、コグニザントはAIを活用した自動化ツールを統合し、医薬品安全性ソリューションのポートフォリオを拡大しました。これにより、ケース処理の効率性と精度が向上しました。同社は、手作業によるデータ入力ミスが大幅に削減され、安全性報告の処理時間が短縮されたと報告しています。この戦略的展開は、コグニザントが医薬品安全性監視サービスにおけるデジタル変革に注力していることを反映しています。
- 2025年3月、パレクセル・インターナショナル・コーポレーションは、大手バイオテクノロジー企業と提携し、世界中の複数の臨床試験施設にクラウドベースのファーマコビジランスシステムを導入しました。この取り組みは、安全性データの収集と報告を統合し、臨床試験全体における一貫した規制遵守と患者の安全性向上を目指しています。この提携は、革新的な医薬品安全性管理ソリューションの推進におけるパレクセルの役割を浮き彫りにしています。
- 2025年2月、アリスグローバルは、機械学習を活用した強化されたリスク管理およびシグナル検出機能を備えたLifeSphere Drug Safetyプラットフォームの最新バージョンを発表しました。このアップデートにより、製薬会社は医薬品安全性シグナルをより正確に監視できるようになり、規制当局への申請を迅速化できます。これにより、アリスグローバルはファーマコビジランス技術のパイオニアとしての地位を強化します。
- 2025年1月、Labcorp Drug Developmentは、市販後の安全性プロファイルをより適切に評価するため、リアルワールドエビデンスデータを医薬品安全性モニタリングサービスに統合すると発表しました。同社は、この包括的なアプローチにより、臨床試験データと多様な医療現場の患者データを組み合わせることで、医薬品安全性監視の成果が向上し、世界中でより安全な医薬品の使用が促進されると強調しました。
SKU-
世界初のマーケットインテリジェンスクラウドに関するレポートにオンラインでアクセスする
- インタラクティブなデータ分析ダッシュボード
- 成長の可能性が高い機会のための企業分析ダッシュボード
- カスタマイズとクエリのためのリサーチアナリストアクセス
- インタラクティブなダッシュボードによる競合分析
- 最新ニュース、更新情報、トレンド分析
- 包括的な競合追跡のためのベンチマーク分析のパワーを活用
調査方法
データ収集と基準年分析は、大規模なサンプル サイズのデータ収集モジュールを使用して行われます。この段階では、さまざまなソースと戦略を通じて市場情報または関連データを取得します。過去に取得したすべてのデータを事前に調査および計画することも含まれます。また、さまざまな情報ソース間で見られる情報の不一致の調査も含まれます。市場データは、市場統計モデルと一貫性モデルを使用して分析および推定されます。また、市場シェア分析と主要トレンド分析は、市場レポートの主要な成功要因です。詳細については、アナリストへの電話をリクエストするか、お問い合わせをドロップダウンしてください。
DBMR 調査チームが使用する主要な調査方法は、データ マイニング、データ変数が市場に与える影響の分析、および一次 (業界の専門家) 検証を含むデータ三角測量です。データ モデルには、ベンダー ポジショニング グリッド、市場タイムライン分析、市場概要とガイド、企業ポジショニング グリッド、特許分析、価格分析、企業市場シェア分析、測定基準、グローバルと地域、ベンダー シェア分析が含まれます。調査方法について詳しくは、お問い合わせフォームから当社の業界専門家にご相談ください。
カスタマイズ可能
Data Bridge Market Research は、高度な形成的調査のリーダーです。当社は、既存および新規のお客様に、お客様の目標に合致し、それに適したデータと分析を提供することに誇りを持っています。レポートは、対象ブランドの価格動向分析、追加国の市場理解 (国のリストをお問い合わせください)、臨床試験結果データ、文献レビュー、リファービッシュ市場および製品ベース分析を含めるようにカスタマイズできます。対象競合他社の市場分析は、技術ベースの分析から市場ポートフォリオ戦略まで分析できます。必要な競合他社のデータを、必要な形式とデータ スタイルでいくつでも追加できます。当社のアナリスト チームは、粗い生の Excel ファイル ピボット テーブル (ファクト ブック) でデータを提供したり、レポートで利用可能なデータ セットからプレゼンテーションを作成するお手伝いをしたりすることもできます。