世界の医療機器臨床調査アドバイザリーソリューション市場規模、シェア、トレンド分析レポート
Market Size in USD Billion
CAGR :
% 
 USD
186.21 Million
USD
446.13 Million
2025
2033
USD
186.21 Million
USD
446.13 Million
2025
2033
| 2026 –2033 | |
| USD 186.21 Million | |
| USD 446.13 Million | |
|
|
|
|
世界の医療機器臨床研究アドバイザリーソリューション市場:サービスタイプ別(規制アドバイザリーおよび臨床試験管理)、エンドユーザー別(医療機器企業および開発業務受託機関(CRO)) - 業界動向と2033年までの予測
医療機器臨床調査アドバイザリーソリューション市場規模
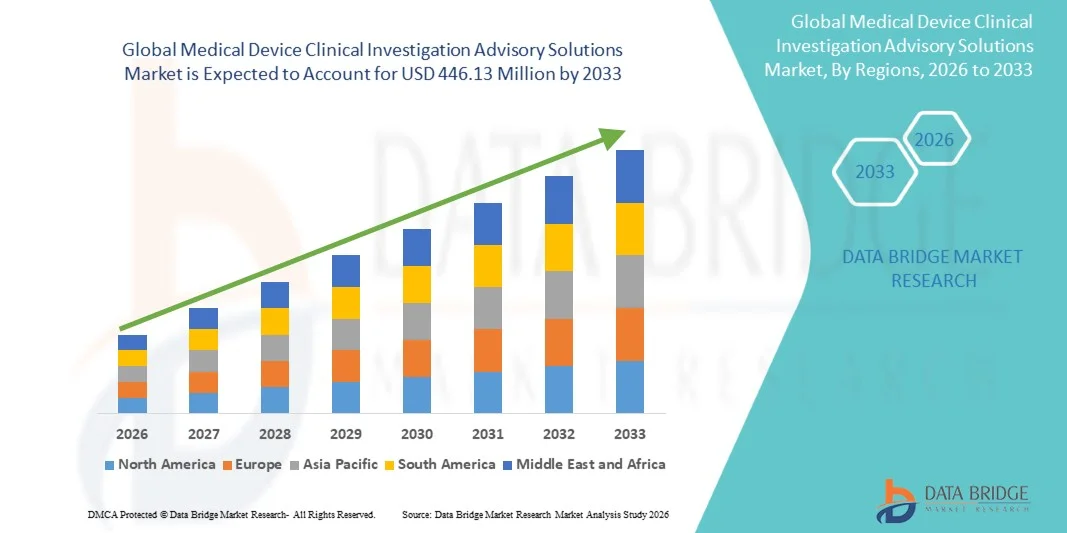
- 世界の医療機器臨床調査アドバイザリーソリューション市場規模は2025年に1億8,621万米ドルと評価され、予測期間中に11.54%のCAGRで成長し、2033年には4億4,613万米ドル に達すると予想されています 。
- 市場の成長は、医療機器業界における規制枠組みの複雑化と、世界市場における製品承認とコンプライアンスの迅速化を確保するための臨床調査アドバイザリーサービスのアウトソーシング導入の増加によって大きく促進されている。
- さらに、費用対効果が高く専門家主導の臨床試験ガイダンスに対する需要の高まりにより、医療機器メーカーは専門的なアドバイザリーソリューションに頼るようになり、業界の成長が大幅に促進されています。
医療機器臨床調査アドバイザリーソリューション市場分析
- 医療機器臨床試験アドバイザリーソリューションは、臨床試験に関する専門家主導のガイダンスと規制サポートを提供しており、医療機器メーカーにとって、製品承認の迅速化、コンプライアンスの確保、そして世界市場における臨床業務の最適化のためにますます重要になっています。
- これらのアドバイザリーソリューションに対する需要の高まりは、主に、規制枠組みの複雑化、市場投入までの時間の短縮、そしてコスト効率が高く専門的な試験サポートを求める医療機器企業によるアウトソーシングの採用の増加によって促進されています。
- 北米は、主要な医療機器企業の強力な存在、成熟した臨床研究インフラ、厳格な規制要件を特徴とし、2025年には医療機器臨床調査アドバイザリーソリューション市場で39.2%という最大の収益シェアを獲得して市場を支配しました。
- アジア太平洋地域は、医療機器産業の急速な成長、臨床試験活動の増加、規制およびアドバイザリーサービスのアウトソーシングの増加により、予測期間中に市場で最も急速に成長する地域になると予想されています。
- 規制アドバイザリーセグメントは、北米、ヨーロッパ、アジア太平洋などの地域における医療機器規制の複雑化により、2025年には58.4%という最大の市場収益シェアを占めました。
レポートの範囲と医療機器臨床調査アドバイザリーソリューション市場のセグメンテーション
|
属性 |
医療機器臨床調査アドバイザリーソリューションの主要市場インサイト |
|
対象セグメント |
|
|
対象国 |
北米
ヨーロッパ
アジア太平洋
中東およびアフリカ
南アメリカ
|
|
主要な市場プレーヤー |
|
|
市場機会 |
|
|
付加価値データ情報セット |
Data Bridge Market Research がまとめた市場レポートには、市場価値、成長率、セグメンテーション、地理的範囲、主要プレーヤーなどの市場シナリオに関する洞察に加えて、専門家による詳細な分析、患者の疫学、パイプライン分析、価格分析、規制の枠組みも含まれています。 |
医療機器臨床調査アドバイザリーソリューション市場動向
「高度な臨床調査アドバイザリーサービスの導入拡大」
- 世界の医療機器臨床調査アドバイザリーソリューション市場における注目すべき傾向は、医療機器の臨床試験、規制申請、市販後調査をサポートする専門的なアドバイザリーサービスの採用が増えていることです。
- 企業は、臨床試験の設計、プロトコル開発、規制遵守を合理化し、市場投入までの時間を短縮し、リスクを軽減するソリューションへの投資を増やしています。
- 例えば、2024年には北米の複数の医療機器メーカーがアドバイザリーソリューションプロバイダーと提携し、臨床試験戦略を最適化し、規制当局の承認を迅速化しました。
- メーカーが高品質でコンプライアンスに準拠した臨床試験を効率的に実施できるよう、科学的、規制的、運用的専門知識を組み合わせた統合ソリューションの需要も高まっています。
- この傾向は、規制枠組みの複雑さの増大と製品ライフサイクル全体にわたる専門家の指導の必要性を反映しており、臨床調査アドバイザリーサービスの採用が世界的に促進されています。
医療機器臨床調査アドバイザリーソリューション市場の動向
ドライバ
「規制遵守と効率的な臨床試験管理の必要性の高まり」
- 厳格な安全性と有効性の基準を含む医療機器に対する規制要件の高まりは、アドバイザリーソリューションの採用の主な推進力となっています。
- 製造業者は、複雑な規制を順守し、申請書類を準備し、FDA、EMA、その他の地域当局などの機関へのコンプライアンスを確保するために専門家のサポートを求めています。
- 例えば、2025年初頭、欧州の医療機器会社は、新しいEU MDR規制への準拠を促進するためにアドバイザリーサービスを利用し、承認の遅延リスクを軽減しました。
- さらに、臨床試験の効率を最適化し、運用コストを削減し、製品開発サイクルを短縮する必要性から、これらのソリューションの需要が高まっています。
- 患者の安全性、臨床的エビデンスの質、リスク管理に対する意識の高まりにより、製薬会社は研究デザインと結果を強化するために専門的な助言サービスに頼る傾向がさらに強まっている。
抑制/挑戦
「高コストと専門知識の不足」
- 医療機器の臨床調査アドバイザリーサービスにかかる比較的高いコストは、特に新興市場において中小規模のメーカーにとって障壁となる可能性がある。
- 高度なアドバイザリーソリューションは長期契約や契約金を必要とすることが多く、予算が限られている組織にとっては負担が大きすぎる場合があります。
- 例えば、アジアのスタートアップ企業数社は予算の制約により2023年にアドバイザリーサービスの契約を延期し、臨床試験のペースに影響を与えた。
- 特定の地域では資格と経験のあるアドバイザーが限られているため、市場への浸透が制限され、プロジェクトの遅延につながる可能性があります。
- 費用対効果の高いサービスモデル、アドバイザリー会社の地域拡大、リモートコンサルティングオプションを通じてこれらの課題に対処することが、持続的な市場成長の鍵となるでしょう。
医療機器臨床調査アドバイザリーソリューション市場の範囲
市場は、サービスタイプとエンドユーザーに基づいてセグメント化されています。
• サービスタイプ別
サービスの種類別に見ると、医療機器臨床調査アドバイザリーソリューション市場は、規制アドバイザリーと臨床試験管理に分類されます。規制アドバイザリーセグメントは、北米、欧州、アジア太平洋などの地域における医療機器規制の複雑化を背景に、2025年には58.4%という最大の市場収益シェアを占めました。医療機器企業は、市販前承認、市販後コンプライアンス、申請プロセスにおいて、規制アドバイザリーサービスに大きく依存しています。患者の安全性と製品品質基準への関心の高まりが、需要を押し上げています。規制コンサルタントは、リスク管理、ラベリング、文書化に関するガイダンスを提供し、市場への迅速な参入を保証します。FDA、EMA、PMDAなどの機関による厳格なコンプライアンス要件も、これらのサービスへの依存度を高めています。電子申請やデジタル規制追跡における技術の進歩は、効率性をさらに高めています。このセグメントは、一流医療機器メーカーとの長期契約の恩恵を受けています。革新的な機器や高価値診断機器の発売数の増加は、安定した需要を促進します。規制アドバイザリーサービスは、メーカーの法的リスクと運用リスクを軽減します。国際的な基準調和への関心の高まりが、このセグメントの優位性を支えています。規制に関する専門知識をアウトソーシングすることで、企業はコストを最適化し、市場投入までの時間を短縮できます。これらの要因が相まって、規制アドバイザリーは最大のサービスセグメントとなっています。
臨床試験管理セグメントは、2026年から2033年にかけて、新規および革新的な医療機器の臨床試験および市販後調査の増加に牽引され、11.3%という最も高いCAGRを達成すると予想されています。デジタル試験管理プラットフォームの導入拡大により、試験計画、患者募集、モニタリング、報告が効率化されます。臨床試験管理を専門プロバイダーにアウトソーシングすることで、医療機器企業の運用負担が軽減されます。多施設試験の複雑化とリアルタイムデータ取得の必要性の高まりが成長を支えています。規制当局はデータの完全性、監査対応、リスクに基づくモニタリングを重視しており、需要が高まっています。新興市場における医療機器の研究開発パイプラインの拡大が、導入を促進しています。CROは、効率化のためにエンドツーエンドの試験管理ソリューションの提供をますます増やしています。試験管理における高度な分析とAI主導のモニタリングは、精度を向上させ、期間を短縮します。デバイス開発中の費用対効果の高いソリューションへの需要が、導入を後押ししています。電子健康記録やウェアラブルデバイスとの統合は、臨床試験の効率性を高めます。患者中心の試験の増加傾向も、導入を促進しています。これらの要因により、臨床試験管理は最も急速に成長しているサービス タイプのセグメントとなっています。
• エンドユーザー
医療機器臨床調査アドバイザリーソリューション市場は、エンドユーザーに基づいて、医療機器企業と開発業務受託機関(CRO)に分類されます。医療機器企業セグメントは、世界的な医療機器発売数の増加と厳格な規制基準への準拠の必要性を背景に、2025年には64.7%という最大の市場収益シェアを占めました。企業は、市場参入の加速とコンプライアンス維持のために、外部のアドバイザリーサービスに大きく依存しています。製品分類、安全性試験、市販後調査の複雑化が需要を押し上げています。大手および中堅の医療機器メーカーは、コスト最適化と市場投入までの期間短縮のため、規制および臨床に関する専門知識を外部委託しています。診断機器、外科用機器、インプラント機器の急速な革新により、アドバイザリーソリューションへの依存度が高まっています。企業は、ラベル変更、有害事象報告、監査準備など、継続的なサポートを必要としています。ISO 13485やMDRなどの国際的な調和イニシアチブにより、導入が進んでいます。CROやアドバイザリーファームとの提携は、業務効率を向上させます。規制による遅延は最小限に抑えられ、商業リスクが軽減されます。高額契約と長期的なアドバイザリーパートナーシップにより、セグメントの優位性が強化されています。北米と欧州の企業が導入をリードしていますが、新興市場もますます貢献しています。これらの要因が相まって、医療機器企業はエンドユーザーセグメントにおける優位性を確立しています。
医薬品開発業務受託機関(CRO)セグメントは、臨床試験および薬事支援サービスのアウトソーシングの増加傾向に牽引され、2026年から2033年にかけて10.2%という最速のCAGRを達成すると予想されています。CROは、サービス提供の拡大と業務効率の向上を目指し、アドバイザリーソリューションを求める傾向が高まっています。多施設共同およびグローバルな臨床試験の増加に伴い、効率的な試験管理とコンプライアンスガイダンスが求められています。デバイスメーカーとCROの連携強化が成長を後押ししています。AIを活用したモニタリングやデジタル試験プラットフォームなどの技術進歩が、導入を促進しています。CROは、データ品質と薬事コンプライアンスを確保しながら、タイムラインと運用コストの削減を目指しています。新興市場へのサービス拡大も、導入を後押ししています。高リスクのデバイスカテゴリーにおける専門知識への強い需要が成長を加速させています。CROは、薬事申請の成功を保証し、リスクを軽減するために、アドバイザリーサービスに依存しています。医療インフラへの投資拡大と革新的なデバイスの発売により、市場の潜在性はさらに高まっています。バーチャルおよびハイブリッド試験モデルの導入は、アドバイザリーソリューションへの依存を促進しています。これらの要因が総合して、CRO は最も急速に成長しているエンドユーザー セグメントとなっています。
医療機器臨床調査アドバイザリーソリューション市場の地域分析
- 医療機器臨床調査アドバイザリーソリューション市場は、2025年に北米が39.2%という最大の収益シェアで市場を席巻した。
- 成熟したヘルスケアエコシステム、医療機器企業の集中、臨床研究を支援する強力な規制枠組みによって推進されている
- この地域は、高度な臨床試験インフラ、高度なスキルを持つ研究専門家、確立された規制遵守システムの恩恵を受けており、医療機器開発、臨床検証、規制申請に関するアドバイザリーサービスのアウトソーシングを促進しています。
米国医療機器臨床調査アドバイザリーソリューション市場インサイト
米国の医療機器臨床調査アドバイザリー・ソリューション市場は、アウトソーシングされた臨床アドバイザリーサービスの普及率の高さと、医療機器承認における規制に関する専門知識の需要の高まりに牽引され、2025年には北米市場における収益の大部分を占めると予測されています。企業は、臨床試験の設計、規制戦略の策定、申請の効率的な管理のために、専門のアドバイザリー会社を活用するケースが増えています。これは、市販前承認やFDA規制への準拠が必要な新規医療機器にとって特に重要です。米国の強力な研究インフラに加え、イノベーションと迅速な医療機器承認への注力も、市場の成長を牽引し続けています。
欧州医療機器臨床調査アドバイザリーソリューション市場インサイト
欧州の医療機器臨床研究アドバイザリー・ソリューション市場は、EU医療機器規則(MDR)などの厳格な規制、革新的な医療機器の導入増加、そして臨床研究イニシアチブの拡大を背景に、予測期間中に大幅なCAGRで拡大すると予測されています。企業は、複雑なコンプライアンス要件への対応、多施設試験の管理、そして規制申請の迅速化を目的として、臨床アドバイザリー・サービスのアウトソーシングをますます増やしています。
英国医療機器臨床調査アドバイザリーソリューション市場インサイト
英国の医療機器臨床研究アドバイザリー・ソリューション市場は、成熟したヘルスケア・エコシステム、強固な臨床研究インフラ、そして医療機器のイノベーションを促進する政府の取り組みに支えられ、着実な成長が見込まれています。英国の規制環境は、臨床試験の管理、規制戦略、そして英国MDR(医療機器規制)および国際基準への準拠に関して、専門のアドバイザリー会社へのアウトソーシングを推奨しています。低侵襲性医療機器や先端技術を搭載した医療機器の増加に伴い、臨床検証や市場参入戦略に関する専門家の指導に対する需要も高まっています。
ドイツ 医療機器臨床調査アドバイザリーソリューション市場インサイト
ドイツの医療機器臨床調査アドバイザリー・ソリューション市場は、確立された医療インフラ、医療技術の普及率の高さ、そして研究開発への注力に牽引され、欧州市場の成長を牽引する重要な要因となっています。ドイツの医療機器メーカーは、MDR(医療機器医薬品規制)への準拠、効果的な臨床試験の設計、そして革新的な機器の迅速な承認取得のために、臨床調査アドバイザリー・ソリューションへの依存度を高めています。同国が精密医療、デジタルヘルス技術、そして最先端診断に重点を置いていることも、アウトソーシング・アドバイザリー・サービスの需要をさらに加速させています。
アジア太平洋地域医療機器臨床調査アドバイザリーソリューション市場インサイト
アジア太平洋地域の医療機器臨床調査アドバイザリー・ソリューション市場は、医療機器業界の急速な拡大、臨床アドバイザリーサービスのアウトソーシングの増加、そして規制要件の厳格化により、予測期間中に最も急速に成長する地域になると予想されています。医療インフラの整備、医療機器製造の拡大、そして費用対効果の高いアドバイザリー専門知識へのアクセスが、主要な成長要因となっています。中国、インド、日本などの国々では、革新的な機器のタイムリーなコンプライアンスと市場承認を確保するための臨床アドバイザリーサービスの需要が高まっています。
日本 医療機器臨床調査アドバイザリーソリューション市場インサイト
日本の医療機器臨床研究アドバイザリー・ソリューション市場の成長は、先進的なヘルスケア分野、高齢化社会、そして革新的な医療機器への旺盛な需要に支えられています。臨床アドバイザリー会社は、医療機器メーカーに対し、規制当局への申請、試験設計、そして現地基準への準拠といった面でサポートを提供し、効率的な臨床検証と市場への迅速な参入を実現します。
中国 医療機器臨床調査アドバイザリーソリューション市場インサイト
中国の医療機器臨床調査アドバイザリーソリューション市場は、急速に拡大する国内医療機器産業、規制遵守を促進する政府の取り組み、そして世界的なアドバイザリーファームとの連携に牽引され、2025年にはアジア太平洋地域で最大の市場収益シェアを占めると予測されています。こうした環境により、医療機器の承認サイクルの短縮と市場アクセスの改善が促進され、臨床調査アドバイザリーソリューションの需要がさらに高まっています。
医療機器臨床調査アドバイザリーソリューションの市場シェア
医療機器臨床調査アドバイザリーソリューション業界は、主に、次のような定評のある企業によって牽引されています。
- メドペース(米国)
- ICON plc(アイルランド)
- PPD Inc.(米国)
- パレクセル・インターナショナル(米国)
- チャールズリバーラボラトリーズ(米国)
- コーヴァンス社(米国)
- メドトロニック臨床試験サービス(米国)
- サイネオス・ヘルス(米国)
- Eurofins Scientific (ルクセンブルク)
- 医薬品開発(PPD)(米国)
- 無錫AppTec(中国)
- SGSライフサイエンス(スイス)
- ラボコープ医薬品開発(米国)
- パレクセル・インターナショナル・コーポレーション(米国)
- CRFヘルス(英国)
- PRAヘルスサイエンス(米国)
- アクセンチュア ライフサイエンス(アイルランド)
- コーヴァンス(米国)
- クリニペース(米国)
世界の医療機器臨床調査アドバイザリーソリューション市場の最新動向
- 2025年1月、タイガーメッドはメディデータとの戦略的パートナーシップを拡大し、メディデータのデジタルプラットフォームを使用して医療機器の臨床試験を加速し、データキャプチャを自動化し、世界中の臨床試験でCRO業務を合理化し、試験管理の効率を高めました。
- 2025年1月、NAMSAはWuXi AppTecの米国医療機器試験事業を買収し、臨床研究および試験ソリューションのポートフォリオを拡大し、規制承認と市場準備を求める機器メーカーに、より包括的な前臨床および臨床アドバイザリーサービスを提供しています。
- 2025年1月、キャニオンラボはiuvoバイオサイエンスのラボサービスおよびコンサルティング事業の買収を完了し、医療機器のライフサイクル全体にわたるアドバイザリーソリューションの不可欠な要素である生体適合性試験や分析試験などのCROサポートサービスを強化しました。
- 2025年2月、Arterexはイタリアに拠点を置く医療機器の設計開発会社であるPhoenixを買収し、欧州市場における機器試験および規制遵守のためのエンドツーエンドの臨床開発サポートとアドバイザリーサービスを強化しました。
- 2025年2月、ArterexはAdroitも買収し、世界的な契約研究および製造能力を拡大し、医療機器企業向けの臨床開発および規制に関するアドバイザリーサービスの合理化を促進しました。
- 2025年3月、インタンデムキャピタルはクリニラボへの戦略的投資を発表した。これは、医療機器研究に特化したCROへの投資家の関心が高まっていることを示しており、間接的に研究および規制戦略に関するアドバイザリーサービスに貢献している。
- 2025年3月、ICON plcはアジア太平洋地域における規制アウトソーシングサービスを拡大し、中国やインドなどの市場の医療機器顧客向けに、より迅速で地域に特化した規制コンサルティングと臨床試験サポートに重点を置きました。
SKU-
世界初のマーケットインテリジェンスクラウドに関するレポートにオンラインでアクセスする
- インタラクティブなデータ分析ダッシュボード
- 成長の可能性が高い機会のための企業分析ダッシュボード
- カスタマイズとクエリのためのリサーチアナリストアクセス
- インタラクティブなダッシュボードによる競合分析
- 最新ニュース、更新情報、トレンド分析
- 包括的な競合追跡のためのベンチマーク分析のパワーを活用
調査方法
データ収集と基準年分析は、大規模なサンプル サイズのデータ収集モジュールを使用して行われます。この段階では、さまざまなソースと戦略を通じて市場情報または関連データを取得します。過去に取得したすべてのデータを事前に調査および計画することも含まれます。また、さまざまな情報ソース間で見られる情報の不一致の調査も含まれます。市場データは、市場統計モデルと一貫性モデルを使用して分析および推定されます。また、市場シェア分析と主要トレンド分析は、市場レポートの主要な成功要因です。詳細については、アナリストへの電話をリクエストするか、お問い合わせをドロップダウンしてください。
DBMR 調査チームが使用する主要な調査方法は、データ マイニング、データ変数が市場に与える影響の分析、および一次 (業界の専門家) 検証を含むデータ三角測量です。データ モデルには、ベンダー ポジショニング グリッド、市場タイムライン分析、市場概要とガイド、企業ポジショニング グリッド、特許分析、価格分析、企業市場シェア分析、測定基準、グローバルと地域、ベンダー シェア分析が含まれます。調査方法について詳しくは、お問い合わせフォームから当社の業界専門家にご相談ください。
カスタマイズ可能
Data Bridge Market Research は、高度な形成的調査のリーダーです。当社は、既存および新規のお客様に、お客様の目標に合致し、それに適したデータと分析を提供することに誇りを持っています。レポートは、対象ブランドの価格動向分析、追加国の市場理解 (国のリストをお問い合わせください)、臨床試験結果データ、文献レビュー、リファービッシュ市場および製品ベース分析を含めるようにカスタマイズできます。対象競合他社の市場分析は、技術ベースの分析から市場ポートフォリオ戦略まで分析できます。必要な競合他社のデータを、必要な形式とデータ スタイルでいくつでも追加できます。当社のアナリスト チームは、粗い生の Excel ファイル ピボット テーブル (ファクト ブック) でデータを提供したり、レポートで利用可能なデータ セットからプレゼンテーションを作成するお手伝いをしたりすることもできます。