Asia Pacific Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Tamanho do mercado em biliões de dólares
CAGR :
% 
 USD
130.00 Million
USD
403.24 Million
2025
2033
USD
130.00 Million
USD
403.24 Million
2025
2033
| 2026 –2033 | |
| USD 130.00 Million | |
| USD 403.24 Million | |
|
|
|
|
Segmentação do mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado na região Ásia-Pacífico, por produto (soluções locais, soluções em nuvem e soluções baseadas na web), abordagem (avaliação de resultados relatados pelo clínico (ClinRO), avaliação de resultados relatados pelo paciente (PRO), avaliação de resultados relatados pelo observador (ObsRO) e avaliação de resultados de desempenho (PerfO)), usuário final (provedores de serviços comerciais, hospitais e centros de transplante, laboratórios de pesquisa e instituições acadêmicas), plataforma (organizações de pesquisa contratadas, empresas farmacêuticas e biofarmacêuticas, fabricantes de dispositivos médicos, hospitais e laboratórios clínicos, empresas de consultoria, pesquisa e academia e outros) - Tendências e previsões do setor até 2033
Tamanho do mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado na região Ásia-Pacífico
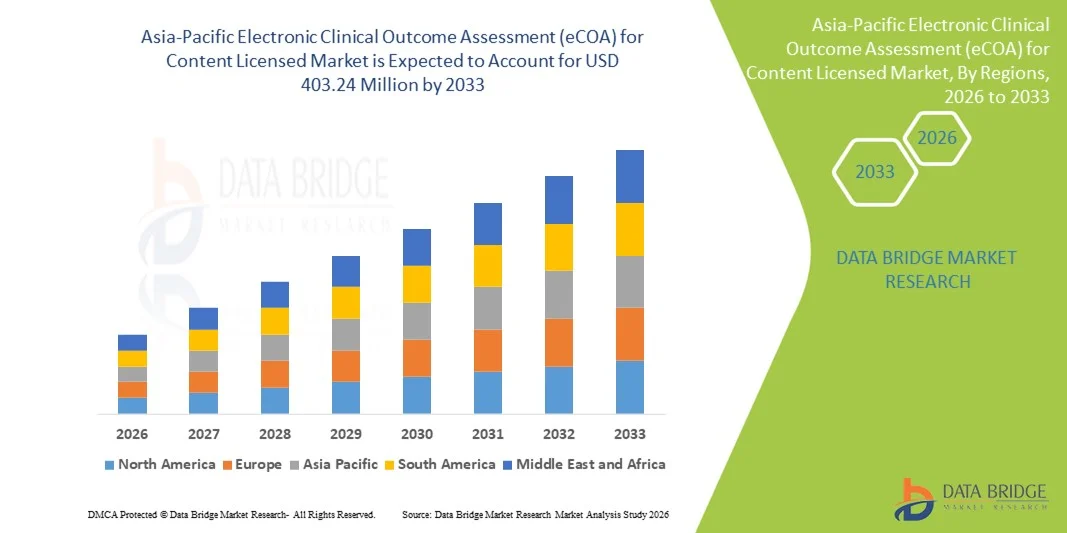
- O mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado na região Ásia-Pacífico foi avaliado em US$ 130 milhões em 2025 e deverá atingir US$ 403,24 milhões até 2033 , com uma taxa de crescimento anual composta (CAGR) de 15,2% durante o período de previsão.
- O crescimento do mercado é impulsionado principalmente pela crescente adoção de tecnologias de saúde digital em ensaios clínicos, pelo incentivo regulatório à captura eletrônica de dados e pela demanda crescente por soluções de monitoramento remoto de resultados centradas no paciente. Essas tendências estão levando patrocinadores de pesquisas clínicas e CROs a migrarem de métodos tradicionais em papel para plataformas digitais de avaliação de resultados em tempo real.
- Além disso, a rápida expansão da atividade de ensaios clínicos nos principais mercados da Ásia-Pacífico, os crescentes investimentos em plataformas de eCOA em nuvem/móveis e a forte ênfase na precisão dos dados, na conformidade e na integração com sistemas eClínicos mais abrangentes estão acelerando a adoção. Esses fatores convergentes estão posicionando o eCOA como um componente essencial da infraestrutura moderna de pesquisa clínica, impulsionando significativamente o crescimento do setor.
Análise do mercado de conteúdo licenciado com avaliação eletrônica de resultados clínicos (eCOA) na região Ásia-Pacífico
- As soluções de avaliação eletrônica de desfechos clínicos (eCOA), que fornecem plataformas digitais para a coleta de dados relatados por pacientes, médicos e observadores, estão se tornando ferramentas essenciais em ensaios clínicos nos setores farmacêutico e de dispositivos médicos, devido à sua capacidade de aprimorar a precisão dos dados, permitir o monitoramento em tempo real e integrar-se perfeitamente a sistemas eClínicos mais abrangentes.
- A crescente adoção do eCOA é impulsionada principalmente pelo foco cada vez maior em ensaios clínicos centrados no paciente, pelo incentivo regulatório à captura eletrônica de dados e pela crescente demanda por soluções remotas e descentralizadas para ensaios clínicos que minimizem as visitas aos centros de pesquisa, ao mesmo tempo que aprimoram a conformidade e o engajamento.
- Em 2025, o Japão dominou o mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado na região Ásia-Pacífico, com a maior participação de receita, de 38,5%. Esse desempenho foi caracterizado por uma infraestrutura avançada de saúde digital, um grande número de ensaios clínicos em andamento e a presença de fornecedores de tecnologia líderes que oferecem plataformas integradas de eCOA.
- Prevê-se que a China seja o país com o crescimento mais rápido no mercado durante o período de previsão, devido ao aumento da atividade de ensaios clínicos, ao crescente investimento em plataformas móveis e em nuvem, à expansão do apoio regulatório à captura eletrônica de dados e à crescente adoção de soluções digitais centradas no paciente.
- O segmento de resultados relatados pelo paciente (PRO, na sigla em inglês) dominou o mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA, na sigla em inglês) para conteúdo licenciado na região Ásia-Pacífico, com uma participação de mercado de 45,2% em 2025, impulsionado por seu papel crucial na captura de feedback do paciente em tempo real, garantindo a conformidade com os padrões regulatórios e fornecendo insights acionáveis para os patrocinadores de ensaios clínicos.
Escopo do relatório e segmentação do mercado de conteúdo licenciado na região Ásia-Pacífico com base em avaliações eletrônicas de resultados clínicos (eCOA).
|
Atributos |
Análise Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado: Principais Insights de Mercado na Região Ásia-Pacífico |
|
Segmentos abrangidos |
|
|
Países abrangidos |
Ásia-Pacífico
|
|
Principais participantes do mercado |
|
|
Oportunidades de mercado |
|
|
Conjuntos de informações de dados de valor agregado |
Além das informações sobre cenários de mercado, como valor de mercado, taxa de crescimento, segmentação, cobertura geográfica e principais players, os relatórios de mercado elaborados pela Data Bridge Market Research também incluem análises aprofundadas de especialistas, epidemiologia de pacientes, análise de projetos em desenvolvimento, análise de preços e estrutura regulatória. |
Tendências do mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado na região Ásia-Pacífico
Integração digital e móvel para ensaios clínicos centrados no paciente
- Uma tendência significativa e crescente no mercado de eCOA (Certificado Eletrônico de Avaliação Clínica) para conteúdo licenciado na região Ásia-Pacífico é a integração de dispositivos móveis, plataformas em nuvem e aplicativos voltados para pacientes, permitindo a coleta de resultados clínicos em tempo real, ao mesmo tempo que aumenta o engajamento do paciente e a adesão ao ensaio clínico.
- Por exemplo, plataformas como o Medidata eCOA Mobile permitem que os pacientes enviem resultados relatados pelos pacientes (PROs) e pelos médicos por meio de smartphones e tablets, possibilitando a coleta remota de dados de forma integrada e melhorando a adesão ao tratamento.
- A integração de plataformas digitais e móveis com registros eletrônicos de saúde (EHR) e sistemas eClínicos mais abrangentes permite o monitoramento de dados em tempo real, a redução de erros e a simplificação da geração de relatórios regulatórios. Por exemplo, isso permite que os patrocinadores acompanhem as respostas dos pacientes instantaneamente e ajustem os protocolos conforme necessário.
- A crescente adoção de dispositivos vestíveis e sensores para monitoramento contínuo de pacientes complementa as plataformas eCOA, permitindo a coleta de dados objetivos de alta frequência, juntamente com resultados subjetivos, para uma visão mais holística da saúde do paciente.
- Essa tendência em direção a uma avaliação de resultados digitais mais integrada, amigável ao paciente e em tempo real está remodelando fundamentalmente os processos de ensaios clínicos. Por exemplo, empresas como a CRF Health e a ERT estão desenvolvendo soluções de eCOA (avaliação eletrônica de resultados clínicos) habilitadas para dispositivos móveis com interfaces personalizáveis e lembretes automatizados para aumentar a adesão do paciente.
- A demanda por plataformas eCOA digitais, móveis e integradas à nuvem está crescendo rapidamente em ensaios clínicos de produtos farmacêuticos e dispositivos médicos, à medida que os patrocinadores priorizam a coleta de dados eficiente, precisa e centrada no paciente.
- O uso de interfaces eCOA multilíngues e adaptadas culturalmente está se tornando mais comum para dar suporte a diversas populações de pacientes em países da região Ásia-Pacífico. Por exemplo, as plataformas agora incluem idiomas locais e formatos de perguntas culturalmente sensíveis para melhorar a adesão e a qualidade dos dados.
Dinâmica do mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado na região Ásia-Pacífico
Motorista
Crescente demanda por ensaios clínicos remotos e centrados no paciente
- O crescente foco em ensaios clínicos centrados no paciente, aliado à mudança para ensaios clínicos descentralizados e híbridos, é um fator-chave para o crescimento do mercado de licenciamento de conteúdo eletrônico (eCOA) na região Ásia-Pacífico.
- Por exemplo, em 2025, a Medrio lançou um módulo eCOA projetado para ensaios clínicos remotos na Índia e na China, permitindo que os patrocinadores registrem os resultados sem a necessidade de visitas frequentes aos locais de coleta de dados.
- À medida que os patrocinadores de ensaios clínicos buscam melhorar o engajamento e a adesão dos pacientes, as plataformas eCOA oferecem monitoramento, alertas e lembretes em tempo real, reduzindo a falta de dados e aprimorando a qualidade geral do ensaio.
- Além disso, a crescente adoção de tecnologias digitais e móveis em centros de pesquisa clínica está tornando as soluções eCOA a escolha preferencial, oferecendo integração perfeita com outras ferramentas e sistemas de dados clínicos eletrônicos.
- A capacidade de coletar remotamente dados relatados por pacientes, médicos e observadores por meio de smartphones ou tablets é um fator crucial que acelera a adoção dessa tecnologia em ensaios clínicos de produtos farmacêuticos e dispositivos médicos.
- A expansão de ensaios clínicos híbridos e descentralizados na região Ásia-Pacífico, combinada com o crescente incentivo regulatório para a captura eletrônica de dados, impulsiona ainda mais o crescimento robusto das soluções de eCOA (avaliação clínica eletrônica).
- O aumento do investimento de empresas farmacêuticas multinacionais em ensaios clínicos na região Ásia-Pacífico está impulsionando a demanda por plataformas eCOA escaláveis e padronizadas. Por exemplo, os patrocinadores estão implementando plataformas unificadas em diversos países para melhorar a eficiência e a conformidade.
- A crescente ênfase na tomada de decisões baseada em dados e em cronogramas mais curtos para ensaios clínicos está incentivando os patrocinadores a adotarem soluções eCOA que fornecem análises e relatórios instantâneos. Por exemplo, painéis de controle em tempo real permitem que os gerentes de ensaios clínicos monitorem as respostas dos pacientes e ajustem os protocolos de forma proativa.
Restrição/Desafio
Preocupações com a privacidade de dados e obstáculos à conformidade regulatória
- As preocupações em torno da segurança dos dados dos pacientes, da privacidade e da conformidade regulatória representam desafios significativos para uma adoção mais ampla das plataformas eCOA na região da Ásia-Pacífico.
- Por exemplo, relatos de grande repercussão sobre violações de dados eletrônicos de saúde deixaram alguns patrocinadores e pacientes cautelosos em relação à coleta remota de dados digitais.
- Garantir a conformidade com regulamentações regionais, como a Lei de Proteção de Informações Pessoais do Japão (APPI) e a Lei de Proteção de Informações Pessoais da China (PIPL), exige criptografia robusta, autenticação segura e software validado, o que pode ser complexo e dispendioso de implementar.
- Além disso, as diferenças nos padrões e requisitos regulatórios entre os países da região Ásia-Pacífico podem retardar a implantação e a adoção da plataforma, exigindo esforços adicionais de localização e validação.
- Embora as plataformas de eCOA em nuvem e móveis melhorem a conveniência e a eficiência, o risco percebido de violações de segurança cibernética e não conformidade pode dificultar a adoção, principalmente entre patrocinadores menores ou CROs com recursos de TI limitados.
- Superar esses desafios por meio de medidas robustas de segurança de dados, adesão às diretrizes regulatórias e comunicação clara das práticas de conformidade será vital para o crescimento sustentado do mercado.
- A infraestrutura e a expertise técnica limitadas em centros clínicos menores em alguns países da região Ásia-Pacífico podem dificultar a adoção de soluções avançadas de eCOA. Por exemplo, esses centros podem não ter o suporte de TI necessário para implementar sistemas de eCOA baseados em nuvem ou móveis de forma eficiente.
- A variabilidade na alfabetização digital dos pacientes também pode ser uma barreira, já que alguns participantes podem ter dificuldades com plataformas móveis ou online. Por exemplo, os patrocinadores precisam fornecer treinamento e interfaces intuitivas para garantir a coleta de dados precisa e completa.
Escopo do mercado de conteúdo licenciado para avaliação eletrônica de resultados clínicos (eCOA) na região Ásia-Pacífico
O mercado está segmentado com base no produto, na abordagem, no usuário final e na plataforma.
- Por produto
Com base no produto, o mercado de eCOA (Orientação Clínica Eletrônica) para conteúdo licenciado na região Ásia-Pacífico é segmentado em Soluções On-Premise, Soluções em Nuvem e Soluções Web. As Soluções em Nuvem dominaram o mercado com a maior participação na receita em 2025, impulsionadas por sua flexibilidade, escalabilidade e capacidade de suportar ensaios clínicos remotos em múltiplos locais. Os patrocinadores preferem cada vez mais as plataformas em nuvem, pois elas permitem o acesso em tempo real aos resultados relatados pelos pacientes (PROs), resultados relatados pelos médicos (ClinROs) e outros dados de eCOA, sem a necessidade de uma infraestrutura de TI extensa em cada local. As soluções em nuvem também facilitam a integração com outros sistemas eClínicos, reduzindo discrepâncias de dados e acelerando a análise. Sua adoção é ainda mais reforçada pela aceitação regulatória da captura eletrônica de dados em ensaios descentralizados. A capacidade de suportar dispositivos móveis, tablets e wearables aumenta o engajamento e a adesão dos pacientes. As soluções em nuvem também permitem atualizações de software contínuas e gerenciamento centralizado dos dados do ensaio, reduzindo os custos operacionais para os patrocinadores.
Prevê-se que as soluções baseadas na Web apresentem o crescimento mais rápido entre 2026 e 2033, impulsionadas pela crescente necessidade de plataformas acessíveis por navegador que não exijam a instalação de softwares complexos. As ferramentas eCOA baseadas na Web permitem que centros clínicos e pacientes insiram dados a partir de qualquer dispositivo com conexão à internet, melhorando a participação em ensaios clínicos descentralizados. Elas são particularmente atraentes para instituições acadêmicas e organizações de pesquisa menores que buscam soluções econômicas e escaláveis. As soluções baseadas na Web também oferecem interfaces multilíngues e adaptadas culturalmente, essenciais para ensaios clínicos que abrangem diversos países da região Ásia-Pacífico. A facilidade de uso, os baixos requisitos de manutenção e a compatibilidade com vários sistemas operacionais são fatores-chave para sua adoção. A crescente preferência por ensaios clínicos híbridos, que combinam visitas presenciais com coleta remota de dados, acelera ainda mais a adoção de soluções baseadas na Web.
- Por abordagem
Com base na abordagem, o mercado é segmentado em Avaliação de Resultados Relatados pelo Clínico (ClinRO), Avaliação de Resultados Relatados pelo Paciente (PRO), Avaliação de Resultados Relatados pelo Observador (ObsRO) e Avaliação de Resultados de Desempenho (PerfO). A Avaliação de Resultados Relatados pelo Paciente (PRO) dominou o mercado com a maior participação na receita, de 45,2% em 2025, impulsionada pela crescente ênfase em ensaios clínicos centrados no paciente. As plataformas PRO permitem que os pacientes relatem diretamente seus sintomas, qualidade de vida e respostas ao tratamento, fornecendo aos patrocinadores informações autênticas e em tempo real. A adoção de plataformas PRO móveis e baseadas em nuvem aprimorou a adesão e reduziu a falta de dados, principalmente em ensaios descentralizados ou híbridos. Agências regulatórias, incluindo a PMDA do Japão e a NMPA da China, incentivam cada vez mais a coleta eletrônica de dados PRO para endpoints precisos. As soluções PRO também permitem o monitoramento em tempo real e alertas automatizados, possibilitando que as equipes clínicas respondam rapidamente a eventos adversos ou não conformidade. Seu domínio é sustentado pela crescente demanda em áreas terapêuticas como oncologia, neurologia e doenças crônicas, onde o feedback do paciente é fundamental.
A Avaliação de Resultados Relatados pelo Observador (ObsRO, na sigla em inglês) deverá apresentar o crescimento mais rápido entre 2026 e 2033, particularmente em ensaios clínicos pediátricos, geriátricos e de doenças raras. As plataformas de ObsRO permitem que cuidadores ou membros da equipe de pesquisa relatem os resultados dos pacientes nos casos em que estes não podem fazê-lo por conta própria, garantindo a coleta de dados abrangente e precisa. O aumento do monitoramento remoto e das plataformas móveis impulsionou a adoção da ObsRO, facilitando o envio de dados em tempo real pelos observadores. As soluções de ObsRO também estão ganhando força devido à ênfase regulatória na inclusão de populações de pacientes vulneráveis em ensaios clínicos. A crescente complexidade dos estudos clínicos e a necessidade de validação de dados de múltiplas fontes impulsionam ainda mais a adoção da ObsRO. A integração com outras abordagens de eCOA (avaliação eletrônica de resultados clínicos), como PRO (resultados relatados pelo paciente) e ClinRO, aprimora a qualidade dos dados e fornece insights holísticos para os patrocinadores.
- Por usuário final
Com base no usuário final, o mercado é segmentado em provedores de serviços comerciais, hospitais e centros de transplante, laboratórios de pesquisa e instituições acadêmicas. Os provedores de serviços comerciais dominaram o mercado com a maior participação na receita em 2025, impulsionados por sua expertise em fornecer soluções eCOA escaláveis e validadas para múltiplos patrocinadores e ensaios clínicos. Esses provedores oferecem serviços completos, incluindo implantação de software, treinamento, suporte técnico e orientação sobre conformidade regulatória. Seu domínio é ainda mais reforçado pela crescente tendência de terceirização entre empresas farmacêuticas e de biotecnologia, que preferem provedores comerciais para gerenciar ensaios clínicos complexos e descentralizados. A implantação baseada em nuvem e os serviços de monitoramento em tempo real aumentam a eficiência e a adesão do paciente. Os provedores de serviços comerciais também oferecem soluções personalizáveis, adaptadas a áreas terapêuticas, tamanho do estudo e regulamentações regionais, tornando-os a escolha preferencial para ensaios clínicos multinacionais. Sua capacidade de integração com outras plataformas eClinical garante o gerenciamento centralizado de dados e cronogramas de ensaios clínicos mais rápidos.
Prevê-se que as instituições acadêmicas apresentem o crescimento mais rápido entre 2026 e 2033, impulsionadas pelo aumento da atividade de pesquisa clínica em universidades e hospitais universitários na região da Ásia-Pacífico. Essas instituições necessitam de soluções eCOA flexíveis e com boa relação custo-benefício que deem suporte a protocolos de pesquisa, engajamento do paciente e conformidade regulatória. A adoção de plataformas eCOA baseadas na web e compatíveis com dispositivos móveis facilita a participação em ensaios multicêntricos e estudos colaborativos. Os usuários acadêmicos também se beneficiam de plataformas que oferecem anonimização de dados e compartilhamento seguro para fins de pesquisa. O aumento do financiamento governamental e as iniciativas para digitalizar a pesquisa clínica em países como Índia, China e Japão estão acelerando ainda mais a adoção. A necessidade de relatórios em tempo real e análise de resultados para publicações acadêmicas também impulsiona o crescimento nesse segmento.
- Por plataforma
Com base na plataforma, o mercado é segmentado em organizações de pesquisa contratada (CROs), empresas farmacêuticas e biofarmacêuticas, fabricantes de dispositivos médicos, hospitais e laboratórios clínicos, empresas de consultoria, instituições de pesquisa e acadêmicas, e outros. As Organizações de Pesquisa Contratada (CROs) dominaram o mercado com a maior participação na receita em 2025, impulsionadas por sua capacidade de gerenciar múltiplos ensaios clínicos em diversas regiões geográficas, utilizando sistemas eCOA centralizados e validados. As CROs oferecem aos patrocinadores a vantagem de terceirizar as complexidades técnicas e regulatórias, incluindo configuração do sistema, treinamento e auditorias de conformidade. Suas plataformas baseadas em nuvem permitem acesso em tempo real aos dados de resultados clínicos, aprimorando o monitoramento e acelerando a tomada de decisões. As CROs também utilizam análises habilitadas por IA para identificar tendências, monitorar a adesão do paciente e sinalizar inconsistências. Seu domínio é reforçado por fortes parcerias com empresas farmacêuticas e de biotecnologia que conduzem ensaios em larga escala na região da Ásia-Pacífico. Plataformas eCOA padronizadas entre as CROs também facilitam as submissões regulatórias em múltiplos países.
Espera-se que as empresas farmacêuticas e biofarmacêuticas apresentem o crescimento mais rápido entre 2026 e 2033, à medida que adotam cada vez mais plataformas eCOA internas para otimizar os ensaios clínicos e aprimorar a coleta de dados centrada no paciente. A implementação direta permite que os patrocinadores mantenham o controle sobre a integridade e a conformidade dos dados, reduzindo a dependência de provedores de serviços terceirizados. O crescimento é impulsionado pelo aumento dos investimentos em soluções móveis e em nuvem que suportam modelos de ensaios híbridos e descentralizados. As empresas também estão utilizando plataformas eCOA para acelerar os cronogramas dos ensaios, aprimorar o engajamento do paciente e cumprir os requisitos regulatórios para coleta eletrônica de dados. A integração com outros sistemas digitais, como EHR e gerenciamento de dados laboratoriais, fortalece ainda mais a adoção entre as empresas farmacêuticas e de biotecnologia.
Análise Regional do Mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado na Ásia-Pacífico
- Em 2025, o Japão dominou o mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado na região Ásia-Pacífico, com a maior participação de receita, de 38,5%. Esse desempenho foi caracterizado por uma infraestrutura avançada de saúde digital, um grande número de ensaios clínicos em andamento e a presença de fornecedores de tecnologia líderes que oferecem plataformas integradas de eCOA.
- Patrocinadores e centros clínicos no Japão valorizam muito a eficiência, o monitoramento em tempo real e os recursos de conformidade regulatória oferecidos pelas plataformas eCOA, permitindo a captura precisa e oportuna de resultados relatados por pacientes, médicos e observadores.
- Essa ampla adoção é ainda mais sustentada por redes de pesquisa clínica bem estabelecidas, pelo crescente apoio governamental às tecnologias de saúde digital e pelo interesse cada vez maior de empresas farmacêuticas e biofarmacêuticas em modelos de ensaios clínicos descentralizados e híbridos, consolidando o eCOA como uma solução preferencial para a coleta de resultados clínicos.
Análise Eletrônica de Resultados Clínicos (eCOA) para o Mercado de Conteúdo Licenciado no Japão
O mercado japonês de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado está ganhando impulso devido à infraestrutura avançada de saúde digital do país, à alta atividade de ensaios clínicos e ao foco em pesquisas centradas no paciente. A adoção de plataformas PRO e ClinRO habilitadas para dispositivos móveis é impulsionada pelo crescente número de hospitais inteligentes e centros de pesquisa clínica conectados. A integração com sistemas EHR e plataformas eClinical mais abrangentes está aprimorando o monitoramento em tempo real, a conformidade regulatória e a eficiência operacional. O envelhecimento da população japonesa também está impulsionando a demanda por soluções de fácil compreensão para o paciente e de resultados relatados pelo observador (ObsRO) em ensaios clínicos, tanto residenciais quanto hospitalares. Além disso, os patrocinadores estão utilizando IA e análises em plataformas eCOA para aprimorar a qualidade dos dados e otimizar a tomada de decisões nos ensaios clínicos.
Análise do mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado na China
O mercado chinês de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado deverá crescer à taxa mais rápida na região Ásia-Pacífico durante o período de previsão, impulsionado por um aumento nos ensaios clínicos, incentivos governamentais para a adoção da saúde digital e uso crescente de plataformas de avaliação de resultados baseadas em dispositivos móveis e na nuvem. Os patrocinadores estão implementando cada vez mais ensaios descentralizados para alcançar populações de pacientes mais amplas, aproveitando as soluções de eCOA para monitoramento de pacientes em tempo real. A integração com dispositivos vestíveis e ferramentas de relatório remoto está aprimorando a precisão dos dados e a conformidade. O crescimento também é sustentado pela expansão dos serviços de CRO e por provedores de plataformas nacionais que oferecem soluções escaláveis e econômicas. Além disso, a aceitação regulatória para dados eletrônicos de PRO, ClinRO e ObsRO está incentivando a adoção entre empresas farmacêuticas e de biotecnologia.
Análise do mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado na Índia
O mercado indiano de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado representou a maior fatia da receita na região Ásia-Pacífico em 2025, devido ao crescente setor de terceirização de pesquisa clínica no país, ao aumento da alfabetização digital entre os pacientes e à rápida adoção de tecnologias de saúde móvel. A ascensão de ensaios clínicos descentralizados, aliada a plataformas de eCOA acessíveis e escaláveis baseadas em nuvem, está facilitando uma adoção mais ampla em hospitais, instituições acadêmicas e CROs (Organizações de Pesquisa Clínica Contratadas). O ecossistema de ensaios clínicos em expansão na Índia, apoiado pelo incentivo regulatório à captura eletrônica de resultados, está permitindo uma coleta de dados mais rápida e uma melhor adesão dos pacientes. Além disso, patrocinadores multinacionais estão cada vez mais escolhendo a Índia para estudos multicêntricos devido à relação custo-benefício e à disponibilidade de pessoal qualificado. A adoção de soluções de PRO (Resultados Relatados pelo Paciente) e ObsRO (Observância de Resultados Relatados pelo Paciente) está aprimorando ainda mais a qualidade dos ensaios clínicos e os recursos de monitoramento em tempo real.
Análise Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado na Austrália
O mercado australiano de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado está apresentando crescimento constante devido à infraestrutura de saúde avançada do país, à alta adoção de tecnologias de saúde digital e ao número crescente de ensaios clínicos conduzidos em hospitais e instituições de pesquisa. Patrocinadores e CROs valorizam a Austrália por seu alinhamento regulatório com os padrões globais, o que facilita a implementação de plataformas eletrônicas de PRO, ClinRO, ObsRO e PerfO. O uso generalizado de soluções de eCOA para dispositivos móveis e web aprimora o engajamento e a adesão dos pacientes, principalmente em ensaios descentralizados ou híbridos. A integração com registros eletrônicos de saúde (EHR) e outros sistemas digitais melhora a precisão dos dados e otimiza o gerenciamento dos ensaios. Além disso, a força de trabalho clínica qualificada da Austrália e a ênfase na pesquisa centrada no paciente impulsionam a adoção de plataformas inovadoras de eCOA em ensaios farmacêuticos, biofarmacêuticos e de dispositivos médicos.
Participação de mercado na região Ásia-Pacífico do mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado
O setor de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado na região Ásia-Pacífico é liderado principalmente por empresas consolidadas, incluindo:
- Veeva Systems (EUA)
- Kayentis (França)
- Signant Health (EUA)
- IQVIA Holdings, Inc. (EUA)
- Clinical Ink, Inc. (EUA)
- Medidata Solutions (EUA)
- eCOA GmbH (Alemanha)
- CRF Saúde (Reino Unido)
- Motentia, LLC (EUA)
- Bracket Global LLC (EUA)
- SHYFT Analytics (EUA)
- Mednet Solutions (Austrália)
- SureClinical (EUA)
- Relypsa (EUA)
- OpenClinica, LLC (EUA)
- Clario (EUA)
- Datacubed Saúde (EUA)
- Florence Healthcare (EUA)
- bloqcube (EUA)
- Clínica em tempo real (EUA)
Quais são os desenvolvimentos recentes na avaliação eletrônica de resultados clínicos (eCOA) para o mercado de conteúdo licenciado na região Ásia-Pacífico?
- Em março de 2024, importantes fornecedores de serviços de pesquisa clínica, como a PPD (Thermo Fisher Scientific), destacaram publicamente seus ecossistemas de ensaios clínicos digitais e descentralizados, enfatizando ferramentas e metodologias que apoiam a captura digital de resultados, incluindo o eCOA (avaliação eletrônica de resultados clínicos), projetado para melhorar a qualidade dos dados, reduzir o ônus para o paciente e aumentar a participação em ensaios clínicos em regiões como a Ásia-Pacífico.
- Em dezembro de 2023, a ObvioHealth anunciou o lançamento de sua inovadora solução eletrônica de avaliação de resultados clínicos (eCOA), integrada à plataforma ObvioGo®, que permite a criação rápida de eCOAs, maior engajamento do paciente e prazos de implementação até 70% mais curtos para ensaios clínicos.
- Em agosto de 2023, a Administração Nacional de Produtos Médicos da China (NMPA) e o Centro de Avaliação de Medicamentos (CDE) divulgaram as Diretrizes Técnicas para a Implementação de Ensaios Clínicos Centrados no Paciente, reconhecendo formalmente ferramentas eletrônicas como eCOA, consentimento eletrônico e coleta remota de dados para modernizar as práticas de ensaios clínicos. Essa clareza regulatória apoia o uso expandido de tecnologias eCOA em ensaios clínicos na região da Ásia-Pacífico.
- Em junho de 2023, a ICON plc anunciou uma grande atualização para sua Plataforma Digital ICON, que inclui um módulo eCOA integrado com bibliotecas de avaliação validadas pré-carregadas. A plataforma oferece suporte ao engajamento do paciente, consentimento eletrônico, eCOA e coleta remota de dados em ensaios clínicos tradicionais e descentralizados, reduzindo o tempo de configuração e melhorando a consistência dos dados de resultados.
- Em abril de 2023, a Almac Clinical Technologies anunciou o lançamento de sua Rede de Parceria IXRS®3, permitindo que patrocinadores biofarmacêuticos e CROs compartilhem dados e tecnologias clínicas interoperáveis, incluindo módulos eCOA, para criar experiências de ensaios clínicos mais integradas e inclusivas para centros de pesquisa e pacientes. Essa iniciativa enfatiza a interoperabilidade e a colaboração para otimizar a coleta de dados de ensaios clínicos e aprimorar a integração de eCOA em estudos multicêntricos.
SKU-
Obtenha acesso online ao relatório sobre a primeira nuvem de inteligência de mercado do mundo
- Painel interativo de análise de dados
- Painel de análise da empresa para oportunidades de elevado potencial de crescimento
- Acesso de analista de pesquisa para personalização e customização. consultas
- Análise da concorrência com painel interativo
- Últimas notícias, atualizações e atualizações Análise de tendências
- Aproveite o poder da análise de benchmark para um rastreio abrangente da concorrência
Metodologia de Investigação
A recolha de dados e a análise do ano base são feitas através de módulos de recolha de dados com amostras grandes. A etapa inclui a obtenção de informações de mercado ou dados relacionados através de diversas fontes e estratégias. Inclui examinar e planear antecipadamente todos os dados adquiridos no passado. Da mesma forma, envolve o exame de inconsistências de informação observadas em diferentes fontes de informação. Os dados de mercado são analisados e estimados utilizando modelos estatísticos e coerentes de mercado. Além disso, a análise da quota de mercado e a análise das principais tendências são os principais fatores de sucesso no relatório de mercado. Para saber mais, solicite uma chamada de analista ou abra a sua consulta.
A principal metodologia de investigação utilizada pela equipa de investigação do DBMR é a triangulação de dados que envolve a mineração de dados, a análise do impacto das variáveis de dados no mercado e a validação primária (especialista do setor). Os modelos de dados incluem grelha de posicionamento de fornecedores, análise da linha de tempo do mercado, visão geral e guia de mercado, grelha de posicionamento da empresa, análise de patentes, análise de preços, análise da quota de mercado da empresa, normas de medição, análise global versus regional e de participação dos fornecedores. Para saber mais sobre a metodologia de investigação, faça uma consulta para falar com os nossos especialistas do setor.
Personalização disponível
A Data Bridge Market Research é líder em investigação formativa avançada. Orgulhamo-nos de servir os nossos clientes novos e existentes com dados e análises que correspondem e atendem aos seus objetivos. O relatório pode ser personalizado para incluir análise de tendências de preços de marcas-alvo, compreensão do mercado para países adicionais (solicite a lista de países), dados de resultados de ensaios clínicos, revisão de literatura, mercado remodelado e análise de base de produtos . A análise de mercado dos concorrentes-alvo pode ser analisada desde análises baseadas em tecnologia até estratégias de carteira de mercado. Podemos adicionar quantos concorrentes necessitar de dados no formato e estilo de dados que procura. A nossa equipa de analistas também pode fornecer dados em tabelas dinâmicas de ficheiros Excel em bruto (livro de factos) ou pode ajudá-lo a criar apresentações a partir dos conjuntos de dados disponíveis no relatório.