Europe Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Tamanho do mercado em biliões de dólares
CAGR :
% 
 USD
704.70 Million
USD
2,067.34 Million
2025
2033
USD
704.70 Million
USD
2,067.34 Million
2025
2033
| 2026 –2033 | |
| USD 704.70 Million | |
| USD 2,067.34 Million | |
|
|
|
|
Segmentação do mercado europeu de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado, por produto (soluções locais, soluções em nuvem e soluções baseadas na web), abordagem (avaliação de resultados relatados pelo clínico (ClinRO), avaliação de resultados relatados pelo paciente (PRO), avaliação de resultados relatados pelo observador (ObsRO) e avaliação de resultados de desempenho (PerfO)), usuário final (provedores de serviços comerciais, hospitais e centros de transplante, laboratórios de pesquisa e instituições acadêmicas), plataforma (organizações de pesquisa contratadas, empresas farmacêuticas e biofarmacêuticas , fabricantes de dispositivos médicos , hospitais e laboratórios clínicos, empresas de consultoria, pesquisa e academia e outros) - Tendências e previsões do setor até 2033
Tamanho do mercado europeu de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado
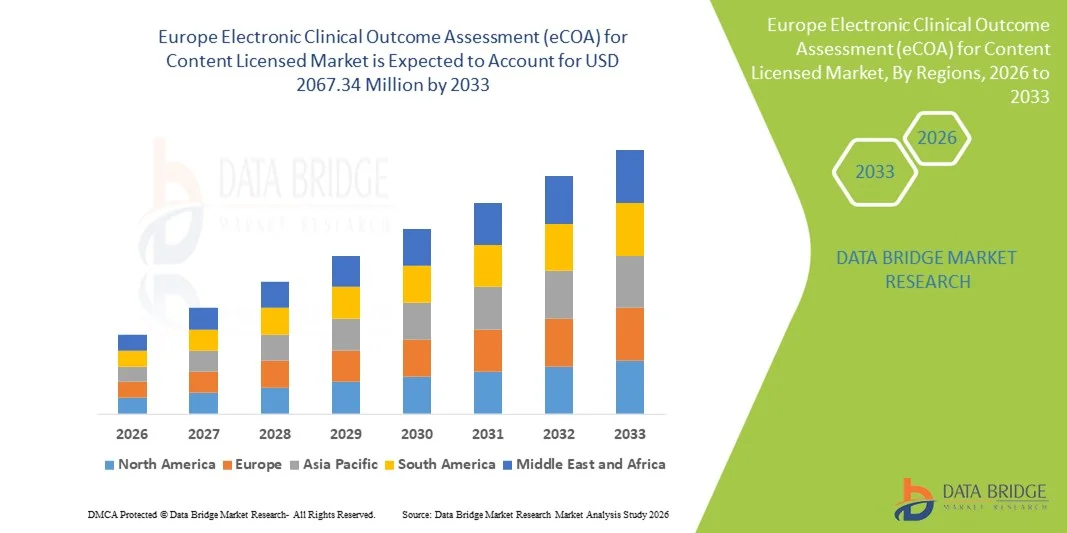
- O mercado europeu de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado foi avaliado em US$ 704,7 milhões em 2025 e deverá atingir US$ 2.067,34 milhões em 2033 , com uma taxa de crescimento anual composta (CAGR) de 14,40% durante o período de previsão.
- O crescimento do mercado é impulsionado principalmente pela crescente adoção de tecnologias digitais em ensaios clínicos, pela ênfase cada vez maior em pesquisas centradas no paciente e pela necessidade de coleta de dados precisa e em tempo real em diversas áreas terapêuticas. A integração de plataformas em nuvem, aplicativos móveis e resultados relatados eletronicamente pelos pacientes (ePRO) está impulsionando ainda mais a expansão do mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado.
- Além disso, a crescente demanda por soluções de ensaios clínicos que sejam compatíveis com as regulamentações, fáceis de usar e escaláveis está consolidando os sistemas eCOA como um componente essencial da pesquisa clínica moderna. Maior eficiência, redução da carga administrativa e melhor engajamento do paciente estão acelerando a adoção da Avaliação Eletrônica de Resultados Clínicos (eCOA) para soluções com Licença de Conteúdo, impulsionando significativamente o crescimento do mercado.
Análise do mercado europeu de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado
- O crescimento do mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para conteúdo licenciado é impulsionado principalmente pela crescente adoção de soluções eletrônicas de resultados relatados pelo paciente (ePRO) e eCOA em ensaios clínicos, motivada pela necessidade de coleta de dados precisa e em tempo real e pelo aprimoramento do monitoramento de pacientes em pesquisas na área da saúde e farmacêutica.
- A crescente demanda por processos simplificados de ensaios clínicos, conformidade regulatória e gerenciamento eficiente de dados está acelerando a adoção da Avaliação Eletrônica de Resultados Clínicos (eCOA) para soluções de Conteúdo Licenciado, impulsionando significativamente o crescimento do setor.
- O Reino Unido dominou o mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado, com a maior participação de receita, de aproximadamente 38,7% em 2025, impulsionado por uma infraestrutura de saúde bem estabelecida, forte adoção de tecnologias digitais para ensaios clínicos e sólido suporte regulatório para o rastreamento eletrônico de resultados de pacientes. O Reino Unido está testemunhando um crescimento substancial nas implementações de eCOA em ensaios clínicos, impulsionado por inovações em plataformas baseadas em nuvem, coleta de dados móveis e integração com sistemas centralizados de gerenciamento de ensaios clínicos.
- A Alemanha deverá ser a região de crescimento mais rápido no mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado durante o período de previsão, com uma forte taxa de crescimento anual composta (CAGR) projetada em dois dígitos. O crescimento é impulsionado pelo aumento da atividade de ensaios clínicos, pelo aumento dos gastos com saúde, pela expansão do acesso a soluções de saúde digital e pela crescente adoção de tecnologias de captura eletrônica de dados e de resultados relatados pelo paciente em hospitais, centros de pesquisa e organizações farmacêuticas.
- O segmento de Soluções Baseadas em Nuvem dominou o mercado com uma participação de 45,3% na receita em 2025, impulsionado pela implantação escalável, facilidade de acesso remoto e integração com múltiplos dispositivos.
Escopo do relatório e avaliação eletrônica de resultados clínicos (eCOA) para segmentação de mercado de conteúdo licenciado.
|
Atributos |
Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado: Principais Insights de Mercado |
|
Segmentos abrangidos |
|
|
Países abrangidos |
Europa
|
|
Principais participantes do mercado |
|
|
Oportunidades de mercado |
|
|
Conjuntos de informações de dados de valor agregado |
Além das informações sobre cenários de mercado, como valor de mercado, taxa de crescimento, segmentação, cobertura geográfica e principais participantes, os relatórios de mercado elaborados pela Data Bridge Market Research também incluem análises aprofundadas de especialistas, epidemiologia de pacientes, análise de projetos em desenvolvimento, análise de preços e estrutura regulatória. |
Tendências do mercado europeu de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado
Adoção crescente de soluções digitais para ensaios clínicos
- Uma das principais tendências no mercado global de eCOA para conteúdo licenciado é a crescente adoção de soluções digitais e remotas para ensaios clínicos, impulsionada pela necessidade de coleta de dados eficiente, em tempo real e centrada no paciente.
- Por exemplo, em março de 2023, a CRF Health (agora parte da Signant Health) expandiu sua plataforma eCOA por toda a Europa para dar suporte a ensaios clínicos totalmente descentralizados, permitindo a coleta eletrônica de resultados relatados pelos pacientes (ePRO) em vários idiomas e protocolos de estudo.
- As ferramentas digitais de eCOA reduzem erros, aceleram a coleta de dados e melhoram a adesão do paciente em comparação com os métodos tradicionais em papel.
- A pandemia de COVID-19 acelerou essa tendência, destacando a necessidade de monitoramento remoto de pacientes e coleta de dados sem contato, que deverá persistir após a pandemia.
- As empresas farmacêuticas e as Organizações de Pesquisa Contratada (CROs) estão integrando cada vez mais plataformas de eCOA com outras tecnologias digitais para ensaios clínicos, como avaliações eletrônicas de resultados clínicos para biomarcadores digitais e dispositivos vestíveis.
Avaliação Eletrônica de Resultados Clínicos (eCOA) na Europa para Dinâmica do Mercado de Conteúdo Licenciado
Motorista
Maior foco em ensaios clínicos centrados no paciente
- A crescente ênfase na centralização no paciente em ensaios clínicos está impulsionando a adoção de plataformas eCOA, permitindo a captura em tempo real de resultados relatados pelo paciente (PROs), monitoramento de sintomas e dados de qualidade de vida relacionados à saúde.
- Por exemplo, em julho de 2024, a Parexel International lançou uma nova solução eCOA personalizada para ensaios clínicos oncológicos em toda a Europa, permitindo que os pacientes relatassem os resultados diretamente de casa, usando interfaces web ou móveis, melhorando o engajamento e a retenção.
- Órgãos reguladores, incluindo a Agência Europeia de Medicamentos (EMA), estão recomendando cada vez mais a coleta digital de PROs (Resultados Relatados pelo Paciente) para submissões de aprovação de medicamentos, incentivando uma adoção mais ampla.
- A capacidade de coletar dados longitudinais, padronizados e de alta qualidade remotamente permite que os patrocinadores otimizem o desenho do estudo e reduzam a carga de trabalho dos centros de pesquisa.
- A integração com sistemas de captura eletrônica de dados (EDC) e plataformas centralizadas de gerenciamento de ensaios clínicos proporciona um fluxo de trabalho contínuo para patrocinadores de ensaios clínicos e CROs, fortalecendo ainda mais a adoção.
Restrição/Desafio
Privacidade de dados, conformidade regulatória e custos de implementação
- O mercado de eCOA enfrenta desafios relacionados à privacidade de dados, conformidade com o GDPR e altos custos de implementação , o que pode retardar a adoção em todo o mundo.
- Por exemplo, em setembro de 2022, várias CROs europeias relataram atrasos na implementação de soluções eCOA na Alemanha e na França devido a regulamentações rigorosas de proteção de dados e à necessidade de armazenamento seguro de dados de pacientes.
- Garantir a conformidade com as leis locais, diretrizes regulatórias e requisitos de validação adiciona complexidade à implementação do eCOA, particularmente para ensaios multinacionais.
- Além disso, os custos de integração com os sistemas de ensaios clínicos existentes , incluindo o treinamento de pessoal e a validação de software, podem ser significativos, representando barreiras para CROs ou patrocinadores de pequeno e médio porte.
- Para enfrentar esses desafios, é necessário investir em cibersegurança robusta, alinhamento regulatório e estratégias de implementação escaláveis e com boa relação custo-benefício para sustentar o crescimento do mercado a longo prazo.
Avaliação Eletrônica de Resultados Clínicos (eCOA) na Europa para Conteúdo Licenciado - Escopo do Mercado
O mercado está segmentado com base no produto, na abordagem, no usuário final e na plataforma.
- Por produto
Com base no produto, o mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado é segmentado em Soluções On-Premise, Soluções em Nuvem e Soluções Web. O segmento de Soluções em Nuvem dominou o mercado com uma participação de 45,3% da receita em 2025, impulsionado pela implantação escalável, facilidade de acesso remoto e integração com múltiplos dispositivos. As plataformas em nuvem permitem que patrocinadores, CROs e centros clínicos gerenciem dados centralmente, aprimorem a conformidade e reduzam os custos de TI. A alta adoção em ensaios clínicos multicêntricos, os protocolos de segurança robustos e os relatórios em tempo real reforçam essa dominância. A flexibilidade dos modelos baseados em assinatura, o alinhamento regulatório e a integração com sistemas EDC e ePRO impulsionam ainda mais o crescimento. Grandes empresas farmacêuticas priorizam soluções em nuvem para ensaios globais. A pandemia de COVID-19 acelerou a adoção devido às necessidades de monitoramento remoto. Maior tempo de atividade e suporte do fornecedor fortalecem a participação de mercado. A validação padronizada entre os centros garante confiabilidade. A relação custo-benefício e a otimização do fluxo de trabalho impulsionam ainda mais a liderança. Recursos aprimorados de análise e painéis atraem usuários finais. A integração com aplicativos móveis melhora a adesão do paciente. De forma geral, esses fatores mantêm a dominância.
O segmento de Soluções On-Premise deverá apresentar a taxa de crescimento anual composta (CAGR) mais rápida, de 14,8%, entre 2026 e 2033, impulsionado por organizações que necessitam de controle e personalização de dados internos. Hospitais, CROs e empresas de biotecnologia com governança de dados rigorosa adotam sistemas on-premise. A integração com a infraestrutura de TI legada aumenta o seu apelo. Os altos requisitos de segurança para dados clínicos sensíveis promovem a adoção. A crescente demanda em regiões com regulamentações rigorosas de privacidade de dados impulsiona o crescimento. Relatórios e análises avançados melhoram a eficiência operacional. Implantações em escala empresarial aceleram o uso. A disponibilidade de módulos personalizáveis atrai grandes patrocinadores. O suporte de TI interno garante uma manutenção robusta. A crescente necessidade de opções de implantação híbrida complementa a expansão. O investimento da indústria farmacêutica em ensaios clínicos de medicina personalizada impulsiona ainda mais a adoção. Treinamento e suporte técnico fortalecem a implementação. O alinhamento regulatório para conformidade com a FDA e a EMA garante uma adoção acelerada.
- Por abordagem
Com base na abordagem, o mercado é segmentado em ClinRO, PRO, ObsRO e PerfO. O segmento de Resultados Relatados pelo Paciente (PRO) dominou com uma participação de 42,1% na receita em 2025, impulsionado pelo uso crescente em submissões regulatórias, ensaios clínicos centrados no paciente e estudos de evidências do mundo real. O PRO permite a mensuração direta do estado de saúde do paciente, satisfação com o tratamento e métricas de qualidade de vida. A integração com aplicativos móveis e plataformas em nuvem aumenta a adoção. O forte apoio das diretrizes da FDA e da EMA reforça a demanda. A alta prevalência de doenças crônicas e ensaios clínicos oncológicos impulsiona o uso. Os desfechos clínicos dependem cada vez mais de dados PRO. O suporte multilíngue expande a implementação global. Lembretes automatizados melhoram a adesão. A coleta frequente de dados aumenta o volume e a utilidade dos dados. A integração com eCOA, diários eletrônicos e dispositivos vestíveis fortalece o fluxo de trabalho. O investimento da indústria farmacêutica em desfechos baseados em PRO acelera a adoção. A escalabilidade entre locais e ensaios clínicos sustenta a dominância. Análises avançadas permitem a segmentação de pacientes e o rastreamento de desfechos.
O segmento de ObsRO (Resultados Relatados por Observadores) deverá apresentar o crescimento mais rápido, com uma taxa composta de crescimento anual (CAGR) de 15,6% entre 2026 e 2033, devido à crescente adoção em doenças raras, pediatria e resultados relatados por cuidadores. Os dados relatados por observadores aprimoram a mensuração em populações incapazes de relatar seus próprios dados. O crescimento em estudos pediátricos e geriátricos impulsiona a demanda. A integração com plataformas de monitoramento remoto facilita a adoção. O investimento de empresas farmacêuticas e biotecnológicas em ensaios clínicos de doenças raras apoia a expansão. A padronização em múltiplos centros melhora a confiabilidade dos dados. Soluções em nuvem e web aceleram a adoção. O relato de observadores via dispositivos móveis aumenta a conformidade. Mercados emergentes estão adotando cada vez mais abordagens de ObsRO. A aceitação regulatória dos endpoints de ObsRO impulsiona o crescimento. Treinamento e suporte aos centros de pesquisa incentivam a implementação. Os avanços tecnológicos reduzem erros de entrada manual de dados. O alto valor agregado para ensaios clínicos com múltiplos participantes acelera o crescimento.
- Por usuário final
Com base no usuário final, o mercado é segmentado em Provedores de Serviços Comerciais, Hospitais e Centros de Transplante, Laboratórios de Pesquisa e Instituições Acadêmicas. O segmento de Hospitais e Centros de Transplante dominou o mercado com uma participação de 47,2% da receita em 2025, devido à extensa atividade de ensaios clínicos, grandes populações de pacientes e à necessidade de sistemas integrados de avaliação de resultados. Os hospitais implementam o eCOA (avaliação eletrônica de resultados clínicos) para o gerenciamento de doenças crônicas, ensaios oncológicos e acompanhamento de resultados cirúrgicos. A alta adoção em ensaios multicêntricos fortalece o uso. A integração com sistemas EHR (prontuário eletrônico de saúde) e EMR (registro médico eletrônico) aprimora a eficiência do fluxo de trabalho. As exigências regulatórias para a coleta de dados de resultados clínicos impulsionam a demanda. Programas de treinamento e suporte em larga escala garantem a adoção. A segurança de dados e a conformidade com os padrões HIPAA/GDPR reforçam a confiança. O suporte a múltiplos dispositivos melhora o engajamento de pacientes e profissionais de saúde. Análises em tempo real apoiam as decisões operacionais. Parcerias com CROs (Organizações de Pesquisa Clínica Contratadas) aumentam a implementação. O monitoramento remoto de pacientes expande o alcance. O investimento em pesquisa clínica hospitalar impulsiona a liderança. Programas de melhoria contínua sustentam a dominância.
O segmento de Provedores de Serviços Comerciais deverá apresentar o crescimento mais rápido, com uma taxa composta de crescimento anual (CAGR) de 16,3% entre 2026 e 2033, impulsionado pelas tendências de terceirização em ensaios clínicos e pela crescente necessidade de gerenciamento especializado de eCOA (Certificado de Autorização Eletrônica). CROs (Organizações de Pesquisa Clínica Contratadas) e fornecedores de serviços clínicos oferecem soluções em nuvem e baseadas na web para ensaios multicêntricos. O aumento da pesquisa contratada em oncologia, neurologia e doenças raras impulsiona o crescimento. A flexibilidade na prestação de serviços atrai clientes de pequeno e médio porte da indústria farmacêutica. Relatórios e análises avançados melhoram a eficiência dos ensaios. A expansão para mercados emergentes apoia a adoção. Treinamento e suporte remoto reduzem as barreiras de implementação. A integração com sistemas EDC (Coleta Eletrônica de Dados) e PRO (Procedimentos Relativos de Resultados) garante um fluxo de trabalho contínuo. A segurança de dados e a conformidade regulatória continuam sendo fatores-chave. A escalabilidade para ensaios globais acelera o uso. Parcerias estratégicas com patrocinadores expandem o alcance de mercado. A inovação na integração com dispositivos móveis e vestíveis impulsiona a rápida adoção.
- Por plataforma
Com base na plataforma, o mercado é segmentado em Organizações de Pesquisa Contratada (CROs), Empresas Farmacêuticas e Biofarmacêuticas, Fabricantes de Dispositivos Médicos, Hospitais e Laboratórios Clínicos, Empresas de Consultoria, Pesquisa e Academia e Outros. O segmento de Empresas Farmacêuticas e Biofarmacêuticas dominou o mercado com uma participação de 44,7% da receita em 2025, devido a programas de desenvolvimento clínico em larga escala, à adoção de ensaios de medicina de precisão e à dependência de dados eletrônicos de resultados para submissões regulatórias. As empresas farmacêuticas investem em plataformas eCOA integradas para estudos em oncologia, cardiologia e doenças crônicas. O alto volume de ensaios clínicos e as operações globais sustentam essa dominância. A integração com dispositivos EDC, PRO e wearables otimiza o fluxo de trabalho. A conformidade regulatória impulsiona a adoção. O gerenciamento centralizado de dados aumenta a eficiência dos ensaios clínicos. Parcerias de longo prazo com fornecedores fortalecem a liderança. A implantação em múltiplos dispositivos e locais facilita o uso. Soluções baseadas em nuvem melhoram a acessibilidade. O investimento em diagnósticos complementares aumenta a utilização da plataforma. Relatórios em tempo real aprimoram a tomada de decisões. Análises avançadas aceleram os programas de desenvolvimento de medicamentos.
O segmento de Organizações de Pesquisa Clínica (CROs) deverá apresentar o crescimento mais rápido, com uma taxa composta de crescimento anual (CAGR) de 15,8% entre 2026 e 2033, impulsionado pela terceirização de ensaios clínicos, pelo aumento da complexidade desses ensaios e pela crescente demanda por serviços completos de gerenciamento de eCOA (Certificado Eletrônico de Avaliação). As CROs fornecem plataformas de eCOA escaláveis e baseadas em nuvem para estudos multinacionais. A rápida adoção em mercados emergentes acelera o crescimento. A integração com os sistemas dos patrocinadores melhora a eficiência operacional. Análises avançadas e painéis de controle aprimoram o conhecimento sobre os ensaios. Modelos de implantação flexíveis atraem clientes de pequeno e médio porte da indústria farmacêutica. Treinamento e suporte técnico facilitam a adoção. O alinhamento regulatório global aumenta a confiança. A adoção em múltiplas áreas terapêuticas impulsiona a expansão. Relatórios remotos e via dispositivos móveis aumentam a conformidade. Colaborações estratégicas com hospitais e instituições acadêmicas fortalecem a presença da empresa. Em suma, esses fatores impulsionam um forte crescimento.
Análise Regional do Mercado Europeu de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado
- Prevê-se que o mercado europeu de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado cresça a uma taxa composta de crescimento anual substancial durante o período de previsão.
- Impulsionado pela crescente adoção de soluções digitais para ensaios clínicos, pelo rigoroso suporte regulatório e pela demanda cada vez maior por um acompanhamento eficiente dos resultados dos pacientes.
- O crescimento é impulsionado pela integração de plataformas baseadas em nuvem, coleta de dados móveis e resultados relatados eletronicamente pelos pacientes, juntamente com o foco da região na melhoria da infraestrutura de saúde e na digitalização da pesquisa clínica.
Análise Eletrônica de Resultados Clínicos (eCOA) do Reino Unido para Conteúdo Licenciado - Informações de Mercado
O mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado no Reino Unido dominou o mercado de eCOA para conteúdo licenciado, com a maior participação de receita, aproximadamente 38,7% em 2025. Esse crescimento é impulsionado por uma infraestrutura de saúde bem estabelecida, forte adoção de tecnologias digitais para ensaios clínicos e sólido suporte regulatório para o rastreamento eletrônico de resultados de pacientes. O crescimento substancial é impulsionado por inovações em plataformas baseadas em nuvem, coleta de dados móveis e integração perfeita com sistemas centralizados de gerenciamento de ensaios clínicos, permitindo uma mensuração mais eficiente e precisa dos resultados dos pacientes.
Alemanha: Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado - Informações de Mercado
A Alemanha deverá apresentar o mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado como a região de crescimento mais rápido durante o período de previsão, com uma forte taxa de crescimento anual composta (CAGR) projetada em dois dígitos. Esse crescimento é impulsionado pelo aumento da atividade de ensaios clínicos, pelo aumento dos gastos com saúde, pela expansão do acesso a soluções de saúde digital e pela crescente adoção de tecnologias de captura eletrônica de dados e de resultados relatados pelos pacientes em hospitais, centros de pesquisa e organizações farmacêuticas. Além disso, a ênfase da Alemanha na inovação tecnológica e na infraestrutura de saúde digital contribui ainda mais para a rápida expansão do mercado.
Participação de mercado na Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado na Europa
O setor de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado é liderado principalmente por empresas consolidadas, incluindo:
• Medidata Solutions, Inc. (EUA)
• CRF Health (Reino Unido)
• Signant Health (EUA)
• Clinion (EUA)
• Celegence (EUA)
• Icon plc (Irlanda)
• PPD, Inc. (EUA)
• Veeva Systems (EUA)
• Oracle Health Sciences (EUA)
• Synteract (EUA)
• Bioclinica, Inc. (EUA)
• Complion (EUA)
• Curebase (EUA)
• ClinOne (EUA)
• CRF Bracket (EUA)
• Datatrak International (EUA)
• Electronic Data Capture, LLC (EUA)
• PAREXEL International (EUA)
• Health Solutions International (Reino Unido)
Últimos desenvolvimentos na Europa: Avaliação Eletrônica de Resultados Clínicos (eCOA) para o Mercado de Conteúdo Licenciado
- Em junho de 2023, a ICON plc lançou sua Plataforma Digital ICON, uma solução integrada que inclui aplicativos móveis para pacientes, consentimento eletrônico (eConsent), Certificado Eletrônico de Avaliação (eCOA), captura direta de dados para serviços domiciliares e gerenciamento de tecnologia de saúde digital para otimizar o engajamento do paciente e a coleta de dados em ensaios clínicos. Isso representa uma grande expansão das capacidades do eCOA para operações mais amplas de ensaios clínicos digitais.
- Em julho de 2023, a Signant Health adquiriu a DSG, Inc., expandindo seu portfólio de tecnologias de eCOA e ensaios híbridos para incluir recursos aprimorados de EDC/DDC e fortalecendo sua presença em ambientes complexos de pesquisa clínica, especialmente na Europa.
- Em novembro de 2023, a Clinical Ink expandiu suas soluções de engajamento de pacientes ao integrar a ferramenta de diagnóstico comportamental SPUR com seu conjunto de eCOA e biomarcadores digitais, oferecendo insights mais profundos sobre o comportamento do paciente e aprimorando a avaliação holística dos resultados clínicos em diversos ensaios.
- Em novembro de 2024, a uMotif concluiu a aquisição da ClinOne, combinando recursos de eCOA/ePRO com ferramentas de produtividade para centros de pesquisa e gerenciamento de consentimento, criando uma plataforma unificada que reduz a sobrecarga administrativa e aumenta a eficiência do engajamento em ensaios clínicos.
- Em fevereiro de 2025, a YPrime anunciou o lançamento do seu recurso de Formulário Automatizado de Alteração de Dados (DCF, na sigla em inglês) como parte da sua plataforma eCOA 7.x, oferecendo gerenciamento de dados clínicos simplificado e eficiente e melhorando a precisão nos fluxos de trabalho de dados de ensaios clínicos.
- Em 2025, a Medable Inc. foi nomeada Líder na Avaliação PEAK Matrix de Produtos eCOA para Ciências da Vida do Everest Group, reconhecida por sua inovação em IA, análises em tempo real e captura de dados multimodais que otimizam as avaliações de resultados clínicos e aprimoram o engajamento do paciente.
SKU-
Obtenha acesso online ao relatório sobre a primeira nuvem de inteligência de mercado do mundo
- Painel interativo de análise de dados
- Painel de análise da empresa para oportunidades de elevado potencial de crescimento
- Acesso de analista de pesquisa para personalização e customização. consultas
- Análise da concorrência com painel interativo
- Últimas notícias, atualizações e atualizações Análise de tendências
- Aproveite o poder da análise de benchmark para um rastreio abrangente da concorrência
Metodologia de Investigação
A recolha de dados e a análise do ano base são feitas através de módulos de recolha de dados com amostras grandes. A etapa inclui a obtenção de informações de mercado ou dados relacionados através de diversas fontes e estratégias. Inclui examinar e planear antecipadamente todos os dados adquiridos no passado. Da mesma forma, envolve o exame de inconsistências de informação observadas em diferentes fontes de informação. Os dados de mercado são analisados e estimados utilizando modelos estatísticos e coerentes de mercado. Além disso, a análise da quota de mercado e a análise das principais tendências são os principais fatores de sucesso no relatório de mercado. Para saber mais, solicite uma chamada de analista ou abra a sua consulta.
A principal metodologia de investigação utilizada pela equipa de investigação do DBMR é a triangulação de dados que envolve a mineração de dados, a análise do impacto das variáveis de dados no mercado e a validação primária (especialista do setor). Os modelos de dados incluem grelha de posicionamento de fornecedores, análise da linha de tempo do mercado, visão geral e guia de mercado, grelha de posicionamento da empresa, análise de patentes, análise de preços, análise da quota de mercado da empresa, normas de medição, análise global versus regional e de participação dos fornecedores. Para saber mais sobre a metodologia de investigação, faça uma consulta para falar com os nossos especialistas do setor.
Personalização disponível
A Data Bridge Market Research é líder em investigação formativa avançada. Orgulhamo-nos de servir os nossos clientes novos e existentes com dados e análises que correspondem e atendem aos seus objetivos. O relatório pode ser personalizado para incluir análise de tendências de preços de marcas-alvo, compreensão do mercado para países adicionais (solicite a lista de países), dados de resultados de ensaios clínicos, revisão de literatura, mercado remodelado e análise de base de produtos . A análise de mercado dos concorrentes-alvo pode ser analisada desde análises baseadas em tecnologia até estratégias de carteira de mercado. Podemos adicionar quantos concorrentes necessitar de dados no formato e estilo de dados que procura. A nossa equipa de analistas também pode fornecer dados em tabelas dinâmicas de ficheiros Excel em bruto (livro de factos) ou pode ajudá-lo a criar apresentações a partir dos conjuntos de dados disponíveis no relatório.