Global Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Tamanho do mercado em biliões de dólares
CAGR :
% 
 USD
543.06 Million
USD
1,593.17 Million
2024
2032
USD
543.06 Million
USD
1,593.17 Million
2024
2032
| 2025 –2032 | |
| USD 543.06 Million | |
| USD 1,593.17 Million | |
|
|
|
|
Avaliação Eletrônica Global de Resultados Clínicos (eCOA) para Segmentação de Mercado de Conteúdo Licenciado, Por Produto (Soluções On-Premise, Soluções Baseadas em Nuvem e Soluções Baseadas na Web), Abordagem (Avaliação de Resultados Relatados por Médicos (ClinRO), Avaliação de Resultados Relatados por Pacientes (PRO), Avaliação de Resultados Relatados por Observadores (ObsRO) e Avaliação de Resultados de Desempenho (PerfO)), Usuário Final (Provedores de Serviços Comerciais, Hospitais e Centros de Transplante, Laboratórios de Pesquisa e Instituições Acadêmicas), Plataforma (Organizações de Pesquisa Contratadas, Empresas Farmacêuticas e Biofarmacêuticas, Fabricantes de Dispositivos Médicos, Hospitais e Laboratórios Clínicos, Empresas de Serviços de Consultoria, Pesquisa e Academia e Outros) - Tendências do Setor e Previsão para 2032
Avaliação Eletrônica de Resultados Clínicos (eCOA) para o Tamanho do Mercado de Conteúdo Licenciado
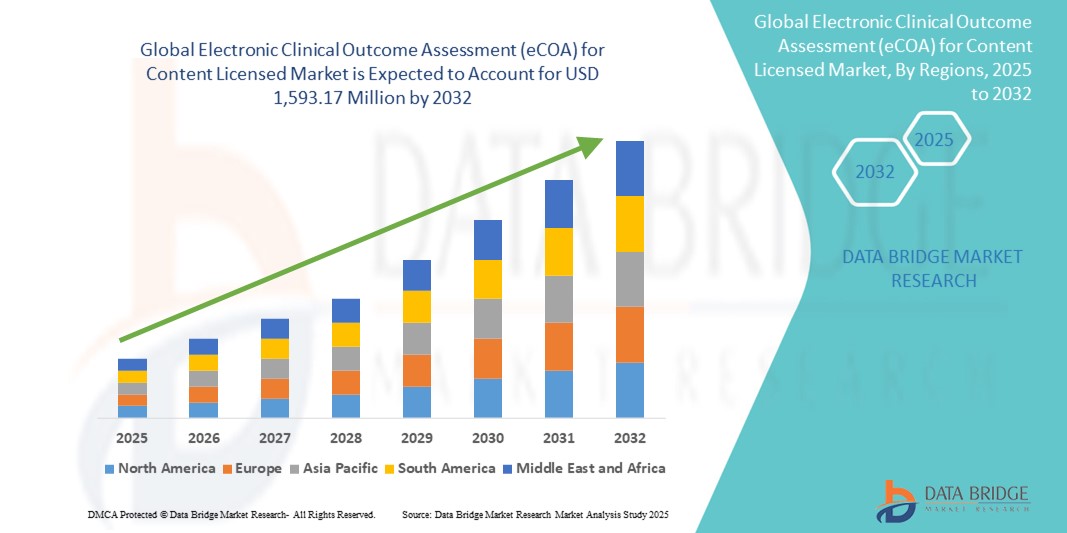
- O tamanho do mercado global de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado foi avaliado em US$ 543,06 milhões em 2024 e deve atingir US$ 1.593,17 milhões até 2032 , com um CAGR de 14,40% durante o período previsto.
- O crescimento do mercado é amplamente impulsionado pela crescente demanda por transformação digital em ensaios clínicos e pela crescente ênfase na coleta de dados em tempo real e centrada no paciente, o que melhora a qualidade e a conformidade dos ensaios.
- Além disso, o crescente apoio regulatório e a adoção de conteúdo eCOA padronizado e validado pela indústria farmacêutica estão posicionando as soluções eCOA licenciadas como o método preferencial para a captura de desfechos clínicos. Esses fatores convergentes estão acelerando a adoção de ferramentas eCOA licenciadas, impulsionando significativamente o crescimento do setor.
Avaliação Eletrônica de Resultados Clínicos (eCOA) para Análise de Mercado de Conteúdo Licenciado
- As soluções eCOA licenciadas, que capturam digitalmente os resultados relatados pelos pacientes, pelos médicos e pelos observadores, estão se tornando ferramentas essenciais na pesquisa clínica moderna devido à sua precisão de dados aprimorada, acesso em tempo real e compatibilidade com modelos de testes descentralizados.
- A crescente demanda por conteúdo eCOA licenciado é alimentada principalmente pela crescente complexidade dos ensaios clínicos, pela ênfase regulatória em métodos de coleta de dados padronizados e validados e pela crescente adoção de plataformas de saúde digital por empresas farmacêuticas e de biotecnologia.
- A América do Norte dominou o mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado, com a maior participação na receita de 46,8% em 2024, atribuída à forte infraestrutura regulatória, à adoção antecipada de tecnologias clínicas digitais e à presença de grandes organizações de pesquisa clínica e provedores de soluções eCOA.
- Espera-se que a Ásia-Pacífico seja a região de crescimento mais rápido no mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado durante o período previsto, devido à expansão das atividades de pesquisa clínica, harmonização regulatória e um foco crescente na coleta de dados centrada no paciente.
- O segmento de avaliação de resultados relatados pelo paciente (PRO) dominou o mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado com uma participação de 50,2% em 2024, impulsionado por seu papel crítico na avaliação da eficácia do tratamento e do bem-estar do paciente, juntamente com maior ênfase na captura de informações diretas do paciente em protocolos de teste.
Escopo do Relatório e Avaliação Eletrônica de Resultados Clínicos (eCOA) para Segmentação de Mercado de Conteúdo Licenciado
|
Atributos |
Avaliação Eletrônica de Resultados Clínicos (eCOA) para Insights de Mercado Principais Licenciados por Conteúdo |
|
Segmentos abrangidos |
|
|
Países abrangidos |
América do Norte
Europa
Ásia-Pacífico
Oriente Médio e África
Ámérica do Sul
|
|
Principais participantes do mercado |
|
|
Oportunidades de mercado |
|
|
Conjuntos de informações de dados de valor agregado |
Além dos insights sobre cenários de mercado, como valor de mercado, taxa de crescimento, segmentação, cobertura geográfica e principais participantes, os relatórios de mercado selecionados pela Data Bridge Market Research também incluem análises aprofundadas de especialistas, análises de preços, análises de participação de marca, pesquisas com consumidores, análises demográficas, análises da cadeia de suprimentos, análises da cadeia de valor, visão geral de matérias-primas/consumíveis, critérios de seleção de fornecedores, análise PESTLE, análise de Porter e estrutura regulatória. |
Tendências de mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado
“Padronização digital e melhorias impulsionadas por IA em ensaios clínicos”
- Uma tendência significativa e em evolução no mercado global de eCOA para licenciamento de conteúdo é a integração de inteligência artificial (IA) e conteúdo digital padronizado para aprimorar a qualidade dos dados, a conformidade regulatória e o engajamento dos pacientes em ensaios clínicos. Essa convergência está agilizando a captura de dados e melhorando a eficiência dos ensaios clínicos.
- Por exemplo, empresas como a Medidata Solutions e a ERT estão oferecendo soluções eCOA licenciadas e aprimoradas por IA que permitem o monitoramento em tempo real das informações dos pacientes e análises preditivas para uma melhor previsão dos resultados dos ensaios clínicos. Plataformas habilitadas por IA podem detectar anomalias nos dados, solicitar revalidações e apoiar projetos de ensaios clínicos adaptativos.
- O conteúdo licenciado do eCOA garante que todos os resultados relatados por pacientes, médicos e observadores atendam aos padrões regulatórios e científicos, promovendo consistência e confiabilidade em estudos multinacionais. Essas licenças de conteúdo estão sendo cada vez mais combinadas com plataformas eCOA avançadas para fornecer soluções completas.
- A integração com plataformas de eConsent e dispositivos vestíveis aumenta ainda mais a adesão do paciente e reduz a sobrecarga do local, automatizando os fluxos de trabalho de captura de dados. Por exemplo, a Signant Health permite que medidas de PRO licenciadas sejam vinculadas a dados biométricos de dispositivos vestíveis para uma compreensão mais holística do impacto do tratamento.
- A tendência para conteúdo digitalizado e validado em plataformas eCOA com capacidade de IA está transformando a forma como as partes interessadas conduzem e gerenciam ensaios clínicos globais. Consequentemente, empresas como a IQVIA e a Kayentis estão investindo em bibliotecas de conteúdo licenciado, multilíngues e escaláveis, incorporadas em plataformas intuitivas e aprimoradas por IA.
- A demanda por soluções eCOA com conteúdo pré-aprovado e em conformidade com as regulamentações está crescendo rapidamente, à medida que patrocinadores e CROs buscam reduzir o risco de ensaios clínicos e melhorar a experiência do paciente e a precisão dos dados por meio de ferramentas digitais inteligentes.
Avaliação Eletrônica de Resultados Clínicos (eCOA) para Dinâmica de Mercado de Conteúdo Licenciado
Motorista
“Crescente demanda regulatória e mudança digital na pesquisa clínica”
- A crescente ênfase na padronização de dados e na conformidade regulatória em ensaios clínicos, juntamente com a transformação digital dos processos de pesquisa clínica, é um dos principais impulsionadores do mercado de conteúdo eCOA licenciado.
- Por exemplo, em março de 2024, a Clinical Ink lançou um conjunto de instrumentos eCOA pré-validados e licenciados para ensaios globais, agilizando o tempo de configuração e reduzindo o risco regulatório. Essas iniciativas destacam o impulso da indústria em direção a métodos de captura de dados digitais validados.
- À medida que os patrocinadores dos ensaios e as autoridades reguladoras priorizam os resultados centrados no paciente e a geração de evidências robustas, os instrumentos eCOA licenciados oferecem metodologias cientificamente validadas que atendem às expectativas regulatórias, reduzindo atrasos na aprovação dos ensaios ou no envio de dados.
- A crescente mudança para ensaios clínicos descentralizados e híbridos também acelerou a demanda por ferramentas digitais que garantam a coleta consistente de dados de pacientes em diversas regiões e populações. Conteúdo licenciado integrado em plataformas digitais aumenta a escalabilidade e a conformidade.
- Além disso, a melhoria da acessibilidade às ferramentas eCOA através de dispositivos móveis, combinada com interfaces intuitivas e suporte multilíngue, está a impulsionar a adoção entre os participantes de ensaios clínicos a nível global, contribuindo para um maior envolvimento dos pacientes e fiabilidade dos dados.
Restrição/Desafio
“Modelos complexos de licenciamento e barreiras à integração”
- Um dos principais desafios na adoção de conteúdo eCOA licenciado é a complexidade dos acordos de licenciamento e da integração em sistemas clínicos. Múltiplas partes interessadas, altos custos e variações regulatórias regionais podem atrasar ou complicar a implementação.
- Por exemplo, o licenciamento de certos PROs padronizados, como o EQ-5D ou o SF-36, pode envolver negociações complexas com os proprietários de conteúdo, especialmente quando usados em testes multinacionais, aumentando os prazos e os custos do projeto.
- Além disso, a integração de conteúdo licenciado em plataformas de captura eletrônica de dados (EDC) ou eSource existentes geralmente requer desenvolvimento personalizado ou middleware, o que pode levar a atrasos técnicos ou aumento da carga operacional.
- Garantir a interoperabilidade entre os instrumentos eCOA licenciados e os sistemas do patrocinador/CRO continua sendo um obstáculo técnico, especialmente ao gerenciar diversos dispositivos, cenários de teste e populações de pacientes
- Os altos custos iniciais para bibliotecas de conteúdo validadas e as taxas de licenciamento contínuas também podem impedir a adoção entre empresas de biotecnologia menores ou pesquisadores acadêmicos com orçamentos limitados
- A superação dessas barreiras por meio de estruturas de licenciamento unificadas, modelos de implantação baseados em nuvem e ferramentas de integração fáceis de usar será crucial para expandir o uso de conteúdo eCOA licenciado em pesquisas clínicas futuras.
Escopo de Mercado de Avaliação Eletrônica de Resultados Clínicos (eCOA) para Conteúdo Licenciado
O mercado é segmentado com base no produto, abordagem, usuário final e plataforma.
- Por produto
Com base no produto, o mercado de avaliação eletrônica de resultados clínicos (eCOA) para licenciamento de conteúdo é segmentado em soluções locais, soluções baseadas em nuvem e soluções baseadas na web. O segmento de soluções baseadas em nuvem dominou o mercado, com a maior participação na receita em 2024, devido à sua escalabilidade, facilidade de implantação e capacidade de suportar ensaios clínicos descentralizados e híbridos. Patrocinadores e CROs preferem cada vez mais plataformas eCOA baseadas em nuvem, pois oferecem captura de dados em tempo real, acesso remoto e integração perfeita com outros sistemas eClinical, reduzindo os custos de infraestrutura e a complexidade de TI.
Prevê-se que o segmento de soluções baseadas na web apresentará a maior taxa de crescimento entre 2025 e 2032, impulsionado pela crescente penetração da internet, pela expansão global dos ensaios clínicos e pela demanda por plataformas acessíveis por navegador que exigem configuração mínima. As ferramentas eCOA baseadas na web oferecem ampla acessibilidade para pacientes e locais de ensaio clínico em todas as regiões e tipos de dispositivos, impulsionando a adoção em estudos multinacionais.
- Por Abordagem
Com base na abordagem, o mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado é segmentado em Avaliação de Resultados Relatada pelo Clínico (ClinRO), Avaliação de Resultados Relatada pelo Paciente (PRO), Avaliação de Resultados Relatada pelo Observador (ObsRO) e Avaliação de Resultados de Desempenho (PerfO). O segmento de resultados relatados pelo paciente (PRO) dominou o mercado, com a maior participação na receita, de 50,2%, em 2024, à medida que os órgãos reguladores exigem cada vez mais a inclusão da perspectiva do paciente na pesquisa clínica. Os instrumentos PRO licenciados fornecem métodos validados e padronizados para avaliar a qualidade de vida, os sintomas e o impacto do tratamento sob a perspectiva do paciente, contribuindo para evidências clínicas e submissões regulatórias mais robustas.
Espera-se que o segmento de avaliação de resultados de desempenho (PerfO) apresente a maior taxa de crescimento entre 2025 e 2032, devido à crescente demanda por avaliações objetivas e funcionais em ensaios clínicos. As ferramentas PerfO capturam dados em tempo real com base em tarefas realizadas por pacientes, frequentemente utilizando dispositivos digitais ou wearables, possibilitando avaliações de eficácia e desfechos de ensaios clínicos mais precisos.
- Por usuário final
Com base no usuário final, o mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado é segmentado em provedores de serviços comerciais, hospitais e centros de transplante, laboratórios de pesquisa e instituições acadêmicas. O segmento de provedores de serviços comerciais deteve a maior participação em 2024, impulsionado pelo amplo uso de plataformas eCOA por organizações de pesquisa contratadas (CROs), empresas de gestão de dados e provedores de tecnologia. Esses provedores de serviços atuam como intermediários entre patrocinadores e centros clínicos, implementando soluções de conteúdo licenciado em escala e garantindo a conformidade com os protocolos de ensaios clínicos e os padrões globais.
Prevê-se que o segmento de instituições acadêmicas cresça ao ritmo mais acelerado entre 2025 e 2032, impulsionado pelo aumento de iniciativas de pesquisa lideradas por acadêmicos, maior acesso a financiamento para ferramentas clínicas digitais e ensaios colaborativos com parceiros da indústria. A adoção de ferramentas eCOA com conteúdo licenciado em estudos acadêmicos contribui para maior precisão e reprodutibilidade dos dados.
- Por plataforma
Com base na plataforma, o mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado é segmentado em organizações de pesquisa contratadas (CROs), empresas farmacêuticas e biofarmacêuticas, fabricantes de dispositivos médicos, hospitais e laboratórios clínicos, empresas de serviços de consultoria, pesquisa e academia, entre outros. O segmento de empresas farmacêuticas e biofarmacêuticas dominou o mercado em 2024, visto que essas organizações impulsionam a maioria dos ensaios clínicos globais e exigem soluções de eCOA validadas e em conformidade com as regulamentações para resultados centrados no paciente. Seu investimento em conteúdo licenciado aumenta a eficiência dos ensaios, a consistência global e a aceitação regulatória.
O segmento de organizações de pesquisa contratadas (CROs) deverá apresentar o crescimento mais rápido entre 2025 e 2032, apoiado pelas tendências de terceirização no desenvolvimento clínico. As CROs adotam cada vez mais plataformas eCOA prontas para uso com conteúdo licenciado integrado para oferecer serviços completos de gestão de ensaios clínicos para patrocinadores, especialmente para estudos multinacionais onde medidas de desfecho padronizadas são cruciais.
Avaliação Eletrônica de Resultados Clínicos (eCOA) para Análise Regional do Mercado de Conteúdo Licenciado
- A América do Norte dominou o mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado, com a maior participação na receita de 46,8% em 2024, atribuída à forte infraestrutura regulatória, à adoção antecipada de tecnologias clínicas digitais e à presença de grandes organizações de pesquisa clínica e provedores de soluções eCOA.
- As partes interessadas na região, incluindo empresas farmacêuticas, CROs e instituições acadêmicas, priorizam o uso de medidas de resultados validadas e padronizadas para atender às expectativas da FDA e da EMA, alimentando a demanda por soluções eCOA licenciadas.
- O domínio da região é ainda apoiado por altos investimentos em P&D, ecossistemas eClinical avançados e um número crescente de ensaios descentralizados e híbridos, estabelecendo o conteúdo eCOA licenciado como um componente crítico para garantir a precisão dos dados, a conformidade e o envolvimento do paciente em ensaios clínicos modernos.
Avaliação Eletrônica de Resultados Clínicos (eCOA) dos EUA para Insights de Mercado de Conteúdo Licenciado
O mercado de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado nos EUA capturou a maior fatia da receita, de 79,5%, em 2024 na América do Norte, impulsionado pela liderança do país em atividades de ensaios clínicos e pela adesão regulatória a medidas de resultados padronizadas. O impulso da FDA para o desenvolvimento de medicamentos com foco no paciente e instrumentos PRO validados continua a incentivar a ampla adoção de ferramentas eCOA licenciadas. Além disso, a prevalência de ensaios descentralizados e a rápida adoção de tecnologias de saúde digital por patrocinadores e CROs impulsionam ainda mais a demanda por plataformas eCOA com conteúdo licenciado e em conformidade com as normas.
Avaliação Eletrônica de Resultados Clínicos da Europa eCOA para Insights de Mercado de Conteúdo Licenciado
O mercado europeu de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado deverá crescer a um CAGR substancial ao longo do período previsto, impulsionado principalmente pela harmonização regulatória da região sob a EMA e pelo aumento do investimento em pesquisa centrada no paciente. O crescente número de ensaios clínicos multinacionais e a demanda por conteúdo multilíngue e validado de PRO e ObsRO estão fomentando a adoção. A tendência de digitalização de todos os aspectos dos ensaios clínicos, incluindo avaliações de consentimento e resultados, apoia a expansão do mercado em áreas terapêuticas e redes de pesquisa clínica.
Avaliação Eletrônica de Resultados Clínicos do Reino Unido eCOA para Insights de Mercado de Conteúdo Licenciado
O mercado de avaliação eletrônica de resultados clínicos (eCOA) do Reino Unido para conteúdo licenciado deverá crescer a um CAGR considerável durante o período previsto, impulsionado por iniciativas de saúde digital apoiadas pelo NHS e pelo foco na geração de evidências do mundo real. A ênfase na captura dos resultados dos pacientes em um formato digital padronizado tem incentivado empresas farmacêuticas e instituições de pesquisa a investir em instrumentos de eCOA licenciados. Além disso, o forte ecossistema de pesquisa acadêmica e a participação ativa em ensaios clínicos em todo o país estão estimulando uma adoção mais ampla da eCOA.
Avaliação Eletrônica de Resultados Clínicos da Alemanha eCOA para Insights de Mercado de Conteúdo Licenciado
Espera-se que o mercado alemão de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado se expanda a um CAGR considerável durante o período previsto, apoiado pela forte ênfase do país em conformidade regulatória, qualidade de dados clínicos e inovação em saúde digital. As indústrias farmacêutica e de tecnologia médica da Alemanha são pioneiras na adoção de conteúdo eCOA validado, particularmente em ensaios clínicos sobre oncologia e doenças raras. O compromisso do país com a medicina de precisão e a privacidade de dados se alinha bem com as soluções de eCOA licenciadas que oferecem captura segura e padronizada de resultados.
Avaliação Eletrônica de Resultados Clínicos da Ásia-Pacífico eCOA para Insights de Mercado de Conteúdo Licenciado
O mercado de avaliação eletrônica de resultados clínicos (eCOA) da Ásia-Pacífico para conteúdo licenciado deverá crescer a uma taxa composta de crescimento anual (CAGR) de 23,2% durante o período previsto de 2025 a 2032, impulsionado por um aumento na atividade de ensaios clínicos em economias emergentes e pelo aumento dos investimentos em infraestrutura de saúde digital. Países como China, Japão e Índia estão acelerando a adoção devido à sua participação em ensaios globais, à localização de conteúdo licenciado e à crescente necessidade de soluções de eCOA multilíngues e centradas no paciente.
Avaliação Eletrônica de Resultados Clínicos do Japão eCOA para Insights de Mercado de Conteúdo Licenciado
O mercado japonês de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado está ganhando força devido à ênfase do país em inovação em saúde, cuidados com idosos e supervisão regulatória rigorosa. As empresas farmacêuticas japonesas estão adotando ferramentas PRO e ClinRO licenciadas para garantir dados de qualidade em ensaios clínicos em estágio avançado e vigilância pós-comercialização. A integração de sistemas eCOA com plataformas eClinical mais amplas e dispositivos médicos de IoT contribui para o engajamento aprimorado do paciente e o monitoramento de resultados.
Avaliação Eletrônica de Resultados Clínicos da Índia eCOA para Insights de Mercado de Conteúdo Licenciado
O mercado indiano de avaliação eletrônica de resultados clínicos (eCOA) para conteúdo licenciado foi responsável pela maior fatia da receita de mercado na Ásia-Pacífico em 2024, devido ao crescente cenário de ensaios clínicos do país, à rápida transformação digital e à prestação de serviços com boa relação custo-benefício pelas CROs. A digitalização da saúde, apoiada pelo governo, e a ascensão de provedores nacionais de tecnologia eClinical estão acelerando a adoção de instrumentos eCOA licenciados. A população multilíngue da Índia e a diversidade de cenários de saúde também impulsionam a demanda por conteúdo flexível e validado, adaptado às necessidades regionais de ensaios clínicos.
Avaliação Eletrônica de Resultados Clínicos (eCOA) para Participação de Mercado de Conteúdo Licenciado
A avaliação eletrônica de resultados clínicos (eCOA) para o setor de conteúdo licenciado é liderada principalmente por empresas bem estabelecidas, incluindo:
- Medidata Solutions, Inc. (EUA)
- Signant Health (EUA)
- IQVIA Inc. (EUA)
- YPrime, Inc. (EUA)
- Clario (EUA)
- Clinical Ink, Inc. (EUA)
- ERT, Inc. (EUA)
- Kayentis SAS (França)
- Veeva Systems Inc. (EUA)
- Oracle Health Sciences (EUA)
- Parexel International Corporation (EUA)
- eResearch Technology, Inc (EUA)
- ArisGlobal LLC (EUA)
- Calyx (EUA)
- Castor EDC (Holanda)
- Datatrak International, Inc. (EUA)
- Medrio, Inc. (EUA)
- OpenClinica, LLC (EUA)
- Trial By Fire Solutions, LLC (EUA)
Quais são os desenvolvimentos recentes na avaliação global eletrônica de resultados clínicos (eCOA) para o mercado de conteúdo licenciado?
- Em maio de 2024, a Medidata Solutions, uma empresa do grupo Dassault Systèmes, lançou uma versão aprimorada de sua plataforma myMedidata, com suporte expandido para avaliações de resultados clínicos licenciadas em ensaios clínicos globais. Esta atualização inclui instrumentos eCOA multilíngues e validados, perfeitamente integrados ao eConsent e dados vestíveis, agilizando a execução descentralizada de ensaios clínicos. O lançamento reforça o compromisso da Medidata em fornecer soluções unificadas e em conformidade com as normas regulatórias que aprimoram o engajamento do paciente e a integridade dos dados em todas as áreas terapêuticas.
- Em abril de 2024, a Signant Health anunciou a expansão de sua biblioteca de conteúdo licenciado por meio de novos acordos com diversos licenciadores de medidas PRO. A iniciativa permite a implementação mais rápida de medidas de desfecho padronizadas em sua plataforma eCOA, especialmente para estudos de oncologia e do SNC. Este desenvolvimento reforça a estratégia da Signant de fortalecer suas capacidades em captura de dados validados, reduzindo, ao mesmo tempo, o tempo de preparação para ensaios clínicos globais.
- Em março de 2024, a IQVIA lançou seu pacote eCOA aprimorado por IA, integrado a PROs licenciados para otimizar a coleta de dados em pesquisas clínicas e no mundo real. A plataforma utiliza análise preditiva e avisos inteligentes aos pacientes para melhorar as taxas de resposta e minimizar lacunas de dados, refletindo o foco da IQVIA em inovação e alinhamento regulatório em ensaios clínicos digitais.
- Em fevereiro de 2024, a YPrime firmou parceria com diversas instituições acadêmicas para fornecer soluções eCOA pré-licenciadas para ensaios clínicos de doenças raras, acelerando o início dos estudos e melhorando a conformidade regulatória. A colaboração permite um acesso mais amplo a medidas de desfechos de difícil obtenção, destacando o compromisso da YPrime em expandir as capacidades de pesquisa em áreas terapêuticas carentes.
- Em janeiro de 2024, a Clinical Ink lançou uma nova plataforma digital que oferece acesso imediato a instrumentos eCOA validados e licenciados para uso em ensaios descentralizados. Projetada para simplificar a implantação global, a solução inclui traduções integradas e rastreamento automatizado de conformidade, refletindo o objetivo da empresa de tornar a implementação do eCOA mais eficiente, escalável e alinhada às crescentes expectativas regulatórias.
SKU-
Obtenha acesso online ao relatório sobre a primeira nuvem de inteligência de mercado do mundo
- Painel interativo de análise de dados
- Painel de análise da empresa para oportunidades de elevado potencial de crescimento
- Acesso de analista de pesquisa para personalização e customização. consultas
- Análise da concorrência com painel interativo
- Últimas notícias, atualizações e atualizações Análise de tendências
- Aproveite o poder da análise de benchmark para um rastreio abrangente da concorrência
Metodologia de Investigação
A recolha de dados e a análise do ano base são feitas através de módulos de recolha de dados com amostras grandes. A etapa inclui a obtenção de informações de mercado ou dados relacionados através de diversas fontes e estratégias. Inclui examinar e planear antecipadamente todos os dados adquiridos no passado. Da mesma forma, envolve o exame de inconsistências de informação observadas em diferentes fontes de informação. Os dados de mercado são analisados e estimados utilizando modelos estatísticos e coerentes de mercado. Além disso, a análise da quota de mercado e a análise das principais tendências são os principais fatores de sucesso no relatório de mercado. Para saber mais, solicite uma chamada de analista ou abra a sua consulta.
A principal metodologia de investigação utilizada pela equipa de investigação do DBMR é a triangulação de dados que envolve a mineração de dados, a análise do impacto das variáveis de dados no mercado e a validação primária (especialista do setor). Os modelos de dados incluem grelha de posicionamento de fornecedores, análise da linha de tempo do mercado, visão geral e guia de mercado, grelha de posicionamento da empresa, análise de patentes, análise de preços, análise da quota de mercado da empresa, normas de medição, análise global versus regional e de participação dos fornecedores. Para saber mais sobre a metodologia de investigação, faça uma consulta para falar com os nossos especialistas do setor.
Personalização disponível
A Data Bridge Market Research é líder em investigação formativa avançada. Orgulhamo-nos de servir os nossos clientes novos e existentes com dados e análises que correspondem e atendem aos seus objetivos. O relatório pode ser personalizado para incluir análise de tendências de preços de marcas-alvo, compreensão do mercado para países adicionais (solicite a lista de países), dados de resultados de ensaios clínicos, revisão de literatura, mercado remodelado e análise de base de produtos . A análise de mercado dos concorrentes-alvo pode ser analisada desde análises baseadas em tecnologia até estratégias de carteira de mercado. Podemos adicionar quantos concorrentes necessitar de dados no formato e estilo de dados que procura. A nossa equipa de analistas também pode fornecer dados em tabelas dinâmicas de ficheiros Excel em bruto (livro de factos) ou pode ajudá-lo a criar apresentações a partir dos conjuntos de dados disponíveis no relatório.