Global Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Размер рынка в млрд долларов США
CAGR :
% 
 USD
543.06 Million
USD
1,593.17 Million
2024
2032
USD
543.06 Million
USD
1,593.17 Million
2024
2032
| 2025 –2032 | |
| USD 543.06 Million | |
| USD 1,593.17 Million | |
|
|
|
|
Глобальная электронная оценка клинических результатов (eCOA) для сегментации рынка лицензированного контента по продуктам (локальные решения, облачные решения и веб-решения), подходу (оценка результатов, сообщаемых врачами (ClinRO), оценка результатов, сообщаемых пациентами (PRO), оценка результатов, сообщаемых наблюдателями (ObsRO) и оценка результатов эффективности (PerfO)), конечный пользователь (коммерческие поставщики услуг, больницы и трансплантационные центры, исследовательские лаборатории и академические учреждения), платформа (контрактные исследовательские организации, фармацевтические и биофармацевтические компании, производители медицинского оборудования, больницы и клинические лаборатории, компании консалтинговых услуг, исследования и академические круги и другие) — отраслевые тенденции и прогноз до 2032 года
Электронная оценка клинических результатов (eCOA) для размера рынка лицензированного контента
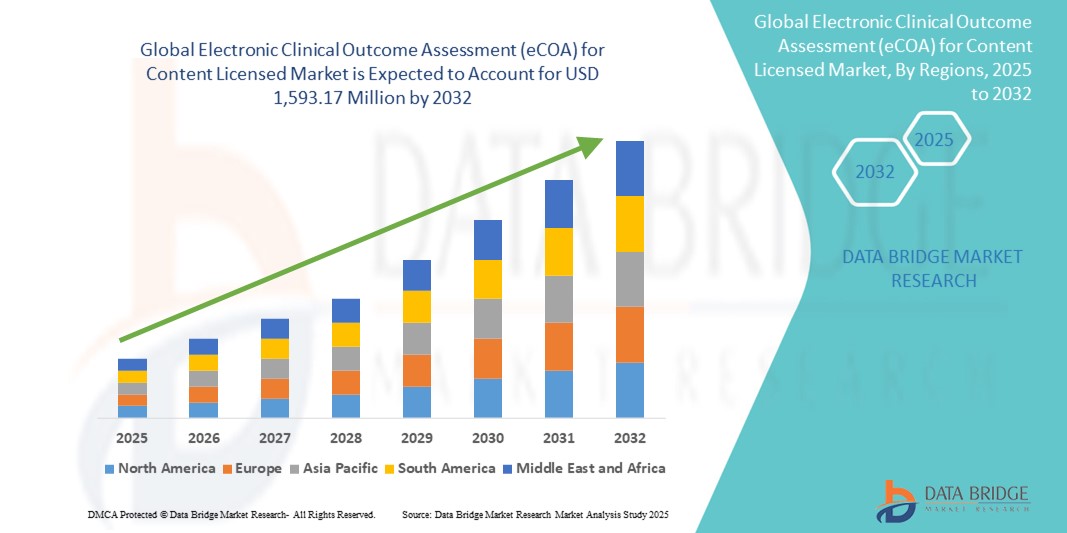
- Глобальная электронная оценка клинических результатов (eCOA) для рынка лицензированного контента оценивается в 543,06 млн долларов США в 2024 году и, как ожидается , достигнет 1 593,17 млн долларов США к 2032 году при среднегодовом темпе роста 14,40% в течение прогнозируемого периода.
- Рост рынка во многом обусловлен растущим спросом на цифровую трансформацию в клинических испытаниях и растущим акцентом на сбор данных в режиме реального времени, ориентированных на пациента, что повышает качество испытаний и соответствие требованиям.
- Кроме того, растущая поддержка со стороны регулирующих органов и принятие фармацевтической промышленностью стандартизированного, проверенного контента eCOA позиционируют лицензированные решения eCOA как предпочтительный метод для захвата клинических конечных точек. Эти сходящиеся факторы ускоряют внедрение лицензированных инструментов eCOA, тем самым значительно стимулируя рост отрасли
Электронная оценка клинических результатов (eCOA) для анализа рынка лицензированного контента
- Лицензированные решения eCOA, которые в цифровом виде фиксируют результаты, сообщаемые пациентами, врачами и наблюдателями, становятся важнейшими инструментами в современных клинических исследованиях благодаря повышенной точности данных, доступу в режиме реального времени и совместимости с децентрализованными моделями испытаний.
- Растущий спрос на лицензированный контент eCOA обусловлен в первую очередь растущей сложностью клинических испытаний, акцентом регулирующих органов на стандартизированных и проверенных методах сбора данных, а также растущим внедрением цифровых медицинских платформ фармацевтическими и биотехнологическими компаниями.
- Северная Америка доминировала на рынке электронной оценки клинических результатов (eCOA) для лицензированного контента с наибольшей долей выручки в 46,8% в 2024 году, что объясняется сильной нормативной инфраструктурой, ранним внедрением цифровых клинических технологий и наличием крупных организаций клинических исследований и поставщиков решений eCOA.
- Ожидается, что Азиатско-Тихоокеанский регион станет самым быстрорастущим регионом в сфере электронной оценки клинических результатов (eCOA) для рынка лицензированного контента в течение прогнозируемого периода из-за расширения деятельности по клиническим исследованиям, гармонизации нормативно-правового регулирования и растущего внимания к сбору данных, ориентированных на пациента.
- Сегмент оценки результатов, сообщаемых пациентами (PRO), доминировал на рынке электронной оценки клинических результатов (eCOA) для лицензированного контента с долей 50,2% в 2024 году, что обусловлено его важнейшей ролью в оценке эффективности лечения и благополучия пациентов, а также повышенным вниманием к получению прямого вклада пациентов в протоколы испытаний.
Область применения отчета и электронная оценка клинических результатов (eCOA) для сегментации рынка лицензированного контента
|
Атрибуты |
Электронная оценка клинических результатов (eCOA) для лицензированного контента Ключевые рыночные идеи |
|
Охваченные сегменты |
|
|
Страны, охваченные |
Северная Америка
Европа
Азиатско-Тихоокеанский регион
Ближний Восток и Африка
Южная Америка
|
|
Ключевые игроки рынка |
|
|
Возможности рынка |
|
|
Информационные наборы данных с добавленной стоимостью |
Помимо аналитических данных о рыночных сценариях, таких как рыночная стоимость, темпы роста, сегментация, географический охват и основные игроки, рыночные отчеты, подготовленные Data Bridge Market Research, также включают в себя углубленный экспертный анализ, анализ цен, анализ доли бренда, опрос потребителей, демографический анализ, анализ цепочки поставок, анализ цепочки создания стоимости, обзор сырья/расходных материалов, критерии выбора поставщиков, анализ PESTLE, анализ Портера и нормативную базу. |
Электронная оценка клинических результатов (eCOA) для тенденций рынка лицензированного контента
«Цифровая стандартизация и усовершенствования на основе искусственного интеллекта в клинических испытаниях»
- Значительная и развивающаяся тенденция на мировом рынке лицензированного контента eCOA — это интеграция искусственного интеллекта (ИИ) и стандартизированного цифрового контента для повышения качества данных, соответствия нормативным требованиям и вовлеченности пациентов в клинические испытания. Эта конвергенция оптимизирует сбор данных и повышает эффективность испытаний
- Например, такие компании, как Medidata Solutions и ERT, предлагают лицензированные решения eCOA с улучшенным ИИ, которые позволяют осуществлять мониторинг данных пациентов в режиме реального времени и предиктивную аналитику для лучшего прогнозирования результатов испытаний. Платформы с поддержкой ИИ могут обнаруживать аномалии данных, запрашивать повторную проверку и поддерживать адаптивные дизайны испытаний
- Лицензированный контент eCOA гарантирует, что все результаты, сообщаемые пациентами, врачами и наблюдателями, соответствуют нормативным и научным стандартам, способствуя согласованности и надежности в многонациональных исследованиях. Эти лицензии на контент все чаще объединяются с передовыми платформами eCOA для предоставления готовых решений
- Интеграция с платформами eConsent и носимыми устройствами еще больше повышает соответствие пациентов и снижает нагрузку на сайт за счет автоматизации рабочих процессов сбора данных. Например, Signant Health позволяет связать лицензированные меры PRO с биометрическими данными с носимых устройств для более целостного понимания воздействия лечения
- Тенденция к оцифрованному, проверенному контенту в рамках платформ eCOA с поддержкой ИИ преобразует то, как заинтересованные стороны проводят и управляют глобальными клиническими испытаниями. Следовательно, такие компании, как IQVIA и Kayentis, инвестируют в масштабируемые, многоязычные библиотеки лицензированного контента, встроенные в удобные для пользователя платформы с поддержкой ИИ
- Спрос на решения eCOA с предварительно одобренным, соответствующим нормативным требованиям контентом стремительно растет, поскольку спонсоры и CRO стремятся снизить риски испытаний и улучшить как опыт пациентов, так и точность данных с помощью интеллектуальных цифровых инструментов.
Электронная оценка клинических результатов (eCOA) для динамики рынка лицензированного контента
Водитель
«Растущий спрос со стороны регулирующих органов и цифровой сдвиг в клинических исследованиях»
- Растущее внимание к стандартизации данных и соблюдению нормативных требований в клинических испытаниях, а также цифровая трансформация процессов клинических исследований являются основными движущими силами рынка лицензированного контента eCOA.
- Например, в марте 2024 года Clinical Ink запустила набор предварительно проверенных инструментов eCOA, лицензированных для глобальных испытаний, что оптимизирует время настройки и снижает нормативный риск. Такие инициативы подчеркивают стремление отрасли к проверенным методам сбора цифровых данных
- Поскольку спонсоры исследований и регулирующие органы отдают приоритет результатам, ориентированным на пациента, и получению надежных доказательств, лицензированные инструменты eCOA предлагают научно обоснованные методики, которые соответствуют ожиданиям регулирующих органов, сокращая задержки в утверждении исследований или представлении данных.
- Растущий переход к децентрализованным и гибридным клиническим испытаниям также ускорил спрос на цифровые инструменты, которые обеспечивают последовательный сбор данных пациентов в различных географических регионах и группах населения. Лицензированный контент, интегрированный в цифровые платформы, повышает как масштабируемость, так и соответствие
- Кроме того, улучшенная доступность инструментов eCOA через мобильные устройства в сочетании с интуитивно понятными интерфейсами и многоязычной поддержкой способствует их принятию участниками глобальных исследований, способствуя более активному участию пациентов и повышению надежности данных.
Сдержанность/Вызов
«Сложные модели лицензирования и барьеры интеграции»
- Одной из основных проблем в принятии лицензионного контента eCOA является сложность лицензионных соглашений и интеграции в клинические системы. Множество заинтересованных сторон, высокие затраты и региональные нормативные различия могут задержать или усложнить внедрение
- Например, лицензирование некоторых стандартизированных PRO, таких как EQ-5D или SF-36, может потребовать сложных переговоров с владельцами контента, особенно при использовании в многонациональных испытаниях, что увеличивает сроки и стоимость проекта.
- Кроме того, интеграция лицензированного контента в существующие платформы электронного сбора данных (EDC) или eSource часто требует индивидуальной разработки или промежуточного программного обеспечения, что может привести к техническим задержкам или увеличению эксплуатационной нагрузки.
- Обеспечение взаимодействия между лицензированными приборами eCOA и системами спонсора/CRO остается техническим препятствием, особенно при управлении различными устройствами, условиями испытаний и группами пациентов.
- Высокие первоначальные затраты на проверенные библиотеки контента и постоянные лицензионные сборы также могут сдерживать внедрение среди небольших биотехнологических компаний или академических исследователей с ограниченным бюджетом.
- Преодоление этих барьеров с помощью унифицированных схем лицензирования, облачных моделей развертывания и удобных для пользователя инструментов интеграции будет иметь решающее значение для расширения использования лицензированного контента eCOA в будущих клинических исследованиях.
Электронная оценка клинических результатов (eCOA) для сферы лицензированного рынка контента
Рынок сегментирован по продукту, подходу, конечному пользователю и платформе.
- По продукту
На основе продукта электронная оценка клинических результатов (eCOA) для рынка лицензированного контента сегментируется на локальные решения, облачные решения и веб-решения. Сегмент облачных решений доминировал на рынке с наибольшей долей дохода на рынке в 2024 году благодаря своей масштабируемости, простоте развертывания и способности поддерживать децентрализованные и гибридные клинические испытания. Спонсоры и CRO все чаще отдают предпочтение облачным платформам eCOA, поскольку они предлагают сбор данных в реальном времени, удаленный доступ и бесшовную интеграцию с другими системами eClinical, при этом снижая затраты на инфраструктуру и сложность ИТ.
Ожидается, что сегмент веб-решений будет демонстрировать самые высокие темпы роста с 2025 по 2032 год, что обусловлено ростом проникновения Интернета, глобальным расширением испытаний и спросом на платформы с доступом через браузер, требующие минимальной настройки. Веб-инструменты eCOA обеспечивают широкую доступность для пациентов и мест испытаний в разных регионах и на разных типах устройств, стимулируя внедрение в многонациональных исследованиях.
- По подходу
На основе подхода электронная оценка клинических результатов (eCOA) для рынка лицензированного контента сегментируется на оценку результатов, сообщаемых клиницистом (ClinRO), оценку результатов, сообщаемых пациентом (PRO), оценку результатов, сообщаемых наблюдателем (ObsRO), и оценку результатов эффективности (PerfO). Сегмент результатов, сообщаемых пациентом (PRO), доминировал на рынке с наибольшей долей дохода в 50,2% в 2024 году, поскольку регулирующие органы все чаще требуют включения точек зрения пациентов в клинические исследования. Лицензированные инструменты PRO предоставляют проверенные и стандартизированные методы оценки качества жизни, симптомов и воздействия лечения с точки зрения пациента, способствуя получению более весомых клинических доказательств и нормативных документов.
Ожидается, что сегмент оценки результатов эффективности (PerfO) будет демонстрировать самые высокие темпы роста с 2025 по 2032 год из-за растущего спроса на объективные и функциональные оценки в клинических испытаниях. Инструменты PerfO собирают данные в реальном времени на основе задач, выполняемых пациентами, часто с использованием цифровых устройств или носимых устройств, поддерживая более точные оценки эффективности и конечные точки испытаний.
- Конечным пользователем
На основе конечного пользователя электронная оценка клинических результатов (eCOA) для рынка лицензированного контента сегментируется на коммерческих поставщиков услуг, больницы и трансплантационные центры, исследовательские лаборатории и академические учреждения. Сегмент коммерческих поставщиков услуг занимал наибольшую долю в 2024 году, что обусловлено широким использованием платформ eCOA организациями по контрактным исследованиям (CRO), фирмами по управлению данными и поставщиками технологий. Эти поставщики услуг выступают в качестве посредников между спонсорами и клиническими центрами, внедряя решения по лицензированному контенту в масштабе и обеспечивая соответствие протоколам испытаний и мировым стандартам.
Ожидается, что сегмент академических учреждений будет расти самыми быстрыми темпами с 2025 по 2032 год, чему будет способствовать рост академических исследовательских инициатив, более широкий доступ к финансированию цифровых клинических инструментов и совместные испытания с отраслевыми партнерами. Внедрение инструментов eCOA с лицензированным контентом в академические исследования способствует повышению точности и воспроизводимости данных.
- По платформе
На основе платформы электронная оценка клинических результатов (eCOA) для рынка лицензированного контента сегментируется на контрактные исследовательские организации (CRO), фармацевтические и биофармацевтические компании, производителей медицинского оборудования, больницы и клинические лаборатории, консалтинговые компании, исследовательские и академические круги и т. д. Сегмент фармацевтических и биофармацевтических компаний доминировал на рынке в 2024 году, поскольку эти организации проводят большинство глобальных клинических испытаний и требуют проверенных, соответствующих нормативным требованиям решений eCOA для результатов, ориентированных на пациента. Их инвестиции в лицензированный контент повышают эффективность испытаний, глобальную согласованность и нормативное принятие.
Сегмент контрактных исследовательских организаций (CRO) по прогнозам будет демонстрировать самый быстрый рост с 2025 по 2032 год, поддерживаемый тенденциями аутсорсинга в клинической разработке. CRO все чаще используют готовые платформы eCOA с интегрированным лицензированным контентом, чтобы предлагать спонсорам услуги по управлению испытаниями от начала до конца, особенно для многострановых исследований, где стандартизированные показатели результатов имеют решающее значение
Электронная оценка клинических результатов (eCOA) для регионального анализа рынка лицензированного контента
- Северная Америка доминировала на рынке электронной оценки клинических результатов (eCOA) для лицензированного контента с наибольшей долей выручки в 46,8% в 2024 году, что объясняется сильной нормативной инфраструктурой, ранним внедрением цифровых клинических технологий и наличием крупных организаций клинических исследований и поставщиков решений eCOA.
- Заинтересованные стороны в регионе, включая фармацевтические компании, CRO и академические учреждения, отдают приоритет использованию проверенных, стандартизированных показателей результатов для соответствия ожиданиям FDA и EMA, что стимулирует спрос на лицензированные решения eCOA.
- Доминирование региона дополнительно подкрепляется крупными инвестициями в НИОКР, передовыми экосистемами eClinical и растущим числом децентрализованных и гибридных испытаний, что делает лицензированный контент eCOA критически важным компонентом для обеспечения точности данных, соответствия требованиям и вовлеченности пациентов в современные клинические испытания.
Электронная оценка клинических результатов в США (eCOA) для анализа рынка лицензированного контента
Электронная оценка клинических результатов (eCOA) в США для рынка лицензированного контента захватила самую большую долю дохода в 79,5% в 2024 году в Северной Америке, что обусловлено лидерством страны в активности клинических испытаний и соблюдением нормативных требований к стандартизированным показателям результатов. Натиск FDA на разработку лекарств, ориентированных на пациента, и проверенные инструменты PRO продолжают поощрять широкое внедрение лицензированных инструментов eCOA. Кроме того, распространенность децентрализованных испытаний и быстрое внедрение цифровых медицинских технологий спонсорами и CRO еще больше подстегивают спрос на платформы eCOA, встроенные в лицензированный, соответствующий нормативным требованиям контент.
Европейская электронная оценка клинических результатов eCOA для анализа рынка лицензированного контента
Европейская электронная оценка клинических результатов (eCOA) для рынка лицензированного контента, как ожидается, будет расширяться со значительным среднегодовым темпом роста в течение прогнозируемого периода, в первую очередь за счет гармонизации нормативных требований региона в рамках EMA и увеличения инвестиций в исследования, ориентированные на пациента. Растущее число многострановых испытаний и спрос на многоязычный, проверенный контент PRO и ObsRO способствуют принятию. Тенденция к оцифровке всех аспектов клинических испытаний, включая оценки согласия и результатов, поддерживает расширение рынка в терапевтических областях и сетях клинических исследований.
Электронная оценка клинических результатов в Великобритании eCOA для анализа рынка лицензированного контента
Ожидается, что электронная оценка клинических результатов (eCOA) в Великобритании для рынка лицензированного контента будет расти с заметным среднегодовым темпом роста в течение прогнозируемого периода, подпитываемого поддерживаемыми NHS инициативами в области цифрового здравоохранения и фокусом на создании реальных доказательств. Акцент на фиксировании результатов пациентов в стандартизированном цифровом формате побудил фармацевтические компании и научно-исследовательские институты инвестировать в лицензированные инструменты eCOA. Более того, сильная академическая исследовательская экосистема и активное участие в испытаниях по всей стране стимулируют более широкое принятие eCOA.
Электронная оценка клинических результатов в Германии eCOA для анализа рынка лицензированного контента
Ожидается, что электронная оценка клинических результатов (eCOA) в Германии для рынка лицензированного контента будет расширяться со значительным среднегодовым темпом роста в течение прогнозируемого периода, поддерживаемого сильным акцентом страны на соблюдении нормативных требований, качестве клинических данных и инновациях в цифровом здравоохранении. Фармацевтическая и медтех-отрасли Германии являются одними из первых, кто принял проверенный контент eCOA, особенно в исследованиях онкологии и редких заболеваний. Приверженность страны точной медицине и конфиденциальности данных хорошо согласуется с лицензированными решениями eCOA, которые предлагают безопасный, стандартизированный сбор результатов.
Электронная оценка клинических результатов eCOA в Азиатско-Тихоокеанском регионе для анализа рынка лицензированного контента
Электронная оценка клинических результатов (eCOA) Азиатско-Тихоокеанского региона для рынка лицензированного контента, как ожидается, будет расти с самым быстрым среднегодовым темпом роста в 23,2% в течение прогнозируемого периода с 2025 по 2032 год, что обусловлено всплеском активности клинических испытаний в странах с развивающейся экономикой и увеличением инвестиций в инфраструктуру цифрового здравоохранения. Такие страны, как Китай, Япония и Индия, ускоряют внедрение благодаря своему участию в глобальных испытаниях, локализации лицензированного контента и растущей потребности в ориентированных на пациента многоязычных решениях eCOA.
Электронная оценка клинических результатов в Японии eCOA для анализа рынка лицензированного контента
Японская электронная оценка клинических результатов (eCOA) для рынка лицензированного контента набирает обороты из-за акцента страны на инновации в здравоохранении, уход за пожилыми людьми и строгий нормативный надзор. Японские фармацевтические компании внедряют лицензированные инструменты PRO и ClinRO для обеспечения качества данных на поздних стадиях испытаний и послепродажного наблюдения. Интеграция систем eCOA с более широкими платформами eClinical и медицинскими устройствами IoT поддерживает улучшенное вовлечение пациентов и мониторинг результатов.
Электронная оценка клинических результатов eCOA для анализа рынка лицензированного контента в Индии
Электронная оценка клинических результатов (eCOA) в Индии для рынка лицензированного контента обеспечила наибольшую долю выручки рынка в Азиатско-Тихоокеанском регионе в 2024 году, что объясняется растущим ландшафтом клинических испытаний в стране, быстрой цифровой трансформацией и экономически эффективным предоставлением услуг CRO. Поддерживаемая правительством цифровизация здравоохранения и рост числа отечественных поставщиков технологий eClinical ускоряют принятие лицензированных инструментов eCOA. Многоязычное население Индии и разнообразные медицинские учреждения также стимулируют спрос на гибкий, проверенный контент, адаптированный к региональным потребностям испытаний.
Электронная оценка клинических результатов (eCOA) для доли рынка лицензированного контента
Электронная оценка клинических результатов (eCOA) для отрасли лицензированного контента в основном проводится известными компаниями, в том числе:
- Medidata Solutions, Inc. (США)
- Signant Health (США)
- IQVIA Inc. (США)
- YPrime, Inc. (США)
- Кларио (США)
- Clinical Ink, Inc. (США)
- ERT, Inc. (США)
- Kayentis SAS (Франция)
- Veeva Systems Inc. (США)
- Oracle Health Sciences (США)
- Parexel International Corporation (США)
- eResearch Technology, Inc (США)
- ArisGlobal LLC (США)
- Чашечка (США)
- Castor EDC (Нидерланды)
- Datatrak International, Inc. (США)
- Medio, Inc. (США)
- OpenClinica, LLC (США)
- Trial By Fire Solutions, LLC (США)
Каковы последние разработки в области глобальной электронной оценки клинических результатов (eCOA) для рынка лицензионного контента?
- В мае 2024 года компания Medidata Solutions, входящая в Dassault Systèmes, запустила улучшенную версию своей платформы myMedidata с расширенной поддержкой лицензированных оценок клинических результатов в рамках глобальных испытаний. Это обновление включает многоязычные, проверенные инструменты eCOA, бесшовно интегрированные с eConsent и данными носимых устройств, что упрощает децентрализованное проведение испытаний. Запуск подтверждает приверженность Medidata предоставлению унифицированных, соответствующих нормативным требованиям решений, которые повышают вовлеченность пациентов и целостность данных в терапевтических областях
- В апреле 2024 года Signant Health объявила о расширении своей библиотеки лицензированного контента посредством новых соглашений с несколькими лицензиарами мер PRO. Этот шаг позволяет быстрее развертывать стандартизированные меры результатов в рамках своей платформы eCOA, особенно для исследований онкологии и ЦНС. Это развитие подчеркивает стратегию Signant по укреплению своих возможностей в сборе проверенных данных, одновременно сокращая время настройки для глобальных испытаний
- В марте 2024 года IQVIA представила свой улучшенный AI-пакет eCOA, интегрированный с лицензированными PRO для оптимизации сбора данных в реальных и клинических исследованиях. Платформа использует предиктивную аналитику и интеллектуальные подсказки для пациентов для улучшения показателей реагирования и минимизации пробелов в данных, что отражает фокус IQVIA на инновациях и нормативном регулировании в цифровых испытаниях
- В феврале 2024 года YPrime заключил партнерство с несколькими академическими учреждениями для предоставления предварительно лицензированных решений eCOA для испытаний редких заболеваний, ускоряя запуск исследований и улучшая соблюдение нормативных требований. Сотрудничество обеспечивает более широкий доступ к труднодоступным показателям результатов, подчеркивая приверженность YPrime расширению исследовательских возможностей в недостаточно обслуживаемых терапевтических областях
- В январе 2024 года Clinical Ink запустила новую цифровую платформу, предлагающую готовый доступ к проверенным, лицензированным инструментам eCOA для использования в децентрализованных испытаниях. Разработанное для упрощения глобального развертывания, решение включает встроенные переводы и автоматизированное отслеживание соответствия, что отражает цель компании сделать внедрение eCOA более эффективным, масштабируемым и соответствующим меняющимся нормативным ожиданиям.
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Интерактивная панель анализа данных
- Панель анализа компании для возможностей с высоким потенциалом роста
- Доступ аналитика-исследователя для настройки и запросов
- Анализ конкурентов с помощью интерактивной панели
- Последние новости, обновления и анализ тенденций
- Используйте возможности сравнительного анализа для комплексного отслеживания конкурентов
Методология исследования
Сбор данных и анализ базового года выполняются с использованием модулей сбора данных с большими размерами выборки. Этап включает получение рыночной информации или связанных данных из различных источников и стратегий. Он включает изучение и планирование всех данных, полученных из прошлого заранее. Он также охватывает изучение несоответствий информации, наблюдаемых в различных источниках информации. Рыночные данные анализируются и оцениваются с использованием статистических и последовательных моделей рынка. Кроме того, анализ доли рынка и анализ ключевых тенденций являются основными факторами успеха в отчете о рынке. Чтобы узнать больше, пожалуйста, запросите звонок аналитика или оставьте свой запрос.
Ключевой методологией исследования, используемой исследовательской группой DBMR, является триангуляция данных, которая включает в себя интеллектуальный анализ данных, анализ влияния переменных данных на рынок и первичную (отраслевую экспертную) проверку. Модели данных включают сетку позиционирования поставщиков, анализ временной линии рынка, обзор рынка и руководство, сетку позиционирования компании, патентный анализ, анализ цен, анализ доли рынка компании, стандарты измерения, глобальный и региональный анализ и анализ доли поставщика. Чтобы узнать больше о методологии исследования, отправьте запрос, чтобы поговорить с нашими отраслевыми экспертами.
Доступна настройка
Data Bridge Market Research является лидером в области передовых формативных исследований. Мы гордимся тем, что предоставляем нашим существующим и новым клиентам данные и анализ, которые соответствуют и подходят их целям. Отчет можно настроить, включив в него анализ ценовых тенденций целевых брендов, понимание рынка для дополнительных стран (запросите список стран), данные о результатах клинических испытаний, обзор литературы, обновленный анализ рынка и продуктовой базы. Анализ рынка целевых конкурентов можно проанализировать от анализа на основе технологий до стратегий портфеля рынка. Мы можем добавить столько конкурентов, о которых вам нужны данные в нужном вам формате и стиле данных. Наша команда аналитиков также может предоставить вам данные в сырых файлах Excel, сводных таблицах (книга фактов) или помочь вам в создании презентаций из наборов данных, доступных в отчете.