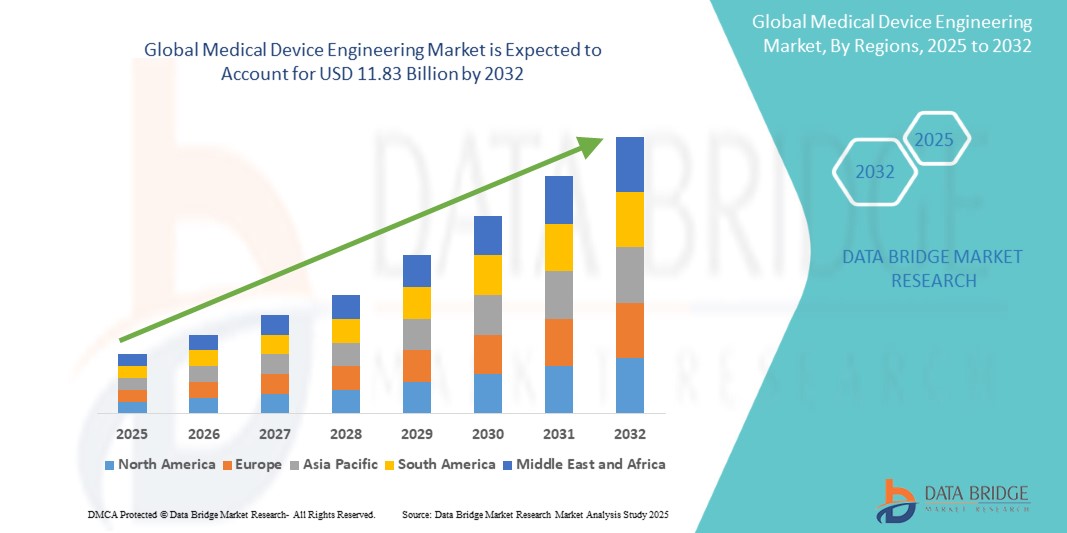
Global Medical Device Engineering Market
Размер рынка в млрд долларов США
CAGR :
% 
 USD
7.66 Billion
USD
11.83 Billion
2024
2032
USD
7.66 Billion
USD
11.83 Billion
2024
2032
| 2025 –2032 | |
| USD 7.66 Billion | |
| USD 11.83 Billion | |
|
|
|
|
Global Medical Device Engineering Market Segmentation, By Service Type (Product Innovation & Design/Industrial Design Services, Prototyping Services, Electronics Engineering Services, Software Development & Testing Services, Connectivity And Mobility Services, Cybersecurity Services, Product Testing Services, Regulatory Consulting Services, Product Support & Maintenance Services), Device Type (Diagnostic Imaging Equipment, Surgical Equipment, Patient Monitoring Devices & Life Support Devices, Medical Lasers, IVD Devices, Other Medical Devices) – Industry Trends and Forecast to 2032
Medical Device Engineering Market Analysis
The medical device engineering market is experiencing robust growth, driven by advancements in healthcare technology, increased investment in R&D, and rising demand for innovative medical solutions. With a market size projected to grow at a CAGR of over 5.8%, the industry benefits from the development of minimally invasive devices, wearable health technologies, and diagnostic tools powered by AI and IoT. Key factors influencing this growth include the aging global population and the rising prevalence of chronic diseases, which necessitate advanced medical devices for effective management. Regulatory changes, such as the EU's MDR (Medical Device Regulation) and stringent FDA requirements, are driving companies to invest in high-quality engineering solutions to ensure compliance and safety. Technological advancements, including 3D printing, robotics, and smart materials, are reshaping medical device engineering. These innovations enable faster prototyping, cost efficiency, and enhanced device functionality. The Asia-Pacific region is emerging as a significant contributor, driven by lower manufacturing costs and a growing healthcare infrastructure. Challenges like high R&D costs and regulatory hurdles remain, but the demand for cutting-edge medical devices in diagnostics, treatment, and monitoring systems ensures a positive trajectory for the industry. The integration of digital health solutions will further propel this market.
Medical Device Engineering Market Size
Global medical device engineering market size was valued at USD 7.66 billion in 2024 and is projected to reach USD 11.83 billion by 2032, with a CAGR of 5.8% during the forecast period of 2025 to 2032. In addition to the insights on market scenarios such as market value, growth rate, segmentation, geographical coverage, and major players, the market reports curated by the Data Bridge Market Research also include depth expert analysis, patient epidemiology, pipeline analysis, pricing analysis, and regulatory framework.
Medical Device Engineering Market Trends
“Artificial Intelligence (AI) and Machine Learning (ML) Integration in Medical Devices”
One of the most transformative trends in medical device engineering market is the integration of Artificial Intelligence (AI) and Machine Learning (ML) capabilities. AI and ML are enabling medical devices to perform more advanced functions such as diagnostics, data analysis, and personalized treatment recommendations, which are paving the way for a new generation of “smart” medical devices
AI-driven medical devices can analyze complex datasets and identify patterns that may not be apparent to human operators. For instance, AI algorithms embedded in imaging devices such as MRI and CT scanners help radiologists detect abnormalities such as tumors, fractures, or blood clots more accurately and at an earlier stage. This is helping healthcare providers make quicker and more accurate diagnoses, leading to better patient outcomes. AI-enabled devices can create individualized treatment plans by analyzing a patient’s unique physiological data, medical history, and genetic information. This is particularly valuable in fields like oncology, where treatments can be tailored to the specific genetic profile of a patient’s tumor, improving the effectiveness of therapies.
Report Scope and Medical Device Engineering Market Segmentation
|
Attributes |
Agriculture Rollers Key Market Insights |
|
Segments Covered |
|
|
Countries Covered |
U.S., Canada, Mexico, Germany, France, U.K., Netherlands, Switzerland, Belgium, Russia, Italy, Spain, Turkey, Rest of Europe, China, Japan, India, South Korea, Singapore, Malaysia, Australia, Thailand, Indonesia, Philippines, Rest of Asia-Pacific, Saudi Arabia, U.A.E., South Africa, Egypt, Israel, Rest of Middle East and Africa, Brazil, Argentina, Rest of South America |
|
Key Market Players |
L&T Technology Services Limited (Индия), Infosys Limited (Индия), HCL Technologies Limited (Индия), Cyient (Индия), Wipro (Индия), Tech Mahindra Limited (Индия), TATA Consultancy Services Limited (Индия), FLEX LTD (США), Capgemini (Франция), Embien Technologies India Pvt Ltd. (Индия), Alten Group (Франция), Accenture (Ирландия), Consonance (Польша), Althea Group (США), MED INSTITUTE (США), Saraca Solutions Private Limited (Индия), Nemedio Inc. (США), Sternum (Израиль), Medcrypt (США), MCRA, LLC (США), North American Science Associates, LLC (США), MedQtech (Швеция), Veranex (США), Ontogen Medtech LLC (США), Seisa Media (США) и Simplexity Product Development (США). |
|
Возможности рынка |
|
|
Информационные наборы данных с добавленной стоимостью |
Помимо аналитических данных о рыночных сценариях, таких как рыночная стоимость, темпы роста, сегментация, географический охват и основные игроки, рыночные отчеты, подготовленные Data Bridge Market Research, также включают в себя углубленный экспертный анализ, эпидемиологию пациентов, анализ воронки продаж, анализ ценообразования и нормативную базу. |
Определение рынка проектирования медицинских приборов
Инженерия медицинских устройств — это многопрофильная область, ориентированная на проектирование, разработку и производство устройств, используемых в медицинских целях, таких как диагностика, лечение, мониторинг или профилактика заболеваний. Она объединяет принципы механической, электрической, программной и биомедицинской инженерии для создания инновационных и надежных устройств, от носимых мониторов здоровья и систем визуализации до минимально инвазивных хирургических инструментов и протезов. Эта область подчеркивает соответствие строгим нормативным стандартам, безопасность и ориентированный на пользователя дизайн для обеспечения эффективности и комфорта пациента. Достижения в области материаловедения, робототехники и цифровых медицинских технологий, таких как ИИ и Интернет вещей, преобразуют инженерию медицинских устройств для улучшения результатов здравоохранения.
Динамика рынка разработки медицинских приборов
Драйверы
- Рост распространенности хронических заболеваний
Растущая распространенность хронических заболеваний, таких как сердечно-сосудистые заболевания, диабет, рак и респираторные заболевания, является основным драйвером рынка разработки медицинских устройств. Хронические заболевания — это долгосрочные, часто связанные с образом жизни состояния, которые требуют постоянного мониторинга, управления и лечения. Поскольку эти заболевания становятся все более распространенными из-за таких факторов, как старение населения, урбанизация и малоподвижный образ жизни, растет потребность в медицинских устройствах, которые могут помочь в диагностике, мониторинге и лечении. Такие состояния, как диабет и сердечно-сосудистые заболевания, требуют постоянного мониторинга. Такие устройства, как глюкометры, пульсометры и даже носимые ЭКГ, стали необходимыми для пациентов, позволяя отслеживать состояние здоровья в режиме реального времени и быстро реагировать на неблагоприятные события.
Например, согласно отчету Международной федерации диабета (IDF) за 2021 год, 10,5% взрослого населения (в возрасте от 20 до 79 лет) страдают диабетом, причем почти половина не знает, что они живут с этим заболеванием. По прогнозам IDF, к 2045 году 1 из 8 взрослых, примерно 783 миллиона человек, будут жить с диабетом, что на 46% больше.
Спрос на медицинские устройства, используемые для лечения хронических заболеваний, привел к инновациям в области портативных, удобных и экономически эффективных устройств, что делает здравоохранение более доступным. Например, разработка подключенных устройств, которые передают данные поставщикам медицинских услуг в режиме реального времени, помогает решать проблемы лечения хронических заболеваний как на уровне пациента, так и на уровне системы. Ожидается, что эта тенденция будет усиливаться, что значительно поспособствует росту рынка разработки медицинских устройств.
- Технологические достижения в области медицинских приборов
Быстрые технологические инновации являются мощным драйвером на рынке проектирования медицинских устройств, преобразуя устройства и расширяя их возможности. Достижения в таких областях, как искусственный интеллект, робототехника, 3D-печать и биосовместимые материалы, позволяют разрабатывать сложные медицинские устройства, которые обеспечивают большую точность, автоматизацию и адаптивность к индивидуальным потребностям пациентов. Внедрение этих передовых технологий позволяет рынку медицинских устройств удовлетворять растущий спрос на более эффективные, действенные и ориентированные на пациента решения. Компании, инвестирующие в эти технологии, готовы захватить долю рынка, предлагая инновационные устройства, которые проще в использовании для врачей и обеспечивают улучшенные клинические преимущества. Например, Philips использует ИИ в своих диагностических устройствах визуализации, таких как IntelliSpace AI Workflow Suite. Эта платформа использует ИИ для повышения качества изображений, ускорения диагностических рабочих процессов и содействия более ранней и точной диагностике. Она разработана для рентгенологов для оптимизации операций визуализации и обеспечения улучшенных результатов для пациентов. Поскольку системы здравоохранения во всем мире все чаще внедряют эти передовые решения, ожидается, что рынок проектирования медицинских устройств будет испытывать устойчивый рост, обусловленный технологическим прогрессом.
Возможности
- Расширение носимых устройств и устройств дистанционного мониторинга
С ростом телемедицины и спроса на проактивное управление здоровьем носимые устройства и устройства дистанционного мониторинга представляют собой существенную возможность на рынке разработки медицинских устройств. Эти устройства, включая умные часы, непрерывные мониторы глюкозы и кардиомониторы, позволяют осуществлять мониторинг здоровья в режиме реального времени за пределами традиционных клинических условий. Возможность отслеживать жизненно важные показатели, такие как частота сердечных сокращений, уровень кислорода и уровень глюкозы, обеспечивает непрерывные данные о пациентах и позволяет людям более эффективно управлять своим здоровьем. Носимые устройства представляют огромную ценность для пациентов, страдающих хроническими заболеваниями, такими как диабет, гипертония и болезни сердца. С ростом осведомленности о профилактическом здравоохранении и ростом инвестиций в носимые технологии ожидается, что этот сегмент будет демонстрировать значительный рост. Согласно исследованию рынка, ожидается, что сегмент носимых медицинских устройств будет расти высокими среднегодовыми темпами в течение следующего десятилетия, что в значительной степени будет способствовать общему расширению рынка медицинских устройств.
Например, в августе 2024 года компания Dexcom объявила, что ее новый безрецептурный непрерывный монитор глюкозы Stelo официально доступен для покупки в США. Stelo Glucose Biosensor System — это безрецептурный (OTC) интегрированный непрерывный монитор глюкозы (iCGM), предназначенный для непрерывного измерения, записи, анализа и отображения значений глюкозы у людей в возрасте 18 лет и старше, не принимающих инсулин. Stelo Glucose Biosensor System помогает определять нормальный (эугликемический) и низкий или высокий (дисгликемический) уровень глюкозы. Stelo Glucose Biosensor System также может помочь пользователю лучше понять, как изменение образа жизни и поведения, включая диету и физические упражнения, влияет на отклонение уровня глюкозы. Таким образом, ожидается, что увеличение доступности носимых и дистанционных устройств мониторинга будет способствовать росту рынка в прогнозируемый период.
- Растущий спрос на малоинвазивные хирургические устройства
Переход к минимально инвазивным процедурам представляет собой еще одну существенную возможность для разработки медицинских устройств. Минимально инвазивные хирургические (МИС) устройства, включая лапароскопические инструменты, роботизированные хирургические инструменты и эндоскопические устройства, сокращают время восстановления, вызывают меньше травм и минимизируют послеоперационные осложнения. Рынок МИС устройств расширяется, поскольку пациенты и поставщики медицинских услуг ищут варианты, которые сокращают пребывание в больнице и улучшают результаты лечения пациентов. Методы МИС предполагают меньшие разрезы, что снижает риск инфекции, боли и рубцевания. Например, роботизированная хирургия обеспечивает большую точность в сложных процедурах, таких как кардиологические и ортопедические операции, улучшая результаты и время восстановления.
Эта тенденция подкрепляется технологическими достижениями в робототехнике, визуализации и хирургических инструментах. Ожидается, что рынок устройств MIS будет демонстрировать устойчивый рост, при этом прогнозы указывают на высокий спрос, особенно в ортопедических, сердечно-сосудистых и желудочно-кишечных приложениях. Возможности также увеличиваются за счет стареющего населения, которому часто требуются хирургические вмешательства при хронических заболеваниях, которые методы MIS могут решать с меньшим количеством осложнений и более быстрым выздоровлением. Например, система Mako от Stryker — это роботизированная платформа, которая позволяет хирургам-ортопедам выполнять точные, минимально инвазивные операции по замене коленного и тазобедренного сустава. Система Mako объединяет 3D-визуализацию и роботизированные руки, что позволяет повысить точность и специфическое для пациента хирургическое планирование. Внедрение этого типа устройств стимулирует рост рынка в течение прогнозируемого периода.
Ограничения/Проблемы
- Соблюдение нормативных требований и задержки в утверждении
Одной из самых существенных проблем, с которой сталкивается отрасль разработки медицинских устройств, является необходимость ориентироваться в сложных и строгих нормативных требованиях. Чтобы получить одобрение регулирующих органов, медицинские устройства должны пройти тщательное тестирование и клинические испытания, чтобы продемонстрировать безопасность и эффективность. Этот процесс может быть длительным и дорогостоящим, часто приводя к задержкам в запуске продуктов и выходе на рынок. Более того, нормативная среда постоянно меняется, вводятся новые правила и стандарты. Это может создавать дополнительные проблемы для производителей, которые должны быть в курсе последних требований и соответствующим образом адаптировать свою продукцию.
Более того, нормативная среда может существенно различаться в разных странах. Получение разрешений на нескольких рынках может быть сложным и дорогостоящим процессом. Это может препятствовать глобальному распространению медицинских устройств и ограничивать доступ на рынок.
- Высокие первоначальные затраты на медицинское оборудование
Высокая стоимость медицинских устройств является существенным препятствием для роста рынка разработки медицинских устройств. Дорогие материалы, сложные производственные процессы и строгие нормативные требования способствуют общей стоимости этих устройств. В результате поставщики медицинских услуг, особенно в развивающихся странах, могут испытывать трудности с приобретением передовых медицинских технологий, что ограничивает их внедрение на рынке. Кроме того, высокие цены могут сдерживать инновации со стороны небольших компаний, у которых нет финансовых ресурсов для инвестиций в НИОКР и соблюдения нормативных стандартов. Это ограничивает доступность и масштабируемость новых технологий.
Например, по данным Американского совета по науке и здравоохранению, стоимость медицинских приборов упоминается редко. Она составляет около 5% расходов на здравоохранение, или около 120 млрд долларов США в 2017 году. Таким образом, высокая стоимость медицинских приборов сдерживает рост рынка разработки медицинских приборов.
Масштаб рынка разработки медицинских приборов
Рынок сегментирован на основе типа сервиса и типа устройства. Рост среди этих сегментов поможет вам проанализировать сегменты с незначительным ростом в отраслях и предоставить пользователям ценный обзор рынка и рыночные идеи, которые помогут им принимать стратегические решения для определения основных рыночных приложений.
Тип услуги
- Инновации и дизайн продукции/Услуги промышленного дизайна
- Услуги прототипирования
- Услуги по электронике
- Услуги по разработке и тестированию программного обеспечения
- Услуги связи и мобильности
- Услуги кибербезопасности
- Услуги по тестированию продукции
- Услуги нормативного консультирования
- Поддержка и обслуживание продукции
Тип устройства
- Диагностическое оборудование для визуализации
- Хирургическое оборудование
- Устройства мониторинга состояния пациентов и устройства жизнеобеспечения
- Медицинские лазеры
- Устройства для диагностики in vitro
- Другие медицинские приборы
Региональный анализ рынка инжиниринга медицинских приборов
Проводится анализ рынка и предоставляются сведения о его размерах и тенденциях по странам, типам устройств и услуг, как указано выше.
Страны, охваченные рынком: США, Канада, Мексика, Германия, Франция, Великобритания, Нидерланды, Швейцария, Бельгия, Россия, Италия, Испания, Турция, остальные страны Европы, Китай, Япония, Индия, Южная Корея, Сингапур, Малайзия, Австралия, Таиланд, Индонезия, Филиппины, остальные страны Азиатско-Тихоокеанского региона, Саудовская Аравия, ОАЭ, Южная Африка, Египет, Израиль, остальные страны Ближнего Востока и Африки, Бразилия, Аргентина и остальные страны Южной Америки.
Ожидается, что Северная Америка будет доминировать на рынке из-за достижений в области технологий медицинских устройств и высоких расходов на здравоохранение, присутствия ключевых игроков. Кроме того, ожидается, что высокая стоимость медицинских устройств и высокая скорость их внедрения будут способствовать дальнейшему росту рынка.
Ожидается, что Азиатско-Тихоокеанский регион будет самым быстрорастущим из-за быстро растущего населения региона. Правительственные инициативы и инвестиции, направленные на модернизацию сектора здравоохранения, наряду с повышением осведомленности людей о преимуществах современных медицинских устройств, всплеск активности стартапов в сфере медицинских устройств способствуют расширению рынка.
Раздел отчета по странам также содержит отдельные факторы, влияющие на рынок, и изменения в регулировании на внутреннем рынке, которые влияют на текущие и будущие тенденции рынка. Такие данные, как анализ цепочки создания стоимости вверх и вниз по течению, технические тенденции и анализ пяти сил Портера, тематические исследования, являются некоторыми из указателей, используемых для прогнозирования рыночного сценария для отдельных стран. Кроме того, при предоставлении прогнозного анализа данных по странам учитываются наличие и доступность глобальных брендов и их проблемы, связанные с большой или малой конкуренцией со стороны местных и внутренних брендов, влияние внутренних тарифов и торговых путей.
Доля рынка проектирования медицинских приборов
Конкурентная среда рынка содержит сведения о конкурентах. Включены сведения о компании, ее финансах, полученном доходе, рыночном потенциале, инвестициях в исследования и разработки, новых рыночных инициативах, глобальном присутствии, производственных площадках и объектах, производственных мощностях, сильных и слабых сторонах компании, запуске продукта, широте и широте продукта, доминировании приложений. Приведенные выше данные касаются только фокуса компаний на рынке.
Лидерами рынка разработки медицинских приборов, работающими на рынке, являются:
- L&T Technology Services Limited (Индия)
- Infosys Limited (Индия)
- HCL Technologies Limited (Индия)
- Cyient (Индия)
- Wipro (Индия)
- Tech Mahindra Limited (Индия)
- TATA Consultancy Services Limited (Индия)
- FLEX LTD (США)
- Капджемини (Франция)
- Embien Technologies India Pvt Ltd. (Индия)
- Группа Alten (Франция)
- Accenture (Ирландия)
- Консонанс (Польша)
- Группа компаний Althea (США)
- МЕДИЦИНСКИЙ ИНСТИТУТ (США)
- Saraca Solutions Private Limited (Индия)
- Nemedio Inc. (США)
- Грудина (Израиль)
- Medcrypt (США)
- MCRA, LLC (США)
- Североамериканская научная ассоциация, ООО (США)
- MedQtech (Швеция)
- Веранекс (США)
- Ontogen Medtech LLC (США)
- Seisa Media (США)
- Разработка продукта Simplexity (США)
Последние разработки на рынке разработки медицинских приборов
- В ноябре 2023 года компания L&T Technology Services Limited (LTTS) (Индия) заключила партнерское соглашение с корпорацией NVIDIA (США) с целью разработки программно-определяемых архитектур для медицинских устройств, в частности для эндоскопии, направленных на улучшение качества изображений и масштабируемости продукции.
- В октябре 2023 года Alten Group (Франция) приобрела East Japan Institute of Technology Co., Ltd. (Япония). Это приобретение поддерживает стратегию Alten по укреплению своих инженерных возможностей в Японии и достижению значительного присутствия на рынке, позиционируя себя как ведущего поставщика инжиниринговых услуг в регионе.
- В январе 2022 года компания HCL Technologies Limited (Индия) приобрела Starschema (США). Этот шаг расширяет возможности HCL в области цифрового инжиниринга, особенно в области dassssta-инжиниринга, и расширяет ее присутствие в Центральной и Восточной Европе.
- В сентябре 2024 года Vision Engineering, британский разработчик, производитель и экспортер эргономичных микроскопов и измерительных систем, выпустила OPTA — экономичный продукт начального уровня для своей запатентованной технологии оптического стереомикроскопа. Доступный менее чем за 1200 долларов США, с выбором из трех стоек и двух объективов, OPTA переопределяет точку входа для пользователей, чтобы получить выгоду от качества изображения, эргономичного дизайна и простоты использования Vision Engineering. Этот продукт направлен на улучшение качества изображения и эргономики, делая расширенную микроскопию более доступной. Запуск этого типа устройств стимулирует рост рынка разработки медицинских устройств.
- In June 2022, Siemens Healthineers introduces Symbia Pro.specta, a single photon emission computed tomography/computed tomography (SPECT/CT) system with CE mark and Food and Drug Administration (FDA) clearance that has advanced SPECT and CT imaging technologies. Capabilities include a low-dose CT of up to 64 slices for impressive detail, automatic SPECT motion correction for additional image clarity, and an intuitive and automated workflow to guide the user through the entire decision-making process of the examination
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Интерактивная панель анализа данных
- Панель анализа компании для возможностей с высоким потенциалом роста
- Доступ аналитика-исследователя для настройки и запросов
- Анализ конкурентов с помощью интерактивной панели
- Последние новости, обновления и анализ тенденций
- Используйте возможности сравнительного анализа для комплексного отслеживания конкурентов
Содержание
1. INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL MEDICAL DEVICE ENGINEERING MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2. MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL MEDICAL DEVICE ENGINEERING MARKETSIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.12 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL MEDICAL DEVICE ENGINEERING MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3. MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4. EXECUTIVE SUMMARY
5. PREMIUM INSIGHTS
5.1 PESTEL ANALYSIS
5.2 PORTER’S FIVE FORCES MODEL
6. INDUSTRY INSIGHTS
6.1 MICRO AND MACRO ECONOMIC FACTORS
6.2 PENETRATION AND GROWTH PROSPECT MAPPING
6.3 KEY PRICING STRATEGIES
6.4 INTERVIEWS WITH SPECIALIST
6.5 ANALYIS AND RECOMMENDATION
7. INTELLECTUAL PROPERTY (IP) PORTFOLIO
7.1 PATENT QUALITY AND STRENGTH
7.2 PATENT FAMILIES
7.3 LICENSING AND COLLABORATIONS
7.4 COMPETITIVE LANDSCAPE
7.5 IP STRATEGY AND MANAGEMENT
7.6 OTHER
8. COST ANALYSIS BREAKDOWN
9. TECHNONLOGY ROADMAP
10. INNOVATION TRACKER AND STRATEGIC ANALYSIS
10.1 MAJOR DEALS AND STRATEGIC ALLIANCES ANALYSIS
10.1.1 JOINT VENTURES
10.1.2 MERGERS AND ACQUISITIONS
10.1.3 LICENSING AND PARTNERSHIP
10.1.4 TECHNOLOGY COLLABORATIONS
10.1.5 STRATEGIC DIVESTMENTS
10.2 NUMBER OF PRODUCTS IN DEVELOPMENT
10.3 STAGE OF DEVELOPMENT
10.4 TIMELINES AND MILESTONES
10.5 INNOVATION STRATEGIES AND METHODOLOGIES
10.6 RISK ASSESSMENT AND MITIGATION
10.7 FUTURE OUTLOOK
11. REGULATORY COMPLIANCE
11.1 REGULATORY AUTHORITIES
11.2 REGULATORY CLASSIFICATIONS
11.2.1 CLASS I
11.2.2 CLASS II
11.2.3 CLASS III
11.3 REGULATORY SUBMISSIONS
11.4 INTERNATIONAL HARMONIZATION
11.5 COMPLIANCE AND QUALITY MANAGEMENT SYSTEMS
11.6 REGULATORY CHALLENGES AND STRATEGIES
12. REIMBURSEMENT FRAMEWORK
13. OPPUTUNITY MAP ANALYSIS
14. VALUE CHAIN ANALYSIS
15. HEALTHCARE ECONOMY
15.1 HEALTHCARE EXPENDITURE
15.2 CAPITAL EXPENDITURE
15.3 CAPEX TRENDS
15.4 CAPEX ALLOCATION
15.5 FUNDING SOURCES
15.6 INDUSTRY BENCHMARKS
15.7 GDP RATION IN OVERALL GDP
15.8 HEALTHCARE SYSTEM STRUCTURE
15.9 GOVERNMENT POLICIES
15.10 ECONOMIC DEVELOPMENT
16. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY SERVICE TYPE
16.1 OVERVIEW
16.2 PRODUCT DESIGN & DEVELOPMENT
16.2.1 CONCEPTUALIZATION & IDEATION
16.2.2 INDUSTRIAL & MECHANICAL DESIGN
16.2.3 USER-CENTERED DESIGN (UCD) & ERGONOMICS
16.2.4 MATERIALS & COMPONENT SELECTION
16.2.5 FINITE ELEMENT ANALYSIS (FEA) & SIMULATION
16.2.6 DESIGN FOR MANUFACTURING (DFM)
16.3 PROTOTYPING & TESTING
16.3.1 RAPID PROTOTYPING (3D PRINTING, CNC, INJECTION MOLDING)
16.3.2 MECHANICAL, ELECTRICAL & THERMAL TESTING
16.3.3 PRECLINICAL TESTING & VALIDATION
16.3.4 BIOCOMPATIBILITY & TOXICITY TESTING
16.3.5 FAILURE MODE & EFFECTS ANALYSIS (FMEA)
16.4 MANUFACTURING & SUPPLY CHAIN MANAGEMENT
16.4.1 CONTRACT MANUFACTURING (OEM & ODM)
16.4.2 COMPONENT SOURCING & SUPPLY CHAIN OPTIMIZATION
16.4.3 CLEANROOM & STERILE MANUFACTURING
16.4.4 LEAN MANUFACTURING & SIX SIGMA PRACTICES
16.4.5 QUALITY CONTROL & ASSURANCE (ISO 13485, GMP)
16.5 REGULATORY COMPLIANCE & CONSULTING
16.5.1 RISK MANAGEMENT & SAFETY ASSESSMENTS
16.5.2 CLINICAL & REGULATORY STRATEGY CONSULTING
16.5.3 REGULATORY SUBMISSIONS (FDA, CE MARKING, ISO CERTIFICATION)
16.5.4 POST-MARKET SURVEILLANCE & COMPLIANCE AUDITS
16.5.5 LEGAL & ETHICAL CONSIDERATIONS
16.6 EMBEDDED SYSTEMS & SOFTWARE DEVELOPMENT
16.7 OTHER
17. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY DEVICE TYPE
17.1 OVERVIEW
(NOTE: MARKET VALUE, VOLUME AND ASP ANALYSIS WOULD BE PROVIDED FOR ALL SEGMENTS AND SUB-SEGMENTS OF PRODUCT)
17.2 DIAGNOSTIC DEVICES
17.2.1 IMAGING SYSTEMS
17.2.1.1. MAGNETIC RESONANCE IMAGING (MRI)
17.2.1.1.1. OPEN MRI
17.2.1.1.2. CLOSED MRI
17.2.1.2. COMPUTED TOMOGRAPHY (CT) SCANNERS
17.2.1.2.1. LOW-SLICE CT (1-16 SLICES)
17.2.1.2.2. MID-SLICE CT (32-64 SLICES)
17.2.1.2.3. HIGH-SLICE CT (128+ SLICES)
17.2.1.2.4. CONE BEAM CT (CBCT)
17.2.1.2.5. SPECTRAL CT
17.2.1.3. ULTRASOUND DEVICES
17.2.1.3.1. 2D ULTRASOUND
17.2.1.3.2. 3D/4D ULTRASOUND
17.2.1.3.3. DOPPLER ULTRASOUND
17.2.1.3.4. PORTABLE & HANDHELD ULTRASOUND
17.2.1.3.5. HIGH-INTENSITY FOCUSED ULTRASOUND (HIFU)
17.2.1.4. X-RAY SYSTEMS
17.2.1.4.1. ANALOG X-RAY
17.2.1.4.2. DIGITAL RADIOGRAPHY (DR)
17.2.1.4.3. COMPUTED RADIOGRAPHY (CR)
17.2.1.4.4. FLUOROSCOPY SYSTEMS
17.2.1.5. POSITRON EMISSION TOMOGRAPHY (PET) SCANNERS
17.2.1.5.1. PET-CT SYSTEMS
17.2.1.5.2. PET-MRI SYSTEMS
17.2.1.5.3. STANDALONE PET SCANNERS
17.2.2 IN-VITRO DIAGNOSTIC (IVD) EQUIPMENT
17.2.2.1. MOLECULAR DIAGNOSTICS
17.2.2.1.1. POLYMERASE CHAIN REACTION (PCR)
17.2.2.1.2. NEXT-GENERATION SEQUENCING (NGS)
17.2.2.1.3. DNA MICROARRAYS
17.2.2.1.4. ISOTHERMAL NUCLEIC ACID AMPLIFICATION
17.2.2.2. IMMUNOASSAYS
17.2.2.2.1. ENZYME-LINKED IMMUNOSORBENT ASSAY (ELISA)
17.2.2.2.2. CHEMILUMINESCENCE IMMUNOASSAY (CLIA)
17.2.2.2.3. RADIOIMMUNOASSAY (RIA)
17.2.2.3. HEMATOLOGY ANALYZERS
17.2.2.3.1. 3-PART HEMATOLOGY ANALYZERS
17.2.2.3.2. 5-PART HEMATOLOGY ANALYZERS
17.2.2.3.3. POINT-OF-CARE HEMATOLOGY DEVICES
17.2.2.4. POINT-OF-CARE TESTING DEVICES
17.2.2.4.1. GLUCOSE MONITORING SYSTEMS
17.2.2.4.2. RAPID ANTIGEN/ANTIBODY TESTS
17.2.2.4.3. HOME PREGNANCY & FERTILITY KITS
17.2.2.4.4. INFECTIOUS DISEASE RAPID TESTS
17.3 THERAPEUTIC DEVICES
17.3.1 SURGICAL INSTRUMENTS & ROBOTICS
17.3.1.1. MINIMALLY INVASIVE SURGERY (MIS) DEVICES
17.3.1.1.1. LAPAROSCOPIC INSTRUMENTS
17.3.1.1.2. ENDOSCOPIC INSTRUMENTS
17.3.1.1.3. ARTHROSCOPIC DEVICES
17.3.1.1.4. ROBOTIC-ASSISTED MIS SYSTEMS
17.3.1.2. ROBOT-ASSISTED SURGERY (RAS) SYSTEMS
17.3.1.2.1. ORTHOPEDIC SURGERY ROBOTS
17.3.1.2.2. NEUROSURGERY ROBOTS
17.3.1.2.3. UROLOGY & GYNECOLOGY SURGERY ROBOTS
17.3.2 IMPLANTABLE MEDICAL DEVICES
17.3.2.1. ORTHOPEDIC IMPLANTS
17.3.2.1.1. HIP IMPLANTS
17.3.2.1.2. KNEE IMPLANTS
17.3.2.1.3. SPINAL IMPLANTS
17.3.2.1.4. TRAUMA FIXATION DEVICES
17.3.2.2. CARDIOVASCULAR IMPLANTS
17.3.2.2.1. PACEMAKERS
17.3.2.2.2. IMPLANTABLE CARDIOVERTER DEFIBRILLATORS (ICDS)
17.3.2.2.3. HEART VALVES
17.3.2.2.4. CORONARY & PERIPHERAL STENTS
17.3.2.3. NEUROSTIMULATION DEVICES
17.3.2.3.1. DEEP BRAIN STIMULATORS (DBS)
17.3.2.3.2. SPINAL CORD STIMULATORS (SCS)
17.3.2.3.3. VAGUS NERVE STIMULATORS (VNS)
17.3.2.3.4. SACRAL NERVE STIMULATORS
17.3.2.4. COCHLEAR & AUDITORY IMPLANTS
17.3.2.4.1. COCHLEAR IMPLANTS
17.3.2.4.2. BONE-ANCHORED HEARING AIDS (BAHA)
17.3.3 DRUG DELIVERY SYSTEMS
17.3.3.1. SMART INFUSION PUMPS
17.3.3.1.1. LARGE VOLUME PUMPS (LVP)
17.3.3.1.2. SYRINGE INFUSION PUMPS
17.3.3.1.3. PATIENT-CONTROLLED ANALGESIA (PCA) PUMPS
17.3.3.1.4. INSULIN PUMPS
17.3.3.2. SMART INHALERS
17.3.3.2.1. METERED-DOSE INHALERS (MDIS)
17.3.3.2.2. DRY POWDER INHALERS (DPIS)
17.3.3.2.3. NEBULIZERS
17.4 PATIENT MONITORING DEVICES
17.4.1 WEARABLE MEDICAL DEVICES
17.4.1.1. SMARTWATCHES & FITNESS TRACKERS
17.4.1.1.1. HEART RATE MONITORING
17.4.1.1.2. BLOOD OXYGEN (SPO2) MONITORING
17.4.1.1.3. ECG MONITORING
17.4.1.2. CONTINUOUS GLUCOSE MONITORS (CGM)
17.4.1.2.1. REAL-TIME CGM (RTCGM)
17.4.1.2.2. INTERMITTENTLY SCANNED CGM (ISCGM)
17.4.2 REMOTE PATIENT MONITORING (RPM) SYSTEMS
17.4.2.1. CARDIAC MONITORING DEVICES
17.4.2.1.1. HOLTER MONITORS
17.4.2.1.2. IMPLANTABLE LOOP RECORDERS
17.4.2.1.3. WIRELESS ECG
17.4.2.2. RESPIRATORY MONITORING DEVICES
17.4.2.2.1. PULSE OXIMETERS
17.4.2.2.2. CAPNOGRAPHY SYSTEMS
17.4.2.3. NEUROLOGICAL MONITORING DEVICES
17.4.2.3.1. EEG MONITORS
17.4.2.3.2. ELECTROMYOGRAPHY (EMG) DEVICES
17.5 HEALTHCARE IT & DIGITAL HEALTH SOLUTIONS
17.5.1 TELEMEDICINE PLATFORMS
17.5.1.1. VIDEO CONSULTATION PLATFORMS
17.5.1.1.1. GENERAL TELECONSULTATION
17.5.1.1.2. TELEPSYCHIATRY
17.5.1.1.3. TELEDERMATOLOGY
17.5.1.1.4. TELENEUROLOGY
17.5.1.2. REMOTE PATIENT MANAGEMENT SYSTEMS
17.5.1.2.1. MOBILE HEALTH APPS
17.5.1.2.2. AI-BASED SYMPTOM CHECKERS
17.5.2 ELECTRONIC HEALTH RECORDS (EHR)
17.5.2.1. CLOUD-BASED EHR
17.5.2.2. ON-PREMISE EHR
17.5.2.3. AI-DRIVEN EHR SYSTEMS
17.5.3 AI-BASED DIAGNOSTIC & DECISION-SUPPORT TOOLS
17.5.3.1. AI IN RADIOLOGY & IMAGING
17.5.3.2. AI IN PATHOLOGY
17.5.3.3. AI FOR HISTOPATHOLOGICAL IMAGE ANALYSIS
17.5.3.4. AUTOMATED CYTOLOGY ANALYSIS
17.6 OTHERS
18. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY APPLICATION
18.1 OVERVIEW
18.2 CARDIOVASCULAR
18.3 ORTHOPEDICS
18.4 NEUROLOGY
18.5 ONCOLOGY
18.6 RESPIRATORY
18.7 GENERAL SURGERY
18.8 OPHTHALMOLOGY
18.9 DENTAL
18.10 OTHERS
19. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY END USER
19.1 OVERVIEW
19.2 MEDICAL DEVICE MANUFACTURERS
19.3 CONTRACT MANUFACTURING ORGANIZATIONS (CMOS) & CONTRACT DEVELOPMENT AND MANUFACTURING ORGANIZATIONS (CDMOS)
19.4 HOSPITALS & HEALTHCARE PROVIDERS
19.5 REMOTE PATIENT MONITORING PROVIDERS
19.6 REGULATORY & COMPLIANCE BODIES
19.7 OTHERS
20. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY COUNTRY
GLOBAL MEDICAL DEVICE ENGINEERING MARKET (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
20.1 NORTH AMERICA
20.1.1 U.S.
20.1.2 CANADA
20.1.3 MEXICO
20.2 EUROPE
20.2.1 GERMANY
20.2.2 U.K.
20.2.3 ITALY
20.2.4 FRANCE
20.2.5 SPAIN
20.2.6 RUSSIA
20.2.7 SWITZERLAND
20.2.8 TURKEY
20.2.9 BELGIUM
20.2.10 NETHERLANDS
20.2.11 DENMARK
20.2.12 SWEDEN
20.2.13 POLAND
20.2.14 NORWAY
20.2.15 FINLAND
20.2.16 REST OF EUROPE
20.3 ASIA-PACIFIC
20.3.1 JAPAN
20.3.2 CHINA
20.3.3 SOUTH KOREA
20.3.4 INDIA
20.3.5 SINGAPORE
20.3.6 THAILAND
20.3.7 INDONESIA
20.3.8 MALAYSIA
20.3.9 PHILIPPINES
20.3.10 AUSTRALIA
20.3.11 NEW ZEALAND
20.3.12 VIETNAM
20.3.13 TAIWAN
20.3.14 REST OF ASIA-PACIFIC
20.4 SOUTH AMERICA
20.4.1 BRAZIL
20.4.2 ARGENTINA
20.4.3 REST OF SOUTH AMERICA
20.5 MIDDLE EAST AND AFRICA
20.5.1 SOUTH AFRICA
20.5.2 EGYPT
20.5.3 BAHRAIN
20.5.4 UNITED ARAB EMIRATES
20.5.5 KUWAIT
20.5.6 OMAN
20.5.7 QATAR
20.5.8 SAUDI ARABIA
20.5.9 REST OF MEA
20.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
21. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, SWOT AND DBMR ANALYSIS
22. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, COMPANY PROFILE
22.1 3M HEALTH CARE
22.1.1 COMPANY OVERVIEW
22.1.2 REVENUE ANALYSIS
22.1.3 GEOGRAPHIC PRESENCE
22.1.4 PRODUCT PORTFOLIO
22.1.5 RECENT DEVELOPMENTS
22.2 ABBOTT LABORATORIES
22.2.1 COMPANY OVERVIEW
22.2.2 REVENUE ANALYSIS
22.2.3 GEOGRAPHIC PRESENCE
22.2.4 PRODUCT PORTFOLIO
22.2.5 RECENT DEVELOPMENTS
22.3 BAXTER INTERNATIONAL
22.3.1 COMPANY OVERVIEW
22.3.2 REVENUE ANALYSIS
22.3.3 GEOGRAPHIC PRESENCE
22.3.4 PRODUCT PORTFOLIO
22.3.5 RECENT DEVELOPMENTS
22.4 BECTON DICKINSON COMPANY
22.4.1 COMPANY OVERVIEW
22.4.2 REVENUE ANALYSIS
22.4.3 GEOGRAPHIC PRESENCE
22.4.4 PRODUCT PORTFOLIO
22.4.5 RECENT DEVELOPMENTS
22.5 BOSTON SCIENTIFIC CORPORATION
22.5.1 COMPANY OVERVIEW
22.5.2 REVENUE ANALYSIS
22.5.3 GEOGRAPHIC PRESENCE
22.5.4 PRODUCT PORTFOLIO
22.5.5 RECENT DEVELOPMENTS
22.6 CANON MEDICAL SYSTEMS CORPORATION
22.6.1 COMPANY OVERVIEW
22.6.2 REVENUE ANALYSIS
22.6.3 GEOGRAPHIC PRESENCE
22.6.4 PRODUCT PORTFOLIO
22.6.5 RECENT DEVELOPMENTS
22.7 CARDINAL HEALTH
22.7.1 COMPANY OVERVIEW
22.7.2 REVENUE ANALYSIS
22.7.3 GEOGRAPHIC PRESENCE
22.7.4 PRODUCT PORTFOLIO
22.7.5 RECENT DEVELOPMENTS
22.8 DANAHER CORPORATION
22.8.1 COMPANY OVERVIEW
22.8.2 REVENUE ANALYSIS
22.8.3 GEOGRAPHIC PRESENCE
22.8.4 PRODUCT PORTFOLIO
22.8.5 RECENT DEVELOPMENTS
22.9 FRESENIUS MEDICAL CARE
22.9.1 COMPANY OVERVIEW
22.9.2 REVENUE ANALYSIS
22.9.3 GEOGRAPHIC PRESENCE
22.9.4 PRODUCT PORTFOLIO
22.9.5 RECENT DEVELOPMENTS
22.10 GE HEALTHCARE
22.10.1 COMPANY OVERVIEW
22.10.2 REVENUE ANALYSIS
22.10.3 GEOGRAPHIC PRESENCE
22.10.4 PRODUCT PORTFOLIO
22.10.5 RECENT DEVELOPMENTS
22.11 HOLOGIC, INC.
22.11.1 COMPANY OVERVIEW
22.11.2 REVENUE ANALYSIS
22.11.3 GEOGRAPHIC PRESENCE
22.11.4 PRODUCT PORTFOLIO
22.11.5 RECENT DEVELOPMENTS
22.12 INTUITIVE SURGICAL
22.12.1 COMPANY OVERVIEW
22.12.2 REVENUE ANALYSIS
22.12.3 GEOGRAPHIC PRESENCE
22.12.4 PRODUCT PORTFOLIO
22.12.5 RECENT DEVELOPMENTS
22.13 JOHNSON & JOHNSON
22.13.1 COMPANY OVERVIEW
22.13.2 REVENUE ANALYSIS
22.13.3 GEOGRAPHIC PRESENCE
22.13.4 PRODUCT PORTFOLIO
22.13.5 RECENT DEVELOPMENTS
22.14 MEDTRONIC PLC
22.14.1 COMPANY OVERVIEW
22.14.2 REVENUE ANALYSIS
22.14.3 GEOGRAPHIC PRESENCE
22.14.4 PRODUCT PORTFOLIO
22.14.5 RECENT DEVELOPMENTS
22.15 PHILIPS HEALTHCARE
22.15.1 COMPANY OVERVIEW
22.15.2 REVENUE ANALYSIS
22.15.3 GEOGRAPHIC PRESENCE
22.15.4 PRODUCT PORTFOLIO
22.15.5 RECENT DEVELOPMENTS
22.16 RESMED INC.
22.16.1 COMPANY OVERVIEW
22.16.2 REVENUE ANALYSIS
22.16.3 GEOGRAPHIC PRESENCE
22.16.4 PRODUCT PORTFOLIO
22.16.5 RECENT DEVELOPMENTS
22.17 ROCHE DIAGNOSTICS INTERNATIONAL LTD
22.17.1 COMPANY OVERVIEW
22.17.2 REVENUE ANALYSIS
22.17.3 GEOGRAPHIC PRESENCE
22.17.4 PRODUCT PORTFOLIO
22.17.5 RECENT DEVELOPMENTS
22.18 SIEMENS HEALTHINEERS AG
22.18.1 COMPANY OVERVIEW
22.18.2 REVENUE ANALYSIS
22.18.3 GEOGRAPHIC PRESENCE
22.18.4 PRODUCT PORTFOLIO
22.18.5 RECENT DEVELOPMENTS
22.19 SMITH & NEPHEW PLC.
22.19.1 COMPANY OVERVIEW
22.19.2 REVENUE ANALYSIS
22.19.3 GEOGRAPHIC PRESENCE
22.19.4 PRODUCT PORTFOLIO
22.19.5 RECENT DEVELOPMENTS
22.20 STRYKER CORPORATION
22.20.1 COMPANY OVERVIEW
22.20.2 REVENUE ANALYSIS
22.20.3 GEOGRAPHIC PRESENCE
22.20.4 PRODUCT PORTFOLIO
22.20.5 RECENT DEVELOPMENTS
22.21 TERUMO CORPORATION
22.21.1 COMPANY OVERVIEW
22.21.2 REVENUE ANALYSIS
22.21.3 GEOGRAPHIC PRESENCE
22.21.4 PRODUCT PORTFOLIO
22.21.5 RECENT DEVELOPMENTS
22.22 THERMO FISHER SCIENTIFIC, INC.
22.22.1 COMPANY OVERVIEW
22.22.2 REVENUE ANALYSIS
22.22.3 GEOGRAPHIC PRESENCE
22.22.4 PRODUCT PORTFOLIO
22.22.5 RECENT DEVELOPMENTS
22.23 ZIMMER BIOMET HOLDINGS, INC.
22.23.1 COMPANY OVERVIEW
22.23.2 REVENUE ANALYSIS
22.23.3 GEOGRAPHIC PRESENCE
22.23.4 PRODUCT PORTFOLIO
22.23.5 RECENT DEVELOPMENTS
22.24 FLEX HEALTH SOLUTIONS
22.24.1 COMPANY OVERVIEW
22.24.2 REVENUE ANALYSIS
22.24.3 GEOGRAPHIC PRESENCE
22.24.4 PRODUCT PORTFOLIO
22.24.5 RECENT DEVELOPMENTS
22.25 JABIL HEALTHCARE
22.25.1 COMPANY OVERVIEW
22.25.2 REVENUE ANALYSIS
22.25.3 GEOGRAPHIC PRESENCE
22.25.4 PRODUCT PORTFOLIO
22.25.5 RECENT DEVELOPMENTS
22.26 SANMINA CORPORATION
22.26.1 COMPANY OVERVIEW
22.26.2 REVENUE ANALYSIS
22.26.3 GEOGRAPHIC PRESENCE
22.26.4 PRODUCT PORTFOLIO
22.26.5 RECENT DEVELOPMENTS
22.27 CELESTICA HEALTHTECH
22.27.1 COMPANY OVERVIEW
22.27.2 REVENUE ANALYSIS
22.27.3 GEOGRAPHIC PRESENCE
22.27.4 PRODUCT PORTFOLIO
22.27.5 RECENT DEVELOPMENTS
22.28 INTEGER HOLDINGS CORPORATION
22.28.1 COMPANY OVERVIEW
22.28.2 REVENUE ANALYSIS
22.28.3 GEOGRAPHIC PRESENCE
22.28.4 PRODUCT PORTFOLIO
22.28.5 RECENT DEVELOPMENTS
RECENT DEVELOPMENTS NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST RELATED REPORTS
23. RELATED REPORTS
24. CONCLUSION
25. QUESTIONNAIRE
26. ABOUT DATA BRIDGE MARKET RESEARCH
Методология исследования
Сбор данных и анализ базового года выполняются с использованием модулей сбора данных с большими размерами выборки. Этап включает получение рыночной информации или связанных данных из различных источников и стратегий. Он включает изучение и планирование всех данных, полученных из прошлого заранее. Он также охватывает изучение несоответствий информации, наблюдаемых в различных источниках информации. Рыночные данные анализируются и оцениваются с использованием статистических и последовательных моделей рынка. Кроме того, анализ доли рынка и анализ ключевых тенденций являются основными факторами успеха в отчете о рынке. Чтобы узнать больше, пожалуйста, запросите звонок аналитика или оставьте свой запрос.
Ключевой методологией исследования, используемой исследовательской группой DBMR, является триангуляция данных, которая включает в себя интеллектуальный анализ данных, анализ влияния переменных данных на рынок и первичную (отраслевую экспертную) проверку. Модели данных включают сетку позиционирования поставщиков, анализ временной линии рынка, обзор рынка и руководство, сетку позиционирования компании, патентный анализ, анализ цен, анализ доли рынка компании, стандарты измерения, глобальный и региональный анализ и анализ доли поставщика. Чтобы узнать больше о методологии исследования, отправьте запрос, чтобы поговорить с нашими отраслевыми экспертами.
Доступна настройка
Data Bridge Market Research является лидером в области передовых формативных исследований. Мы гордимся тем, что предоставляем нашим существующим и новым клиентам данные и анализ, которые соответствуют и подходят их целям. Отчет можно настроить, включив в него анализ ценовых тенденций целевых брендов, понимание рынка для дополнительных стран (запросите список стран), данные о результатах клинических испытаний, обзор литературы, обновленный анализ рынка и продуктовой базы. Анализ рынка целевых конкурентов можно проанализировать от анализа на основе технологий до стратегий портфеля рынка. Мы можем добавить столько конкурентов, о которых вам нужны данные в нужном вам формате и стиле данных. Наша команда аналитиков также может предоставить вам данные в сырых файлах Excel, сводных таблицах (книга фактов) или помочь вам в создании презентаций из наборов данных, доступных в отчете.