North America Drug Safety Solutions And Pharmacovigilance Market
Размер рынка в млрд долларов США
CAGR :
% 
 USD
2.04 Billion
USD
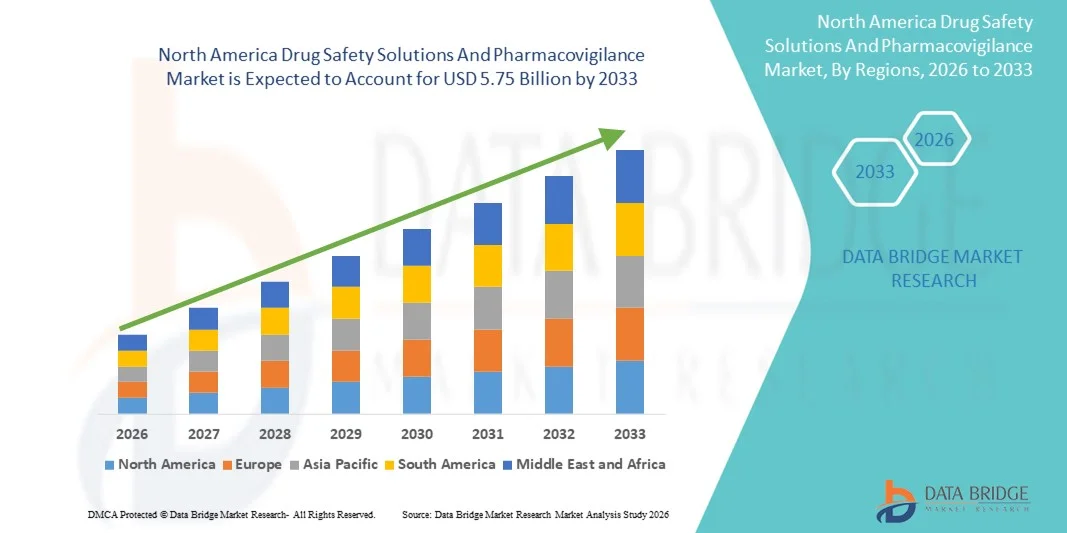
5.75 Billion
2025
2033
USD
2.04 Billion
USD
5.75 Billion
2025
2033
| 2026 –2033 | |
| USD 2.04 Billion | |
| USD 5.75 Billion | |
|
|
|
|
Сегментация рынка решений по обеспечению безопасности лекарственных средств и фармаконадзору в Северной Америке по типу (программное обеспечение и услуги), конечным пользователям ( биотехнологические и фармацевтические компании, контрактные исследовательские организации (CROS), больницы, KPO/BPO и медицинские учреждения), каналам сбыта (прямые продажи и розничные продажи) — отраслевые тенденции и прогноз до 2033 года.
Размер рынка решений в области безопасности лекарственных средств и фармаконадзора в Северной Америке
- Объем рынка решений в области безопасности лекарственных средств и фармаконадзора в Северной Америке в 2025 году оценивался в 2,04 млрд долларов США и, как ожидается, достигнет 5,75 млрд долларов США к 2033 году , демонстрируя среднегодовой темп роста в 13,85% в течение прогнозируемого периода.
- Рост рынка в значительной степени обусловлен ужесточением требований к соблюдению нормативных требований, расширением использования цифровых инструментов в клинических исследованиях, а также повышением осведомленности фармацевтической отрасли о безопасности пациентов и управлении рисками.
- Кроме того, расширение использования данных из реальной клинической практики, анализа больших данных и платформ фармаконадзора на основе искусственного интеллекта позволяет более эффективно отслеживать безопасность лекарственных средств и нежелательные явления. Эти факторы в совокупности ускоряют внедрение решений в области безопасности лекарственных средств и фармаконадзора, что значительно способствует росту отрасли.
Анализ рынка решений в области безопасности лекарственных средств и фармаконадзора в Северной Америке
- Решения в области безопасности лекарственных средств и фармаконадзора приобретают все большее значение для обеспечения безопасности пациентов, мониторинга побочных реакций на лекарственные препараты и поддержания соответствия строгим нормативным стандартам в фармацевтической и биотехнологической отраслях.
- Растущий спрос обусловлен внедрением цифровых платформ фармаконадзора, искусственного интеллекта и машинного обучения для прогнозирования побочных эффектов, а также интеграцией данных из реальной клинической практики в мониторинг безопасности лекарственных средств. Эти факторы значительно стимулируют глобальное использование решений в области безопасности лекарственных средств и фармаконадзора.
- США доминировали на рынке решений по обеспечению безопасности лекарственных средств и фармаконадзора, занимая наибольшую долю выручки — приблизительно 42% — в 2025 году. Этому способствовало присутствие ведущих фармацевтических компаний, развитая нормативно-правовая база и раннее внедрение решений для фармаконадзора на основе искусственного интеллекта.
- Ожидается, что Канада станет самым быстрорастущим регионом в течение прогнозируемого периода, демонстрируя среднегодовой темп роста в 9,8%, чему способствуют растущая цифровизация здравоохранения, благоприятная государственная политика и увеличение инвестиций в клинические испытания и мониторинг безопасности лекарственных препаратов.
- В 2025 году сегмент программного обеспечения занимал наибольшую долю рынка по выручке, составляющую 61,8%, что было обусловлено растущим внедрением интегрированных платформ фармаконадзора для отчетности о нежелательных явлениях, выявления сигналов и соблюдения нормативных требований.
Обзор отчета и сегментация рынка решений в области безопасности лекарственных средств и фармаконадзора
|
Атрибуты |
Ключевые рыночные тенденции в сфере решений по обеспечению безопасности лекарственных средств и фармаконадзора. |
|
Охваченные сегменты |
|
|
Охваченные страны |
Северная Америка
|
|
Ключевые игроки рынка |
• Oracle Health Sciences (США) |
|
Рыночные возможности |
|
|
Информационные наборы данных, представляющие добавленную стоимость |
Помимо анализа рыночных сценариев, таких как рыночная стоимость, темпы роста, сегментация, географический охват и основные игроки, отчеты о рынке, подготовленные Data Bridge Market Research, также включают углубленный экспертный анализ, эпидемиологию пациентов, анализ перспективных разработок, анализ ценообразования и нормативно-правовую базу. |
Тенденции рынка решений в области безопасности лекарственных средств и фармаконадзора в Северной Америке
Растущее внедрение облачных и интегрированных платформ безопасности
- Значительной и быстро набирающей обороты тенденцией на мировом рынке решений для обеспечения безопасности лекарственных средств и фармаконадзора является растущее внедрение облачных и интегрированных платформ безопасности. Эти платформы обеспечивают бесперебойный сбор, обработку и отчетность о нежелательных лекарственных реакциях в различных регионах и нормативных актах.
- Например, в июне 2023 года компания ArisGlobal запустила свою облачную платформу безопасности LifeSphere Safety, предлагающую отчетность о нежелательных явлениях в режиме реального времени, автоматическое обнаружение сигналов и управление соответствием глобальным нормативным стандартам. Этот запуск отражает переход к централизованным, масштабируемым и совместимым системам фармаконадзора.
- Современные платформы фармаконадзора объединяют электронные медицинские карты (ЭМК), данные клинических испытаний и информацию пострегистрационного наблюдения, предоставляя практические рекомендации по управлению рисками.
- Интеграция передовых аналитических методов и алгоритмов машинного обучения позволяет выявлять сигналы, указывающие на потенциальные риски, связанные с лекарственными препаратами, на ранних стадиях, сокращая время, необходимое для принятия мер.
- Эта тенденция дополнительно подкрепляется тем, что регулирующие органы уделяют особое внимание отчетности в режиме реального времени и прозрачности в целях обеспечения безопасности пациентов, что побуждает компании внедрять более эффективные и соответствующие нормативным требованиям решения.
- Кроме того, масштабируемость облачных решений позволяет фармацевтическим компаниям любого размера внедрять надежные процессы фармаконадзора без значительных инвестиций в инфраструктуру.
Динамика рынка решений в области безопасности лекарственных средств и фармаконадзора в Северной Америке
Водитель
Регуляторное давление и активизация разработки лекарственных препаратов
- Растущая сложность требований к соблюдению нормативных требований и фармаконадзору во всем мире является одним из основных факторов роста рынка. Регулирующие органы, такие как FDA, EMA и PMDA, предъявляют строгие требования к отчетности о побочных реакциях на лекарственные препараты, что стимулирует спрос на автоматизированные и стандартизированные решения.
- Например, в марте 2024 года компания IQVIA расширила свои услуги в области безопасности и фармаконадзора в Европе, чтобы помочь фармацевтическим компаниям соответствовать рекомендациям EMA по периодическим отчетам об обновлении информации о безопасности (PSUR) и планам управления рисками (RMP).
- Быстрый рост числа разрабатываемых лекарственных препаратов, особенно биологических и специализированных, повышает потребность в надежных решениях для пострегистрационного мониторинга безопасности.
- Фармацевтические компании инвестируют в централизованные базы данных по безопасности для управления данными клинических испытаний, пострегистрационного наблюдения и регистров пациентов.
- Облачные системы фармаконадзора улучшают взаимодействие между глобальными командами, обеспечивая своевременную подачу документов в регулирующие органы.
- Растущее внимание к пациентоориентированному подходу, безопасности и снижению рисков еще больше ускоряет внедрение комплексных платформ фармаконадзора.
Сдержанность/Вызов
Высокие затраты на внедрение и проблемы с безопасностью данных.
- Несмотря на преимущества, высокие затраты на внедрение и сложность интеграции создают проблемы для выхода на рынок, особенно для малых и средних фармацевтических компаний. Первоначальные инвестиции в передовое программное обеспечение, обучение и перепроектирование процессов могут быть значительными.
- Например, переход от устаревших систем безопасности к современным облачным платформам может потребовать нескольких месяцев настройки и проверки, что временно замедлит внутренние операции.
- Проблемы конфиденциальности данных и кибербезопасности также остаются серьезным сдерживающим фактором, поскольку системы фармаконадзора обрабатывают конфиденциальные данные пациентов и клинические данные. Нарушения могут привести к санкциям со стороны регулирующих органов и ущербу для репутации.
- Обеспечение соответствия нормативным актам по защите данных, таким как GDPR в Европе, HIPAA в США и другим региональным законам, усложняет операционную деятельность.
- Для поддержания соответствия нормативным требованиям и предотвращения потенциальных сбоев в отчетности по безопасности лекарственных средств необходимы постоянные обновления, аудиты и проверка систем.
- Для преодоления этих проблем необходимы стратегические инвестиции в безопасные и масштабируемые решения, обучение персонала и надежную ИТ-инфраструктуру, гарантирующие как соответствие нормативным требованиям, так и операционную эффективность.
Обзор рынка решений в области безопасности лекарственных средств и фармаконадзора в Северной Америке
Рынок сегментирован по типу, конечному пользователю и каналу сбыта.
- По типу
По типу сегментации рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора делится на программное обеспечение и услуги. В 2025 году сегмент программного обеспечения занимал наибольшую долю рынка, составляющую 61,8% выручки, что обусловлено растущим внедрением интегрированных платформ фармаконадзора для отчетности о нежелательных явлениях, выявления сигналов и соблюдения нормативных требований. Фармацевтические и биотехнологические компании все чаще используют программное обеспечение для обеспечения безопасности, автоматизируя сбор данных, их обработку и отправку в регулирующие органы, такие как FDA и EMA. Растущий объем данных клинических испытаний и постмаркетингового надзора усилил потребность в централизованных базах данных по безопасности. Программные решения повышают операционную эффективность, снижают количество ошибок, связанных с ручным вводом данных, и обеспечивают своевременное соблюдение глобальных нормативных требований. Интеграция с системами управления клиническими данными и электронными медицинскими картами еще больше укрепляет лидирующие позиции. Постоянные обновления программного обеспечения в соответствии с меняющимися нормативными требованиями также способствуют его внедрению. Крупные предприятия предпочитают лицензированные платформы из-за масштабируемости и долгосрочной экономической эффективности. В результате программное обеспечение для обеспечения безопасности остается основой операций фармаконадзора во всем мире.
Ожидается, что сегмент услуг продемонстрирует самый быстрый среднегодовой темп роста в 13,9% в период с 2026 по 2033 год, чему способствует растущее число аутсорсинговых операций по фармаконадзору специализированным поставщикам услуг. Фармацевтические компании все чаще передают на аутсорсинг обработку случаев, медицинскую экспертизу и подготовку нормативных документов для снижения операционной нагрузки и контроля затрат. Рост числа малых и средних биотехнологических компаний, не имеющих собственных экспертов по безопасности, еще больше ускоряет спрос на услуги. Контрактные организации по обеспечению безопасности обеспечивают гибкость и доступ к квалифицированным специалистам. Услуги также поддерживают соответствие нормативным требованиям в различных регионах. Рост числа одобренных лекарственных препаратов и обязательств после выхода на рынок увеличивает зависимость от аутсорсинговых операций по обеспечению безопасности. Следовательно, услуги фармаконадзора становятся быстрорастущим сегментом в глобальном масштабе.
- Конечным пользователем
В зависимости от конечного пользователя рынок решений по обеспечению безопасности лекарственных средств и фармаконадзора сегментируется на биотехнологические и фармацевтические компании, контрактные исследовательские организации (CRO), больницы, KPO/BPO и медицинские учреждения. Сегмент биотехнологических и фармацевтических компаний занимал наибольшую долю рынка (48,4%) в 2025 году благодаря строгим нормативным требованиям к мониторингу безопасности лекарственных средств на протяжении всего жизненного цикла продукта. Эти компании проводят масштабные клинические испытания и постмаркетинговое наблюдение, генерируя большие объемы данных о безопасности. Обязательная отчетность о нежелательных явлениях и планы управления рисками стимулируют постоянные инвестиции в системы фармаконадзора. Глобальные запуски лекарственных препаратов еще больше требуют централизованных платформ безопасности. Крупные фармацевтические компании внедряют комплексные решения для обеспечения соответствия требованиям в разных регионах. Повышенное внимание к безопасности пациентов и снижению рисков укрепляет доминирование сегмента. Постоянное расширение портфеля разработок поддерживает долгосрочный спрос на решения по обеспечению безопасности в этом сегменте.
Прогнозируется, что сегмент CRO продемонстрирует самый быстрый среднегодовой темп роста в 14,6% в период с 2026 по 2033 год, чему способствует растущая тенденция аутсорсинга клинических испытаний и мониторинга безопасности. CRO все чаще управляют операциями по фармаконадзору от имени спонсоров. Расширение глобальной деятельности в области клинических исследований стимулирует спрос на услуги по обеспечению безопасности. CRO предоставляют экономически эффективные, масштабируемые решения с экспертной поддержкой в области регулирования. Небольшие фармацевтические компании предпочитают CRO для комплексного управления безопасностью. Рост производства биологических препаратов и специализированных лекарств дополнительно способствует внедрению CRO. По мере увеличения проникновения аутсорсинга CRO становятся самым быстрорастущим сегментом конечных пользователей.
- По каналам сбыта
В зависимости от канала сбыта рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора сегментируется на прямые продажи и розничные продажи. В 2025 году на долю прямых продаж приходилась наибольшая доля выручки рынка – 67,2%, что обусловлено сложностью и требованиями к индивидуальной настройке решений в области фармаконадзора. Поставщики программного обеспечения и услуг, как правило, напрямую взаимодействуют с фармацевтическими компаниями для адаптации решений к нормативным и операционным потребностям. Прямое взаимодействие обеспечивает надлежащую реализацию, обучение и валидацию. Долгосрочные контракты и модели корпоративного лицензирования поддерживают стабильность доходов. Требования к соблюдению нормативных требований также способствуют сотрудничеству между поставщиком и клиентом через прямые каналы. Крупные организации предпочитают прямые закупки из-за безопасности данных и системной интеграции. В результате прямые продажи доминируют на рынке дистрибуции.
Ожидается, что сегмент розничных продаж будет расти самыми быстрыми темпами, достигая среднегодового темпа роста в 11,8% в период с 2026 по 2033 год, чему способствует растущая доступность модульных и облачных решений в области безопасности. Небольшие биотехнологические компании и медицинские учреждения предпочитают готовые платформы с более быстрым развертыванием. Модели ценообразования на основе подписки повышают доступность. Рост цифровых медицинских площадок способствует доступности. Розничные каналы упрощают процесс закупок для новых игроков. Растущее внедрение среди малых предприятий ускоряет рост. Таким образом, розничные продажи представляют собой быстро расширяющийся канал дистрибуции.
Региональный анализ рынка решений по обеспечению безопасности лекарственных средств и фармаконадзора в Северной Америке
- Северная Америка доминировала на рынке решений по обеспечению безопасности лекарственных средств и фармаконадзора, занимая наибольшую долю выручки — приблизительно 42% в 2025 году. Это лидерство подкрепляется сильным присутствием глобальных фармацевтических и биотехнологических компаний, хорошо развитой нормативно-правовой базой, возглавляемой такими ведомствами, как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и Министерство здравоохранения Канады, а также ранним внедрением передовых технологий фармаконадзора.
- В регионе наблюдается растущее внедрение платформ обеспечения безопасности лекарственных средств на основе искусственного интеллекта и машинного обучения для улучшения выявления нежелательных явлений, управления сигналами и соблюдения нормативных требований.
- Кроме того, высокие затраты на НИОКР, масштабные клинические испытания и растущее внимание к пострегистрационному мониторингу лекарственных препаратов продолжают укреплять рыночный рост в Северной Америке.
Анализ рынка решений по обеспечению безопасности лекарственных средств и фармаконадзора в США.
В 2025 году рынок решений по обеспечению безопасности лекарственных средств и фармаконадзора в США доминировал на североамериканском рынке, занимая большую часть региональной выручки. Рост рынка США обусловлен присутствием ведущих фармацевтических компаний, контрактных исследовательских организаций (CRO) и специализированных поставщиков услуг по фармаконадзору. Строгие нормативные требования к одобрению лекарственных средств и постмаркетинговому надзору, а также раннее внедрение обработки случаев на основе ИИ, анализа данных из реальной практики и облачных баз данных по безопасности значительно стимулируют спрос. Кроме того, растущая сложность разработки лекарственных средств, биологических препаратов и персонализированной медицины усилила потребность в надежных решениях по фармаконадзору на всех клинических и коммерческих этапах.
Анализ рынка решений по обеспечению безопасности лекарственных средств и фармаконадзора в Канаде
: Ожидается, что рынок решений по обеспечению безопасности лекарственных средств и фармаконадзора в Канаде станет самым быстрорастущим на этом рынке в течение прогнозируемого периода, демонстрируя среднегодовой темп роста около 9,8%. Этот рост обусловлен растущей цифровизацией здравоохранения, поддержкой государственных инициатив по улучшению мониторинга безопасности лекарственных средств и увеличением инвестиций в клинические испытания. Расширение присутствия глобальных фармацевтических компаний и CRO в Канаде, а также растущее внедрение электронных систем отчетности о нежелательных явлениях и интегрированных платформ фармаконадзора дополнительно способствуют расширению рынка. Кроме того, более тесное соответствие международным нормативным стандартам побуждает фармацевтических производителей укреплять свои операции по обеспечению безопасности лекарственных средств в стране.
Доля рынка решений в области безопасности лекарственных средств и фармаконадзора в Северной Америке
В отрасли решений по обеспечению безопасности лекарственных средств и фармаконадзора лидируют преимущественно хорошо зарекомендовавшие себя компании, в том числе:
• Oracle Health Sciences (США)
• IQVIA (США)
• Veeva Systems (США)
• ArisGlobal (США)
• Dassault Systèmes (Франция)
• Cognizant Technology Solutions (США)
• Wipro (Индия)
• Tata Consultancy Services – TCS (Индия)
• Accenture (Ирландия)
• Parexel International (США)
• ICON plc (Ирландия)
• Labcorp Drug Development (США)
• Medidata Solutions (США)
• Ennov (Франция)
• EXTEDO (Германия)
• CliniSys (Великобритания)
• United BioSource Corporation (США)
Последние разработки на рынке решений по обеспечению безопасности лекарственных средств и фармаконадзора в Северной Америке.
- В декабре 2023 года компания Thermo Fisher Scientific запустила CorEvidence, облачную платформу для управления данными, предназначенную для оптимизации обработки случаев фармаконадзора и управления данными о безопасности путем упрощения управления нежелательными явлениями и поддержки нормативных требований для пострегистрационных исследований безопасности.
- В июле 2024 года Oracle представила новые возможности, основанные на искусственном интеллекте, в своих решениях Argus и Safety One Intake, чтобы помочь организациям, работающим в сфере медико-биологических наук, справляться с растущим объемом работы по обработке нежелательных событий, автоматизировать обработку случаев безопасности, повысить соответствие глобальным нормативным требованиям, а также улучшить конфиденциальность данных и эффективность отчетности. Это обновление отражает переход к платформам безопасности лекарственных средств на основе искусственного интеллекта, которые помогают фармацевтическим компаниям и CRO соответствовать меняющимся нормативным требованиям.
- В апреле 2024 года компания Qinecsa Solutions приобрела датскую компанию Insife ApS, укрепив свои позиции в качестве ведущего поставщика цифровых решений для фармаконадзора за счет объединения опыта Qinecsa с платформой HALOPV компании Insife, что позволило расширить глобальные возможности управления данными о безопасности лекарственных средств и технологические решения для фармаконадзора.
- В ноябре 2024 года компания Veeva Systems расширила свою платформу Vault Safety, запустив SafetyConnect, которая обеспечивает унифицированное управление случаями, связанными с безопасностью, в глобальных филиалах с помощью сортировки с использованием ИИ и многоязычной обработки, что позволяет улучшить обработку случаев фармаконадзора в глобальном масштабе и ускорить рабочие процессы составления отчетов.
- В марте 2025 года компания ArisGlobal объявила о стратегическом сотрудничестве с IBM с целью интеграции возможностей искусственного интеллекта IBM с ArisGlobal LifeSphere для ускорения обработки случаев фармаконадзора и улучшения анализа данных о безопасности, что отражает растущее внедрение ИИ для более эффективного мониторинга безопасности и управления рисками.
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Интерактивная панель анализа данных
- Панель анализа компании для возможностей с высоким потенциалом роста
- Доступ аналитика-исследователя для настройки и запросов
- Анализ конкурентов с помощью интерактивной панели
- Последние новости, обновления и анализ тенденций
- Используйте возможности сравнительного анализа для комплексного отслеживания конкурентов
Методология исследования
Сбор данных и анализ базового года выполняются с использованием модулей сбора данных с большими размерами выборки. Этап включает получение рыночной информации или связанных данных из различных источников и стратегий. Он включает изучение и планирование всех данных, полученных из прошлого заранее. Он также охватывает изучение несоответствий информации, наблюдаемых в различных источниках информации. Рыночные данные анализируются и оцениваются с использованием статистических и последовательных моделей рынка. Кроме того, анализ доли рынка и анализ ключевых тенденций являются основными факторами успеха в отчете о рынке. Чтобы узнать больше, пожалуйста, запросите звонок аналитика или оставьте свой запрос.
Ключевой методологией исследования, используемой исследовательской группой DBMR, является триангуляция данных, которая включает в себя интеллектуальный анализ данных, анализ влияния переменных данных на рынок и первичную (отраслевую экспертную) проверку. Модели данных включают сетку позиционирования поставщиков, анализ временной линии рынка, обзор рынка и руководство, сетку позиционирования компании, патентный анализ, анализ цен, анализ доли рынка компании, стандарты измерения, глобальный и региональный анализ и анализ доли поставщика. Чтобы узнать больше о методологии исследования, отправьте запрос, чтобы поговорить с нашими отраслевыми экспертами.
Доступна настройка
Data Bridge Market Research является лидером в области передовых формативных исследований. Мы гордимся тем, что предоставляем нашим существующим и новым клиентам данные и анализ, которые соответствуют и подходят их целям. Отчет можно настроить, включив в него анализ ценовых тенденций целевых брендов, понимание рынка для дополнительных стран (запросите список стран), данные о результатах клинических испытаний, обзор литературы, обновленный анализ рынка и продуктовой базы. Анализ рынка целевых конкурентов можно проанализировать от анализа на основе технологий до стратегий портфеля рынка. Мы можем добавить столько конкурентов, о которых вам нужны данные в нужном вам формате и стиле данных. Наша команда аналитиков также может предоставить вам данные в сырых файлах Excel, сводных таблицах (книга фактов) или помочь вам в создании презентаций из наборов данных, доступных в отчете.