Europe Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
市场规模(十亿美元)
CAGR :
% 
 USD
704.70 Million
USD
2,067.34 Million
2025
2033
USD
704.70 Million
USD
2,067.34 Million
2025
2033
| 2026 –2033 | |
| USD 704.70 Million | |
| USD 2,067.34 Million | |
|
|
|
|
歐洲電子臨床結果評估 (eCOA) 內容授權市場細分,按產品(本地部署解決方案、雲端解決方案和網路解決方案)、方法(臨床醫生報告結果評估 (ClinRO)、患者報告結果評估 (PRO)、觀察者報告結果評估 (ObsRO) 和績效結果評估(PerfO))、最終用戶(商業服務提供者、醫院和移植中心、研究實驗室和學術機構)、平台(合約研究組織、製藥和生物製藥公司、醫療器材製造商、醫院和臨床實驗室、諮詢服務公司、研究和學術機構及其他)劃分——行業趨勢及至 2033 年的預測
歐洲電子臨床結果評估(eCOA)內容許可市場規模
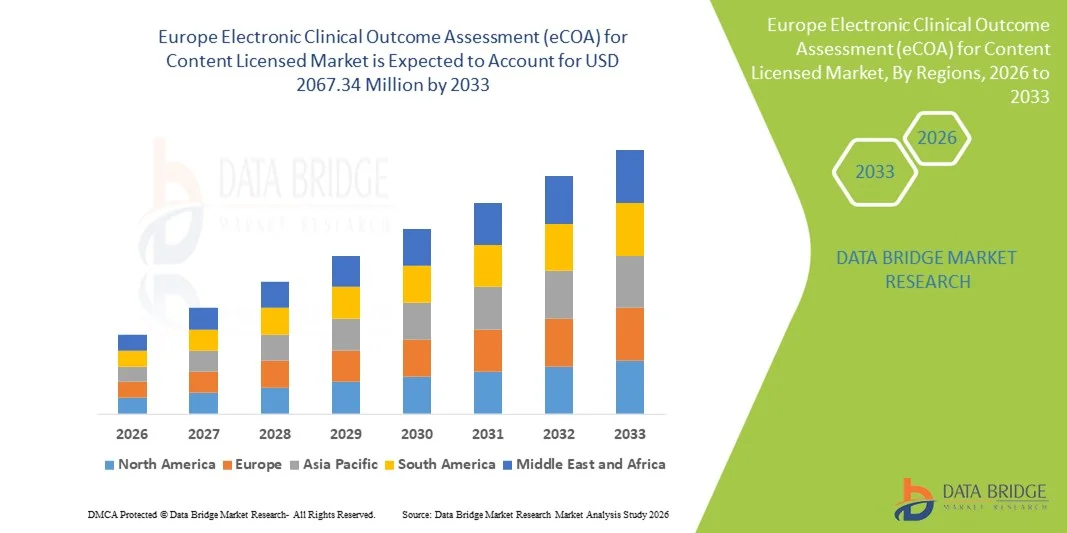
- 2025年歐洲電子臨床結果評估(eCOA)內容授權市場規模為7.047億美元 ,預計 到2033年將達到20.6734億美元,預測期內 複合年增長率為14.40%。
- 市場成長主要得益於臨床試驗中數位科技的日益普及、以病人為中心的研究日益受到重視,以及各治療領域對準確、即時資料收集的需求。雲端平台、行動應用程式和電子病患報告結局 (ePRO) 的整合進一步推動了電子臨床結局評估 (eCOA) 內容授權市場的擴張。
- 此外,對符合監管要求、使用者友好且可擴展的臨床試驗解決方案的需求不斷增長,正使電子臨床結果評估 (eCOA) 系統成為現代臨床研究的關鍵組成部分。效率的提升、管理負擔的減輕以及患者參與度的提高,正在加速內容許可型電子臨床結果評估 (eCOA) 解決方案的普及,從而顯著推動市場成長。
歐洲電子臨床結果評估(eCOA)內容許可市場分析
- 電子臨床結果評估 (eCOA) 內容授權市場的成長主要得益於臨床試驗中電子病患報告結果 (ePRO) 和 eCOA 解決方案的日益普及,而這又源於醫療保健和製藥研究領域對準確、即時資料收集和改善病患監測的需求。
- 對簡化臨床試驗流程、合規監管和高效數據管理的需求不斷增長,正在加速電子臨床結果評估(eCOA)內容授權解決方案的普及,從而顯著推動產業成長。
- 英國在電子臨床結果評估(eCOA)內容授權市場中佔據主導地位,預計到2025年將佔據約38.7%的最大市場份額。這得益於其完善的醫療保健基礎設施、數位化臨床試驗技術的廣泛應用以及對電子病患結果追蹤的強有力的監管支持。在雲端平台、行動數據採集以及與集中式臨床試驗管理系統整合等方面的創新推動下,英國的eCOA應用在臨床試驗中正經歷顯著成長。
- 預計在預測期內,德國將成為電子臨床結果評估(eCOA)內容授權市場成長最快的地區,預計將實現兩位數的強勁複合年增長率。推動成長的因素包括:臨床試驗活動的增加、醫療保健支出的成長、數位健康解決方案的普及,以及醫院、研究中心和製藥機構對電子資料收集和病患報告結果技術的日益普及。
- 2025年,雲端解決方案細分市場佔據主導地位,收入份額達45.3%,這主要得益於其可擴展的部署、便捷的遠端存取以及與多種裝置的整合。
內容許可市場細分報告範圍和電子臨床結果評估 (eCOA)
|
屬性 |
電子臨床結果評估 (eCOA) 內容許可關鍵市場洞察 |
|
涵蓋的領域 |
|
|
覆蓋國家/地區 |
歐洲
|
|
主要市場參與者 |
|
|
市場機遇 |
|
|
加值資料資訊集 |
除了對市場價值、成長率、細分、地理覆蓋範圍和主要參與者等市場狀況的洞察之外,Data Bridge Market Research 精心編制的市場報告還包括深入的專家分析、病患流行病學、研發管線分析、定價分析和監管框架。 |
歐洲電子臨床結果評估(eCOA)內容許可市場趨勢
數位化臨床試驗解決方案的日益普及
- 全球內容授權電子臨床結果評估 (eCOA) 市場的一大趨勢是,在高效、即時和以患者為中心的數據收集需求驅動下,數位化和遠端臨床試驗解決方案的採用率不斷提高。
- 例如,2023年3月,CRF Health(現為Signant Health的一部分)將其eCOA平台擴展至整個歐洲,以支持完全分散的臨床試驗,從而能夠以多種語言和研究方案收集電子患者報告結局(ePRO)。
- 與傳統的紙本方法相比,數位化電子臨床結果評估 (eCOA) 工具可以減少錯誤、加快資料收集速度並提高患者依從性。
- 新冠疫情加速了這一趨勢,凸顯了遠端患者監測和非接觸式資料收集的必要性,預計這種需求在疫情後仍將持續存在。
- 製藥公司和合約研究組織 (CRO) 正日益將電子臨床結果評估 (eCOA) 平台與其他數位臨床試驗技術相結合,例如用於數位生物標記和穿戴式裝置的電子臨床結果評估。
歐洲電子臨床結果評估(eCOA)內容許可市場動態
司機
更重視以病人為中心的臨床試驗
- 臨床試驗中日益重視以患者為中心,這推動了電子臨床結果評估(eCOA)平台的應用,該平台能夠即時採集患者報告結局(PRO)、症狀追蹤和健康相關生活品質數據。
- 例如,2024年7月,Parexel International推出了一款專為歐洲腫瘤臨床試驗量身定制的全新電子臨床結果評估(eCOA)解決方案,使患者能夠透過網頁或行動介面在家中直接報告治療結果,從而提高患者的參與度和留存率。
- 包括歐洲藥品管理局 (EMA) 在內的監管機構正日益推薦在藥物審批申請中使用數位化患者報告結局 (PRO) 數據,從而鼓勵更廣泛地採用這種方法。
- 遠端採集高品質、標準化和縱向資料的能力,使申辦者能夠優化試驗設計並減輕研究中心的負擔。
- 與電子資料採集 (EDC) 系統和集中式試驗管理平台的集成,為臨床試驗申辦方和合約研究組織 (CRO) 提供無縫的工作流程,進一步促進了其應用。
克制/挑戰
資料隱私、監管合規和實施成本
- 電子臨床價值評估(eCOA)市場面臨資料隱私、GDPR合規性和高昂的實施成本等挑戰,這些挑戰可能會減緩其在全球的普及速度。
- 例如,2022年9月,多家歐洲合約研究組織(CRO)報告稱,由於德國和法國嚴格的資料保護法規以及對安全病患資料儲存的需求,導致其在兩國部署電子臨床結果評估(eCOA)解決方案的進程有所延遲。
- 確保符合當地法律、監管指南和驗證要求,增加了電子臨床結果評估(eCOA)實施的複雜性,尤其是在跨國試驗中。
- 此外,與現有臨床試驗系統整合的成本,包括人員培訓和軟體驗證,可能非常高昂,這對中小型合約研究組織或申辦者構成障礙。
- 應對這些挑戰需要投資強大的網路安全、監管協調以及具有成本效益且可擴展的部署策略,以支援市場的長期成長。
歐洲電子臨床結果評估 (eCOA) 內容許可市場範圍
市場按產品、方法、最終用戶和平台進行細分。
- 副產品
根據產品類型,電子臨床結果評估(eCOA)內容授權市場可細分為本地部署解決方案、雲端解決方案和網頁解決方案。雲端解決方案憑藉其可擴展的部署、便利的遠端存取以及與多種設備的集成,在2025年佔據主導地位,市場份額高達45.3%。雲端平台使申辦方、合約研究組織(CRO)和臨床試驗中心能夠集中管理資料、提高合規性並降低IT成本。多中心臨床試驗的高採用率、強大的安全協議和即時報告功能進一步鞏固了其市場主導地位。靈活的訂閱模式、符合監管要求以及與電子數據採集(EDC)和電子患者報告結局(ePRO)系統的整合也進一步推動了市場成長。大型製藥公司傾向於選擇雲端解決方案進行全球試驗。新冠疫情加速了遠端監測需求,從而推動了雲端解決方案的普及。更高的正常運作時間和更完善的供應商支援進一步鞏固了其市場份額。跨中心的標準化驗證確保了可靠性。成本效益和工作流程優化進一步鞏固了其市場領先地位。增強的分析和儀錶板功能吸引了終端用戶。與行動應用程式的整合提高了患者的依從性。總體而言,這些因素維持了其優勢地位。
預計從2026年到2033年,本地部署解決方案細分市場將以14.8%的複合年增長率快速成長,主要受需要內部資料控制和客製化的機構的推動。醫院、合約研究組織 (CRO) 和擁有嚴格資料治理的生物技術公司傾向於採用本地部署系統。與現有IT基礎設施的整合增強了其吸引力。對敏感臨床數據的高安全性要求促進了其應用。資料隱私法規嚴格的地區需求不斷增長,推動了市場成長。高級報告和分析功能提高了營運效率。企業級部署加速了應用程式。可自訂模組的可用性吸引了大型贊助商。內部IT支援確保了強大的維護能力。對混合部署選項日益增長的需求促進了市場擴張。製藥公司對個人化醫療試驗的投資進一步推動了其應用。培訓和技術支援加強了實施。符合FDA和EMA法規的要求確保了其加速普及。
- 透過方法
根據方法,市場可細分為臨床研究結局 (ClinRO)、病患報告結局 (PRO)、觀察研究結局 (ObsRO) 和績效研究結局 (PerfO)。病患報告結局 (PRO) 細分市場佔據主導地位,預計到 2025 年將達到 42.1% 的收入份額,這主要得益於其在監管申報、以患者為中心的試驗和真實世界證據研究中日益增長的應用。 PRO 可以直接測量患者的健康狀況、治療滿意度和生活品質指標。與行動應用程式和雲端平台的整合提高了其應用率。 FDA 和 EMA 的強大指南支持強化了市場需求。慢性病和腫瘤試驗的高發生率推動了 PRO 的應用。臨床終點越來越依賴 PRO 數據。多語言支援擴大了全球部署。自動提醒提高了依從性。頻繁的資料收集增加了資料量和實用性。與電子臨床結局評估 (eCOA)、電子日記和穿戴式裝置的整合優化了工作流程。製藥公司對基於 PRO 的終點的投資加速了其應用。跨中心和跨試驗的可擴展性鞏固了其市場主導地位。進階分析功能支援患者細分和結局追蹤。
由於罕見疾病、兒科和照顧者報告結局等領域對觀察者報告結局(ObsRO)的需求不斷增長,預計2026年至2033年間,ObsRO細分市場將以15.6%的複合年增長率快速增長。觀察者報告數據能夠增強無法自我報告族群的測量效果。兒科和老年醫學研究的成長推動了市場需求。與遠端監測平台的整合促進了ObsRO的普及。製藥和生物技術公司對罕見疾病試驗的投資支持了ObsRO的擴張。多中心標準化提高了數據的可靠性。雲端和網路解決方案加速了ObsRO的推廣應用。行動端觀察者報告提高了依從性。新興市場越來越多地採用ObsRO方法。監管機構對ObsRO終點的認可促進了市場成長。培訓和現場支援鼓勵了ObsRO的實施。技術進步減少了人工輸入錯誤。 ObsRO在多方參與試驗中的高價值也加速了市場成長。
- 最終用戶
根據最終用戶,市場可細分為商業服務提供者、醫院和移植中心、研究實驗室以及學術機構。由於廣泛的臨床試驗活動、龐大的患者群體以及對整合式結果評估系統的需求,醫院和移植中心細分市場在2025年將佔據主導地位,收入份額達47.2%。醫院將電子臨床結果評估(eCOA)應用於慢性病管理、腫瘤試驗和手術結果追蹤。多中心試驗的高採用率進一步提升了其應用。與電子健康記錄(EHR)和電子病歷(EMR)系統的整合提高了工作流程效率。監管機構對臨床結果資料收集的要求推動了市場需求。大規模的培訓和支援計劃確保了系統的普及。資料安全和符合HIPAA/GDPR標準增強了用戶信任。多設備支援提高了患者和臨床醫生的參與度。即時分析支援營運決策。與合約研究組織(CRO)的合作促進了系統的部署。遠端患者監測擴大了覆蓋範圍。對醫院臨床研究的投資鞏固了其市場領先地位。持續改進計劃維持了其市場主導地位。
受臨床試驗外包趨勢和對專業電子臨床結果評估(eCOA)管理日益增長的需求的推動,商業服務提供商(CRO)細分市場預計將在2026年至2033年間以16.3%的複合年增長率(CAGR)實現最快增長。 CRO和臨床供應商為多中心試驗提供基於雲端和網路的解決方案。腫瘤學、神經病學和罕見疾病領域的合約研究不斷增加,推動了這一增長。靈活的服務交付方式吸引了中小型製藥客戶。先進的報告和分析功能提高了試驗效率。新興市場的擴張促進了該領域的應用。培訓和遠端支援降低了實施門檻。與電子數據採集(EDC)和患者報告結局(PRO)系統的整合確保了無縫工作流程。資料安全和法規遵循仍然是關鍵驅動因素。全球試驗的可擴展性加速了應用。與申辦方的策略合作擴大了市場覆蓋範圍。行動和穿戴式裝置整合的創新推動了該領域的快速普及。
- 按平台
根據平台類型,市場可細分為合約研究組織 (CRO)、製藥和生物製藥公司、醫療器材製造商、醫院和臨床實驗室、諮詢服務公司、研究機構和學術機構以及其他機構。製藥和生物製藥公司板塊佔據主導地位,預計到 2025 年將以 44.7% 的收入份額佔據市場,這主要得益於其大規模的臨床開發項目、精準醫療試驗的普及以及對電子結果數據 (eCOD) 用於監管申報的依賴。製藥公司投資於用於腫瘤學、心臟病學和慢性病研究的整合式 eCOD 平台。龐大的試驗量和全球營運支撐了其市場主導地位。與電子資料採集 (EDC)、病患報告結局 (PRO) 和穿戴式裝置的整合簡化了工作流程。監管合規性推動了平台的普及。集中式資料管理提高了試驗效率。長期的供應商合作關係鞏固了其市場領導地位。多設備和多中心部署支援了平台的使用。基於雲端的解決方案提高了平台的可訪問性。對伴隨診斷的投資提高了平台的使用率。即時報告增強了決策能力。進階分析加速了藥物開發專案。
受臨床試驗外包、試驗複雜性增加以及對全方位電子臨床結果評估(eCOA)管理服務需求增長的推動,合約研究組織(CRO)領域預計將在2026年至2033年間以15.8%的複合年增長率(CAGR)實現最快增長。 CRO為跨國研究提供可擴展的雲端eCOA平台。新興市場的快速普及加速了成長。與申辦方系統的整合提高了營運效率。進階分析和儀錶板增強了對試驗的洞察。靈活的部署模式吸引了中小型製藥客戶。培訓和技術支援促進了應用。全球監理一致性增強了信心。多治療領域的應用推動了擴張。移動和遠端報告提高了合規性。與醫院和學術機構的策略合作鞏固了市場地位。總而言之,這些因素推動了強勁成長。
歐洲電子臨床結果評估(eCOA)內容許可市場區域分析
- 預計歐洲電子臨床結果評估(eCOA)內容授權市場在預測期內將以顯著的複合年增長率成長。
- 受數位化臨床試驗解決方案日益普及、監管力度加大以及對高效患者療效追蹤需求不斷增長的推動。
- 雲端平台、行動數據採集和電子病患報告結果的整合,以及該地區對加強醫療基礎設施和臨床研究數位化的重視,共同推動了成長。
英國電子臨床結果評估(eCOA)內容許可市場洞察
英國電子臨床結果評估(eCOA)內容授權市場預計將在2025年佔據主導地位,收入份額約為38.7%,這得益於其完善的醫療保健基礎設施、數位化臨床試驗技術的廣泛應用以及對電子患者結果追蹤的強有力的監管支持。雲端平台、行動數據採集以及與集中式臨床試驗管理系統的無縫整合等方面的創新正在推動市場顯著成長,從而實現更有效率、更準確的患者結果測量。
德國電子臨床結果評估 (eCOA) 內容授權市場洞察
在預測期內,德國電子臨床結果評估(eCOA)內容授權市場預計將成為成長最快的地區,以實現兩位數的強勁複合年增長率。這一增長主要得益於臨床試驗活動的增加、醫療保健支出的上升、數位醫療解決方案的普及以及醫院、研究中心和製藥機構對電子數據採集和患者報告結果技術的日益廣泛應用。此外,德國對技術創新和數位醫療基礎設施的重視也進一步推動了市場的快速擴張。
歐洲電子臨床結果評估(eCOA)內容許可市場份額
電子臨床結果評估(eCOA)內容授權產業主要由一些成熟企業主導,其中包括:
• Medidata Solutions, Inc.(美國)
• CRF Health(英國)
• Signant Health(美國
) • Clinion(
美國) • Celegence(美國)
• Icon plc(愛爾蘭)
• PPD, Inc.(美國)
• Veeva Systems(美國)
• Oracle Health Sciences(美國)
• Synteract(美國)
• Bioclinica, Inc. Systems(美國)
• Oracle Health Sciences(
美國)
• Synteract(美國)
• Bioclinica, Inc. Bracket(美國)
• Datatrak International(美國)
• Electronic Data Capture, LLC(美國)
• PAREXEL International(美國)
• Health Solutions International(英國)
歐洲電子臨床結果評估(eCOA)內容許可市場的最新進展
- 2023年6月,ICON plc推出了ICON數位平台,這是一個整合解決方案,包括患者行動應用程式、電子知情同意書、電子臨床結果評估(eCOA)、家庭服務直接數據採集以及數位健康技術管理,旨在簡化臨床試驗中的患者參與和數據收集流程,標誌著eCOA功能向更廣泛的數位臨床試驗營運領域進行了重大擴展。
- 2023年7月,Signant Health收購了DSG公司,擴展了其電子臨床結果評估(eCOA)和混合試驗技術組合,使其包含增強的電子數據採集/直接數據採集(EDC/DDC)功能,並鞏固了其在複雜臨床研究環境(尤其是在歐洲)中的地位。
- 2023年11月,Clinical Ink透過將SPUR行為診斷工具與其eCOA和數位生物標記套件集成,擴展了其患者參與解決方案,從而更深入地了解患者行為,並改善對各項試驗臨床結果的整體評估。
- 2024年11月,uMotif完成了對ClinOne的收購,將eCOA/ePRO功能與研究中心效率提升和知情同意管理工具相結合,創建了一個統一的平台,從而降低了管理成本並提高了試驗參與效率。
- 2025年2月,YPrime宣布推出其eCOA 7.x平台的自動化資料變更表單(DCF)功能,可提供精簡、高效的臨床資料管理,並提高試驗資料工作流程的準確性。
- 2025年,Medable Inc.在Everest Group的生命科學eCOA產品PEAK矩陣評估中被評為領導者,其人工智慧創新、即時分析和多模態數據採集技術得到了認可,這些技術簡化了臨床結果評估流程並增強了患者參與度。
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Interactive Data Analysis Dashboard
- Company Analysis Dashboard for high growth potential opportunities
- Research Analyst Access for customization & queries
- Competitor Analysis with Interactive dashboard
- Latest News, Updates & Trend analysis
- Harness the Power of Benchmark Analysis for Comprehensive Competitor Tracking
研究方法
数据收集和基准年分析是使用具有大样本量的数据收集模块完成的。该阶段包括通过各种来源和策略获取市场信息或相关数据。它包括提前检查和规划从过去获得的所有数据。它同样包括检查不同信息源中出现的信息不一致。使用市场统计和连贯模型分析和估计市场数据。此外,市场份额分析和关键趋势分析是市场报告中的主要成功因素。要了解更多信息,请请求分析师致电或下拉您的询问。
DBMR 研究团队使用的关键研究方法是数据三角测量,其中包括数据挖掘、数据变量对市场影响的分析和主要(行业专家)验证。数据模型包括供应商定位网格、市场时间线分析、市场概览和指南、公司定位网格、专利分析、定价分析、公司市场份额分析、测量标准、全球与区域和供应商份额分析。要了解有关研究方法的更多信息,请向我们的行业专家咨询。
可定制
Data Bridge Market Research 是高级形成性研究领域的领导者。我们为向现有和新客户提供符合其目标的数据和分析而感到自豪。报告可定制,包括目标品牌的价格趋势分析、了解其他国家的市场(索取国家列表)、临床试验结果数据、文献综述、翻新市场和产品基础分析。目标竞争对手的市场分析可以从基于技术的分析到市场组合策略进行分析。我们可以按照您所需的格式和数据样式添加您需要的任意数量的竞争对手数据。我们的分析师团队还可以为您提供原始 Excel 文件数据透视表(事实手册)中的数据,或者可以帮助您根据报告中的数据集创建演示文稿。