Global Car T Therapy Treatment Market
市场规模(十亿美元)
CAGR :
% 
 USD
2.44 Billion
USD
6.66 Billion
2024
2032
USD
2.44 Billion
USD
6.66 Billion
2024
2032
| 2025 –2032 | |
| USD 2.44 Billion | |
| USD 6.66 Billion | |
|
|
|
|
全球嵌合抗原受體(CAR)-T療法市場細分,按類型(Abecma、Breyanzi、Kymriah、Tecartus、Yescarta 等)、目標抗原(CD19、CD20、GD2、CD22、CD30、CD33、HER1、HER2、Meso、EGFR VIII等)、治療應用(急性淋巴性白血病、慢性淋巴性白血病、非何杰金氏白血病、多發性骨髓瘤、胰臟癌、神經母細胞瘤、乳癌、急性髓性白血病、肝細胞癌、大腸直腸癌等)分割-產業趨勢及至2032年的預測
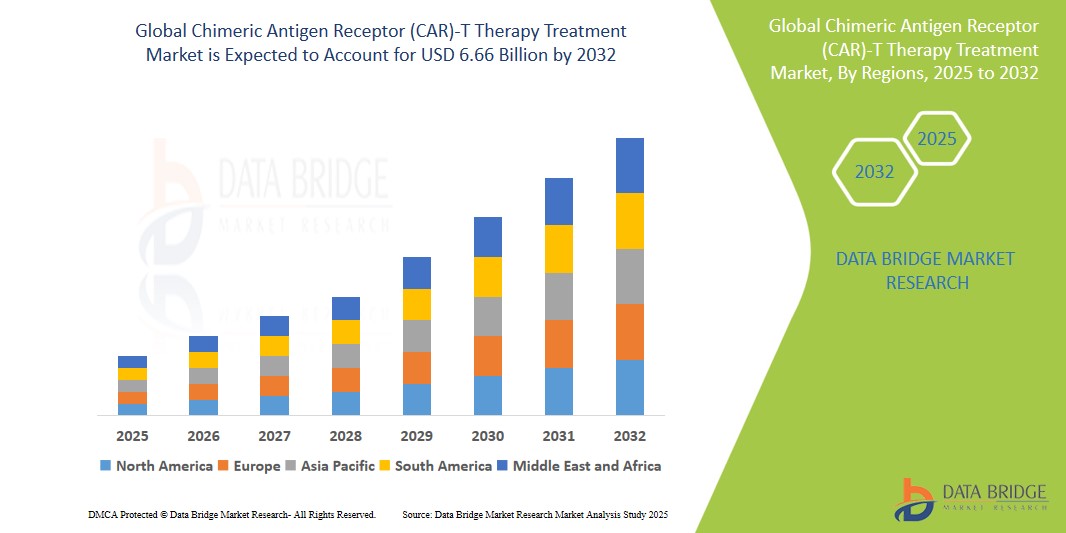
嵌合抗原受體(CAR)-T療法治療市場規模
- 2023 年全球嵌合抗原受體 (CAR)-T 細胞療法市場規模為 24.4 億美元,預計到 2031 年將達到 59.7 億美元,預測期內複合年增長率為 15.3%。
- 這一增長是由多種因素推動的,例如癌症發病率的上升、免疫療法的進步以及監管機構對CAR-T細胞療法的批准數量不斷增加。
嵌合抗原受體(CAR)-T療法治療市場分析
- CAR-T細胞療法是一種革命性的癌症治療方法,它透過改造患者自身的T細胞,使其能夠靶向並摧毀癌細胞。該療法在治療某些類型的白血病、淋巴瘤和多發性骨髓瘤方面顯示出很高的療效。
- 由於血液系統惡性腫瘤發生率不斷上升以及臨床試驗中取得令人鼓舞的結果,對CAR-T細胞療法的需求正在增長。
- 由於強大的研發活動、高昂的醫療保健支出以及對先進療法的早期應用,預計北美將主導CAR-T細胞療法市場。
- 由於生物技術產業的擴張和癌症負擔的加重,預計亞太地區將在預測期內成為 CAR-T 細胞療法市場成長最快的地區。
- 由於治療反應率高且臨床研發持續進行,急性淋巴性白血病領域預計將佔據市場主導地位,市場份額達30%。作為CAR-T療法首批獲準的適應症之一,急性淋巴性白血病領域持續推動著市場成長。
報告範圍及嵌合抗原受體(CAR)-T療法治療市場區隔
|
屬性 |
嵌合抗原受體(CAR)-T療法治療關鍵市場洞察 |
|
涵蓋的領域 |
|
|
覆蓋國家/地區 |
北美洲
歐洲
亞太
中東和非洲
南美洲
|
|
主要市場參與者 |
|
|
市場機遇 |
|
|
加值資料資訊集 |
除了對市場狀況(如市場價值、成長率、細分、地理覆蓋範圍和主要參與者)的洞察之外,Data Bridge Market Research 精心編制的市場報告還包括進出口分析、產能概覽、生產消費分析、價格趨勢分析、氣候變遷情境、供應鏈分析、價值鏈分析、原材料/消耗標準概覽、供應商選擇、PESTLE 分析、五力分析和監管框架。 |
嵌合抗原受體(CAR)-T療法治療市場趨勢
“下一代 CAR-T 療法和現成的(異體)解決方案”
- CAR-T細胞療法領域的一個主要趨勢是新一代CAR-T療法的出現以及現成(異基因)CAR-T解決方案的開發,旨在克服傳統自體CAR-T產品的局限性。
- 這些創新旨在提高生產效率、降低治療成本,並透過消除採集和改造患者自身T細胞的需求,確保患者更快獲得治療。
- 例如,Allogene Therapeutics 和 Precision BioSciences 等公司正在開發的同種異體 CAR-T 療法利用基因編輯技術,從健康捐贈者中生產通用 CAR-T 細胞,有望實現可擴展且易於獲得的治療。
- 這些進展有望徹底改變癌症免疫療法,縮短治療時間,提高治療可及性,並支持 CAR-T 療法在更廣泛的適應症和患者群體中推廣應用。
嵌合抗原受體(CAR)-T療法治療市場動態
司機
“癌症發生率上升與CAR-T療法在血液系統惡性腫瘤中的高療效”
- 全球癌症負擔日益加重,尤其是白血病、淋巴瘤和多發性骨髓瘤等血液系統惡性腫瘤,是推動CAR-T細胞療法需求成長的關鍵因素。
- CAR-T療法療效顯著,多種獲得FDA批准的產品在對傳統療法無反應的患者中顯示出較高的緩解率。
- 例如,根據國際癌症研究機構(IARC)2022年的數據,全球約有2,000萬例新增癌症病例,其中血液癌症佔很大比例。抗藥性癌症的日益增多,推動了對CAR-T等先進治療方案的需求。
- 隨著CAR設計、標靶抗原選擇和治療遞送技術的不斷進步,CAR-T療法的有效性和安全性持續提高,推動了市場成長。
機會
“將適應症擴展至實體瘤和早期治療線”
- 最有前景的機會之一在於將CAR-T細胞療法的應用範圍從血液系統惡性腫瘤擴展到實體腫瘤,而實體腫瘤佔全球癌症病例的大多數。
- 腫瘤微環境調控、雙靶向CAR和強化CAR-T細胞等方面的創新,使得CAR-T細胞能夠更好地浸潤並持續存在於實體腫瘤中。
- 此外,監管機構和研究人員正在探索將CAR-T療法應用於更早期的治療方案,預計將擴大患者群體並改善治療效果。
- 例如,2024年3月,美國國家癌症研究所(NCI)的研究人員啟動了針對HER2陽性乳癌和EGFR陽性膠質母細胞瘤的CAR-T療法的I期臨床試驗,標誌著CAR-T療法的應用方向轉向實體瘤。
- 這些進展可能會顯著擴大CAR-T療法的商業範圍,並使其成為更廣泛癌症類型的一線或二線治療方案。
克制/挑戰
“高昂的治療成本和複雜的製造流程”
- 限制CAR-T療法廣泛應用的最大挑戰之一是其高昂的成本和複雜、個性化的生產過程,該過程涉及提取、改造和重新輸注患者自身的T細胞。
- 治療費用通常每位患者高達數十萬美元,給患者和支付方造成了巨大的經濟負擔,並限制了中低收入國家獲得治療的機會。
- 例如,2024年10月發表在《健康事務》(Health Affairs)雜誌上的一項研究估計,在美國,CAR-T療法的平均總成本(包括住院和支持性護理)超過每位患者50萬美元,這使得治療費用成為醫療保健系統面臨的一個主要問題。
- 因此,這些限制可能導致醫療品質和獲得先進外科手術的機會出現差異,最終阻礙市場的整體成長。
嵌合抗原受體(CAR)-T療法治療市場範圍
市場按類型、標靶抗原和治療應用進行細分。
|
分割 |
子細分 |
|
按類型 |
|
|
透過標靶抗原 |
|
|
透過治療應用 |
|
預計到2025年,急性淋巴性白血病(ALL)細分市場將佔據市場主導地位,在治療應用領域佔最大份額。
預計到2025年,急性淋巴性白血病(ALL)領域將引領CAR-T細胞療法市場,佔約30%的市場。這一主導地位歸功於Kymriah和Tecartus等CAR-T療法早期獲批並取得臨床成功,用於治療復發或難治性ALL。憑藉其高緩解率和挽救生命的潛力,CAR-T療法正逐漸成為傳統療法無效患者的標準治療方案。 ALL發病率的不斷上升,尤其是在兒童群體中,以及臨床技術的持續進步,預計將進一步鞏固該領域的領先地位。
CD19標靶抗原細分市場預計將佔據市場主導地位,在目標抗原細分市場中佔據最大份額。
預計到2025年,CD19標靶抗原細分市場將在CAR-T細胞療法市場中佔據48.6%的最大市佔率。由於CD19在急性淋巴細胞白血病、非何杰金氏淋巴瘤和慢性淋巴細胞白血病等B細胞惡性腫瘤中高表達,因此它一直是應用最廣泛的標靶抗原。包括Kymriah、Yescarta和Breyanzi在內的多種FDA批准的CAR-T療法均針對CD19,並已證實具有顯著的臨床療效。隨著正在進行的臨床試驗探索CD19在聯合療法和新適應症的應用,預計該細分市場將在整個預測期內保持其主導地位。
嵌合抗原受體(CAR)-T療法治療市場區域分析
“北美在嵌合抗原受體(CAR)-T療法治療市場中佔最大份額”
- 北美在 CAR-T 細胞療法市場佔據主導地位,這得益於強大的臨床研究基礎設施、對創新免疫療法的早期採用以及有利於先進細胞療法審批的健全監管框架。
- 美國在該地區擁有大量核准的 CAR-T 療法,包括 Kymriah、Yescarta 和 Breyanzi,這些療法在專門的癌症治療中心廣泛應用。
- 有利的報銷政策、不斷上升的癌症發病率以及政府支持的精準腫瘤學推廣舉措,都極大地促進了市場擴張。
- 此外,領先的生物技術公司入駐、針對新適應症的持續臨床試驗以及對細胞療法生產設施的投資,都鞏固了該地區在全球 CAR-T 療法領域的領先地位。
“亞太地區預計將在嵌合抗原受體(CAR)-T療法治療市場中實現最高的複合年增長率”
- 亞太地區預計將成為CAR-T細胞療法市場成長最快的地區,這主要得益於醫療基礎設施的不斷改善、癌症發病率的上升以及對生物技術創新投資的持續成長。
- 由於個人化癌症治療的日益普及以及政府對臨床研究和細胞療法開發的支持,中國、日本、韓國和印度等國家正在崛起為關鍵市場。
- 尤其值得一提的是,中國在CAR-T領域發展迅速,並進行了大量臨床試驗,國內生物技術公司也紛紛推出針對CD19、CD22和BCMA抗原的競爭性療法。
- 日本監管機構已對再生療法和先進療法採取快速審批途徑,有助於加速CAR-T療法的普及。
- 在學術合作和在地化生產及降低治療成本的措施推動下,印度對CAR-T療法的需求日益增長。預計這一區域成長勢頭將在預測期內顯著促進全球市場成長。
嵌合抗原受體(CAR)-T療法治療市場份額
市場競爭格局部分按競爭對手提供詳細信息,包括公司概況、財務狀況、收入、市場潛力、研發投入、新市場拓展計劃、全球佈局、生產基地及設施、產能、公司優勢與劣勢、產品發布、產品線寬度與廣度以及應用領域優勢。以上數據僅與各公司在市場上的業務重點相關。
市場上的主要市場領導者包括:
- Autolus Therapeutics(英國)
- CARsgen Therapeutics Holdings Limited(英國)
- 百時美施貴寶公司(美國)
- 索倫托治療公司(美國)
- bluebird bio, Inc.(美國)
- 尤里卡治療公司(美國)
- Avacta集團有限公司(英國)
- Cibus 公司(法國)
- Celyad Oncology SA(比利時)
- Fortress Biotech, Inc.(美國)
- 吉利德科學公司(美國)
- 諾華公司(瑞士)
- Alaunos Therapeutics, Inc.(美國)
- Poseida Therapeutics, Inc.(美國)
全球嵌合抗原受體(CAR)-T療法治療市場最新進展
- 2023年12月,Max Healthcare成功在德里-NCR地區引進CAR-T細胞療法,標誌著癌症治療領域的重大突破。這項與ImmunoACT合作開發的創新療法,專門用於對抗淋巴瘤和白血病,為與這些頑疾抗爭的患者帶來了新的希望。
- 2022年12月,CARsgen Therapeutics Co., Ltd.與上海腫瘤研究所合作開發了一種新技術,可顯著增強T細胞的抗腫瘤療效。他們的研究團隊發現,經基因工程改造過表達Runx3的CAR-T細胞,與傳統的嵌合抗原受體T細胞療法相比,展現出更持久的抗腫瘤活性,並能更好地控制腫瘤。
- 2022年11月,Caribou Biosciences公司宣布,其同種異體抗CD19 CAR-T細胞療法CB-010獲得美國食品藥品監督管理局(FDA)授予的再生醫學先進療法(RMAT)資格,用於治療復發或難治性大B細胞淋巴瘤(LBCL),同時獲得治療中律師的快速通道資格,B細胞復發或難治性。
- 2022年6月,渥太華大學發表了由加拿大主導的癌症免疫療法-01(CLIC-01)臨床試驗的初步成果。該試驗重點研究了加拿大首批自主研發的CAR-T細胞癌症療法之一。這種療法採用獨特的生產工藝,有望帶來更經濟實惠、更公平的治療選擇。
- 2021年11月,加州再生醫學研究所理事會批准了一項410萬美元的撥款,用於支持加州大學聖地牙哥分校醫學院的科學家們正在研發的創新型嵌合抗原受體T細胞療法(CAR-T療法)的進展,幫助他們將這項前景廣闊的癌症療法從實驗室轉化為臨床應用。
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Interactive Data Analysis Dashboard
- Company Analysis Dashboard for high growth potential opportunities
- Research Analyst Access for customization & queries
- Competitor Analysis with Interactive dashboard
- Latest News, Updates & Trend analysis
- Harness the Power of Benchmark Analysis for Comprehensive Competitor Tracking
目录
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 EPIDEMIOLOGY
2.2.12 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.13 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3 MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4 EXECUTIVE SUMMARY
5 PREMIUM INSIGHTS
5.1 PESTEL ANALYSIS
5.2 PORTER’S FIVE FORCES MODEL
6 INDUSTRY INSIGHTS
6.1 PATENT ANALYSIS
6.1.1 PATENT LANDSCAPE
6.1.2 USPTO NUMBER
6.1.3 PATENT EXPIRY
6.1.4 EPIO NUMBER
6.1.5 PATENT STRENGTH AND QUALITY
6.1.6 PATENT CLAIMS
6.1.7 PATENT CITATIONS
6.1.8 PATENT LITIGATION AND LICENSING
6.1.9 FILE OF PATENT
6.1.10 PATENT RECEIVED CONTRIES
6.1.11 TECHNOLOGY BACKGROUND
6.2 DRUG TREATMENT RATE BY MATURED MARKETS
6.3 DEMOGRAPHIC TRENDS: IMPACTS ON ALL INCIDENCE RATES
6.4 PATIENT FLOW DIAGRAM
6.5 KEY PRICING STRATEGIES
6.6 KEY PATIENT ENROLLMENT STRATEGIES
6.7 INTERVIEWS WITH SPECIALIST
6.8 OTHER KOL SNAPSHOTS
7 EPIDEMIOLOGY
7.1 INCIDENCE OF ALL BY GENDER
7.1.1 PREVALENCE OF B-CELL ACUTE LYMPHOBLASTIC LEUKEMIA (ALL)
7.1.2 PREVALENCE OF B-CELL NON-HODGKIN LYMPHOMA (NHL)
7.1.3 PREVALENCE OF FOLLICULAR LYMPHOMA
7.1.4 PREVALENCE OF MANTLE CELL LYMPHOMA (MCL)
7.1.5 PREVALENCE OF MULTIPLE MYELOMA
7.2 TREATMENT RATE
7.3 MORTALITY RATE
7.4 PATIENT TREATMENT SUCCESS RATES
8 MERGERS AND ACQUISITION
8.1 LICENSING
8.2 COMMERCIALIZATION AGREEMENTS
9 REGULATORY FRAMEWORK
9.1 REGULATORY APPROVAL PROCESS
9.2 GEOGRAPHIES’ EASE OF REGULATORY APPROVAL
9.3 REGULATORY APPROVAL PATHWAYS
9.4 LICENSING AND REGISTRATION
9.5 POST-MARKETING SURVEILLANCE
9.6 GOOD MANUFACTURING PRACTICES (GMPS) GUIDELINES
10 PIPELINE ANALYSIS
10.1 CLINICAL TRIALS AND PHASE ANALYSIS
10.2 DRUG THERAPY PIPELINE
10.3 PHASE III CANDIDATES
10.4 PHASE II CANDIDATES
10.5 PHASE I CANDIDATES
10.6 OTHERS (PRE-CLINICAL AND RESEARCH)
TABLE 1 GLOBAL CLINICAL TRIAL MARKET FOR XX
Company Name Therapeutic Area
XX XX
XX XX
XX XX
XX XX
XX XX
XX XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 2 DISTRIBUTION OF PRODUCTS AND PROJECTS BY PHASE
Phase Number of Projects
Preclinical/Research Projects XX
Clinical Development XX
Phase I XX
Phase II XX
Phase III XX
U.S. Filed/Approved But Not Yet Marketed XX
Total XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 3 DISTRIBUTION OF PROJECTS BY THERAPEUTIC AREA AND PHASE
Therapeutic Area Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 4 DISTRIBUTION OF PROJECTS BY SCIENTIFIC APPROACH AND PHASE
Technology Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
FIGURE 1 TOP ENTITIES BASED ON R&D GLANCE FOR XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
11 MARKETED DRUG ANALYSIS
11.1 DRUG
11.1.1 BRAND NAME
11.1.2 GENERICS NAME
11.2 THERAPEUTIC INDICTION
11.3 PHARMACOLOGICAL CLASS OF THE DRUG
11.4 DRUG PRIMARY INDICATION
11.5 MARKET STATUS
11.6 MEDICATION TYPE
11.7 DRUG DOSAGES FORM
11.8 DOSAGES AVAILABILITY
11.9 DRUG ROUTE OF ADMINISTRATION
11.1 DOSING FREQUENCY
11.11 DRUG INSIGHT
11.12 AN OVERVIEW OF THE DRUG DEVELOPMENT ACTIVITIES SUCH AS REGULATORY MILSTONE, SAFETY DATA AND EFFICACY DATA, MARKET EXCLUSIVITY DATA.
11.12.1 FORECAST MARKET OUTLOOK
11.12.2 CROSS COMPETITION
11.12.3 THERAPEUTIC PORTFOLIO
11.12.4 CURRENT DEVELOPMENT SCENARIO
12 MARKET ACCESS
12.1 10-YEAR MARKET FORECAST
12.2 CLINICAL TRIAL RECENT UPDATES
12.3 ANNUAL NEW FDA APPROVED DRUGS
12.4 DRUGS MANUFACTURER AND DEALS
12.5 MAJOR DRUG UPTAKE
12.6 CURRENT TREATMENT PRACTICES
12.7 IMPACT OF UPCOMING THERAPY
13 R & D ANALYSIS
13.1 COMPARATIVE ANALYSIS
13.2 DRUG DEVELOPMENTAL LANDSCAPE
13.3 IN-DEPTH INSIGHTS ON REGULATORY MILESTONES
13.4 THERAPEUTIC ASSESSMENT
13.5 ASSET-BASED COLLABORATIONS AND PARTNERSHIPS
14 MARKET OVERVIEW
14.1 DRIVERS
14.2 RESTRAINTS
14.3 OPPORTUNITIES
14.4 CHALLENGES
15 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY TARGET INDICATION
15.1 OVERVIEW
15.2 B-CELL ACUTE LYMPHOBLASTIC LEUKEMIA (ALL)
15.3 B-CELL NON-HODGKIN LYMPHOMA (NHL)
15.4 FOLLICULAR LYMPHOMA
15.5 MANTLE CELL LYMPHOMA (MCL)
15.6 MULTIPLE MYELOMA
15.7 OTHERS
16 GLOBAL
16.1 OVERVIEW
16.2 AUTOLOGOUS CAR-T CELLS
16.3 ALLOGENEIC CAR-T CELLS
17 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY TARGET ANTIGEN
17.1 OVERVIEW
17.2 CD19
17.2.1 TISAGENLECLEUCEL
17.2.1.1. MARKET VALUE (USD MN)
17.2.1.2. MARKET VOLUME (SU)
17.2.1.3. AVERAGE SELLING PRICE (USD)
17.2.2 AXIXABTAGENE CILOLEUCEL
17.2.2.1. MARKET VALUE (USD MN)
17.2.2.2. MARKET VOLUME (SU)
17.2.2.3. AVERAGE SELLING PRICE (USD)
17.2.3 BREXUCABTAGENE AUTOLLEUCEL
17.2.3.1. MARKET VALUE (USD MN)
17.2.3.2. MARKET VOLUME (SU)
17.2.3.3. AVERAGE SELLING PRICE (USD)
17.2.4 LISOCABTAGENE MARALEUCEL
17.2.4.1. MARKET VALUE (USD MN)
17.2.4.2. MARKET VOLUME (SU)
17.2.4.3. AVERAGE SELLING PRICE (USD)
17.2.5 OTHERS
17.3 BCMA
17.3.1 IDECABTAGENE VICLEUCEL
17.3.1.1. MARKET VALUE (USD MN)
17.3.1.2. MARKET VOLUME (SU)
17.3.1.3. AVERAGE SELLING PRICE (USD)
17.3.2 CILTACABTAGENE AUTOLEUCEL
17.3.2.1. MARKET VALUE (USD MN)
17.3.2.2. MARKET VOLUME (SU)
17.3.2.3. AVERAGE SELLING PRICE (USD)
17.3.3 OTHERS
17.4 OTHERS
18 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY AGE GROUP
18.1 OVERVIEW
18.2 CHILDREN (0-15)
18.3 ADULTS (16- 64)
18.4 SENIORS (65 AND ABOVE)
19 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY GENDER
19.1 OVERVIEW
19.2 MALE
19.3 FEMALE
20 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY END USER
20.1 OVERVIEW
20.2 HOSPITAL
20.2.1 PRIVATE
20.2.2 PUBLIC
20.3 SPECIALTY CLINICS
20.4 RESEARCH INSTITUTES
20.5 CANCER INSTITUTES
20.6 PHARMACEUTICAL & BIOTECHNOLOGY COMPANIES
20.7 OTHERS
21 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY DISTRIBUTION CHANNEL
21.1 OVERVIEW
21.2 DIRECT SALE
21.3 RETAIL SALES
21.4 OTHERS
22 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, COMPANY LANDSCAPE
22.1 COMPANY SHARE ANALYSIS: GLOBAL
22.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
22.3 COMPANY SHARE ANALYSIS: EUROPE
22.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
22.5 MERGERS & ACQUISITIONS
22.6 NEW PRODUCT DEVELOPMENT & APPROVALS
22.7 EXPANSIONS
22.8 REGULATORY CHANGES
22.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
23 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, BY GEOGRAPHY
GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
23.1 NORTH AMERICA
23.1.1 U.S.
23.1.2 CANADA
23.1.3 MEXICO
23.2 EUROPE
23.2.1 GERMANY
23.2.2 U.K.
23.2.3 ITALY
23.2.4 FRANCE
23.2.5 SPAIN
23.2.6 RUSSIA
23.2.7 SWITZERLAND
23.2.8 TURKEY
23.2.9 BELGIUM
23.2.10 NETHERLANDS
23.2.11 DENMARK
23.2.12 SWEDEN
23.2.13 POLAND
23.2.14 NORWAY
23.2.15 FINLAND
23.2.16 REST OF EUROPE
23.3 ASIA-PACIFIC
23.3.1 JAPAN
23.3.2 CHINA
23.3.3 SOUTH KOREA
23.3.4 INDIA
23.3.5 SINGAPORE
23.3.6 THAILAND
23.3.7 INDONESIA
23.3.8 MALAYSIA
23.3.9 PHILIPPINES
23.3.10 AUSTRALIA
23.3.11 NEW ZEALAND
23.3.12 VIETNAM
23.3.13 TAIWAN
23.3.14 REST OF ASIA-PACIFIC
23.4 SOUTH AMERICA
23.4.1 BRAZIL
23.4.2 ARGENTINA
23.4.3 REST OF SOUTH AMERICA
23.5 MIDDLE EAST AND AFRICA
23.5.1 SOUTH AFRICA
23.5.2 EGYPT
23.5.3 BAHRAIN
23.5.4 UNITED ARAB EMIRATES
23.5.5 KUWAIT
23.5.6 OMAN
23.5.7 QATAR
23.5.8 SAUDI ARABIA
23.5.9 REST OF MIDDLE EAST AND AFRICA
23.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
24 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, SWOT AND DBMR ANALYSIS
25 GLOBAL CHIMERIC ANTIGEN RECEPTOR (CAR)-T THERAPY TREATMENT MARKET, COMPANY PROFILE
25.1 NOVARTIS AG
25.1.1 COMPANY OVERVIEW
25.1.2 REVENUE ANALYSIS
25.1.3 GEOGRAPHIC PRESENCE
25.1.4 PRODUCT PORTFOLIO
25.1.5 RECENT DEVELOPMENTS
25.2 KITE PHARMA
25.2.1 COMPANY OVERVIEW
25.2.2 REVENUE ANALYSIS
25.2.3 GEOGRAPHIC PRESENCE
25.2.4 PRODUCT PORTFOLIO
25.2.5 RECENT DEVELOPMENTS
25.3 JUNO THERAPTICS
25.3.1 COMPANY OVERVIEW
25.3.2 REVENUE ANALYSIS
25.3.3 GEOGRAPHIC PRESENCE
25.3.4 PRODUCT PORTFOLIO
25.3.5 RECENT DEVELOPMENTS
25.4 BRISTOL MYERS SQUIBB
25.4.1 COMPANY OVERVIEW
25.4.2 REVENUE ANALYSIS
25.4.3 GEOGRAPHIC PRESENCE
25.4.4 PRODUCT PORTFOLIO
25.4.5 RECENT DEVELOPMENTS
25.5 LEGEND BIOTECH INC
25.5.1 COMPANY OVERVIEW
25.5.2 REVENUE ANALYSIS
25.5.3 GEOGRAPHIC PRESENCE
25.5.4 PRODUCT PORTFOLIO
25.5.5 RECENT DEVELOPMENTS
25.6 AMMGEN, INC
25.6.1 COMPANY OVERVIEW
25.6.2 REVENUE ANALYSIS
25.6.3 GEOGRAPHIC PRESENCE
25.6.4 PRODUCT PORTFOLIO
25.6.5 RECENT DEVELOPMENTS
25.7 SORRENTO THERAPUTICS, INC.
25.7.1 COMPANY OVERVIEW
25.7.2 REVENUE ANALYSIS
25.7.3 GEOGRAPHIC PRESENCE
25.7.4 PRODUCT PORTFOLIO
25.7.5 RECENT DEVELOPMENTS
25.8 GILEAD SCIENCE
25.8.1 COMPANY OVERVIEW
25.8.2 REVENUE ANALYSIS
25.8.3 GEOGRAPHIC PRESENCE
25.8.4 PRODUCT PORTFOLIO
25.8.5 RECENT DEVELOPMENTS
25.9 BLUE BIRD BIO, INC.
25.9.1 COMPANY OVERVIEW
25.9.2 REVENUE ANALYSIS
25.9.3 GEOGRAPHIC PRESENCE
25.9.4 PRODUCT PORTFOLIO
25.9.5 RECENT DEVELOPMENTS
25.1 IMMUN THERAPUTICS, INC
25.10.1 COMPANY OVERVIEW
25.10.2 REVENUE ANALYSIS
25.10.3 GEOGRAPHIC PRESENCE
25.10.4 PRODUCT PORTFOLIO
25.10.5 RECENT DEVELOPMENTS
25.11 BELLICUM PARMACEUTICALS, INC.
25.11.1 COMPANY OVERVIEW
25.11.2 REVENUE ANALYSIS
25.11.3 GEOGRAPHIC PRESENCE
25.11.4 PRODUCT PORTFOLIO
25.11.5 RECENT DEVELOPMENTS
25.12 PFIZER, INC.
25.12.1 COMPANY OVERVIEW
25.12.2 REVENUE ANALYSIS
25.12.3 GEOGRAPHIC PRESENCE
25.12.4 PRODUCT PORTFOLIO
25.12.5 RECENT DEVELOPMENTS
25.13 ELI LILLY AND COMPANY
25.13.1 COMPANY OVERVIEW
25.13.2 REVENUE ANALYSIS
25.13.3 GEOGRAPHIC PRESENCE
25.13.4 PRODUCT PORTFOLIO
25.13.5 RECENT DEVELOPMENTS
25.14 JW THERAPEUTICS
25.14.1 COMPANY OVERVIEW
25.14.2 REVENUE ANALYSIS
25.14.3 GEOGRAPHIC PRESENCE
25.14.4 PRODUCT PORTFOLIO
25.14.5 RECENT DEVELOPMENTS
25.15 FORTRESS BIOTECH, INC.
25.15.1 COMPANY OVERVIEW
25.15.2 REVENUE ANALYSIS
25.15.3 GEOGRAPHIC PRESENCE
25.15.4 PRODUCT PORTFOLIO
25.15.5 RECENT DEVELOPMENTS
25.16 CARTESIAN THERAPEUTICS, INC.
25.16.1 COMPANY OVERVIEW
25.16.2 REVENUE ANALYSIS
25.16.3 GEOGRAPHIC PRESENCE
25.16.4 PRODUCT PORTFOLIO
25.16.5 RECENT DEVELOPMENTS
25.17 CASI PHARMACEUTICALS
25.17.1 COMPANY OVERVIEW
25.17.2 REVENUE ANALYSIS
25.17.3 GEOGRAPHIC PRESENCE
25.17.4 PRODUCT PORTFOLIO
25.17.5 RECENT DEVELOPMENTS
25.18 POSEIDA THERAPEUTICS, INC.
25.18.1 COMPANY OVERVIEW
25.18.2 REVENUE ANALYSIS
25.18.3 GEOGRAPHIC PRESENCE
25.18.4 PRODUCT PORTFOLIO
25.18.5 RECENT DEVELOPMENTS
25.19 AUTOLUS THERAPEUTICS
25.19.1 COMPANY OVERVIEW
25.19.2 REVENUE ANALYSIS
25.19.3 GEOGRAPHIC PRESENCE
25.19.4 PRODUCT PORTFOLIO
25.19.5 RECENT DEVELOPMENTS
25.2 EUREKA THERAPEUTICS
25.20.1 COMPANY OVERVIEW
25.20.2 REVENUE ANALYSIS
25.20.3 GEOGRAPHIC PRESENCE
25.20.4 PRODUCT PORTFOLIO
25.20.5 RECENT DEVELOPMENTS
25.21 AURORA BIOPHARMA
25.21.1 COMPANY OVERVIEW
25.21.2 REVENUE ANALYSIS
25.21.3 GEOGRAPHIC PRESENCE
25.21.4 PRODUCT PORTFOLIO
25.21.5 RECENT DEVELOPMENTS
25.22 IMMUNOACT
25.22.1 COMPANY OVERVIEW
25.22.2 REVENUE ANALYSIS
25.22.3 GEOGRAPHIC PRESENCE
25.22.4 PRODUCT PORTFOLIO
25.22.5 RECENT DEVELOPMENTS
25.23 FERRING PHARMACEUTICALS A/S
25.23.1 COMPANY OVERVIEW
25.23.2 REVENUE ANALYSIS
25.23.3 GEOGRAPHIC PRESENCE
25.23.4 PRODUCT PORTFOLIO
25.23.5 RECENT DEVELOPMENTS
25.24 JANSSEN BIOTECH, INC.
25.24.1 COMPANY OVERVIEW
25.24.2 REVENUE ANALYSIS
25.24.3 GEOGRAPHIC PRESENCE
25.24.4 PRODUCT PORTFOLIO
25.24.5 RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
26 RELATED REPORTS
27 CONCLUSION
28 QUESTIONNAIRE
29 ABOUT DATA BRIDGE MARKET RESEARCH
研究方法
数据收集和基准年分析是使用具有大样本量的数据收集模块完成的。该阶段包括通过各种来源和策略获取市场信息或相关数据。它包括提前检查和规划从过去获得的所有数据。它同样包括检查不同信息源中出现的信息不一致。使用市场统计和连贯模型分析和估计市场数据。此外,市场份额分析和关键趋势分析是市场报告中的主要成功因素。要了解更多信息,请请求分析师致电或下拉您的询问。
DBMR 研究团队使用的关键研究方法是数据三角测量,其中包括数据挖掘、数据变量对市场影响的分析和主要(行业专家)验证。数据模型包括供应商定位网格、市场时间线分析、市场概览和指南、公司定位网格、专利分析、定价分析、公司市场份额分析、测量标准、全球与区域和供应商份额分析。要了解有关研究方法的更多信息,请向我们的行业专家咨询。
可定制
Data Bridge Market Research 是高级形成性研究领域的领导者。我们为向现有和新客户提供符合其目标的数据和分析而感到自豪。报告可定制,包括目标品牌的价格趋势分析、了解其他国家的市场(索取国家列表)、临床试验结果数据、文献综述、翻新市场和产品基础分析。目标竞争对手的市场分析可以从基于技术的分析到市场组合策略进行分析。我们可以按照您所需的格式和数据样式添加您需要的任意数量的竞争对手数据。我们的分析师团队还可以为您提供原始 Excel 文件数据透视表(事实手册)中的数据,或者可以帮助您根据报告中的数据集创建演示文稿。