Global Medical Device Engineering Market
市场规模(十亿美元)
CAGR :
% 
 USD
7.66 Billion
USD
11.83 Billion
2024
2032
USD
7.66 Billion
USD
11.83 Billion
2024
2032
| 2025 –2032 | |
| USD 7.66 Billion | |
| USD 11.83 Billion | |
|
|
|
|
全球醫療器材工程市場細分,依服務類型(產品創新與設計/工業設計服務、原型服務、電子工程服務、軟體開發與測試服務、連接與行動服務、網路安全服務、產品測試服務、監理諮詢服務、產品支援與維修服務)、設備類型(診斷影像設備、手術設備、病患監護設備與生命支持設備、用雷射器、IVD、設備類型(診斷影像設備、手術設備、病患監護設備與生命支持設備、用雷射器、IVD設備、其他醫療預測
醫療器材工程市場分析
醫療器材工程市場正在經歷強勁成長,這得益於醫療技術的進步、研發投資的增加以及對創新醫療解決方案的需求不斷增長。該行業市場規模預計將以超過 5.8% 的複合年增長率成長,受益於微創設備、穿戴式健康技術以及由人工智慧和物聯網驅動的診斷工具的發展。影響這一增長的關鍵因素包括全球人口老化和慢性病盛行率上升,這需要先進的醫療設備進行有效管理。歐盟的 MDR(醫療器材法規)和嚴格的 FDA 要求等監管變化正在促使公司投資高品質的工程解決方案,以確保合規性和安全性。 3D 列印、機器人和智慧材料等技術進步正在重塑醫療器材工程。這些創新實現了更快的原型設計、成本效率和增強的設備功能。受製造成本降低和醫療保健基礎設施不斷發展的推動,亞太地區正在成為重要的貢獻者。高研發成本和監管障礙等挑戰仍然存在,但診斷、治療和監測系統對尖端醫療設備的需求確保了該行業保持積極的發展軌跡。數位健康解決方案的整合將進一步推動這一市場的發展。
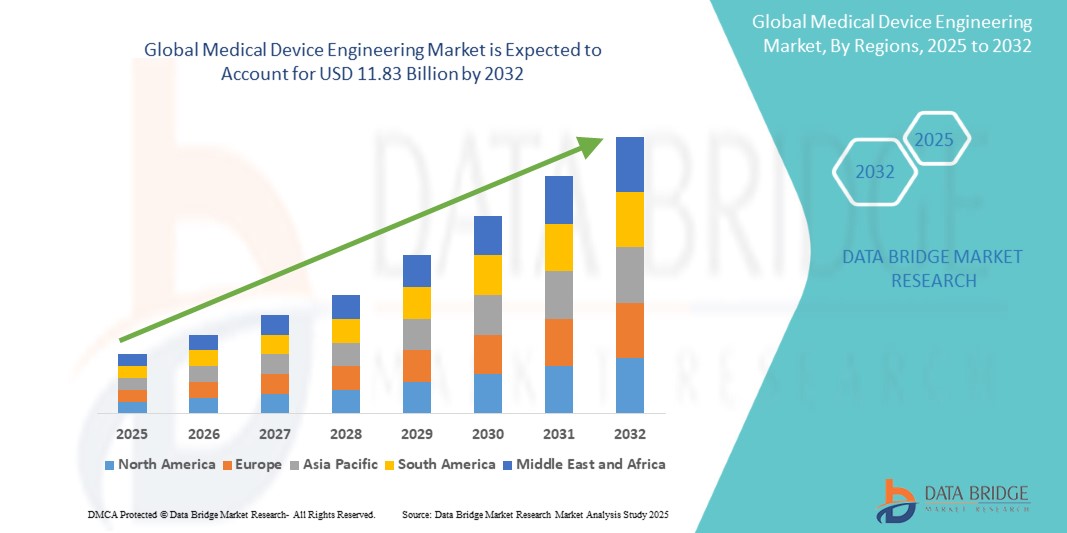
醫療器材工程市場規模
2024 年全球醫療器材工程市場規模為 76.6 億美元,預計到 2032 年將達到 118.3 億美元,2025 年至 2032 年預測期內的複合年增長率為 5.8%。除了對市場價值、成長率、細分、地理覆蓋範圍和主要參與者等市場情景的洞察外,Data Bridge Market Research 策劃的市場報告還包括深度專家分析、患者流行病學、管道分析、定價分析和監管框架。
醫療器材工程市場趨勢
“醫療設備中的人工智慧 (AI) 和機器學習 (ML) 整合”
醫療器材工程市場最具變革性的趨勢之一是人工智慧(AI) 和機器學習 (ML) 功能的整合。人工智慧和機器學習使醫療設備能夠執行更高級的功能,例如診斷、數據分析和個人化治療建議,這為新一代「智慧」醫療設備鋪平了道路
人工智慧驅動的醫療設備可以分析複雜的數據集並識別人類操作員可能無法察覺的模式。例如,嵌入在 MRI 和 CT 掃描儀等影像設備中的 AI 演算法可以幫助放射科醫生更準確、更早地檢測出腫瘤、骨折或血栓等異常情況。這有助於醫療保健提供者做出更快、更準確的診斷,進而改善患者的治療效果。人工智慧設備可以透過分析患者獨特的生理數據、病史和基因資訊來制定個人化的治療計劃。這在腫瘤學等領域尤其有價值,因為可以根據患者腫瘤的特定基因特徵來客製化治療方案,從而提高治療的效果。
報告範圍和醫療器材工程市場細分
|
屬性 |
農業滾筒關鍵市場洞察 |
|
涵蓋的領域 |
|
|
覆蓋國家 |
美國、加拿大、墨西哥、德國、法國、英國、荷蘭、瑞士、比利時、俄羅斯、義大利、西班牙、土耳其、歐洲其他地區、中國、日本、印度、韓國、新加坡、馬來西亞、澳洲、泰國、印尼、菲律賓、亞太其他地區、沙烏地阿拉伯、阿聯酋、南非、埃及、以色列、中東和非洲其他地區、巴西、阿根廷、南美洲其他地區 |
|
主要市場參與者 |
L&T Technology Services Limited(印度)、Infosys Limited(印度)、HCL Technologies Limited(印度)、Cyient(印度)、Wipro(印度)、Tech Mahindra Limited(印度)、TATA Consultancy Services Limited(印度)、FLEX LTD(美國)、Capgemini(法國)、Embien Technologies India Pvt Ltd.(印度)、Altenance Group(法國)、法國)、Embien Technologies India Pvt Ltd.(印度)、Altenance Group(法國)。 INSTITUTE(美國)、Saraca Solutions Private Limited(印度)、Nemedio Inc.(美國)、Sternum(以色列)、Medcrypt(美國)、MCRA, LLC(美國)、North American Science Associates, LLC(美國)、MedQtech(瑞典)、Veranex(美國)、Ontogen Medtech LLC(美國)、Seisa Media(美國)和美國)。 |
|
市場機會 |
|
|
加值資料資訊集 |
除了對市場價值、成長率、細分、地理覆蓋範圍和主要參與者等市場情景的洞察之外,Data Bridge Market Research 策劃的市場報告還包括深度專家分析、患者流行病學、管道分析、定價分析和監管框架。 |
醫療器材工程市場定義
醫療器材工程是一個多學科領域,專注於用於醫療目的(例如疾病的診斷、治療、監測或預防)的設備的設計、開發和製造。它融合了機械、電氣、軟體和生物醫學工程原理,創造出創新可靠的設備,包括穿戴式健康監測器和影像系統到微創手術工具和義肢。該領域強調遵守嚴格的監管標準、安全性和以使用者為中心的設計,以確保療效和患者的舒適度。材料科學、機器人技術和人工智慧、物聯網等數位健康技術的進步正在重塑醫療器材工程,以改善醫療保健結果。
醫療器材工程市場動態
驅動程式
- 慢性病盛行率不斷上升
心血管疾病、糖尿病、癌症和呼吸系統疾病等慢性疾病的盛行率不斷上升,是醫療器材工程市場發展的主要驅動力。慢性病是長期的、通常與生活方式有關的疾病,需要持續的監測、管理和治療。由於人口老化、城市化和久坐不動的生活方式等因素導致這些疾病變得越來越普遍,對有助於診斷、監測和治療的醫療設備的需求也日益增長。糖尿病和心血管疾病等狀況需要持續監測。血糖監測儀、心率監測儀甚至穿戴式心電圖等設備已成為患者的必需品,可即時追蹤健康狀況並快速應對不良事件。
例如,根據 2021 年國際糖尿病聯盟 (IDF) 的報告,10.5% 的成年人口(20-79 歲)患有糖尿病,其中近一半的人不知道自己患有這種疾病。 IDF 預測顯示,到 2045 年,每 8 個成年人中就有 1 個(約 7.83 億)將患有糖尿病,增幅為 46%。
用於管理慢性疾病的醫療設備的需求導致了便攜式、用戶友好型和經濟高效的設備的創新,使得醫療保健變得更加容易獲得。例如,開發能夠即時向醫療保健提供者傳輸資料的連接設備有助於解決患者和系統層面的慢性病管理問題。預計這一趨勢將會增強,對醫療器材工程市場的成長做出重大貢獻。
- 醫療器材技術進步
快速的技術創新是醫療器材工程市場的強大驅動力,重塑了設備並增強了其功能。人工智慧、機器人、3D 列印和生物相容性材料等領域的進步推動了複雜醫療設備的開發,這些設備可以提供更高的精度、自動化程度和對個別患者需求的適應性。這些先進技術的採用使醫療器材市場能夠滿足對更有效、更有效率、以病人為中心的解決方案日益增長的需求。投資這些技術的公司準備好透過提供更易於臨床醫生使用並提供增強臨床益處的創新設備來佔領市場份額。例如,飛利浦在其診斷影像設備中利用了人工智慧,例如 IntelliSpace AI Workflow Suite。該平台利用人工智慧來提高成像質量,加快診斷工作流程,並協助更早、更準確的診斷。它專為放射科醫生設計,旨在簡化成像操作並改善患者的治療效果。隨著全球醫療保健系統越來越多地採用這些先進的解決方案,醫療器材工程市場預計將在技術進步的推動下實現強勁成長。
機會
- 穿戴式和遠端監控設備的擴展
隨著遠距醫療的興起和主動健康管理的需求,穿戴式和遠端監控設備為醫療器材工程市場帶來了巨大的機會。這些設備包括智慧手錶、連續血糖監測儀和心臟監測儀,可在傳統臨床環境之外進行即時健康監測。追蹤心率、氧氣水平和血糖等生命體徵的能力可以提供持續的患者數據,並使個人能夠更有效地管理自己的健康。穿戴式裝置對於治療糖尿病、高血壓和心臟病等慢性疾病的患者俱有巨大的價值。隨著人們對預防性醫療保健的認識不斷提高以及對穿戴式科技的投資不斷增加,預計該領域將實現顯著成長。根據市場研究,穿戴式醫療設備領域預計未來十年將以高複合年增長率成長,為整體醫療器材市場的擴張做出巨大貢獻。
例如,2024 年 8 月,Dexcom 宣布其新型非處方連續血糖監測儀 Stelo 在美國正式上市。 Stelo 葡萄糖生物感測器系統是一種非處方 (OTC) 整合式連續血糖監測儀 (iCGM),旨在持續測量、記錄、分析和顯示 18 歲及以上未註射胰島素的人群的血糖值。 Stelo 葡萄糖生物感測器系統有助於檢測正常(血糖正常)和低或高(血糖異常)的葡萄糖水平。 Stelo 葡萄糖生物感測器系統還可以幫助使用者更好地了解生活方式和行為改變(包括飲食和運動)如何影響血糖波動。因此,預計可穿戴和遠端監控設備供應量的增加將在預測期內推動市場的成長。
- 微創手術設備需求不斷成長
向微創手術的轉變為醫療器材工程帶來了另一個重大機會。微創手術 (MIS) 設備,包括腹腔鏡器械、機器人輔助手術工具和內視鏡設備,可縮短恢復時間、減少創傷並最大限度地減少術後併發症。隨著患者和醫療保健提供者尋求縮短住院時間和改善患者治療效果的方案,MIS 設備的市場正在擴大。 MIS 技術涉及較小的切口,從而降低了感染、疼痛和疤痕的風險。例如,機器人輔助手術可以提高心臟和骨科手術等複雜手術的精確度,從而改善手術結果並縮短恢復時間。
機器人、影像和手術工具等技術的進步進一步增強了這一趨勢。 MIS 設備市場預計將出現強勁成長,預測顯示需求旺盛,特別是在骨科、心血管和胃腸道應用領域。人口老化也增加了這個機會,因為老化通常需要對慢性疾病進行手術幹預,而 MIS 技術可以減少併發症並加快康復速度。例如,史賽克的 Mako 系統是一個機器人輔助平台,使骨科醫生能夠進行精確、微創的膝關節和髖關節置換手術。 Mako 系統整合了 3D 成像和機械手臂,可提高精度並制定針對特定患者的手術計劃。此類設備的引入將在預測期內促進市場的成長。
限制/挑戰
- 監理合規和審批延遲
醫療器材工程產業面臨的最大挑戰之一是滿足複雜而嚴格的監管要求。為了獲得監管部門的批准,醫療器材必須經過嚴格的測試和臨床試驗,以證明其安全性和有效性。該過程可能耗時且昂貴,常常導致產品發布和市場進入的延遲。此外,監管環境也不斷發展,新的法規和標準也不斷出台。這會給製造商帶來額外的挑戰,他們必須隨時了解最新要求並相應地調整其產品。
此外,不同國家的監管環境可能存在很大差異。獲得多個市場的批准可能是一個複雜且昂貴的過程。這可能會阻礙醫療器材的全球分銷並限制市場准入。
- 醫療器材初始成本高
醫療器材成本高是醫療器材工程市場成長的重大障礙。昂貴的材料、複雜的製造流程以及嚴格的監管要求增加了這些設備的總成本。因此,醫療保健提供者(尤其是發展中國家的醫療保健提供者)可能難以負擔先進的醫療技術,從而限制了市場採用。此外,高價格可能會阻礙那些缺乏財力投資研發和遵守監管標準的小型公司的創新。這限制了新技術的可訪問性和可擴展性。
例如,根據美國科學與健康委員會的說法,醫療器材的成本很少被提及。它約佔醫療保健支出的5%,或2017年約為1200億美元。因此,醫療器材的高成本限制了醫療器材工程市場的成長。
醫療器材工程市場範圍
市場根據服務類型和設備類型進行細分。這些細分市場之間的成長將幫助您分析行業中成長微弱的細分市場,並為用戶提供有價值的市場概覽和市場洞察,幫助他們做出策略決策,確定核心市場應用。
服務類型
- 產品創新與設計/工業設計服務
- 原型製作服務
- 電子工程服務
- 軟體開發和測試服務
- 連接和移動服務
- 網路安全服務
- 產品測試服務
- 監理諮詢服務
- 產品支援與維護服務
設備類型
- 診斷影像設備
- 手術設備
- 病人監護設備和維生設備
- 醫療雷射器
- 體外診斷設備
- 其他醫療器材
醫療器材工程市場區域分析
對市場進行分析,並按上述國家、設備類型、服務類型提供市場規模洞察和趨勢。
市場涵蓋的國家有美國、加拿大、墨西哥、德國、法國、英國、荷蘭、瑞士、比利時、俄羅斯、義大利、西班牙、土耳其、歐洲其他地區、中國、日本、印度、韓國、新加坡、馬來西亞、澳洲、泰國、印尼、菲律賓、亞太其他地區、沙烏地阿拉伯、阿聯酋、南非、埃及、以色列、中東和非洲其他地區、巴西、阿根廷以及其他地區南美洲。
由於醫療器材技術的進步和高昂的醫療支出以及主要參與者的存在,北美預計將主導市場。此外,醫療器材的高成本和高採用率預計將進一步推動市場的成長。
由於亞太地區人口快速成長,預計該地區將成為成長最快的地區。政府旨在實現醫療保健產業現代化的措施和投資,以及人們對先進醫療設備益處的認識不斷提高,以及醫療設備新創活動的激增,都促進了市場的擴張。
報告的國家部分還提供了影響個別市場因素以及影響市場當前和未來趨勢的國內市場監管變化。下游和上游價值鏈分析、技術趨勢和波特五力分析、案例研究等數據點是用於預測各國市場情景的一些指標。此外,在對國家數據進行預測分析時,還考慮了全球品牌的存在和可用性及其因來自本地和國內品牌的大量或稀缺的競爭而面臨的挑戰、國內關稅和貿易路線的影響。
醫療器材工程市場佔有率
市場競爭格局提供了競爭對手的詳細資訊。詳細資訊包括公司概況、公司財務狀況、收入、市場潛力、研發投資、新市場計劃、全球影響力、生產基地和設施、生產能力、公司優勢和劣勢、產品發布、產品寬度和廣度、應用優勢。以上提供的數據點僅與公司對市場的關注有關。
在市場上運作的醫療器材工程市場領導者是:
- L&T技術服務有限公司(印度)
- 印孚瑟斯有限公司(印度)
- HCL Technologies Limited(印度)
- Cyient(印度)
- Wipro(印度)
- Tech Mahindra Limited(印度)
- 塔塔諮詢服務有限公司(印度)
- FLEX LTD(美國)
- 凱捷(法國)
- Embien Technologies India Pvt Ltd.(印度)
- Alten集團(法國)
- 埃森哲(愛爾蘭)
- 和諧(波蘭)
- Althea集團(美國)
- 美國醫學研究院
- 薩拉卡解決方案私人有限公司(印度)
- Nemedio公司(LOUSE)
- 胸骨(以色列)
- Medcrypt(美國)
- MCRA有限責任公司(美國)
- 北美科學協會有限責任公司(美國)
- MedQtech(瑞典)
- Veranex(美國)
- Ontogen Medtech LLC(美國)
- Stand Media(美國)
- Simplexity 產品開發(美國)
醫療器材工程市場的最新發展
- 2023 年 11 月,L&T Technology Services Limited (LTTS)(印度)與 NVIDIA Corporation(美國)合作,開發用於醫療設備(特別是內視鏡)的軟體定義架構,旨在提高影像品質和產品可擴展性
- 2023年10月,Alten集團(法國)收購東日本工業大學株式會社(日本)。此次收購支持了 Alten 加強其在日本的工程能力並佔據重要市場份額的策略,從而確立了其作為該地區領先工程服務提供商的地位
- 2022 年 1 月,HCL Technologies Limited(印度)收購了 Starschema(美國),此舉增強了 HCL 的數位工程能力,尤其是在 dassssta 工程方面,並擴大了其在中歐和東歐的影響力
- 2024 年 9 月,英國人體工學顯微鏡和測量系統設計商、製造商和出口商 Vision Engineering 推出了 OPTA,這是一款採用其專利光學立體顯微鏡技術的經濟高效的入門級產品。 OPTA 售價不到 1,200 美元,有三種支架和兩種鏡頭可供選擇,它重新定義了用戶從 Vision Engineering 的圖像品質、人體工學設計和易用性中獲益的切入點。該產品旨在提高影像品質和人體工學,使先進的顯微鏡更容易使用。該類設備的推出推動了醫療器材工程市場的成長
- 2022 年 6 月,西門子醫療推出了 Symbia Pro.specta,這是一款單光子發射電腦斷層掃描/電腦斷層掃描 (SPECT/CT) 系統,具有 CE 標誌和食品藥物監督管理局 (FDA) 批准,具有先進的 SPECT 和 CT 成像技術。其功能包括高達 64 層的低劑量 CT,可提供令人印象深刻的細節,自動 SPECT 運動校正可提供額外的影像清晰度,以及直覺和自動化的工作流程,可引導使用者完成檢查的整個決策過程
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Interactive Data Analysis Dashboard
- Company Analysis Dashboard for high growth potential opportunities
- Research Analyst Access for customization & queries
- Competitor Analysis with Interactive dashboard
- Latest News, Updates & Trend analysis
- Harness the Power of Benchmark Analysis for Comprehensive Competitor Tracking
目录
1. INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL MEDICAL DEVICE ENGINEERING MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2. MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL MEDICAL DEVICE ENGINEERING MARKETSIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.12 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL MEDICAL DEVICE ENGINEERING MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3. MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4. EXECUTIVE SUMMARY
5. PREMIUM INSIGHTS
5.1 PESTEL ANALYSIS
5.2 PORTER’S FIVE FORCES MODEL
6. INDUSTRY INSIGHTS
6.1 MICRO AND MACRO ECONOMIC FACTORS
6.2 PENETRATION AND GROWTH PROSPECT MAPPING
6.3 KEY PRICING STRATEGIES
6.4 INTERVIEWS WITH SPECIALIST
6.5 ANALYIS AND RECOMMENDATION
7. INTELLECTUAL PROPERTY (IP) PORTFOLIO
7.1 PATENT QUALITY AND STRENGTH
7.2 PATENT FAMILIES
7.3 LICENSING AND COLLABORATIONS
7.4 COMPETITIVE LANDSCAPE
7.5 IP STRATEGY AND MANAGEMENT
7.6 OTHER
8. COST ANALYSIS BREAKDOWN
9. TECHNONLOGY ROADMAP
10. INNOVATION TRACKER AND STRATEGIC ANALYSIS
10.1 MAJOR DEALS AND STRATEGIC ALLIANCES ANALYSIS
10.1.1 JOINT VENTURES
10.1.2 MERGERS AND ACQUISITIONS
10.1.3 LICENSING AND PARTNERSHIP
10.1.4 TECHNOLOGY COLLABORATIONS
10.1.5 STRATEGIC DIVESTMENTS
10.2 NUMBER OF PRODUCTS IN DEVELOPMENT
10.3 STAGE OF DEVELOPMENT
10.4 TIMELINES AND MILESTONES
10.5 INNOVATION STRATEGIES AND METHODOLOGIES
10.6 RISK ASSESSMENT AND MITIGATION
10.7 FUTURE OUTLOOK
11. REGULATORY COMPLIANCE
11.1 REGULATORY AUTHORITIES
11.2 REGULATORY CLASSIFICATIONS
11.2.1 CLASS I
11.2.2 CLASS II
11.2.3 CLASS III
11.3 REGULATORY SUBMISSIONS
11.4 INTERNATIONAL HARMONIZATION
11.5 COMPLIANCE AND QUALITY MANAGEMENT SYSTEMS
11.6 REGULATORY CHALLENGES AND STRATEGIES
12. REIMBURSEMENT FRAMEWORK
13. OPPUTUNITY MAP ANALYSIS
14. VALUE CHAIN ANALYSIS
15. HEALTHCARE ECONOMY
15.1 HEALTHCARE EXPENDITURE
15.2 CAPITAL EXPENDITURE
15.3 CAPEX TRENDS
15.4 CAPEX ALLOCATION
15.5 FUNDING SOURCES
15.6 INDUSTRY BENCHMARKS
15.7 GDP RATION IN OVERALL GDP
15.8 HEALTHCARE SYSTEM STRUCTURE
15.9 GOVERNMENT POLICIES
15.10 ECONOMIC DEVELOPMENT
16. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY SERVICE TYPE
16.1 OVERVIEW
16.2 PRODUCT DESIGN & DEVELOPMENT
16.2.1 CONCEPTUALIZATION & IDEATION
16.2.2 INDUSTRIAL & MECHANICAL DESIGN
16.2.3 USER-CENTERED DESIGN (UCD) & ERGONOMICS
16.2.4 MATERIALS & COMPONENT SELECTION
16.2.5 FINITE ELEMENT ANALYSIS (FEA) & SIMULATION
16.2.6 DESIGN FOR MANUFACTURING (DFM)
16.3 PROTOTYPING & TESTING
16.3.1 RAPID PROTOTYPING (3D PRINTING, CNC, INJECTION MOLDING)
16.3.2 MECHANICAL, ELECTRICAL & THERMAL TESTING
16.3.3 PRECLINICAL TESTING & VALIDATION
16.3.4 BIOCOMPATIBILITY & TOXICITY TESTING
16.3.5 FAILURE MODE & EFFECTS ANALYSIS (FMEA)
16.4 MANUFACTURING & SUPPLY CHAIN MANAGEMENT
16.4.1 CONTRACT MANUFACTURING (OEM & ODM)
16.4.2 COMPONENT SOURCING & SUPPLY CHAIN OPTIMIZATION
16.4.3 CLEANROOM & STERILE MANUFACTURING
16.4.4 LEAN MANUFACTURING & SIX SIGMA PRACTICES
16.4.5 QUALITY CONTROL & ASSURANCE (ISO 13485, GMP)
16.5 REGULATORY COMPLIANCE & CONSULTING
16.5.1 RISK MANAGEMENT & SAFETY ASSESSMENTS
16.5.2 CLINICAL & REGULATORY STRATEGY CONSULTING
16.5.3 REGULATORY SUBMISSIONS (FDA, CE MARKING, ISO CERTIFICATION)
16.5.4 POST-MARKET SURVEILLANCE & COMPLIANCE AUDITS
16.5.5 LEGAL & ETHICAL CONSIDERATIONS
16.6 EMBEDDED SYSTEMS & SOFTWARE DEVELOPMENT
16.7 OTHER
17. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY DEVICE TYPE
17.1 OVERVIEW
(NOTE: MARKET VALUE, VOLUME AND ASP ANALYSIS WOULD BE PROVIDED FOR ALL SEGMENTS AND SUB-SEGMENTS OF PRODUCT)
17.2 DIAGNOSTIC DEVICES
17.2.1 IMAGING SYSTEMS
17.2.1.1. MAGNETIC RESONANCE IMAGING (MRI)
17.2.1.1.1. OPEN MRI
17.2.1.1.2. CLOSED MRI
17.2.1.2. COMPUTED TOMOGRAPHY (CT) SCANNERS
17.2.1.2.1. LOW-SLICE CT (1-16 SLICES)
17.2.1.2.2. MID-SLICE CT (32-64 SLICES)
17.2.1.2.3. HIGH-SLICE CT (128+ SLICES)
17.2.1.2.4. CONE BEAM CT (CBCT)
17.2.1.2.5. SPECTRAL CT
17.2.1.3. ULTRASOUND DEVICES
17.2.1.3.1. 2D ULTRASOUND
17.2.1.3.2. 3D/4D ULTRASOUND
17.2.1.3.3. DOPPLER ULTRASOUND
17.2.1.3.4. PORTABLE & HANDHELD ULTRASOUND
17.2.1.3.5. HIGH-INTENSITY FOCUSED ULTRASOUND (HIFU)
17.2.1.4. X-RAY SYSTEMS
17.2.1.4.1. ANALOG X-RAY
17.2.1.4.2. DIGITAL RADIOGRAPHY (DR)
17.2.1.4.3. COMPUTED RADIOGRAPHY (CR)
17.2.1.4.4. FLUOROSCOPY SYSTEMS
17.2.1.5. POSITRON EMISSION TOMOGRAPHY (PET) SCANNERS
17.2.1.5.1. PET-CT SYSTEMS
17.2.1.5.2. PET-MRI SYSTEMS
17.2.1.5.3. STANDALONE PET SCANNERS
17.2.2 IN-VITRO DIAGNOSTIC (IVD) EQUIPMENT
17.2.2.1. MOLECULAR DIAGNOSTICS
17.2.2.1.1. POLYMERASE CHAIN REACTION (PCR)
17.2.2.1.2. NEXT-GENERATION SEQUENCING (NGS)
17.2.2.1.3. DNA MICROARRAYS
17.2.2.1.4. ISOTHERMAL NUCLEIC ACID AMPLIFICATION
17.2.2.2. IMMUNOASSAYS
17.2.2.2.1. ENZYME-LINKED IMMUNOSORBENT ASSAY (ELISA)
17.2.2.2.2. CHEMILUMINESCENCE IMMUNOASSAY (CLIA)
17.2.2.2.3. RADIOIMMUNOASSAY (RIA)
17.2.2.3. HEMATOLOGY ANALYZERS
17.2.2.3.1. 3-PART HEMATOLOGY ANALYZERS
17.2.2.3.2. 5-PART HEMATOLOGY ANALYZERS
17.2.2.3.3. POINT-OF-CARE HEMATOLOGY DEVICES
17.2.2.4. POINT-OF-CARE TESTING DEVICES
17.2.2.4.1. GLUCOSE MONITORING SYSTEMS
17.2.2.4.2. RAPID ANTIGEN/ANTIBODY TESTS
17.2.2.4.3. HOME PREGNANCY & FERTILITY KITS
17.2.2.4.4. INFECTIOUS DISEASE RAPID TESTS
17.3 THERAPEUTIC DEVICES
17.3.1 SURGICAL INSTRUMENTS & ROBOTICS
17.3.1.1. MINIMALLY INVASIVE SURGERY (MIS) DEVICES
17.3.1.1.1. LAPAROSCOPIC INSTRUMENTS
17.3.1.1.2. ENDOSCOPIC INSTRUMENTS
17.3.1.1.3. ARTHROSCOPIC DEVICES
17.3.1.1.4. ROBOTIC-ASSISTED MIS SYSTEMS
17.3.1.2. ROBOT-ASSISTED SURGERY (RAS) SYSTEMS
17.3.1.2.1. ORTHOPEDIC SURGERY ROBOTS
17.3.1.2.2. NEUROSURGERY ROBOTS
17.3.1.2.3. UROLOGY & GYNECOLOGY SURGERY ROBOTS
17.3.2 IMPLANTABLE MEDICAL DEVICES
17.3.2.1. ORTHOPEDIC IMPLANTS
17.3.2.1.1. HIP IMPLANTS
17.3.2.1.2. KNEE IMPLANTS
17.3.2.1.3. SPINAL IMPLANTS
17.3.2.1.4. TRAUMA FIXATION DEVICES
17.3.2.2. CARDIOVASCULAR IMPLANTS
17.3.2.2.1. PACEMAKERS
17.3.2.2.2. IMPLANTABLE CARDIOVERTER DEFIBRILLATORS (ICDS)
17.3.2.2.3. HEART VALVES
17.3.2.2.4. CORONARY & PERIPHERAL STENTS
17.3.2.3. NEUROSTIMULATION DEVICES
17.3.2.3.1. DEEP BRAIN STIMULATORS (DBS)
17.3.2.3.2. SPINAL CORD STIMULATORS (SCS)
17.3.2.3.3. VAGUS NERVE STIMULATORS (VNS)
17.3.2.3.4. SACRAL NERVE STIMULATORS
17.3.2.4. COCHLEAR & AUDITORY IMPLANTS
17.3.2.4.1. COCHLEAR IMPLANTS
17.3.2.4.2. BONE-ANCHORED HEARING AIDS (BAHA)
17.3.3 DRUG DELIVERY SYSTEMS
17.3.3.1. SMART INFUSION PUMPS
17.3.3.1.1. LARGE VOLUME PUMPS (LVP)
17.3.3.1.2. SYRINGE INFUSION PUMPS
17.3.3.1.3. PATIENT-CONTROLLED ANALGESIA (PCA) PUMPS
17.3.3.1.4. INSULIN PUMPS
17.3.3.2. SMART INHALERS
17.3.3.2.1. METERED-DOSE INHALERS (MDIS)
17.3.3.2.2. DRY POWDER INHALERS (DPIS)
17.3.3.2.3. NEBULIZERS
17.4 PATIENT MONITORING DEVICES
17.4.1 WEARABLE MEDICAL DEVICES
17.4.1.1. SMARTWATCHES & FITNESS TRACKERS
17.4.1.1.1. HEART RATE MONITORING
17.4.1.1.2. BLOOD OXYGEN (SPO2) MONITORING
17.4.1.1.3. ECG MONITORING
17.4.1.2. CONTINUOUS GLUCOSE MONITORS (CGM)
17.4.1.2.1. REAL-TIME CGM (RTCGM)
17.4.1.2.2. INTERMITTENTLY SCANNED CGM (ISCGM)
17.4.2 REMOTE PATIENT MONITORING (RPM) SYSTEMS
17.4.2.1. CARDIAC MONITORING DEVICES
17.4.2.1.1. HOLTER MONITORS
17.4.2.1.2. IMPLANTABLE LOOP RECORDERS
17.4.2.1.3. WIRELESS ECG
17.4.2.2. RESPIRATORY MONITORING DEVICES
17.4.2.2.1. PULSE OXIMETERS
17.4.2.2.2. CAPNOGRAPHY SYSTEMS
17.4.2.3. NEUROLOGICAL MONITORING DEVICES
17.4.2.3.1. EEG MONITORS
17.4.2.3.2. ELECTROMYOGRAPHY (EMG) DEVICES
17.5 HEALTHCARE IT & DIGITAL HEALTH SOLUTIONS
17.5.1 TELEMEDICINE PLATFORMS
17.5.1.1. VIDEO CONSULTATION PLATFORMS
17.5.1.1.1. GENERAL TELECONSULTATION
17.5.1.1.2. TELEPSYCHIATRY
17.5.1.1.3. TELEDERMATOLOGY
17.5.1.1.4. TELENEUROLOGY
17.5.1.2. REMOTE PATIENT MANAGEMENT SYSTEMS
17.5.1.2.1. MOBILE HEALTH APPS
17.5.1.2.2. AI-BASED SYMPTOM CHECKERS
17.5.2 ELECTRONIC HEALTH RECORDS (EHR)
17.5.2.1. CLOUD-BASED EHR
17.5.2.2. ON-PREMISE EHR
17.5.2.3. AI-DRIVEN EHR SYSTEMS
17.5.3 AI-BASED DIAGNOSTIC & DECISION-SUPPORT TOOLS
17.5.3.1. AI IN RADIOLOGY & IMAGING
17.5.3.2. AI IN PATHOLOGY
17.5.3.3. AI FOR HISTOPATHOLOGICAL IMAGE ANALYSIS
17.5.3.4. AUTOMATED CYTOLOGY ANALYSIS
17.6 OTHERS
18. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY APPLICATION
18.1 OVERVIEW
18.2 CARDIOVASCULAR
18.3 ORTHOPEDICS
18.4 NEUROLOGY
18.5 ONCOLOGY
18.6 RESPIRATORY
18.7 GENERAL SURGERY
18.8 OPHTHALMOLOGY
18.9 DENTAL
18.10 OTHERS
19. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY END USER
19.1 OVERVIEW
19.2 MEDICAL DEVICE MANUFACTURERS
19.3 CONTRACT MANUFACTURING ORGANIZATIONS (CMOS) & CONTRACT DEVELOPMENT AND MANUFACTURING ORGANIZATIONS (CDMOS)
19.4 HOSPITALS & HEALTHCARE PROVIDERS
19.5 REMOTE PATIENT MONITORING PROVIDERS
19.6 REGULATORY & COMPLIANCE BODIES
19.7 OTHERS
20. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, BY COUNTRY
GLOBAL MEDICAL DEVICE ENGINEERING MARKET (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
20.1 NORTH AMERICA
20.1.1 U.S.
20.1.2 CANADA
20.1.3 MEXICO
20.2 EUROPE
20.2.1 GERMANY
20.2.2 U.K.
20.2.3 ITALY
20.2.4 FRANCE
20.2.5 SPAIN
20.2.6 RUSSIA
20.2.7 SWITZERLAND
20.2.8 TURKEY
20.2.9 BELGIUM
20.2.10 NETHERLANDS
20.2.11 DENMARK
20.2.12 SWEDEN
20.2.13 POLAND
20.2.14 NORWAY
20.2.15 FINLAND
20.2.16 REST OF EUROPE
20.3 ASIA-PACIFIC
20.3.1 JAPAN
20.3.2 CHINA
20.3.3 SOUTH KOREA
20.3.4 INDIA
20.3.5 SINGAPORE
20.3.6 THAILAND
20.3.7 INDONESIA
20.3.8 MALAYSIA
20.3.9 PHILIPPINES
20.3.10 AUSTRALIA
20.3.11 NEW ZEALAND
20.3.12 VIETNAM
20.3.13 TAIWAN
20.3.14 REST OF ASIA-PACIFIC
20.4 SOUTH AMERICA
20.4.1 BRAZIL
20.4.2 ARGENTINA
20.4.3 REST OF SOUTH AMERICA
20.5 MIDDLE EAST AND AFRICA
20.5.1 SOUTH AFRICA
20.5.2 EGYPT
20.5.3 BAHRAIN
20.5.4 UNITED ARAB EMIRATES
20.5.5 KUWAIT
20.5.6 OMAN
20.5.7 QATAR
20.5.8 SAUDI ARABIA
20.5.9 REST OF MEA
20.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
21. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, SWOT AND DBMR ANALYSIS
22. GLOBAL MEDICAL DEVICE ENGINEERING MARKET, COMPANY PROFILE
22.1 3M HEALTH CARE
22.1.1 COMPANY OVERVIEW
22.1.2 REVENUE ANALYSIS
22.1.3 GEOGRAPHIC PRESENCE
22.1.4 PRODUCT PORTFOLIO
22.1.5 RECENT DEVELOPMENTS
22.2 ABBOTT LABORATORIES
22.2.1 COMPANY OVERVIEW
22.2.2 REVENUE ANALYSIS
22.2.3 GEOGRAPHIC PRESENCE
22.2.4 PRODUCT PORTFOLIO
22.2.5 RECENT DEVELOPMENTS
22.3 BAXTER INTERNATIONAL
22.3.1 COMPANY OVERVIEW
22.3.2 REVENUE ANALYSIS
22.3.3 GEOGRAPHIC PRESENCE
22.3.4 PRODUCT PORTFOLIO
22.3.5 RECENT DEVELOPMENTS
22.4 BECTON DICKINSON COMPANY
22.4.1 COMPANY OVERVIEW
22.4.2 REVENUE ANALYSIS
22.4.3 GEOGRAPHIC PRESENCE
22.4.4 PRODUCT PORTFOLIO
22.4.5 RECENT DEVELOPMENTS
22.5 BOSTON SCIENTIFIC CORPORATION
22.5.1 COMPANY OVERVIEW
22.5.2 REVENUE ANALYSIS
22.5.3 GEOGRAPHIC PRESENCE
22.5.4 PRODUCT PORTFOLIO
22.5.5 RECENT DEVELOPMENTS
22.6 CANON MEDICAL SYSTEMS CORPORATION
22.6.1 COMPANY OVERVIEW
22.6.2 REVENUE ANALYSIS
22.6.3 GEOGRAPHIC PRESENCE
22.6.4 PRODUCT PORTFOLIO
22.6.5 RECENT DEVELOPMENTS
22.7 CARDINAL HEALTH
22.7.1 COMPANY OVERVIEW
22.7.2 REVENUE ANALYSIS
22.7.3 GEOGRAPHIC PRESENCE
22.7.4 PRODUCT PORTFOLIO
22.7.5 RECENT DEVELOPMENTS
22.8 DANAHER CORPORATION
22.8.1 COMPANY OVERVIEW
22.8.2 REVENUE ANALYSIS
22.8.3 GEOGRAPHIC PRESENCE
22.8.4 PRODUCT PORTFOLIO
22.8.5 RECENT DEVELOPMENTS
22.9 FRESENIUS MEDICAL CARE
22.9.1 COMPANY OVERVIEW
22.9.2 REVENUE ANALYSIS
22.9.3 GEOGRAPHIC PRESENCE
22.9.4 PRODUCT PORTFOLIO
22.9.5 RECENT DEVELOPMENTS
22.10 GE HEALTHCARE
22.10.1 COMPANY OVERVIEW
22.10.2 REVENUE ANALYSIS
22.10.3 GEOGRAPHIC PRESENCE
22.10.4 PRODUCT PORTFOLIO
22.10.5 RECENT DEVELOPMENTS
22.11 HOLOGIC, INC.
22.11.1 COMPANY OVERVIEW
22.11.2 REVENUE ANALYSIS
22.11.3 GEOGRAPHIC PRESENCE
22.11.4 PRODUCT PORTFOLIO
22.11.5 RECENT DEVELOPMENTS
22.12 INTUITIVE SURGICAL
22.12.1 COMPANY OVERVIEW
22.12.2 REVENUE ANALYSIS
22.12.3 GEOGRAPHIC PRESENCE
22.12.4 PRODUCT PORTFOLIO
22.12.5 RECENT DEVELOPMENTS
22.13 JOHNSON & JOHNSON
22.13.1 COMPANY OVERVIEW
22.13.2 REVENUE ANALYSIS
22.13.3 GEOGRAPHIC PRESENCE
22.13.4 PRODUCT PORTFOLIO
22.13.5 RECENT DEVELOPMENTS
22.14 MEDTRONIC PLC
22.14.1 COMPANY OVERVIEW
22.14.2 REVENUE ANALYSIS
22.14.3 GEOGRAPHIC PRESENCE
22.14.4 PRODUCT PORTFOLIO
22.14.5 RECENT DEVELOPMENTS
22.15 PHILIPS HEALTHCARE
22.15.1 COMPANY OVERVIEW
22.15.2 REVENUE ANALYSIS
22.15.3 GEOGRAPHIC PRESENCE
22.15.4 PRODUCT PORTFOLIO
22.15.5 RECENT DEVELOPMENTS
22.16 RESMED INC.
22.16.1 COMPANY OVERVIEW
22.16.2 REVENUE ANALYSIS
22.16.3 GEOGRAPHIC PRESENCE
22.16.4 PRODUCT PORTFOLIO
22.16.5 RECENT DEVELOPMENTS
22.17 ROCHE DIAGNOSTICS INTERNATIONAL LTD
22.17.1 COMPANY OVERVIEW
22.17.2 REVENUE ANALYSIS
22.17.3 GEOGRAPHIC PRESENCE
22.17.4 PRODUCT PORTFOLIO
22.17.5 RECENT DEVELOPMENTS
22.18 SIEMENS HEALTHINEERS AG
22.18.1 COMPANY OVERVIEW
22.18.2 REVENUE ANALYSIS
22.18.3 GEOGRAPHIC PRESENCE
22.18.4 PRODUCT PORTFOLIO
22.18.5 RECENT DEVELOPMENTS
22.19 SMITH & NEPHEW PLC.
22.19.1 COMPANY OVERVIEW
22.19.2 REVENUE ANALYSIS
22.19.3 GEOGRAPHIC PRESENCE
22.19.4 PRODUCT PORTFOLIO
22.19.5 RECENT DEVELOPMENTS
22.20 STRYKER CORPORATION
22.20.1 COMPANY OVERVIEW
22.20.2 REVENUE ANALYSIS
22.20.3 GEOGRAPHIC PRESENCE
22.20.4 PRODUCT PORTFOLIO
22.20.5 RECENT DEVELOPMENTS
22.21 TERUMO CORPORATION
22.21.1 COMPANY OVERVIEW
22.21.2 REVENUE ANALYSIS
22.21.3 GEOGRAPHIC PRESENCE
22.21.4 PRODUCT PORTFOLIO
22.21.5 RECENT DEVELOPMENTS
22.22 THERMO FISHER SCIENTIFIC, INC.
22.22.1 COMPANY OVERVIEW
22.22.2 REVENUE ANALYSIS
22.22.3 GEOGRAPHIC PRESENCE
22.22.4 PRODUCT PORTFOLIO
22.22.5 RECENT DEVELOPMENTS
22.23 ZIMMER BIOMET HOLDINGS, INC.
22.23.1 COMPANY OVERVIEW
22.23.2 REVENUE ANALYSIS
22.23.3 GEOGRAPHIC PRESENCE
22.23.4 PRODUCT PORTFOLIO
22.23.5 RECENT DEVELOPMENTS
22.24 FLEX HEALTH SOLUTIONS
22.24.1 COMPANY OVERVIEW
22.24.2 REVENUE ANALYSIS
22.24.3 GEOGRAPHIC PRESENCE
22.24.4 PRODUCT PORTFOLIO
22.24.5 RECENT DEVELOPMENTS
22.25 JABIL HEALTHCARE
22.25.1 COMPANY OVERVIEW
22.25.2 REVENUE ANALYSIS
22.25.3 GEOGRAPHIC PRESENCE
22.25.4 PRODUCT PORTFOLIO
22.25.5 RECENT DEVELOPMENTS
22.26 SANMINA CORPORATION
22.26.1 COMPANY OVERVIEW
22.26.2 REVENUE ANALYSIS
22.26.3 GEOGRAPHIC PRESENCE
22.26.4 PRODUCT PORTFOLIO
22.26.5 RECENT DEVELOPMENTS
22.27 CELESTICA HEALTHTECH
22.27.1 COMPANY OVERVIEW
22.27.2 REVENUE ANALYSIS
22.27.3 GEOGRAPHIC PRESENCE
22.27.4 PRODUCT PORTFOLIO
22.27.5 RECENT DEVELOPMENTS
22.28 INTEGER HOLDINGS CORPORATION
22.28.1 COMPANY OVERVIEW
22.28.2 REVENUE ANALYSIS
22.28.3 GEOGRAPHIC PRESENCE
22.28.4 PRODUCT PORTFOLIO
22.28.5 RECENT DEVELOPMENTS
RECENT DEVELOPMENTS NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST RELATED REPORTS
23. RELATED REPORTS
24. CONCLUSION
25. QUESTIONNAIRE
26. ABOUT DATA BRIDGE MARKET RESEARCH
研究方法
数据收集和基准年分析是使用具有大样本量的数据收集模块完成的。该阶段包括通过各种来源和策略获取市场信息或相关数据。它包括提前检查和规划从过去获得的所有数据。它同样包括检查不同信息源中出现的信息不一致。使用市场统计和连贯模型分析和估计市场数据。此外,市场份额分析和关键趋势分析是市场报告中的主要成功因素。要了解更多信息,请请求分析师致电或下拉您的询问。
DBMR 研究团队使用的关键研究方法是数据三角测量,其中包括数据挖掘、数据变量对市场影响的分析和主要(行业专家)验证。数据模型包括供应商定位网格、市场时间线分析、市场概览和指南、公司定位网格、专利分析、定价分析、公司市场份额分析、测量标准、全球与区域和供应商份额分析。要了解有关研究方法的更多信息,请向我们的行业专家咨询。
可定制
Data Bridge Market Research 是高级形成性研究领域的领导者。我们为向现有和新客户提供符合其目标的数据和分析而感到自豪。报告可定制,包括目标品牌的价格趋势分析、了解其他国家的市场(索取国家列表)、临床试验结果数据、文献综述、翻新市场和产品基础分析。目标竞争对手的市场分析可以从基于技术的分析到市场组合策略进行分析。我们可以按照您所需的格式和数据样式添加您需要的任意数量的竞争对手数据。我们的分析师团队还可以为您提供原始 Excel 文件数据透视表(事实手册)中的数据,或者可以帮助您根据报告中的数据集创建演示文稿。