Global Neuromyelitis Optica Treatment Market
市场规模(十亿美元)
CAGR :
% 
 USD
297.72 Million
USD
503.94 Million
2024
2032
USD
297.72 Million
USD
503.94 Million
2024
2032
| 2025 –2032 | |
| USD 297.72 Million | |
| USD 503.94 Million | |
|
|
|
|
全球視神經脊髓炎治療市場細分,按類型(伴有水通道蛋白4抗體的視神經脊髓炎譜系障礙和不伴有水通道蛋白4抗體的視神經脊髓炎譜系障礙)、治療類型(藥物治療、血漿置換療法和免疫球蛋白療法)、藥物(C5蛋白抑制劑、口服皮質類固醇、非類固醇類免疫抑制劑及其他、診療中心、診所
視神經脊髓炎治療市場分析
由於視神經脊髓炎譜系障礙(NMSD)盛行率不斷上升以及治療方案的不斷進步,NMSD治療市場正蓬勃發展。 NMSD是一種罕見的自體免疫疾病,其特徵是視神經和脊髓嚴重炎症,導致視力喪失和殘疾。近期市場發展主要集中在針對該疾病潛在病理生理機制的標靶治療上,包括抑制發炎過程中關鍵蛋白的單株抗體。醫療專業人員和患者對NMSD的認識不斷提高,推動了對有效治療方案的需求。此外,正在進行的臨床試驗和研究正在拓展潛在療法的研發管線,有望改善病患的治療效果。隨著對該疾病的認知不斷深入,市場有望實現顯著成長,為製藥公司和醫療服務提供者開發針對患者需求的創新解決方案提供了機會。
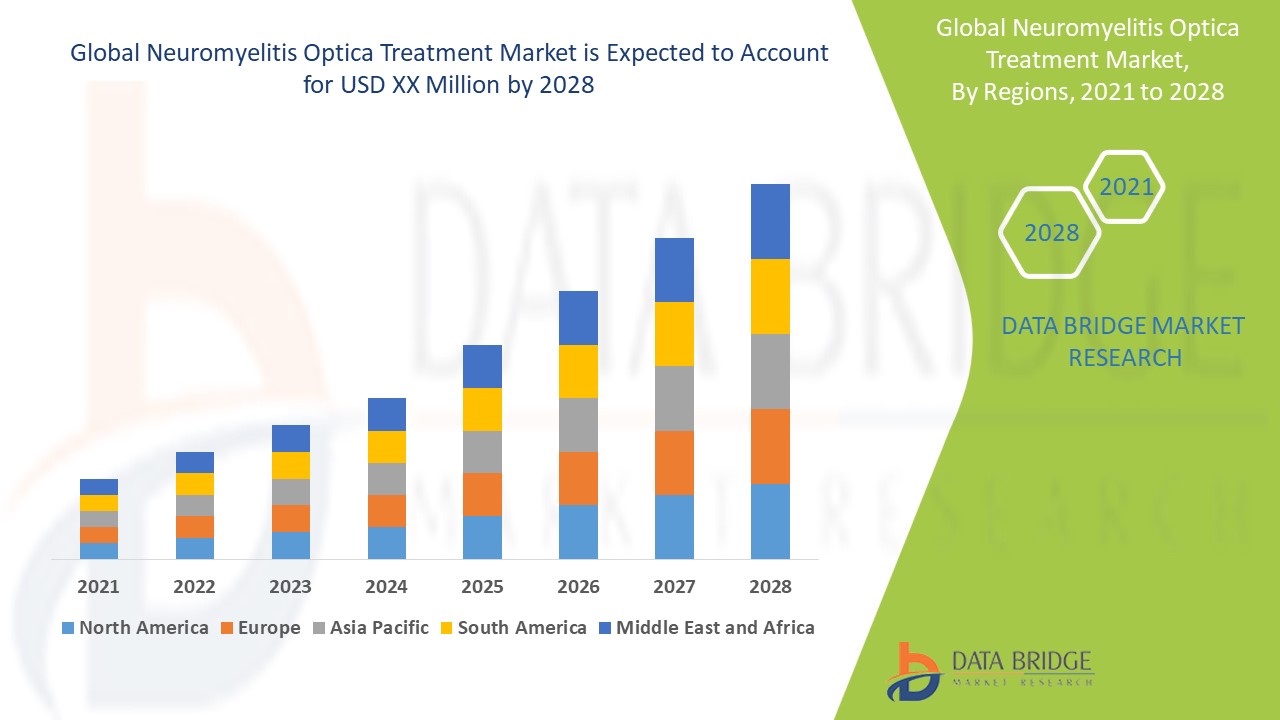
視神經脊髓炎治療市場規模
2024年全球視神經脊髓炎治療市場規模為2.9772億美元,預計到2032年將達到5.0394億美元,2025年至2032年預測期內的複合年增長率為6.80%。除了市場價值、成長率、市場區隔、地理覆蓋範圍和主要參與者等市場概況外,Data Bridge Market Research發布的市場報告還包括深入的專家分析、病患流行病學、研發管線分析、定價分析和監管架構。
視神經脊髓炎治療市場趨勢
“標靶療法的開發”
視神經脊髓炎治療市場正迅速發展,這主要得益於治療方法的創新和研究投入的增加。一個顯著的趨勢是標靶療法的開發,特別是單株抗體,這些療法旨在特異性地抑制與視神經脊髓炎譜系障礙相關的發炎過程。這些進展提高了治療的有效性和安全性,為改善患者預後帶來了希望。此外,精準醫療的整合也日益普及,使得基於個別病患特徵制定個人化治療方案成為可能。隨著人們對這種疾病的認識不斷提高,以及更多臨床試驗的啟動,預計該市場將迎來顯著增長,這體現了人們致力於改善受這種疾病影響的患者的護理品質的決心。
報告範圍及視神經脊髓炎治療市場細分
|
屬性 |
視神經脊髓炎治療關鍵市場洞察 |
|
涵蓋的領域 |
|
|
覆蓋國家/地區 |
北美洲的美國、加拿大和墨西哥;歐洲的德國、法國、英國、荷蘭、瑞士、比利時、俄羅斯、義大利、西班牙、土耳其和歐洲其他地區;亞太地區的中國、日本、印度、韓國、新加坡、馬來西亞、澳洲、泰國、印尼、菲律賓和亞太其他地區;中東和非洲地區的沙烏地阿拉伯、阿聯酋、南非、埃及、以色列和中東其他地區; |
|
主要市場參與者 |
F. Hoffmann-La Roche Ltd(瑞士)、AstraZeneca(英國)、Teva Pharmaceutical Industries Ltd.(以色列)、Alexion Pharmaceuticals, Inc(美國)、Viela Bio(美國)、Ancevil Biosciences(美國)、Opexa Therapeutics, Inc(美國)、Arrien Pharmaceuvil Biosciences(美國)、Opexa Therapeutics, Inc(美國)、Arrien Pharmaceuvil Biosciences(美國)、Opexa Therapeutics, Inc(美國)、Arrien Pharmaceuvil Biosciences LLC(美國) |
|
市場機遇 |
|
|
加值資料資訊集 |
除了對市場狀況(如市場價值、成長率、細分、地理覆蓋範圍和主要參與者)的洞察之外,Data Bridge Market Research 精心編制的市場報告還包括深入的專家分析、患者流行病學、產品線分析、定價分析和監管框架。 |
視神經脊髓炎治療市場定義
視神經脊髓炎的治療包括旨在控制視神經脊髓炎譜系障礙的醫療幹預措施,這是一種自體免疫疾病,會導致視神經和脊髓發炎。治療通常包括免疫抑制劑、單株抗體、皮質類固醇和血漿置換療法,重點在於減輕發炎、緩解症狀、預防復發和保護神經功能,從而提高患者的生活品質。
視神經脊髓炎治療市場動態
司機
- 視神經脊髓炎發生率不斷上升
視神經脊髓炎譜系障礙的日益普遍顯著增加了對有效治療方案的需求,從而推動了市場成長。隨著人們對這種罕見自體免疫疾病的認識不斷提高,越來越多的患者被診斷出並尋求醫療幹預以控制症狀、改善生活品質。發病率的上升迫切需要開發和推廣標靶療法和創新治療方案。醫療服務提供者日益認識到及時有效管理該疾病的重要性,從而擴大了治療方案的市場。因此,製藥公司更有動力加大研發投入,以滿足患者不斷增長的需求,進一步推動市場成長。
- 研究和臨床試驗的增加
正在進行的臨床試驗和研究計畫對於拓展視神經脊髓炎譜系障礙潛在療法的研發管線至關重要,從而推動了治療市場的發展。這些努力致力於開發創新且具有標靶性的療法,以應對疾病的獨特挑戰,並顯著改善患者的治療效果。隨著新療法從臨床試驗中脫穎而出,它們為傳統治療方案提供了極具前景的替代方案,提高了整體治療策略的療效和安全性。此外,不斷增加的研究投入凸顯了製藥公司和研究人員致力於加深對視神經脊髓炎的理解,創造了一個鼓勵探索新型治療方法並進一步刺激市場成長的積極環境。
機會
- 遠距醫療的興起
遠距醫療的興起為提升視神經脊髓炎譜系障礙患者獲得專科醫生診療的機會,並促進遠距監測提供了重要契機。透過利用遠距醫療平台,患者足不出戶即可輕鬆諮詢神經科醫生和其他醫療專業人員,從而消除出行和時間安排方面的障礙。這種便捷性的提升使得及時幹預和定期追蹤成為可能,這對有效控制病情至關重要。此外,遠端監測技術使醫療服務提供者能夠即時追蹤患者的健康數據,從而實現個人化治療方案的調整和症狀的主動管理。因此,將遠距醫療應用於視神經脊髓炎的診療,不僅能改善病患的治療效果,還能拓展創新醫療解決方案的市場潛力。
- 開發新型創新療法
針對視神經脊髓炎譜系障礙的潛在機制,開發新型創新療法(例如單株抗體和小分子藥物)具有巨大的潛力。這些先進療法能夠從根本解決疾病問題,從而提供更有效的治療方案,並有望顯著改善患者的預後。對視神經脊髓炎病理生理學的深入理解,為靶向幹預措施鋪平了道路,這些幹預措施可以降低疾病活動度並預防復發。此外,隨著研究不斷發現新的治療途徑,製藥公司更有動力投資開發這些前景廣闊的療法,從而擴大市場份額,滿足患者不斷變化的需求。這種創新不僅豐富了治療選擇,也有助於實現更個人化的視神經脊髓炎治療方案。
限制/挑戰
- 競爭性治療方案
自體免疫疾病替代療法的存在,對視神經脊髓炎譜系障礙的治療構成了重大挑戰。其他自體免疫疾病的成熟療法可能會掩蓋視神經脊髓炎療法的光芒,使得更新、潛在更有效的療法難以獲得市場份額。醫生通常優先選擇療效確切的常用療法,導致他們對採用視神經脊髓炎的新療法猶豫不決。這種競爭可能導致人們對視神經脊髓炎療法的益處和獨特作用機制了解有限,最終影響患者獲得治療的機會,並降低製藥公司在該領域進行研發投入的動力。因此,儘管市場對有效的治療方案有著迫切的需求,但視神經脊髓炎市場仍難以充分發揮其潛力。
- 治療費用高昂
創新療法(例如單株抗體)的高昂費用對視神經脊髓炎治療市場構成了相當大的限制。這些先進療法通常價格昂貴,這會限制患者的就醫機會,尤其是在醫療預算緊張的地區。許多醫療服務提供者可能因為擔心患者無法負擔費用或缺乏醫療保險而猶豫是否開立這些昂貴的治療方案。這種經濟障礙會影響患者的治療順從性,加劇醫療資源分配不均,最終阻礙視神經脊髓炎譜系障礙治療策略的整體有效性。因此,創新療法的高昂成本仍然是限制市場成長和病患照護的關鍵挑戰。
本市場報告詳細介紹了近期新發展動態、貿易法規、進出口分析、生產分析、價值鏈優化、市場份額、國內外市場參與者的影響、新興收入來源的機會分析、市場法規變化、戰略市場增長分析、市場規模、各品類市場增長、應用領域及主導地位、產品認證、產品發布、地域擴張以及市場技術創新。如需了解更多市場信息,請聯繫 Data Bridge Market Research 獲取分析師簡報,我們的團隊將協助您做出明智的市場決策,實現市場成長。
視神經脊髓炎治療市場範圍
市場按治療類型、藥物、給藥途徑和最終用戶進行細分。這些細分市場的成長將有助於您分析行業中成長緩慢的細分市場,並為用戶提供有價值的市場概覽和市場洞察,以幫助他們制定策略決策,從而確定核心市場應用。
類型
- 視神經脊髓炎譜系障礙伴隨水通道蛋白4抗體
- 視神經脊髓炎譜系障礙(無水通道蛋白4抗體)
治療類型
- 藥物
- 血漿置換療法
- 免疫球蛋白療法
藥物
- C5蛋白抑制劑
- 口服皮質類固醇
- 非類固醇類免疫抑制劑
- 其他的
給藥途徑
- 口服
- 注射劑
最終用戶
- 醫院
- 居家照護
- 專科診所
- 其他的
視神經脊髓炎治療市場區域分析
如上所述,對市場進行分析,並按國家、治療類型、藥物、給藥途徑和最終用戶提供市場規模洞察和趨勢。
本市場報告涵蓋的國家包括:北美洲的美國、加拿大和墨西哥;歐洲的德國、法國、英國、荷蘭、瑞士、比利時、俄羅斯、義大利、西班牙、土耳其和歐洲其他地區;亞太地區的中國、日本、印度、韓國、新加坡、馬來西亞、澳洲、泰國、印尼、菲律賓和亞太地區其他地區;中東和非洲地區的沙烏地阿拉伯、阿聯酋、南非、其他地區、以色列和其他非洲歐洲地區的其他地區;
北美在視神經脊髓炎治療市場佔據領先地位,這主要得益於人們對早期診斷和治療方案重要性的認識不斷提高。醫療專業人員和患者日益增長的這種認知,創造了有利於新產品上市和治療方法進步的環境。因此,該地區在視神經脊髓炎譜系障礙有效療法的開發和普及方面,持續鞏固其關鍵地位。
預計2025年至2032年間,亞太地區將經歷顯著成長,這主要歸因於視神經脊髓炎譜系障礙患者群體的不斷擴大。病例的增加促使人們對有效的治療方案和醫療保健服務的需求日益增長。隨著人們對該疾病的認識不斷提高,醫療服務的可近性不斷增強,該地區有望成為視神經脊髓炎治療的重要市場。
報告的國別部分還提供了影響各個市場的因素以及國內市場監管變化,這些因素和變化會影響市場的當前和未來趨勢。下游和上游價值鏈分析、技術趨勢和波特五力分析、案例研究等數據點是預測各國市場前景的基礎。此外,在進行國別數據預測分析時,還會考慮全球品牌的市場佔有率和可用性,以及它們因本地品牌競爭激烈或稀缺而面臨的挑戰,以及國內關稅和貿易路線的影響。
視神經脊髓炎治療市佔率
市場競爭格局部分按競爭對手提供詳細信息,包括公司概況、財務狀況、收入、市場潛力、研發投入、新市場拓展計劃、全球佈局、生產基地及設施、產能、公司優勢與劣勢、產品發布、產品線寬度與廣度以及應用領域優勢。以上數據僅與各公司在市場上的業務重點相關。
視神經脊髓炎治療市場的主要參與者包括:
- F. Hoffmann-La Roche Ltd(瑞士)
- 阿斯特捷利康(英國)
- 梯瓦製藥工業股份有限公司(以色列)
- Alexion Pharmaceuticals, Inc (美國)
- Viela Bio(美國)
- Anvil Biosciences(美國)
- Opexa Therapeutics, Inc (美國)
- Arrien Pharmaceuticals, LLC(美國)
- TG Therapeutics, Inc(美國)
- Bionure(西班牙)
視神經脊髓炎治療市場最新進展
- 2024年3月,阿斯特捷利康的Ultomiris(ravulizumab-cwvz)獲得美國食品藥物管理局(FDA)批准,用於治療視神經脊髓炎譜系障礙(NMOSD)。 NMOSD是一種罕見的自體免疫疾病,據估計,美國約有6,000名成年人患有此病。此次獲準標誌著NMOSD患者的治療選擇取得了重大進展。阿斯特捷利康希望透過提供針對NMOSD的標靶治療,改善這項醫療資源匱乏族群的治療效果和生活品質。
- 2024年3月,阿斯特捷利康旗下的Alexion公司宣布,其藥物Ultomiris獲批第四項適應症,用於治療視神經脊髓炎譜系障礙(NMSD),這是一種罕見的自體免疫疾病。這項里程碑式的進展凸顯了Ultomiris在治療多種嚴重自體免疫疾病方面日益增強的適應性。阿斯特捷利康希望透過這項新適應症,為患有此種棘手疾病的患者提供更多治療選擇,進而改善他們的健康狀況。
- 2023年10月,安進公司發表了N-MOmentum III期臨床試驗的最新結果,這些結果為視神經脊髓炎譜系障礙(NMOSD)相關的發炎生物標記提供了寶貴的見解。這些發現進一步證實了Uplizna(inebilizumab)在減少疾病相關發作方面的「持久療效」。該研究強調了Uplizna作為有效治療方案的潛力,並著重指出其透過針對NMOSD相關的潛在發炎過程,在控制病情和改善患者預後方面發揮重要作用。
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Interactive Data Analysis Dashboard
- Company Analysis Dashboard for high growth potential opportunities
- Research Analyst Access for customization & queries
- Competitor Analysis with Interactive dashboard
- Latest News, Updates & Trend analysis
- Harness the Power of Benchmark Analysis for Comprehensive Competitor Tracking
目录
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 TRIPOD DATA VALIDATION MODEL
2.2.4 MARKET GUIDE
2.2.5 MULTIVARIATE MODELLING
2.2.6 TOP TO BOTTOM ANALYSIS
2.2.7 CHALLENGE MATRIX
2.2.8 APPLICATION COVERAGE GRID
2.2.9 STANDARDS OF MEASUREMENT
2.2.10 VENDOR SHARE ANALYSIS
2.2.11 EPIDEMIOLOGY BASED MODEL
2.2.12 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.13 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3 EXECUTIVE SUMMARY
4 PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTER’S FIVE FORCES MODEL
5 INDUSTRY INSIGHTS
5.1 PATENT ANALYSIS
5.1.1 PATENT LANDSCAPE
5.1.2 USPTO NUMBER
5.1.3 PATENT EXPIRY
5.1.4 EPIO NUMBER
5.1.5 PATENT STRENGTH AND QUALITY
5.1.6 PATENT CLAIMS
5.1.7 PATENT CITATIONS
5.1.8 PATENT LITIGATION AND LICENSING
5.1.9 FILE OF PATENT
5.1.10 PATENT RECEIVED CONTRIES
5.1.11 TECHNOLOGY BACKGROUND
5.2 DRUG TREATMENT RATE BY MATURED MARKETS
5.3 DEMOGRAPHIC TRENDS: IMPACTS ON ALL INCIDENCE RATES
5.4 PATIENT FLOW DIAGRAM
5.5 KEY PRICING STRATEGIES
5.6 KEY PATIENT ENROLLMENT STRATEGIES
5.7 INTERVIEWS WITH SPECIALIST
5.8 OTHER KOL SNAPSHOTS
6 EPIDEMIOLOGY
6.1 INCIDENCE OF ALL BY GENDER
6.2 TREATMENT RATE
6.3 MORTALITY RATE
6.4 DRUG ADHERENCE AND THERAPY SWITCH MODEL
6.5 PATIENT TREATMENT SUCCESS RATES
7 MERGERS AND ACQUISITION
7.1 LICENSING
7.2 COMMERCIALIZATION AGREEMENTS
8 REGULATORY FRAMEWORK
8.1 REGULATORY APPROVAL PROCESS
8.2 GEOGRAPHIES’ EASE OF REGULATORY APPROVAL
8.3 REGULATORY APPROVAL PATHWAYS
8.4 LICENSING AND REGISTRATION
8.5 POST-MARKETING SURVEILLANCE
8.6 GOOD MANUFACTURING PRACTICES (GMPS) GUIDELINES
9 PIPELINE ANALYSIS
9.1 CLINICAL TRIALS AND PHASE ANALYSIS
9.2 DRUG THERAPY PIPELINE
9.3 PHASE III CANDIDATES
9.4 PHASE II CANDIDATES
9.5 PHASE I CANDIDATES
9.6 OTHERS (PRE-CLINICAL AND RESEARCH)
TABLE 1 GLOBAL CLINICAL TRIAL MARKET FOR NEUROMYELITIS OPTICA TREATMENT MARKET
Company Name Therapeutic Area
XX XX
XX XX
XX XX
XX XX
XX XX
XX XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 2 DISTRIBUTION OF PRODUCTS AND PROJECTS BY PHASE NEUROMYELITIS OPTICA TREATMENT MARKET
Phase Number of Projects
Preclinical/Research Projects XX
Clinical Development XX
Phase I XX
Phase II XX
Phase III XX
U.S. Filed/Approved But Not Yest Marketed XX
Total XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 3 DISTRIBUTION OF PROJECTS BY THERAPEUTIC AREA AND PHASE NEUROMYELITIS OPTICA TREATMENT MARKET
Therapeutic Area Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
TABLE 4 DISTRIBUTION OF PROJECTS BY SCIENTIFIC APPROACH AND PHASE NEUROMYELITIS OPTICA TREATMENT MARKET
Technology Preclinical/ Research Project
XX XX
XX XX
XX XX
XX XX
XX XX
Total Projects XX
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
FIGURE 1 TOP ENTITIES BASED ON R&D GLANCE FOR NEUROMYELITIS OPTICA TREATMENT MARKET
Sources: Press Releases, Annual Reports, SEC Filings, Investor Presentations, Other Government Sources, Analysis Based on Inputs from Secondary, Expert Interviews
10 MARKETED DRUG ANALYSIS
10.1 DRUG
10.1.1 BRAND NAME
10.1.2 GENERICS NAME
10.2 THERAPEUTIC INDIACTION
10.3 PHARACOLOGICAL CLASS OD THE DRUG
10.4 DRUG PRIMARY INDICATION
10.5 MARKET STATUS
10.6 MEDICATION TYPE
10.7 DRUG DOSAGES FORM
10.8 DOSAGES AVAILABILITY
10.9 PACKAGING TYPE
10.1 DRUG ROUTE OF ADMINISTRATION
10.11 DOSING FREQUENCY
10.12 DRUG INSIGHT
10.13 AN OVERVIEW OF THE DRUG DEVELOPMENT ACTIVITIES SUCH AS REGULATORY MILSTONE, SAFETY DATA AND EFFICACY DATA, MARKET EXCLUSIVITY DATA.
10.13.1 FORECAST MARKET OUTLOOK
10.13.2 CROSS COMPETITION
10.13.3 THERAPEUTIC PORTFOLIO
10.13.4 CURRENT DEVELOPMENT SCENARIO
11 MARKET ACCESS
11.1 10-YEAR MARKET FORECAST
11.2 CLINICAL TRIAL RECENT UPDATES
11.3 ANNUAL NEW FDA APPROVED DRUGS
11.4 DRUGS MANUFACTURER AND DEALS
11.5 MAJOR DRUG UPTAKE
11.6 CURRENT TREATMENT PRACTICES
11.7 IMPACT OF UPCOMING THERAPY
12 R & D ANALYSIS
12.1 COMPARATIVE ANALYSIS
12.2 DRUG DEVELOPMENTAL LANDSCAPE
12.3 IN-DEPTH INSIGHTS ON REGULATORY MILESTONES
12.4 THERAPEUTIC ASSESSMENT
12.5 ASSET-BASED COLLABORATIONS AND PARTNERSHIPS
13 MARKET OVERVIEW
13.1 DRIVERS
13.2 RESTRAINTS
13.3 OPPORTUNITIES
13.4 CHALLENGES
14 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY TYPE
14.1 OVERVIEW
14.2 WITH AQUAPORIN-4 ANTIBODIES
14.3 WITHOUT AQUAPORIN-4 ANTIBODIES
15 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY DISEASE TYPE
15.1 OVERVIEW
15.2 RELAPSING FORM
15.3 MONOPHASIC FORM
16 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY TREATMENT TYPE
16.1 OVERVIEW
16.2 MEDICATION
16.2.1 APPROVED/MARKETED TREATMENT
16.2.1.1. IMMUNOSUPPRESSANT
16.2.1.1.1. AZATHIOPRINE
16.2.1.1.2. MYCOPHENOLATE
16.2.1.1.3. RITUXIMAB
16.2.1.1.4. CORTICOSTEROID
16.2.1.1.4.1 METHYLPREDNISOLONE
16.2.1.1.4.2 PREDNISONE
16.2.1.1.4.3 OTHERS
16.2.1.1.5. OTHERS
16.2.1.2. MONOCLONAL ANTIBODY
16.2.1.2.1. ECULIZUMAB
16.2.1.2.2. INEBILIZUMAB
16.2.1.2.3. SATRALIZUMAB-MWGE
16.2.1.2.4. OTHERS
16.2.1.3. ANTI-EPILEPTIC MEDICATIONS
16.2.1.3.1. GABAPENTIN
16.2.1.3.2. CARBAMAZEPINE
16.2.1.3.3. OTHERS
16.2.1.4. ANTI-SPASMODICS
16.2.1.4.1. BACLOFEN
16.2.1.4.2. TIZANIDINE
16.2.1.4.3. OTHERS
16.2.1.5. ANTI-DEPRESSANTS
16.2.1.5.1. AMITRIPTYLINE
16.2.1.5.2. DULOXETINE
16.2.1.5.3. OTHERS
16.2.1.6. ANALGESICS
16.2.1.6.1. TRAMADOL
16.2.1.6.2. OPIATES
16.2.1.6.3. OTHERS
16.2.1.7. OTHERS
16.2.2 PIPELINE MEDICATION
16.2.2.1. ANTI-FCRN BATOCLIMAB
16.2.2.2. ABX-1431
16.2.2.3. TG-1101
16.2.2.4. NDC-1308
16.2.2.5. OTHERS
16.3 PLASMAPHERESIS
16.3.1 FILTERS
16.3.1.1. PLASMA EXCHANGE
16.3.1.2. DOUBLE FILTRATION PLASMAPHERESIS
16.3.1.3. IMMUNOADSORPTION
16.3.1.4. OTHERS
16.3.2 MACHINES
16.3.2.1. BY TYPE
16.3.2.1.1. THERAPEUTIC APHAERESISI MACHINE
16.3.2.1.2. PLASMAPHERESIS MACHINE
16.3.2.1.3. CENTRIFUGES
16.3.2.1.4. OTHERS
16.3.2.2. BY MODALITY
16.3.2.2.1. TROLLEY MOUNTED
16.3.2.2.2. BENCH TOP
16.3.2.2.3. OTHERS
16.3.3 REPLACEMENT FLUIDS
16.3.3.1. ALBUMIN
16.3.3.2. ELECTROLYTE
16.3.3.3. HYDROXYETHYL STARCH
16.3.3.4. FFP
16.3.3.5. PURIFIED PROTEIN PRODUCTS
16.3.3.6. OTHERS
16.3.4 DISPOSABLES
16.3.4.1. SINGLE USE TUBING SETS
16.3.4.2. INJECTION NEEDLE
16.3.4.3. SPARE FILTERS
16.3.4.4. SOLUTIONS
16.3.4.5. OTHERS
16.3.5 OTHERS
16.4 STEM CELL THERAPY
16.4.1 HEMATOPOIETIC STEM CELL TRANSPLANTATION (HSCT)
16.4.1.1. AUTOLOGOUS
16.4.1.2. ALLOGENEIC
16.4.2 MESENCHYMAL STEM CELLS
16.5 OTHERS
17 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY DRUG TYPE
17.1 OVERVIEW
17.2 BRANDED
17.2.1 SOLIRIS
17.2.2 UPLIZNA
17.2.3 ENSPRYNG
17.2.4 OTHERS
17.3 GENERICS
18 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY ROUTE OF ADMINISTRATION
18.1 OVERVIEW
18.2 ORAL
18.2.1 TABLETS
18.2.2 SUSPENSION
18.2.3 OTHERS
18.3 PARENTERAL
18.3.1 INTRAVENOUS
18.3.2 SUBCUTANEOUS
18.3.3 OTHERS
18.4 OTHERS
19 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY POPULATION TYPE
19.1 OVERVIEW
19.2 MALE
19.2.1 PEDIATRIC
19.2.2 ADULTS
19.2.3 GERIATRIC
19.3 FEMALE
19.3.1 PEDIATRIC
19.3.2 ADULTS
19.3.3 GERIATRIC
20 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY AGE GROUP
20.1 OVERVIEW
20.2 PEDIATRIC
20.3 ADULTS
20.4 GERIATRIC
21 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY END USER
21.1 OVERVIEW
21.2 HOSPITALS
21.2.1 BY TYPE
21.2.1.1. PUBLIC
21.2.1.2. PRIVATE
21.2.2 BY LEVEL
21.2.2.1. TIER 1
21.2.2.2. TIER 2
21.2.2.3. TIER 3
21.3 SPECIALTY CLINICS
21.4 HOME HEALTHCARE
21.5 ACADEMIC AND RESEARCH INSTITUTES
21.6 OTHERS
22 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY DISTRIBUTION CHANNEL
22.1 OVERVIEW
22.2 DIRECT TENDER
22.3 RETAIL SALES
22.3.1 OFFLINE SALES
22.3.1.1. HOSPITAL PHARMACIES
22.3.1.2. RETAIL PHARMACIES
22.3.1.3. OTHERS
22.3.2 ONLINE SALES
22.3.2.1. E-STORES
22.3.2.2. COMPANY WEBSITE
22.3.2.3. OTHERS
22.4 OTHERS
23 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, BY GEOGRAPHY
23.1 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
23.1.1 NORTH AMERICA
23.1.1.1. U.S.
23.1.1.2. CANADA
23.1.1.3. MEXICO
23.1.2 EUROPE
23.1.2.1. GERMANY
23.1.2.2. FRANCE
23.1.2.3. U.K.
23.1.2.4. HUNGARY
23.1.2.5. LITHUANIA
23.1.2.6. AUSTRIA
23.1.2.7. IRELAND
23.1.2.8. NORWAY
23.1.2.9. POLAND
23.1.2.10. ITALY
23.1.2.11. SPAIN
23.1.2.12. RUSSIA
23.1.2.13. TURKEY
23.1.2.14. BELGIUM
23.1.2.15. NETHERLANDS
23.1.2.16. SWITZERLAND
23.1.2.17. REST OF EUROPE
23.1.3 ASIA-PACIFIC
23.1.3.1. JAPAN
23.1.3.2. CHINA
23.1.3.3. SOUTH KOREA
23.1.3.4. INDIA
23.1.3.5. AUSTRALIA
23.1.3.6. SINGAPORE
23.1.3.7. THAILAND
23.1.3.8. MALAYSIA
23.1.3.9. INDONESIA
23.1.3.10. PHILIPPINES
23.1.3.11. VIETNAM
23.1.3.12. REST OF ASIA-PACIFIC
23.1.4 SOUTH AMERICA
23.1.4.1. BRAZIL
23.1.4.2. ARGENTINA
23.1.4.3. PERU
23.1.4.4. REST OF SOUTH AMERICA
23.1.5 MIDDLE EAST AND AFRICA
23.1.5.1. SOUTH AFRICA
23.1.5.2. SAUDI ARABIA
23.1.5.3. UAE
23.1.5.4. EGYPT
23.1.5.5. KUWAIT
23.1.5.6. ISRAEL
23.1.5.7. REST OF MIDDLE EAST AND AFRICA
23.1.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
24 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, COMPANY LANDSCAPE
24.1 COMPANY SHARE ANALYSIS: GLOBAL
24.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
24.3 COMPANY SHARE ANALYSIS: EUROPE
24.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
24.5 MERGERS & ACQUISITIONS
24.6 NEW PRODUCT DEVELOPMENT & APPROVALS
24.7 EXPANSIONS
24.8 REGULATORY CHANGES
24.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
25 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, SWOT AND DBMR ANALYSIS
26 GLOBAL NEUROMYELITIS OPTICA TREATMENT MARKET, COMPANY PROFILE
26.1 PHARMA MANUFACTURES
26.1.1 CORESTEMCHEMON INC.
26.1.1.1. COMPANY OVERVIEW
26.1.1.2. REVENUE ANALYSIS
26.1.1.3. GEOGRAPHIC PRESENCE
26.1.1.4. PRODUCT PORTFOLIO
26.1.1.5. RECENT DEVELOPMENTS
26.1.2 ASTRAZENECA
26.1.2.1. COMPANY OVERVIEW
26.1.2.2. REVENUE ANALYSIS
26.1.2.3. GEOGRAPHIC PRESENCE
26.1.2.4. PRODUCT PORTFOLIO
26.1.2.5. RECENT DEVELOPMENTS
26.1.3 HARBOUR BIOMED
26.1.3.1. COMPANY OVERVIEW
26.1.3.2. REVENUE ANALYSIS
26.1.3.3. GEOGRAPHIC PRESENCE
26.1.3.4. PRODUCT PORTFOLIO
26.1.3.5. RECENT DEVELOPMENTS
26.1.4 TG THERAPEUTICS
26.1.4.1. COMPANY OVERVIEW
26.1.4.2. REVENUE ANALYSIS
26.1.4.3. GEOGRAPHIC PRESENCE
26.1.4.4. PRODUCT PORTFOLIO
26.1.4.5. RECENT DEVELOPMENTS
26.1.5 ENDECE
26.1.5.1. COMPANY OVERVIEW
26.1.5.2. REVENUE ANALYSIS
26.1.5.3. GEOGRAPHIC PRESENCE
26.1.5.4. PRODUCT PORTFOLIO
26.1.5.5. RECENT DEVELOPMENTS
26.1.6 ALEXION PHARMACEUTICALS
26.1.6.1. COMPANY OVERVIEW
26.1.6.2. REVENUE ANALYSIS
26.1.6.3. GEOGRAPHIC PRESENCE
26.1.6.4. PRODUCT PORTFOLIO
26.1.6.5. RECENT DEVELOPMENTS
26.1.7 HORIZON THERAPEUTICS PLC
26.1.7.1. COMPANY OVERVIEW
26.1.7.2. REVENUE ANALYSIS
26.1.7.3. GEOGRAPHIC PRESENCE
26.1.7.4. PRODUCT PORTFOLIO
26.1.7.5. RECENT DEVELOPMENTS
26.1.8 F. HOFFMANN-LA ROCHE LTD
26.1.8.1. COMPANY OVERVIEW
26.1.8.2. REVENUE ANALYSIS
26.1.8.3. GEOGRAPHIC PRESENCE
26.1.8.4. PRODUCT PORTFOLIO
26.1.8.5. RECENT DEVELOPMENTS
26.1.9 PFIZER INC.
26.1.9.1. COMPANY OVERVIEW
26.1.9.2. REVENUE ANALYSIS
26.1.9.3. GEOGRAPHIC PRESENCE
26.1.9.4. PRODUCT PORTFOLIO
26.1.9.5. RECENT DEVELOPMENTS
26.1.10 AMNEAL PHARMACEUTICALS LLC.
26.1.10.1. COMPANY OVERVIEW
26.1.10.2. REVENUE ANALYSIS
26.1.10.3. GEOGRAPHIC PRESENCE
26.1.10.4. PRODUCT PORTFOLIO
26.1.10.5. RECENT DEVELOPMENTS
26.1.11 ZYDUS GROUP
26.1.11.1. COMPANY OVERVIEW
26.1.11.2. REVENUE ANALYSIS
26.1.11.3. GEOGRAPHIC PRESENCE
26.1.11.4. PRODUCT PORTFOLIO
26.1.11.5. RECENT DEVELOPMENTS
26.1.12 JUBILANT CADISTA PHARMACEUTICALS INC.
26.1.12.1. COMPANY OVERVIEW
26.1.12.2. REVENUE ANALYSIS
26.1.12.3. GEOGRAPHIC PRESENCE
26.1.12.4. PRODUCT PORTFOLIO
26.1.12.5. RECENT DEVELOPMENTS
26.1.13 HIKMA PHARMACEUTICALS PLC
26.1.13.1. COMPANY OVERVIEW
26.1.13.2. REVENUE ANALYSIS
26.1.13.3. GEOGRAPHIC PRESENCE
26.1.13.4. PRODUCT PORTFOLIO
26.1.13.5. RECENT DEVELOPMENTS
26.1.14 VIATRIS INC.
26.1.14.1. COMPANY OVERVIEW
26.1.14.2. REVENUE ANALYSIS
26.1.14.3. GEOGRAPHIC PRESENCE
26.1.14.4. PRODUCT PORTFOLIO
26.1.14.5. RECENT DEVELOPMENTS
26.1.15 SEBELA PHARMACEUTICALS
26.1.15.1. COMPANY OVERVIEW
26.1.15.2. REVENUE ANALYSIS
26.1.15.3. GEOGRAPHIC PRESENCE
26.1.15.4. PRODUCT PORTFOLIO
26.1.15.5. RECENT DEVELOPMENTS
26.1.16 NOVARTIS AG
26.1.16.1. COMPANY OVERVIEW
26.1.16.2. REVENUE ANALYSIS
26.1.16.3. GEOGRAPHIC PRESENCE
26.1.16.4. PRODUCT PORTFOLIO
26.1.16.5. RECENT DEVELOPMENTS
26.1.17 ACCORD-UK LTD
26.1.17.1. COMPANY OVERVIEW
26.1.17.2. REVENUE ANALYSIS
26.1.17.3. GEOGRAPHIC PRESENCE
26.1.17.4. PRODUCT PORTFOLIO
26.1.17.5. RECENT DEVELOPMENTS
26.1.18 TEVA PHARMACEUTICALS USA, INC.
26.1.18.1. COMPANY OVERVIEW
26.1.18.2. REVENUE ANALYSIS
26.1.18.3. GEOGRAPHIC PRESENCE
26.1.18.4. PRODUCT PORTFOLIO
26.1.18.5. RECENT DEVELOPMENTS
26.1.19 ALKEM LABS
26.1.19.1. COMPANY OVERVIEW
26.1.19.2. REVENUE ANALYSIS
26.1.19.3. GEOGRAPHIC PRESENCE
26.1.19.4. PRODUCT PORTFOLIO
26.1.19.5. RECENT DEVELOPMENTS
26.1.20 STRIDES PHARMA INC.
26.1.20.1. COMPANY OVERVIEW
26.1.20.2. REVENUE ANALYSIS
26.1.20.3. GEOGRAPHIC PRESENCE
26.1.20.4. PRODUCT PORTFOLIO
26.1.20.5. RECENT DEVELOPMENTS
26.1.21 CONCORD BIOTECH
26.1.21.1. COMPANY OVERVIEW
26.1.21.2. REVENUE ANALYSIS
26.1.21.3. GEOGRAPHIC PRESENCE
26.1.21.4. PRODUCT PORTFOLIO
26.1.21.5. RECENT DEVELOPMENTS
26.2 MEDICAL DEVICE MANUFACTURE
26.2.1 ASAHI KESEI CORPORATION
26.2.1.1. COMPANY OVERVIEW
26.2.1.2. REVENUE ANALYSIS
26.2.1.3. GEOGRAPHIC PRESENCE
26.2.1.4. PRODUCT PORTFOLIO
26.2.1.5. RECENT DEVELOPMENTS
26.2.2 HAEMONETICS CORPORATION
26.2.2.1. COMPANY OVERVIEW
26.2.2.2. REVENUE ANALYSIS
26.2.2.3. GEOGRAPHIC PRESENCE
26.2.2.4. PRODUCT PORTFOLIO
26.2.2.5. RECENT DEVELOPMENTS
26.2.3 MILTENYI BIOTEC AND/OR ITS AFFILIATES
26.2.3.1. COMPANY OVERVIEW
26.2.3.2. REVENUE ANALYSIS
26.2.3.3. GEOGRAPHIC PRESENCE
26.2.3.4. PRODUCT PORTFOLIO
26.2.3.5. RECENT DEVELOPMENTS
26.2.4 GRIFOLS, S.A.
26.2.4.1. COMPANY OVERVIEW
26.2.4.2. REVENUE ANALYSIS
26.2.4.3. GEOGRAPHIC PRESENCE
26.2.4.4. PRODUCT PORTFOLIO
26.2.4.5. RECENT DEVELOPMENTS
26.2.5 OCTAPHARMA AG
26.2.5.1. COMPANY OVERVIEW
26.2.5.2. REVENUE ANALYSIS
26.2.5.3. GEOGRAPHIC PRESENCE
26.2.5.4. PRODUCT PORTFOLIO
26.2.5.5. RECENT DEVELOPMENTS
26.2.6 3M (SOLVENTUM)
26.2.6.1. COMPANY OVERVIEW
26.2.6.2. REVENUE ANALYSIS
26.2.6.3. GEOGRAPHIC PRESENCE
26.2.6.4. PRODUCT PORTFOLIO
26.2.6.5. RECENT DEVELOPMENTS
26.2.7 B. BRAUN SE
26.2.7.1. COMPANY OVERVIEW
26.2.7.2. REVENUE ANALYSIS
26.2.7.3. GEOGRAPHIC PRESENCE
26.2.7.4. PRODUCT PORTFOLIO
26.2.7.5. RECENT DEVELOPMENTS
26.2.8 FRESENIUS SE & CO. KGAA
26.2.8.1. COMPANY OVERVIEW
26.2.8.2. REVENUE ANALYSIS
26.2.8.3. GEOGRAPHIC PRESENCE
26.2.8.4. PRODUCT PORTFOLIO
26.2.8.5. RECENT DEVELOPMENTS
26.2.9 INFOMED SA
26.2.9.1. COMPANY OVERVIEW
26.2.9.2. REVENUE ANALYSIS
26.2.9.3. GEOGRAPHIC PRESENCE
26.2.9.4. PRODUCT PORTFOLIO
26.2.9.5. RECENT DEVELOPMENTS
26.2.10 SB-KAWASUMI LABORATORIES, INC.
26.2.10.1. COMPANY OVERVIEW
26.2.10.2. REVENUE ANALYSIS
26.2.10.3. GEOGRAPHIC PRESENCE
26.2.10.4. PRODUCT PORTFOLIO
26.2.10.5. RECENT DEVELOPMENTS
26.2.11 TERUMO BCT, INC.
26.2.11.1. COMPANY OVERVIEW
26.2.11.2. REVENUE ANALYSIS
26.2.11.3. GEOGRAPHIC PRESENCE
26.2.11.4. PRODUCT PORTFOLIO
26.2.11.5. RECENT DEVELOPMENTS
26.2.12 BIOBASE BIOTECH (JINAN) CO., LTD
26.2.12.1. COMPANY OVERVIEW
26.2.12.2. REVENUE ANALYSIS
26.2.12.3. GEOGRAPHIC PRESENCE
26.2.12.4. PRODUCT PORTFOLIO
26.2.12.5. RECENT DEVELOPMENTS
26.2.13 BAXTER
26.2.13.1. COMPANY OVERVIEW
26.2.13.2. REVENUE ANALYSIS
26.2.13.3. GEOGRAPHIC PRESENCE
26.2.13.4. PRODUCT PORTFOLIO
26.2.13.5. RECENT DEVELOPMENTS
26.2.14 KANEKA CORPORATION
26.2.14.1. COMPANY OVERVIEW
26.2.14.2. REVENUE ANALYSIS
26.2.14.3. GEOGRAPHIC PRESENCE
26.2.14.4. PRODUCT PORTFOLIO
26.2.14.5. RECENT DEVELOPMENTS
26.2.15 SHANGHAI DAHUA MEDICAL APPARATUS CO., LTD
26.2.15.1. COMPANY OVERVIEW
26.2.15.2. REVENUE ANALYSIS
26.2.15.3. GEOGRAPHIC PRESENCE
26.2.15.4. PRODUCT PORTFOLIO
26.2.15.5. RECENT DEVELOPMENTS
26.2.16 ZHENGYUAN TECHNOLOGY CO., LTD.
26.2.16.1. COMPANY OVERVIEW
26.2.16.2. REVENUE ANALYSIS
26.2.16.3. GEOGRAPHIC PRESENCE
26.2.16.4. PRODUCT PORTFOLIO
26.2.16.5. RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
27 RELATED REPORTS
28 CONCLUSION
29 QUESTIONNAIRE
30 ABOUT DATA BRIDGE MARKET RESEARCH
研究方法
数据收集和基准年分析是使用具有大样本量的数据收集模块完成的。该阶段包括通过各种来源和策略获取市场信息或相关数据。它包括提前检查和规划从过去获得的所有数据。它同样包括检查不同信息源中出现的信息不一致。使用市场统计和连贯模型分析和估计市场数据。此外,市场份额分析和关键趋势分析是市场报告中的主要成功因素。要了解更多信息,请请求分析师致电或下拉您的询问。
DBMR 研究团队使用的关键研究方法是数据三角测量,其中包括数据挖掘、数据变量对市场影响的分析和主要(行业专家)验证。数据模型包括供应商定位网格、市场时间线分析、市场概览和指南、公司定位网格、专利分析、定价分析、公司市场份额分析、测量标准、全球与区域和供应商份额分析。要了解有关研究方法的更多信息,请向我们的行业专家咨询。
可定制
Data Bridge Market Research 是高级形成性研究领域的领导者。我们为向现有和新客户提供符合其目标的数据和分析而感到自豪。报告可定制,包括目标品牌的价格趋势分析、了解其他国家的市场(索取国家列表)、临床试验结果数据、文献综述、翻新市场和产品基础分析。目标竞争对手的市场分析可以从基于技术的分析到市场组合策略进行分析。我们可以按照您所需的格式和数据样式添加您需要的任意数量的竞争对手数据。我们的分析师团队还可以为您提供原始 Excel 文件数据透视表(事实手册)中的数据,或者可以帮助您根据报告中的数据集创建演示文稿。