Each DNA molecule in the body carries tens of thousands of genes. Certain characteristics of these genes determine skin tone, height, and hair color. That's not all, though. The genetic makeup of an individual also contains other crucial characteristics. Some of these characteristics have the potential to be detrimental to general health and wellness under specific situations. This may be referred to as a hereditary propensity by a doctor. Knowing one's hereditary susceptibility to disease can help avoid disease and potentially have an effect on future generations. Many are of the notion that having a genetic predisposition would definitely result in developing a disease somewhere in the future. However, this is not the case.
Genetic predisposition simply means a likelihood or increased probability of developing a disease due to one or more genetic variants. Family history of diseases is a simple example of diseases developing as result of genetic predisposition. Over time, genetic variants are transmitted to offspring. These can occasionally deviate from the typical gene in a healthy individual. It frequently happens that one or more relatives will have the same illness or condition. A genetic predisposition does not guarantee that a person will get the disease. External factors become responsible for triggering the disease. Numerous diseases and ailments have a hereditary propensity attached to them. Several malignancies include diabetes, obesity, heart disease, asthma, celiac disease, and other conditions. Additionally, researchers have linked genetics to autism, addiction, and mental illnesses. Usually, there is an external trigger, such as a change in nutrition, the environment, smoking, hormonal changes, or severe disease. One family member acquires a sickness while the other does not due to external circumstances.
Most people are unaware of their hereditary susceptibility until a serious sickness manifests. The fact that family members are ill could have given others an idea. The presence of specific genes can be ascertained using a common genetic test. A doctor could inquire about a patient's family history. A person with a genetic predisposition or genetic susceptibility to cancer has a higher risk of getting the illness due to their genes. It does not guarantee that you will develop the disease even if you are genetically susceptible to a specific type of cancer. Additionally, there are varying degrees of risk, with some individuals having a very high risk of acquiring cancer and others simply have a marginally higher risk. Approximately 10% of cancers are thought to be hereditary, while the influence of hereditary factors varies depending on the kind of cancer.
Data Bridge Market Research analyses that the cancer diagnostics market is expected to reach a value of USD 28.21 billion by the year 2029, at a CAGR of 7.29% during the forecast period. The rise in the Cancer cases provides growth opportunities to the market.
To know more about the study, visit: https://www.databridgemarketresearch.com/reports/global-cancer-diagnostics-market
Genetic Predisposition is Multifactorial in Causation
Mutations in tumor suppressor genes are responsible for hereditary susceptibility. Tumor suppressor genes code for proteins that repair DNA damage. The body often fixes DNA damage or removes aberrant cells when it occurs in a cell. A cancer cell may develop if the mutations (genetic alterations) are not corrected. Most cancers are believed to be multifactorial, which means that several variables (genetic, environmental, lifestyle, medical, and others) can either raise or decrease the risk.
Cancer may result if genetic alterations affect how your cells develop and spread. The majority of DNA alterations that lead to cancer occur in genes, which are parts of DNA that contain the instructions needed to generate proteins or specialized RNA like microRNA. For instance, some DNA alterations increase the number of proteins that instruct cells to continue growing. The amount of proteins that inform cells when to cease growing is decreased by additional DNA alterations. Additionally, some DNA alterations halt the proteins that instruct injured cells to self-destruct. A variety of genetic alterations can cause cancer. One type of gene alteration, referred to as a DNA mutation or genetic variant, is a modification in the DNA code, similar to a typing error in the DNA letter sequence.
Some variations only alter a single nucleotide or DNA letter. It's possible for a nucleotide to be absent or another to take its place. Point mutations are what they are known for. For instance, the KRAS gene has a point mutation in about 5% of cancer patients, changing the DNA letter G to the letter A. A KRAS protein that is aberrant and constantly instructs cells to expand is the result of this one-letter mutation. Additionally, rearranging, deleting, or copying DNA segments—sometimes extremely big—can cause cancer genetic alterations. Chromosome rearrangements are what they are known as.
According to researchers, more than one DNA alteration must occur for a healthy cell to develop cancer. Furthermore, most malignancies are caused by an average of six mutations rather than just one. These mutations could develop over time and as a result of various exposures. Determining if a person has a hereditary susceptibility to cancer can be relatively simple in some circumstances but more difficult in others. Below is a detailed discussion in this regard:
Family History
One is likely in greater danger with a closer family member (such as a first-degree relative). The following are first-degree relatives: parents, siblings, and kids. Grandparents, aunts, uncles, nieces, nephews, and half-siblings are examples of second-degree relations. First cousins, great-grandparents, and great-grandchildren are all considered third-degree relatives. Some patterns are alarming:
- The same form of cancer in three or more family members
- Combinations of specific cancers, such as having a breast cancer survivor and a pancreatic cancer survivor on the same side, may indicate a BRCA2 gene mutation
- A close relative who was diagnosed with cancer at a young age
It's crucial to distinguish between acquired mutations and hereditary mutations when discussing family history. Today, some cancer kinds are genetically tested to see if tailored medicines might work. Mutations like those in lung cancer's EGFR gene or melanoma's BRAF gene are invariably acquired mutations. These mutations can't be handed on to future generations because they only appear in malignant cells.
Cancer Concerns: Age and Sex
A genetic predisposition is linked to cancer developing earlier than typical in life. For instance, breast cancer is more likely to have a genetic basis in young women (under 30 to 40). Compared to breast cancer in women, male breast cancer is significantly more likely to be caused by a hereditary predisposition. Cancer may not often run in families, although some kids who get it have hereditary susceptibility. 8.3% of the youngsters in a 2015 study of more than 1000 cancer patients showed predisposing gene alterations. However, only 40% of the kids with gene abnormalities had a history of cancer in their families.
Data Bridge Market Research analyses that the breast cancer 1 (BRCA1) and breast cancer 2 (BRCA2) genes market was valued at USD 5.149 billion in 2021 and is expected to reach USD 10.34 billion by 2029, registering a CAGR of 9.10% during the forecast period of 2022 to 2029.
To know more about the study, visit: https://www.databridgemarketresearch.com/reports/global-brca1-and-brca2-genes-market
Multiple Tumors and Rare Cancers
In a 2018 study, those who had multiple primary tumors were more likely to have aberrant cancer-predisposition genes (two or more unrelated cancers). Cancer propensity genes were discovered in one-third of persons with two primary malignancies before the age of 60 or three primary tumors before the age of 70. It is believed that at least half of these abnormalities would have gone unnoticed with traditional targeted sequencing used in this thorough whole-genome sequencing. There is a higher likelihood of a genetic predisposition among people who acquire unusual cancers like retinoblastoma or particular endocrine tumors.
Data Bridge Market Research analyses that the cancer tumor profiling market is expected to undergo a CAGR of 12.75% during the forecast period. This indicates that the market value, which was USD 9.35 billion in 2021, would rocket up to USD 24.44 billion by 2029.
To know more about the study, visit: https://www.databridgemarketresearch.com/reports/global-cancer-tumor-profiling-market
Genetic Testing and Genomic Editing in the field of Oncology
What if you could stop a genetic illness from happening? Or to treat illnesses like leukemia? Do you want to do it? Once upon a time, issues like this appeared to be reserved for science fiction. However, they are now a definite possibility due to the quick advancements in genetic technologies over the previous 70 years. Geneticists have made astoundingly rapid advances since the discovery of DNA's structure in the 1950s. The first genetically engineered medicine, insulin, which is used to treat diabetes, was created in 1982, and the first human gene therapy studies began in 1990. A human genome can now be sequenced more efficiently than ever before.
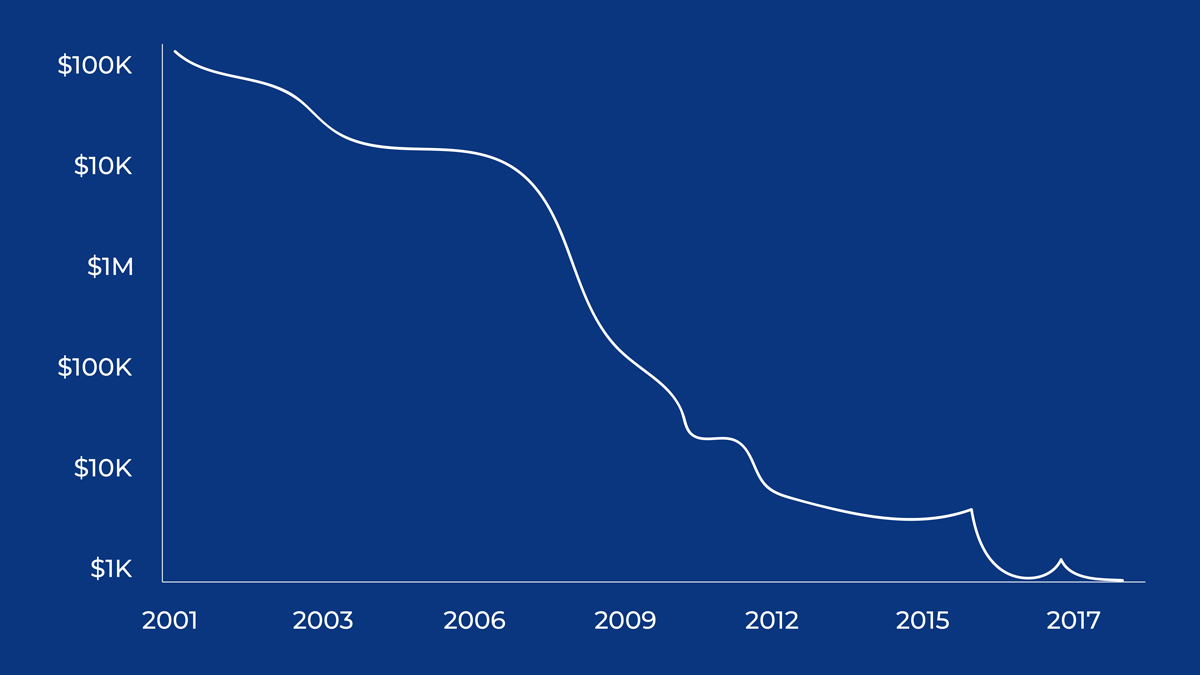
Fig.1: The Declining Costs of Sequencing
Genetic testing is a sort of genetic technology that is already available. This entails conducting tests to determine the gene variants you have inherited. They can be used for a variety of things, including identifying rare diseases and using commercial services that give you family history or medical information. However, a rapidly emerging field is helping us better understand the impact our genes have on our life by analyzing the DNA of a vast number of people. This might make it easier to create medications that consider each patient's genetic composition. In the U.K., genetic testing is applied in the following ways, for example:
- Patients supply blood samples that can be used to either analyze the complete patient's genetic code or a gene or genes connected to a particular illness
- Although there is now some testing for specific genes that may be run immediately, this is typically handled in a lab
- Typically, just a small number of genes are examined; however, there are whole-genome techniques that analyses every DNA letter. The 100,000 Genomes Project, which focuses on cancer and uncommon disorders, is one of them
|
What's in favor of genetic testing?
|
What's holding against genetic testing?
|
|
If you are aware that you have a genetic illness, you may be able to receive appropriate treatment or take steps to lessen the likelihood that the disease may manifest.
|
Your level of service could be affected if third parties, such as insurance companies, had access to your genetic information.
|
|
Effective preventative care may lower the cost of healthcare.
|
The cost of genetic testing may divert funds from other NHS departments.
|
|
Even if there is no cure, knowing what your future health will be like can help you decide on things like whether or not to have children.
|
Discovering that your family member is at risk of developing cancer can cause anxiety in the mind and affect relationships.
|
Genome Testing and Editing offer Improvement by Leaps and Bounds over Conventional Science
As it enables them to change cancer cells for laboratory experiments genetically, genome editing has developed into a potent tool for cancer researchers because it produces results much more quickly. 83% of those polled previously support utilizing genome editing to treat patients with serious illnesses that are currently incurable. The topic of genome editing is controversial. We are "playing God" and going too far for some people and some applications when we do this. It also prompts questions about accessibility (would it be available to everyone for no cost?) and regulation (who will oversee its use?). Others, especially individuals with conditions that might otherwise be fatal, find that the advantages outweigh the hazards. Because it enables them to change cancer cells for laboratory experiments genetically, genome editing has developed into a potent tool for cancer researchers because it produces results much more quickly.
Genome editing is not limited to editing the genomes of adults and children. The embryonic genomes can also be altered. This editing, called germline editing, is carried out at the embryonic level, implying that the modification would be permanent and potentially inherited. In the U.K. and the U.S., it is currently against the law to implant a genetically modified embryo into a woman's womb; hence this procedure cannot be used unless the legislation is amended. Before any modification in the law is considered, scientists have stated that far more substantial evidence on whether the treatment is safe and effective, as well as an inclusive public debate, are required. Genome editing advocates contend that treating genetic disorders in embryos lessens suffering and may lower expenses for the larger health system. Those opposed say that it will lessen respect for diversity and put more pressure on racial and ethnic groups who exhibit traits associated with "disorders." Do you think genome editing should be used clinically instead of solely for research to treat embryos prone to hereditary diseases? Because other options are available to parents who do not want to pass on an inherited genetic disease to their offspring, this is unacceptable for some people. According to this claim, genome editing should only be employed as a last option. These other choices include:
- Adoptive parents have the option. Or they could make use of a donated embryo that is not genetically related to them
- After IVF, it is feasible to check embryos for a gene variant that is defective and only implant those that won't result in a genetic disorder in the woman's womb
- Some hereditary illnesses are treatable. For instance, patients with cardiomyopathy can be watched, advised to avoid excessive exercise, and given medicine to control their heart rate
Conclusion: The Silver Lining of Genetic Predisposition
It can be worrisome to discover you have a genetic predisposition to a disease like cancer, but there are some benefits to being aware of your risk. You can learn about the symptoms of a condition if you have a higher risk of developing it, and your healthcare practitioner may check you for early signs. If you were alert, you might have a better chance of surviving a condition like cancer since it might be detected earlier. Cancer predisposition genes are those in which germline mutations provide highly or moderately higher risks of developing cancer. More than 100 of these genes have been discovered, offering significant scientific insights into various fields, including the mechanisms behind cancer development. Additionally, the practical application of cancer propensity genes has significantly impacted cancer diagnosis, optimal care, and prevention. Recent revolutionary developments in DNA sequencing carry the prospect of numerous further cancer predisposition gene discoveries as well as more extensive and varied clinical applications.
There is, nevertheless, a considerable chance for erroneous conclusions and improper clinical applications. Thus, careful maneuvering will be necessary to realize the potential of cancer predisposition genes for research and medicine. If you have inherited a genetic alteration that raises your risk of developing cancer, several genetic testing can reveal this. Normally, a little amount of blood is used for this examination, but it is also occasionally possible to use saliva, cells inside the cheek, or skin cells. Genetic testing for cancer risk is not necessary for everyone. You can decide if you should get tested for genetic abnormalities that raise your chance of developing cancer with the assistance of your doctor or other healthcare practitioners. They'll probably inquire whether your personal or family medical history exhibits any uncommon patterns, such as cancer at a young age or multiple relatives who have same cancer.
If your doctor advises genetic testing, discussing the potential risks, advantages, and disadvantages of genetic testing in your circumstance with a genetic counselor might be helpful. Following testing, a genetic counselor, physician, or other medical experts with genetics training can assist you in comprehending the implications of the test results for you and your family. Even though it is feasible to order an at-home genetic test on your own, these procedures have several limitations and are not typically advised as a way to determine whether you have inherited a genetic alteration that raises your chance of developing cancer.









