Asia Pacific Electronic Clinical Outcome Assessment Ecoa Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
265.11 million
USD
924.58 million
2024
2032
USD
265.11 million
USD
924.58 million
2024
2032
| 2025 –2032 | |
| USD 265.11 million | |
| USD 924.58 million | |
|
|
|
|
Marktsegmentierung für elektronische klinische Ergebnisbeurteilungen (eCOA) im asiatisch-pazifischen Raum nach Produkt (On-Premise-Lösungen, Cloud-basierte Lösungen und webbasierte Lösungen), Ansatz (Clinician Reported Outcome Assessment (CLINRO), Patient Reported Outcome Assessment (PRO), Observer Reported Outcome Assessment (OBSRO) und Performance Outcome Assessment (PERFO)), Endbenutzer (kommerzielle Dienstleister, Krankenhäuser und Transplantationszentren, Forschungslabore und akademische Einrichtungen), Plattform (Auftragsforschungsinstitute, Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte, Krankenhäuser und klinische Labore, Beratungsunternehmen, Forschung und Wissenschaft und andere) – Branchentrends und Prognose bis 2032
Marktgröße für elektronische klinische Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum
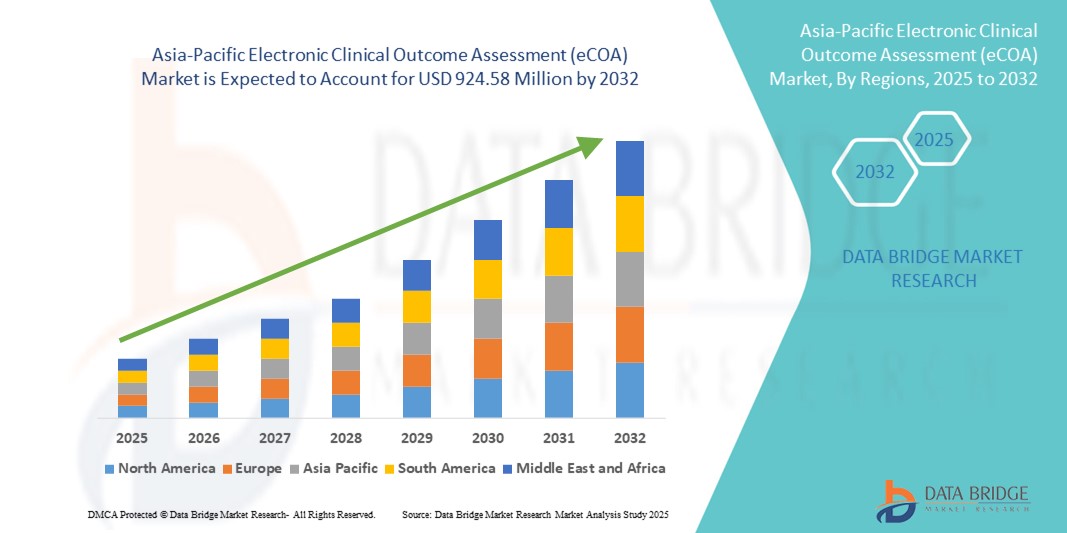
- Der Markt für elektronische klinische Ergebnisbewertungen (eCOA) im asiatisch-pazifischen Raum hatte im Jahr 2024 ein Volumen von 265,11 Millionen US-Dollar und dürfte bis 2032 einen Wert von 924,58 Millionen US-Dollar erreichen , bei einer CAGR von 16,90 % im Prognosezeitraum.
- Das Marktwachstum wird vor allem durch die zunehmende Nutzung digitaler Gesundheitstechnologien, die regulatorische Förderung der elektronischen Datenerfassung bei klinischen Studien und die wachsende Nachfrage nach patientenzentrierten und Fernüberwachungslösungen in der gesamten Region vorangetrieben.
- Darüber hinaus positioniert der zunehmende Fokus auf die Verbesserung der Datengenauigkeit, Compliance und Echtzeit-Patienteninformationen eCOA-Plattformen als wichtige Komponente der modernen klinischen Forschung. Diese Faktoren beschleunigen gemeinsam die Einführung von eCOA-Lösungen und treiben damit die Marktexpansion im asiatisch-pazifischen Raum deutlich voran.
Marktanalyse für elektronische klinische Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum
- eCOA-Plattformen, die die elektronische Erfassung von patienten-, klinik- und beobachterberichteten Ergebnissen in klinischen Studien ermöglichen, werden aufgrund ihrer verbesserten Datengenauigkeit, Echtzeit-Überwachungsmöglichkeiten und nahtlosen Integration mit anderen digitalen Gesundheitslösungen zu unverzichtbaren Werkzeugen in der modernen Arzneimittelentwicklung und klinischen Forschung.
- Die zunehmende Verbreitung von eCOA-Lösungen ist vor allem auf die zunehmende Digitalisierung klinischer Studien, die regulatorische Förderung der elektronischen Datenerfassung und den wachsenden Bedarf an patientenzentrierten, Remote- und dezentralen Studiendesigns zurückzuführen.
- China dominierte den Markt für elektronische klinische Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum mit dem größten Umsatzanteil von 39 % im Jahr 2024. Dies ist gekennzeichnet durch zunehmende klinische Studienaktivitäten, eine schnelle Einführung der digitalen Gesundheit und die Präsenz wichtiger Branchenakteure mit einer signifikanten Akzeptanz von eCOA-Lösungen in multizentrischen und dezentralen klinischen Studien.
- Indien wird im Prognosezeitraum voraussichtlich das am schnellsten wachsende Land im Markt für elektronische klinische Ergebnisbewertungen (eCOA) im asiatisch-pazifischen Raum sein. Dies ist auf steigende Investitionen in die klinische Forschung, staatliche Unterstützung für digitale Gesundheitsinitiativen und die zunehmende Akzeptanz patientenzentrierter und mobiler eCOA-Lösungen zurückzuführen.
- Das Segment Patient Reported Outcome Assessment (PRO) dominierte den Markt für elektronische klinische Ergebnisbewertungen (eCOA) im asiatisch-pazifischen Raum mit einem Marktanteil von 42,8 % im Jahr 2024, getrieben von seiner entscheidenden Rolle bei der Erfassung realer Patientenerfahrungen, der Verbesserung der Studienkonformität und der Erhöhung der allgemeinen Datenzuverlässigkeit.
Berichtsumfang und Marktsegmentierung für elektronische klinische Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum
|
Eigenschaften |
Wichtige Markteinblicke im Bereich der elektronischen klinischen Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum |
|
Abgedeckte Segmente |
|
|
Abgedeckte Länder |
Asien-Pazifik
|
|
Wichtige Marktteilnehmer |
|
|
Marktchancen |
|
|
Wertschöpfungsdaten-Infosets |
Zusätzlich zu den Einblicken in Marktszenarien wie Marktwert, Wachstumsrate, Segmentierung, geografische Abdeckung und wichtige Akteure enthalten die von Data Bridge Market Research kuratierten Marktberichte auch ausführliche Expertenanalysen, Preisanalysen, Markenanteilsanalysen, Verbraucherumfragen, demografische Analysen, Lieferkettenanalysen, Wertschöpfungskettenanalysen, eine Übersicht über Rohstoffe/Verbrauchsmaterialien, Kriterien für die Lieferantenauswahl, PESTLE-Analysen, Porter-Analysen und regulatorische Rahmenbedingungen. |
Markttrends für elektronische klinische Ergebnisbeurteilungen (eCOA) im asiatisch-pazifischen Raum
Digitale Transformation und mobile eCOA-Lösungen
- Ein bedeutender und sich beschleunigender Trend im eCOA-Markt im asiatisch-pazifischen Raum ist die zunehmende Nutzung mobiler und Cloud-fähiger Plattformen, die die Erfassung von Patientendaten in klinischen Studien in Echtzeit ermöglichen und so die Genauigkeit und Effizienz verbessern.
- So erweiterte CRF Health (jetzt Medidata Solutions) im Jahr 2024 sein mobiles eCOA-Angebot in China und Indien und ermöglichte es Patienten, Ergebnisse über Smartphones und Tablets zu melden, was die Studienkonformität und Datenzuverlässigkeit erhöhte.
- Die Integration von KI- und Analysetools erweitert die Funktionalität von eCOA-Plattformen und ermöglicht prädiktive Erkenntnisse, automatisierte Datenqualitätsprüfungen und die frühzeitige Erkennung von Protokollabweichungen. Einige Plattformen können patientenberichtete Ergebnisse in Echtzeit analysieren, um Inkonsistenzen oder ungewöhnliche Muster zu erkennen und so die allgemeine Studienüberwachung zu verbessern.
- Die Interoperabilität von eCOA-Systemen mit elektronischen Gesundheitsakten (EHRs) und anderen klinischen Studienmanagementsystemen (CTMS) ermöglicht eine zentrale Verwaltung von Studiendaten, was eine effizientere Überwachung, schnellere Entscheidungsfindung und einen geringeren Verwaltungsaufwand ermöglicht.
- Dieser Trend zu intelligenteren, patientenzentrierten und vernetzten eCOA-Lösungen verändert die Durchführung klinischer Studien im asiatisch-pazifischen Raum und veranlasst Anbieter wie Signant Health und Oracle Health Sciences, mobile, Cloud- und KI-gestützte Funktionen für lokale Studienabläufe zu verbessern.
- Die Nachfrage nach mobilfreundlichen, integrierten und analytikbasierten eCOA-Plattformen steigt sowohl bei pharmazeutischen als auch bei CRO-geführten klinischen Studien rapide an, da Sponsoren und Prüfer Datengenauigkeit, Patientencompliance und Betriebseffizienz priorisieren.
Marktdynamik für elektronische klinische Ergebnisbeurteilungen (eCOA) im asiatisch-pazifischen Raum
Treiber
Steigende Aktivität bei klinischen Studien und Nutzung digitaler Gesundheitsdienste
- Die steigende Zahl klinischer Studien im asiatisch-pazifischen Raum sowie die schnelle Einführung digitaler Gesundheitslösungen sind ein wichtiger Treiber für das Wachstum des eCOA-Marktes.
- So kündigte PPD im März 2024 die Einführung von eCOA-Plattformen für dezentrale klinische Studien in Indien an, die eine Fernüberwachung von Patienten und Datenerfassung ermöglichen. Solche Initiativen wichtiger Unternehmen dürften die Marktexpansion im Prognosezeitraum beschleunigen.
- Da sich Pharmaunternehmen auf patientenzentrierte Studien konzentrieren, bieten eCOA-Lösungen Vorteile wie Echtzeit-Datenerfassung, automatisierte Compliance-Erinnerungen und weniger Besuche vor Ort, was sowohl die Studienqualität als auch das Engagement der Teilnehmer verbessert.
- Darüber hinaus fördern staatliche Initiativen zur Unterstützung der digitalen Gesundheit und regulatorische Leitlinien zur elektronischen Erfassung patientenberichteter Ergebnisse die Einführung von eCOA-Plattformen.
- Die Flexibilität der mobilen und Tablet-basierten Berichterstattung, kombiniert mit der Integration in umfassendere Arbeitsabläufe im klinischen Studienmanagement, macht eCOA zu einem unverzichtbaren Werkzeug sowohl für lokale als auch für multinationale Studien im gesamten asiatisch-pazifischen Raum.
Einschränkung/Herausforderung
Regulatorische Abweichungen und Datenschutzbedenken
- Die Unterschiede in den regulatorischen Rahmenbedingungen und Datenschutzgesetzen in den Ländern des asiatisch-pazifischen Raums stellen eine erhebliche Herausforderung für die breite Einführung von eCOA-Lösungen dar. Die Einhaltung der Vorschriften zur lokalen Datenspeicherung, zur Patienteneinwilligung und zum grenzüberschreitenden Datentransfer erfordert sorgfältige Planung und Investitionen.
- Beispielsweise müssen Studien in China und Südkorea strenge Anforderungen an die Datenlokalisierung erfüllen, was die Bereitstellung cloudbasierter eCOA-Systeme erschweren kann.
- Die Gewährleistung der Datensicherheit durch robuste Verschlüsselung, sichere Authentifizierungsprotokolle und die Einhaltung lokaler Vorschriften ist entscheidend für das Vertrauen von Sponsoren, CROs und Teilnehmern. Unternehmen wie Medidata und CRF Health legen in ihren Angeboten im Asien-Pazifik-Raum Wert auf die Einhaltung gesetzlicher Vorschriften und fortschrittliche Sicherheitsmaßnahmen, um diese Bedenken auszuräumen.
- Darüber hinaus können Infrastruktureinschränkungen in einigen Regionen, wie z. B. eine inkonsistente Internetverbindung oder geringe digitale Kompetenz der Patienten, die effektive Umsetzung von eCOA-Lösungen behindern.
- Die Bewältigung dieser Herausforderungen durch lokalisierte Einsatzstrategien, Patientenschulungen, regulatorische Anpassungen und Investitionen in sichere, anpassungsfähige Plattformen ist für ein nachhaltiges Wachstum des eCOA-Marktes im asiatisch-pazifischen Raum von entscheidender Bedeutung.
Marktumfang für elektronische klinische Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum
Der Markt ist nach Produkt, Ansatz, Endbenutzer und Plattform segmentiert.
- Nach Produkt
Der Markt für elektronische klinische Ergebnisbewertungen (eCOA) im asiatisch-pazifischen Raum ist produktbezogen in On-Premise-Lösungen, Cloud-Lösungen und webbasierte Lösungen unterteilt. Das Segment der Cloud-Lösungen dominierte den Markt mit dem größten Umsatzanteil von 45,6 % im Jahr 2024, getrieben durch die zunehmende Nutzung digitaler Plattformen für klinische Studien und die gebotene Flexibilität für Remote- und dezentrale Studien. Cloud-basierte eCOA-Plattformen ermöglichen Sponsoren, CROs und Krankenhäusern den Echtzeitzugriff auf patientenberichtete und klinische Ergebnisdaten, was die Betriebseffizienz verbessert und Dateneingabefehler reduziert. Diese Plattformen erleichtern auch die Zusammenarbeit zwischen klinischen Studien an mehreren Standorten und ermöglichen es Studienleitern und Prüfern, den Fortschritt zu verfolgen, die Einhaltung der Vorschriften zu überwachen und Anfragen sofort zu beantworten. Der Markt verzeichnet eine starke Nachfrage nach Cloud-basierten Lösungen aufgrund ihrer Skalierbarkeit, der minimalen Anforderungen an die IT-Infrastruktur und der Kosteneffizienz sowohl für große als auch für kleine Studien.
Das Segment webbasierter Lösungen wird voraussichtlich zwischen 2025 und 2032 mit 23,4 % das höchste Wachstum verzeichnen. Dies ist auf den steigenden Bedarf an browserbasierten Plattformen zurückzuführen, die unterschiedliche Studienumgebungen unterstützen. Diese Plattformen bieten benutzerfreundliche Oberflächen für Patienten, Ärzte und Studienkoordinatoren und verkürzen so den Lernaufwand für die elektronische Datenerfassung. Webbasierte eCOA-Systeme ermöglichen zudem den Fernzugriff auf Studiendaten, was insbesondere für dezentrale und hybride klinische Studien wichtig ist und die Patienteneinbindung und -treue verbessert. Die Flexibilität webbasierter Plattformen ermöglicht die Durchführung von Studien in Regionen mit unterschiedlicher technologischer Infrastruktur. Die Einführung webbasierter Lösungen wird auch von Aufsichtsbehörden gefördert, die Wert auf die elektronische Datenerfassung für patientenberichtete Ergebnisse legen.
- Nach Ansatz
Basierend auf dem Ansatz ist der Markt für elektronische klinische Ergebnisbewertungen (eCOA) im asiatisch-pazifischen Raum in Clinician Reported Outcome Assessment (CLINRO), Patient Reported Outcome Assessment (PRO), Observer Reported Outcome Assessment (OBSRO) und Performance Outcome Assessment (PERFO) segmentiert. Das Segment Patient Reported Outcome Assessment (PRO) dominierte den Markt mit einem signifikanten Umsatzanteil von 42,8 % im Jahr 2024, getrieben von seiner Bedeutung für die Erfassung realer Patientenerfahrungen und Zufriedenheitsgrade. PRO-Lösungen ermöglichen es den Teilnehmern, Symptome, Nebenwirkungen und Lebensqualitätsmaße direkt zu melden, wodurch die Abhängigkeit von Vermittlern reduziert und Berichterstattungsverzerrungen minimiert werden. Dieser Ansatz ist besonders wertvoll bei Studien zu chronischen Krankheiten und Langzeitstudien, bei denen Patientenfeedback entscheidend für die Bewertung von Wirksamkeit und Sicherheit ist. PRO-Daten helfen Sponsoren und Aufsichtsbehörden, fundierte Entscheidungen zu treffen und gleichzeitig das Engagement und die Adhärenz der Patienten zu verbessern. Darüber hinaus verbessert die zunehmende Integration von PRO-Modulen mit Mobilgeräten und Tablets die Genauigkeit der Datenerfassung und den Komfort für die Teilnehmer.
Das Segment Observer Reported Outcome Assessment (OBSRO) wird voraussichtlich von 2025 bis 2032 die höchste durchschnittliche jährliche Wachstumsrate verzeichnen, da klinische Studien zunehmend pädiatrische, geriatrische und spezielle Bevölkerungsgruppen einbeziehen, die ihre Ergebnisse nicht zuverlässig selbst auswerten können. OBSRO-Lösungen ermöglichen es Pflegekräften, Eltern oder geschulten Beobachtern, wichtige klinische und verhaltensbezogene Daten im Namen des Patienten zu erfassen. Diese Methode gewährleistet eine qualitativ hochwertige, standardisierte Datenerfassung bei gleichzeitiger Wahrung der Patientensicherheit und -compliance. Das Segment profitiert von der Entwicklung mobiler und Wearable-gestützter OBSRO-Plattformen, die Datenerfassung und -analyse in Echtzeit ermöglichen. Die zunehmende regulatorische Betonung patientenzentrierter Studien und präziser Datenerfassung unterstützt das Wachstum des OBSRO-Segments zusätzlich.
- Nach Endbenutzer
Auf Basis der Endnutzer ist der Markt für elektronische klinische Ergebnisbewertungen (eCOA) im asiatisch-pazifischen Raum in kommerzielle Dienstleister, Krankenhäuser und Transplantationszentren, Forschungslabore und akademische Einrichtungen segmentiert. Das Segment der kommerziellen Dienstleister dominierte den Markt mit dem größten Umsatzanteil von 39,8 % im Jahr 2024, was auf ihre zentrale Rolle bei der Durchführung ausgelagerter klinischer Studien für Pharma- und Biotechunternehmen zurückzuführen ist. Diese Anbieter nutzen eCOA-Plattformen, um eine konsistente, genaue und konforme Datenerfassung bei Studien an mehreren Standorten sicherzustellen, die Effizienz zu steigern und Zeitpläne zu verkürzen. Sie profitieren außerdem von cloudbasierten und mobilen eCOA-Lösungen, die eine zentrale Überwachung und Echtzeit-Berichterstattung ermöglichen. Kommerzielle Dienstleister setzen zunehmend integrierte eCOA-Lösungen ein, um umfassende Dienstleistungen anzubieten, darunter Patientenrekrutierung, -bindung und Studienüberwachung. Darüber hinaus treibt ihre Fähigkeit, groß angelegte Studien zu verwalten und eine robuste Support-Infrastruktur bereitzustellen, kontinuierliche Investitionen in fortschrittliche eCOA-Systeme voran.
Krankenhäuser und Transplantationszentren werden voraussichtlich zwischen 2025 und 2032 mit 22,1 % die höchste Wachstumsrate verzeichnen. Grund hierfür ist die zunehmende Nutzung von eCOA-Systemen zur Patientenüberwachung, elektronischen Patientenaktenführung und Integration in Krankenhausinformationssysteme. Diese Einrichtungen nehmen zunehmend an multizentrischen klinischen Studien teil und benötigen standardisierte Plattformen für die Datenerfassung und -berichterstattung. eCOA-Lösungen ermöglichen es Ärzten, Patienten aus der Ferne zu überwachen, Ergebnisse in Echtzeit zu erfassen und die Compliance zu verbessern. Die Integration in elektronische Patientenakten (EHRs) gewährleistet die nahtlose Übertragung klinischer Daten bei gleichzeitiger Einhaltung gesetzlicher Vorschriften. Krankenhäuser profitieren zudem von einer verbesserten Patienteneinbindung durch mobile PRO-Module, die die Studienspeicherung und Datenzuverlässigkeit verbessern.
- Nach Plattform
Auf Basis der Plattformen ist der Markt für elektronische klinische Ergebnisbewertungen (eCOA) im asiatisch-pazifischen Raum in Auftragsforschungsinstitute (CROs), Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte, Krankenhäuser und klinische Labore, Beratungsunternehmen, Forschungs- und Wissenschaftseinrichtungen und weitere segmentiert. Das CRO-Segment dominierte den Markt mit einem Umsatzanteil von 41,5 % im Jahr 2024, getrieben durch das zunehmende Outsourcing klinischer Studien und die Nutzung von eCOA-Plattformen für patientenzentrierte Datenerfassung, Einhaltung gesetzlicher Vorschriften und betriebliche Effizienz. CROs bevorzugen zunehmend integrierte digitale Studienlösungen, die eCOA, eConsent und Fernüberwachungsfunktionen kombinieren. Dieser Ansatz verkürzt die Studiendauer, verbessert die Datenqualität und ermöglicht eine nahtlose Zusammenarbeit mit Sponsoren und Standorten in mehreren Regionen. Darüber hinaus investieren CROs in cloudbasierte und mobile eCOA-Lösungen, um dezentrale und hybride Studienmodelle zu unterstützen. Der Bedarf an Echtzeitüberwachung, -analyse und -berichterstattung fördert die Einführung von eCOA-Lösungen im CRO-Betrieb zusätzlich.
Pharma- und Biopharmaunternehmen werden voraussichtlich zwischen 2025 und 2032 die höchste durchschnittliche jährliche Wachstumsrate verzeichnen. Dies wird durch den zunehmenden Fokus auf digitale Lösungen für klinische Studien und patientenberichtete Ergebnisse zur Beschleunigung der Arzneimittelentwicklung unterstützt. Diese Unternehmen nutzen eCOA-Plattformen, um genaue Wirksamkeits- und Sicherheitsdaten zu erfassen, das Studiendesign zu optimieren und die Einreichungsbereitschaft für Zulassungsanträge zu verbessern. Die Integration mit anderen digitalen Lösungen wie Systemen zum Management klinischer Studien (CTMS) und Systemen zur elektronischen Datenerfassung (EDC) steigert die betriebliche Effizienz. Darüber hinaus setzen Pharmasponsoren zunehmend auf patientenzentrierte Studienmodelle, die robuste eCOA-Systeme zur Erfassung hochwertiger Echtzeitdaten erfordern.
Regionale Marktanalyse für elektronische klinische Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum
- China dominierte den Markt für elektronische klinische Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum mit dem größten Umsatzanteil von 39 % im Jahr 2024. Dies ist gekennzeichnet durch zunehmende klinische Studienaktivitäten, eine schnelle Einführung der digitalen Gesundheit und die Präsenz wichtiger Branchenakteure mit einer signifikanten Akzeptanz von eCOA-Lösungen in multizentrischen und dezentralen klinischen Studien.
- Klinische Forscher und Sponsoren in der Region schätzen die Genauigkeit, den Echtzeit-Datenzugriff und die patientenzentrierten Funktionen der eCOA-Plattformen sehr. Diese optimieren die Datenerfassung und verbessern die Compliance sowohl bei krankenhausbasierten als auch bei dezentralen Studien.
- Diese breite Akzeptanz wird durch steigende Investitionen in die Gesundheitsinfrastruktur, die zunehmende Zusammenarbeit zwischen Pharmaunternehmen und CROs sowie eine zunehmende Anzahl dezentraler und hybrider klinischer Studien weiter unterstützt, wodurch sich eCOA-Lösungen als bevorzugtes Instrument für die klinische Forschung im gesamten asiatisch-pazifischen Raum etablieren.
Der China eCOA Market Insight
Der chinesische Markt für elektronische klinische Ergebnisbewertungen (eCOA) erzielte 2024 mit 38,5 % den größten Umsatzanteil im asiatisch-pazifischen Raum. Dieser Anteil ist auf das schnelle Wachstum klinischer Studien, die zunehmende Nutzung digitaler Gesundheitstechnologien und unterstützende staatliche Initiativen zur Förderung der elektronischen Patientendatenerfassung zurückzuführen. Klinische Forscher und Sponsoren legen zunehmend Wert auf die Echtzeit-, präzise und patientenzentrierte Datenerfassung, um Studien zu optimieren. Darüber hinaus verbessert die Integration mobiler Plattformen und Cloud-Lösungen die Zugänglichkeit und die betriebliche Effizienz multizentrischer Studien.
Japan eCOA Markteinblick
Der japanische Markt für elektronische klinische Ergebnisbewertungen (eCOA) gewinnt aufgrund der fortschrittlichen Gesundheitsinfrastruktur, des Einsatzes hochtechnologischer Technologien und der zunehmenden Konzentration auf patientenzentrierte klinische Studien an Dynamik. Der Markt legt Wert auf sichere, präzise und benutzerfreundliche Lösungen zur elektronischen Datenerfassung, insbesondere bei krankenhausbasierten und dezentralen Studien. Die Integration mobiler Geräte und Analysetools steigert Effizienz und Compliance, während die alternde Bevölkerung die Nachfrage nach Plattformen erhöht, die die Berichterstattung für ältere Patienten vereinfachen.
Indien eCOA Markteinblick
Der indische Markt für elektronische klinische Ergebnisbewertungen (eCOA) hatte 2024 einen erheblichen Umsatzanteil im asiatisch-pazifischen Raum. Dies ist auf das wachsende klinische Forschungsökosystem des Landes, steigende Investitionen in digitale Gesundheitstechnologien und die schnelle Einführung mobiler und webbasierter Berichtslösungen zurückzuführen. Indien entwickelt sich zu einem Zentrum für multinationale und lokale klinische Studien, und die zunehmende Verfügbarkeit kostengünstiger eCOA-Plattformen sowie staatliche Initiativen zur Förderung der digitalen Gesundheit treiben das Marktwachstum voran.
Australien eCOA Markteinblick
Der australische Markt für elektronische klinische Ergebnisbewertungen (eCOA) dürfte aufgrund der zunehmenden Fokussierung auf dezentrale Studien, digitale Patienteneinbindung und die Nutzung cloud- und webbasierter eCOA-Plattformen stetig wachsen. Die robuste Gesundheitsinfrastruktur des Landes und der hohe Stellenwert der Einhaltung gesetzlicher Vorschriften fördern den Einsatz sicherer und effizienter elektronischer Ergebnisbewertungstools. Die Integration mit Krankenhausinformationssystemen und Plattformen für das Management klinischer Studien unterstützt die Marktexpansion zusätzlich.
Südkorea eCOA Markteinblick
Der südkoreanische Markt für elektronische klinische Ergebnisbewertungen (eCOA) verzeichnet Wachstum, das durch technologische Fortschritte bei klinischen Studien, starke staatliche Unterstützung für die Einführung digitaler Gesundheitssysteme und eine steigende Nachfrage nach patientenbezogenen Ergebniserfassungen vorangetrieben wird. Krankenhäuser und Forschungseinrichtungen nutzen zunehmend mobile und Cloud-basierte eCOA-Lösungen, um die Patienteneinbindung zu stärken, die Datenqualität zu verbessern und Studienlaufzeiten zu beschleunigen. Der Fokus auf regulatorische Compliance und Datensicherheit stärkt das Marktvertrauen zusätzlich.
Marktanteil der elektronischen klinischen Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum
Die Branche der elektronischen klinischen Ergebnisbewertung (eCOA) im asiatisch-pazifischen Raum wird hauptsächlich von etablierten Unternehmen angeführt, darunter:
- IQVIA (USA)
- Medidata Solutions, Inc. (USA)
- Clario (USA)
- ArisGlobal (USA)
- Signant Health (USA)
- TransPerfect (USA)
- Cloudbyz (USA)
- Climedo Health GmbH (Deutschland)
- ClinCapture (USA)
- Veeva Systems (USA)
- ObvioHealth (USA)
- Novotech (Australien)
- Parexel International (MA) Corporation (USA)
- Anju Software, Inc. (USA)
- Kayentis (Frankreich)
- The Diary Pte. Ltd (Singapur)
- Bracket Global LLC (USA)
- Dassault Systèmes SE (Frankreich)
- CRF Health (USA)
- ERT Clinical (USA)
Was sind die jüngsten Entwicklungen auf dem Markt für elektronische klinische Ergebnisbeurteilungen (eCOA) im asiatisch-pazifischen Raum?
- Im Mai 2025 gab Clario den Abschluss der Übernahme des Geschäftsbereichs Electronic Clinical Outcome Assessment (eCOA) von WCG bekannt. Diese strategische Akquisition erweitert Clarios Fähigkeiten bei der Bereitstellung digitaler Endpunktdatenlösungen, insbesondere im Bereich der Neurowissenschaften, durch die Integration der Expertise und Technologie von WCG. Der Schritt soll Clarios Marktposition weltweit, auch im asiatisch-pazifischen Raum, stärken, indem er seinen Kunden umfassendere Lösungen anbietet.
- Im Februar 2024 beleuchtete ein IQVIA-Blogbeitrag die Strategien des Unternehmens zur Beschleunigung der eCOA-Implementierung, um den Anstieg dezentraler klinischer Studien (DCTs) zu unterstützen. Der Artikel betonte die Vorteile der umfangreichen Bibliothek vorgefertigter und vorvalidierter Bewertungen, die dazu beitragen, die Studienstartzeiten von mehreren Monaten auf wenige Wochen zu verkürzen. Dieser Fokus auf Agilität und Effizienz ist zu einem Eckpfeiler des IQVIA-Ansatzes im asiatisch-pazifischen Markt geworden, wo DCTs zunehmend an Bedeutung gewinnen.
- Im August 2023 veröffentlichten die chinesische National Medical Products Administration (NMPA) und das Center for Drug Evaluation (CDE) offiziell die „Technischen Richtlinien für die Durchführung patientenzentrierter klinischer Arzneimittelstudien“. Diese Richtlinien bieten einen Rahmen für den Einsatz digitaler Tools wie eCOA, elektronische Einwilligungserklärung und Remote-Datenerfassung und signalisieren damit die offizielle Unterstützung der chinesischen Regierung für die Modernisierung klinischer Studien. Diese regulatorische Klarheit dürfte die zunehmende Nutzung von eCOA-Technologien im Land vorantreiben.
- Im April 2023 gab Almac Clinical Technologies, ein Mitglied der Almac Group, den Start seines IXRS3-Partnerschaftsnetzwerks bekannt. Diese Initiative zielt darauf ab, die Kapazitäten des Unternehmens bei der Bereitstellung fortschrittlicher elektronischer Lösungen zur klinischen Ergebnisbewertung (eCOA) im gesamten asiatisch-pazifischen Raum zu erweitern. Das Netzwerk soll klinische Studien durch die Integration innovativer Technologien und Expertise beschleunigen und so die Effizienz und Effektivität von eCOA-Implementierungen in der Region steigern.
- Im März 2021 gab Veeva Systems bekannt, dass LSK Global Pharma Services Co. Ltd., ein führendes koreanisches Auftragsforschungsinstitut, Veeva Vault eTMF, Veeva Vault CTMS und Veeva SiteVault Free eingeführt hat. Dieser Schritt war Teil der umfassenderen Strategie von Veeva, seine integrierten, cloudbasierten klinischen Lösungen im asiatisch-pazifischen Raum zu erweitern und lokalen Unternehmen dabei zu helfen, das Studienmanagement zu optimieren und global effektiver zusammenzuarbeiten.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.