Global Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Tamaño del mercado en miles de millones de dólares
Tasa de crecimiento anual compuesta (CAGR) :
% 
 USD
543.06 Million
USD
1,593.17 Million
2024
2032
USD
543.06 Million
USD
1,593.17 Million
2024
2032
| 2025 –2032 | |
| USD 543.06 Million | |
| USD 1,593.17 Million | |
|
|
|
|
Segmentación del mercado global de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia, por producto (soluciones locales, soluciones en la nube y soluciones web), enfoque (evaluación de resultados informada por el médico [ClinRO], evaluación de resultados informada por el paciente [PRO], evaluación de resultados informada por el observador [ObsRO] y evaluación de resultados de rendimiento [PerfO]), usuario final (proveedores de servicios comerciales, hospitales y centros de trasplantes, laboratorios de investigación e instituciones académicas), plataforma (organizaciones de investigación por contrato, empresas farmacéuticas y biofarmacéuticas, fabricantes de dispositivos médicos, hospitales y laboratorios clínicos, empresas de servicios de consultoría, investigación y academia, entre otros): tendencias del sector y pronóstico hasta 2032.
Evaluación electrónica de resultados clínicos (eCOA) para el tamaño del mercado de contenido con licencia
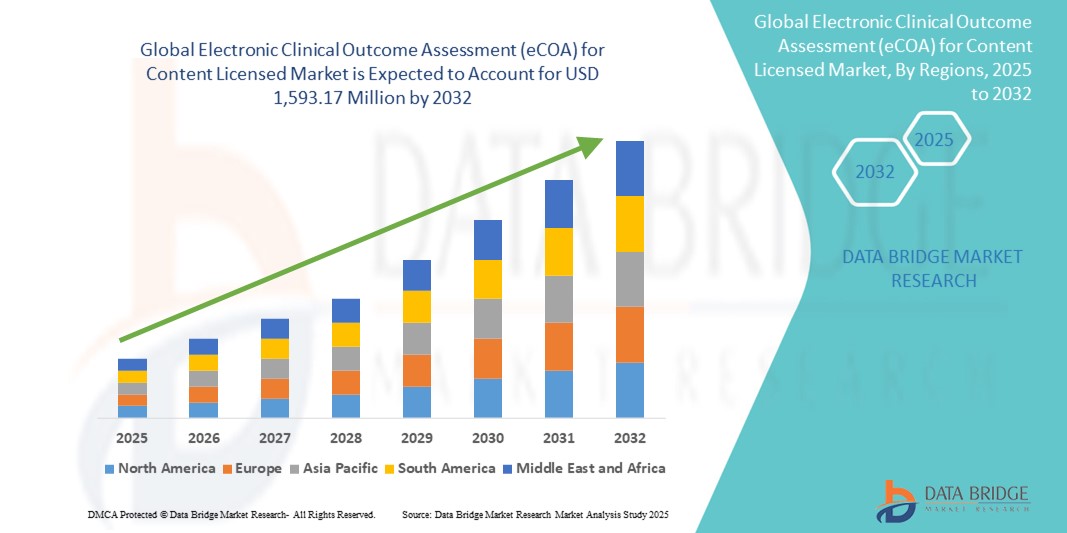
- El tamaño del mercado global de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia se valoró en USD 543,06 millones en 2024 y se espera que alcance los USD 1.593,17 millones para 2032 , con una CAGR del 14,40 % durante el período de pronóstico.
- El crecimiento del mercado está impulsado en gran medida por la creciente demanda de transformación digital en ensayos clínicos y el énfasis creciente en la recopilación de datos en tiempo real centrados en el paciente que mejoran la calidad y el cumplimiento de los ensayos.
- Además, el creciente apoyo regulatorio y la adopción por parte de la industria farmacéutica de contenido eCOA estandarizado y validado están posicionando las soluciones eCOA con licencia como el método preferido para capturar criterios de valoración clínicos. Estos factores convergentes están acelerando la adopción de herramientas eCOA con licencia, impulsando así significativamente el crecimiento de la industria.
Evaluación electrónica de resultados clínicos (eCOA) para el análisis de mercado de contenido con licencia
- Las soluciones eCOA con licencia, que capturan digitalmente los resultados informados por el paciente, el médico y el observador, se están convirtiendo en herramientas esenciales en la investigación clínica moderna debido a su mayor precisión de datos, acceso en tiempo real y compatibilidad con modelos de ensayos descentralizados.
- La creciente demanda de contenido eCOA con licencia se ve impulsada principalmente por la creciente complejidad de los ensayos clínicos, el énfasis regulatorio en métodos de recopilación de datos estandarizados y validados y la creciente adopción de plataformas de salud digital por parte de empresas farmacéuticas y biotecnológicas.
- América del Norte dominó el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia con la mayor participación en los ingresos del 46,8 % en 2024, atribuido a una sólida infraestructura regulatoria, la adopción temprana de tecnologías clínicas digitales y la presencia de importantes organizaciones de investigación clínica y proveedores de soluciones eCOA.
- Se espera que Asia-Pacífico sea la región de más rápido crecimiento en el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia durante el período de pronóstico debido a la expansión de las actividades de investigación clínica, la armonización regulatoria y un enfoque creciente en la recopilación de datos centrados en el paciente.
- El segmento de evaluación de resultados informados por el paciente (PRO) dominó el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia con una participación del 50,2 % en 2024, impulsado por su papel fundamental en la evaluación de la eficacia del tratamiento y el bienestar del paciente, junto con un mayor énfasis en la captura de aportes directos del paciente en los protocolos de ensayos.
Alcance del informe y evaluación electrónica de resultados clínicos (eCOA) para la segmentación del mercado de contenido con licencia
|
Atributos |
Evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia: información clave del mercado |
|
Segmentos cubiertos |
|
|
Países cubiertos |
América del norte
Europa
Asia-Pacífico
Oriente Medio y África
Sudamerica
|
|
Actores clave del mercado |
|
|
Oportunidades de mercado |
|
|
Conjuntos de información de datos de valor añadido |
Además de los conocimientos sobre escenarios de mercado, como valor de mercado, tasa de crecimiento, segmentación, cobertura geográfica y actores principales, los informes de mercado seleccionados por Data Bridge Market Research también incluyen análisis en profundidad de expertos, análisis de precios, análisis de participación de marca, encuesta de consumidores, análisis demográfico, análisis de la cadena de suministro, análisis de la cadena de valor, descripción general de materias primas/consumibles, criterios de selección de proveedores, análisis PESTLE, análisis de Porter y marco regulatorio. |
Tendencias del mercado de la evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia
Estandarización digital y mejoras impulsadas por IA en ensayos clínicos
- Una tendencia significativa y en evolución en el mercado global de eCOA para el contenido con licencia es la integración de la inteligencia artificial (IA) y el contenido digital estandarizado para mejorar la calidad de los datos, el cumplimiento normativo y la participación de los pacientes en los ensayos clínicos. Esta convergencia está optimizando la captura de datos y mejorando la eficiencia de los ensayos.
- Por ejemplo, empresas como Medidata Solutions y ERT ofrecen soluciones de eCOA con licencia y optimizadas con IA que permiten la monitorización en tiempo real de la información de los pacientes y el análisis predictivo para una mejor previsión de los resultados de los ensayos. Las plataformas basadas en IA pueden detectar anomalías en los datos, impulsar la revalidación y respaldar diseños de ensayos adaptativos.
- El contenido de eCOA con licencia garantiza que todos los resultados informados por pacientes, médicos y observadores cumplan con los estándares regulatorios y científicos, lo que promueve la consistencia y la confiabilidad en estudios multinacionales. Estas licencias de contenido se combinan cada vez más con plataformas avanzadas de eCOA para ofrecer soluciones integrales.
- La integración con plataformas de consentimiento electrónico y dispositivos portátiles mejora aún más el cumplimiento del paciente y reduce la carga de trabajo del centro al automatizar los flujos de trabajo de captura de datos. Por ejemplo, Signant Health permite vincular las medidas de PRO autorizadas con los datos biométricos de los dispositivos portátiles para una comprensión más integral del impacto del tratamiento.
- La tendencia hacia contenido digitalizado y validado dentro de plataformas eCOA con capacidad de IA está transformando la forma en que las partes interesadas realizan y gestionan ensayos clínicos globales. Por ello, empresas como IQVIA y Kayentis están invirtiendo en bibliotecas de contenido escalables, multilingües y con licencia, integradas en plataformas intuitivas y optimizadas con IA.
- La demanda de soluciones eCOA con contenido preaprobado y que cumple con las normativas está creciendo rápidamente, ya que los patrocinadores y las CRO buscan reducir los riesgos de los ensayos y mejorar tanto la experiencia del paciente como la precisión de los datos a través de herramientas digitales inteligentes.
Evaluación electrónica de resultados clínicos (eCOA) para la dinámica del mercado de contenido con licencia
Conductor
Aumento de la demanda regulatoria y la transición digital en la investigación clínica
- El creciente énfasis en la estandarización de datos y el cumplimiento normativo en los ensayos clínicos, junto con la transformación digital de los procesos de investigación clínica, es un impulsor principal del mercado de contenido eCOA con licencia.
- Por ejemplo, en marzo de 2024, Clinical Ink lanzó un conjunto de instrumentos de eCOA prevalidados y con licencia para ensayos globales, lo que agilizó el tiempo de configuración y redujo el riesgo regulatorio. Estas iniciativas destacan el impulso de la industria hacia métodos validados de captura digital de datos.
- A medida que los patrocinadores de ensayos y las autoridades reguladoras priorizan los resultados centrados en el paciente y la generación de evidencia sólida, los instrumentos eCOA con licencia ofrecen metodologías validadas científicamente que cumplen con las expectativas regulatorias, lo que reduce las demoras en la aprobación de ensayos o la presentación de datos.
- La creciente transición hacia ensayos clínicos descentralizados e híbridos también ha acelerado la demanda de herramientas digitales que garanticen la recopilación consistente de datos de pacientes en diversas geografías y poblaciones. El contenido con licencia integrado en plataformas digitales mejora la escalabilidad y el cumplimiento normativo.
- Además, la accesibilidad mejorada a las herramientas eCOA a través de dispositivos móviles, combinada con interfaces intuitivas y soporte multilingüe, está impulsando la adopción entre los participantes de ensayos globales, lo que contribuye a una mayor participación de los pacientes y confiabilidad de los datos.
Restricción/Desafío
“Modelos de licencias complejos y barreras de integración”
- Uno de los principales desafíos en la adopción de contenido eCOA licenciado es la complejidad de los acuerdos de licencia y su integración en los sistemas clínicos. La multiplicidad de actores, los altos costos y las variaciones regulatorias regionales pueden retrasar o complicar la implementación.
- Por ejemplo, la concesión de licencias para ciertos PRO estandarizados como el EQ-5D o el SF-36 puede implicar negociaciones intrincadas con los propietarios de contenido, especialmente cuando se utilizan en ensayos multinacionales, lo que aumenta los plazos y los costos del proyecto.
- Además, la integración de contenido con licencia en plataformas existentes de captura electrónica de datos (EDC) o eSource a menudo requiere desarrollo personalizado o middleware, lo que puede generar demoras técnicas o una mayor carga operativa.
- Garantizar la interoperabilidad entre los instrumentos eCOA con licencia y los sistemas de patrocinadores/CRO sigue siendo un obstáculo técnico, en particular cuando se gestionan diversos dispositivos, entornos de ensayo y poblaciones de pacientes.
- Los altos costos iniciales de las bibliotecas de contenido validado y las tarifas de licencias constantes también pueden disuadir la adopción entre empresas de biotecnología más pequeñas o investigadores académicos con presupuestos limitados.
- Superar estas barreras a través de marcos de licencias unificados, modelos de implementación basados en la nube y herramientas de integración fáciles de usar será crucial para expandir el uso de contenido eCOA con licencia en futuras investigaciones clínicas.
Evaluación electrónica de resultados clínicos (eCOA) para el alcance del mercado de contenido con licencia
El mercado está segmentado en función del producto, el enfoque, el usuario final y la plataforma.
- Por producto
En función del producto, el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia se segmenta en soluciones locales, soluciones en la nube y soluciones web. El segmento de soluciones en la nube dominó el mercado con la mayor cuota de mercado en 2024, gracias a su escalabilidad, facilidad de implementación y capacidad para respaldar ensayos clínicos descentralizados e híbridos. Los patrocinadores y las CRO prefieren cada vez más las plataformas de eCOA en la nube, ya que ofrecen captura de datos en tiempo real, acceso remoto e integración fluida con otros sistemas eClinical, a la vez que reducen los costes de infraestructura y la complejidad de TI.
Se prevé que el segmento de soluciones web experimente el mayor crecimiento entre 2025 y 2032, impulsado por la creciente penetración de internet, la expansión global de los ensayos clínicos y la demanda de plataformas accesibles desde navegador que requieren una configuración mínima. Las herramientas de eCOA web ofrecen amplia accesibilidad a pacientes y centros de ensayo en todas las regiones y tipos de dispositivos, lo que impulsa su adopción en estudios multinacionales.
- Por enfoque
Según este enfoque, la evaluación electrónica de resultados clínicos (eCOA) para el mercado de contenido con licencia se segmenta en Evaluación de Resultados Informados por el Clínico (ClinRO), Evaluación de Resultados Informados por el Paciente (PRO), Evaluación de Resultados Informados por el Observador (ObsRO) y Evaluación de Resultados de Desempeño (PerfO). El segmento de resultados informados por el paciente (PRO) dominó el mercado con la mayor participación en los ingresos, con un 50,2 % en 2024, a medida que los organismos reguladores exigen cada vez más la inclusión de la perspectiva del paciente en la investigación clínica. Los instrumentos PRO con licencia proporcionan métodos validados y estandarizados para evaluar la calidad de vida, los síntomas y el impacto del tratamiento desde la perspectiva del paciente, lo que contribuye a una evidencia clínica más sólida y a la presentación de solicitudes regulatorias.
Se prevé que el segmento de evaluación de resultados de rendimiento (PerfO) experimente el mayor crecimiento entre 2025 y 2032, debido a la creciente demanda de evaluaciones objetivas y funcionales en ensayos clínicos. Las herramientas PerfO capturan datos en tiempo real basados en las tareas realizadas por los pacientes, a menudo mediante dispositivos digitales o wearables, lo que facilita evaluaciones de eficacia y criterios de valoración de ensayos más precisos.
- Por el usuario final
En función del usuario final, el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia se segmenta en proveedores de servicios comerciales, hospitales y centros de trasplantes, laboratorios de investigación e instituciones académicas. El segmento de proveedores de servicios comerciales tuvo la mayor participación en 2024, impulsado por el amplio uso de plataformas eCOA por parte de organizaciones de investigación por contrato (CRO), empresas de gestión de datos y proveedores de tecnología. Estos proveedores de servicios actúan como intermediarios entre los patrocinadores y los centros clínicos, implementando soluciones de contenido con licencia a gran escala y garantizando el cumplimiento de los protocolos de los ensayos clínicos y los estándares globales.
Se prevé que el segmento de instituciones académicas crezca a su ritmo más rápido entre 2025 y 2032, impulsado por el aumento de las iniciativas de investigación académica, un mayor acceso a financiación para herramientas clínicas digitales y ensayos colaborativos con socios de la industria. La adopción de herramientas de eCOA con contenido licenciado en estudios académicos favorece una mayor precisión y reproducibilidad de los datos.
- Por plataforma
Según la plataforma, el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido licenciado se segmenta en organizaciones de investigación por contrato (CRO), compañías farmacéuticas y biofarmacéuticas, fabricantes de dispositivos médicos, hospitales y laboratorios clínicos, empresas de servicios de consultoría, investigación y academia, entre otros. El segmento de compañías farmacéuticas y biofarmacéuticas dominó el mercado en 2024, ya que estas organizaciones impulsan la mayoría de los ensayos clínicos globales y requieren soluciones de eCOA validadas y que cumplan con las regulaciones para obtener resultados centrados en el paciente. Su inversión en contenido licenciado mejora la eficiencia de los ensayos, la consistencia global y la aceptación regulatoria.
Se proyecta que el segmento de las organizaciones de investigación por contrato (CRO) experimente el mayor crecimiento entre 2025 y 2032, impulsado por las tendencias de externalización en el desarrollo clínico. Las CRO adoptan cada vez más plataformas de eCOA llave en mano con contenido licenciado integrado para ofrecer servicios integrales de gestión de ensayos a los patrocinadores, en particular para estudios multinacionales donde las medidas de resultados estandarizadas son cruciales.
Análisis regional del mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia
- América del Norte dominó el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia con la mayor participación en los ingresos del 46,8 % en 2024, atribuido a una sólida infraestructura regulatoria, la adopción temprana de tecnologías clínicas digitales y la presencia de importantes organizaciones de investigación clínica y proveedores de soluciones eCOA.
- Las partes interesadas de la región, incluidas las compañías farmacéuticas, las CRO y las instituciones académicas, priorizan el uso de medidas de resultados validadas y estandarizadas para cumplir con las expectativas de la FDA y la EMA, lo que impulsa la demanda de soluciones eCOA autorizadas.
- El dominio de la región se ve respaldado además por una alta inversión en I+D, ecosistemas eClinical avanzados y un número cada vez mayor de ensayos descentralizados e híbridos, lo que establece el contenido eCOA con licencia como un componente crítico para garantizar la precisión de los datos, el cumplimiento y la participación del paciente en los ensayos clínicos modernos.
Evaluación electrónica de resultados clínicos (eCOA) de EE. UU. para el análisis del mercado de contenido con licencia
El mercado estadounidense de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia capturó la mayor participación en los ingresos, con un 79,5 %, en 2024 en Norteamérica, gracias al liderazgo del país en la actividad de ensayos clínicos y al cumplimiento normativo de las medidas de resultados estandarizadas. El impulso de la FDA al desarrollo de fármacos centrado en el paciente y a los instrumentos PRO validados continúa impulsando la adopción generalizada de herramientas eCOA con licencia. Además, la prevalencia de ensayos descentralizados y la rápida adopción de tecnologías de salud digital por parte de patrocinadores y CRO impulsan aún más la demanda de plataformas eCOA con contenido con licencia y que cumple con las normativas.
Evaluación electrónica de resultados clínicos (eCOA) en Europa para el conocimiento del mercado de contenido con licencia
Se proyecta que el mercado europeo de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia se expanda a una tasa de crecimiento anual compuesta (TCAC) sustancial durante el período de pronóstico, impulsado principalmente por la armonización regulatoria de la región bajo la EMA y la creciente inversión en investigación centrada en el paciente. El creciente número de ensayos multinacionales y la demanda de contenido multilingüe y validado de PRO y ObsRO están impulsando su adopción. La tendencia hacia la digitalización de todos los aspectos de los ensayos clínicos, incluyendo el consentimiento y las evaluaciones de resultados, impulsa la expansión del mercado en todas las áreas terapéuticas y redes de investigación clínica.
Evaluación electrónica de resultados clínicos (eCOA) del Reino Unido para el conocimiento del mercado de contenido con licencia
Se prevé que el mercado británico de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia crezca a una tasa de crecimiento anual compuesta (TCAC) notable durante el período de pronóstico, impulsado por las iniciativas de salud digital respaldadas por el NHS y un enfoque en la generación de evidencia práctica. El énfasis en la captura de resultados de pacientes en un formato digital estandarizado ha animado a las compañías farmacéuticas y a las instituciones de investigación a invertir en instrumentos de eCOA con licencia. Además, el sólido ecosistema de investigación académica y la activa participación en ensayos clínicos en todo el país están impulsando una mayor adopción de eCOA.
Evaluación electrónica de resultados clínicos (eCOA) de Alemania para el conocimiento del mercado de contenido con licencia
Se espera que el mercado alemán de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia crezca a una tasa de crecimiento anual compuesta (TCAC) considerable durante el período de pronóstico, gracias al fuerte énfasis del país en el cumplimiento normativo, la calidad de los datos clínicos y la innovación en la atención médica digital. Las industrias farmacéutica y de tecnología médica alemanas son pioneras en la adopción de contenido eCOA validado, especialmente en ensayos clínicos de oncología y enfermedades raras. El compromiso del país con la medicina de precisión y la privacidad de datos se alinea con las soluciones de eCOA con licencia, que ofrecen una captura de resultados segura y estandarizada.
eCOA de la evaluación electrónica de resultados clínicos de Asia-Pacífico para el conocimiento del mercado de contenido con licencia
Se prevé que el mercado de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia en Asia-Pacífico crezca a la tasa de crecimiento anual compuesta (TCAC) más rápida, del 23,2 %, durante el período de pronóstico de 2025 a 2032, impulsado por un aumento en la actividad de ensayos clínicos en las economías emergentes y una mayor inversión en infraestructura de salud digital. Países como China, Japón e India están acelerando su adopción gracias a su participación en ensayos globales, la localización de contenido con licencia y la creciente necesidad de soluciones de eCOA multilingües centradas en el paciente.
Evaluación electrónica de resultados clínicos de Japón (eCOA) para el análisis del mercado de contenido con licencia
El mercado japonés de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia está cobrando impulso gracias al énfasis del país en la innovación sanitaria, la atención a personas mayores y una rigurosa supervisión regulatoria. Las compañías farmacéuticas japonesas están adoptando herramientas PRO y ClinRO con licencia para garantizar la calidad de los datos en ensayos clínicos avanzados y la vigilancia poscomercialización. La integración de los sistemas eCOA con plataformas eClínicas más amplias y dispositivos médicos IoT facilita una mayor participación del paciente y la monitorización de resultados.
eCOA de la evaluación electrónica de resultados clínicos de la India para el conocimiento del mercado de contenido con licencia
El mercado indio de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia representó la mayor cuota de mercado en ingresos en Asia-Pacífico en 2024, gracias al creciente panorama de ensayos clínicos del país, la rápida transformación digital y la prestación de servicios rentables por parte de las CRO. La digitalización de la atención médica, impulsada por el gobierno, y el auge de los proveedores nacionales de tecnología eClinic están acelerando la adopción de instrumentos de eCOA con licencia. La población multilingüe de la India y la diversidad de entornos sanitarios también impulsan la demanda de contenido flexible y validado, adaptado a las necesidades de los ensayos regionales.
Evaluación electrónica de resultados clínicos (eCOA) para la cuota de mercado de contenido con licencia
La evaluación electrónica de resultados clínicos (eCOA) para la industria de contenido con licencia está dirigida principalmente por empresas bien establecidas, entre las que se incluyen:
- Medidata Solutions, Inc. (EE. UU.)
- Signant Health (EE. UU.)
- IQVIA Inc. (EE. UU.)
- YPrime, Inc. (EE. UU.)
- Clario (EE. UU.)
- Clinical Ink, Inc. (EE. UU.)
- ERT, Inc. (EE. UU.)
- Kayentis SAS (Francia)
- Veeva Systems Inc. (EE. UU.)
- Oracle Health Sciences (EE. UU.)
- Parexel International Corporation (EE. UU.)
- eResearch Technology, Inc. (EE. UU.)
- ArisGlobal LLC (EE. UU.)
- Cáliz (EE. UU.)
- Castor EDC (Países Bajos)
- Datatrak International, Inc. (EE. UU.)
- Medrio, Inc. (EE. UU.)
- OpenClinica, LLC (EE. UU.)
- Trial By Fire Solutions, LLC (EE. UU.)
¿Cuáles son los últimos avances en el mercado global de evaluación electrónica de resultados clínicos (eCOA) para contenido con licencia?
- En mayo de 2024, Medidata Solutions, una empresa de Dassault Systèmes, lanzó una versión mejorada de su plataforma myMedidata, que ofrece mayor compatibilidad con evaluaciones de resultados clínicos con licencia en ensayos globales. Esta actualización incluye instrumentos eCOA multilingües y validados, perfectamente integrados con eConsent y datos portátiles, lo que agiliza la ejecución descentralizada de ensayos. Este lanzamiento refuerza el compromiso de Medidata con la entrega de soluciones unificadas y que cumplen con las normativas, que mejoran la participación del paciente y la integridad de los datos en todas las áreas terapéuticas.
- En abril de 2024, Signant Health anunció la expansión de su biblioteca de contenido licenciado mediante nuevos acuerdos con varios licenciantes de medidas PRO. Esta medida permite una implementación más rápida de medidas de resultados estandarizadas dentro de su plataforma eCOA, especialmente para estudios de oncología y del sistema nervioso central (SNC). Este avance subraya la estrategia de Signant de fortalecer sus capacidades en la captura de datos validados, a la vez que reduce el tiempo de configuración para ensayos globales.
- En marzo de 2024, IQVIA presentó su suite eCOA mejorada con IA, integrada con los profesionales de la salud (PRO) autorizados, para optimizar la recopilación de datos en la investigación clínica y en el mundo real. La plataforma utiliza análisis predictivos e indicaciones inteligentes para pacientes para mejorar las tasas de respuesta y minimizar la brecha de datos, lo que refleja el enfoque de IQVIA en la innovación y la adaptación regulatoria en ensayos digitales.
- En febrero de 2024, YPrime se asoció con varias instituciones académicas para ofrecer soluciones de eCOA preautorizadas para ensayos de enfermedades raras, acelerando así el inicio de los estudios y mejorando el cumplimiento normativo. Esta colaboración facilita un acceso más amplio a medidas de resultados difíciles de obtener, lo que pone de relieve el compromiso de YPrime con la expansión de las capacidades de investigación en áreas terapéuticas desatendidas.
- En enero de 2024, Clinical Ink lanzó una nueva plataforma digital que ofrece acceso inmediato a instrumentos eCOA validados y con licencia para su uso en ensayos descentralizados. Diseñada para simplificar la implementación global, la solución incluye traducciones integradas y seguimiento automatizado del cumplimiento, lo que refleja el objetivo de la empresa de lograr una implementación de eCOA más eficiente, escalable y alineada con las cambiantes expectativas regulatorias.
SKU-
Obtenga acceso en línea al informe sobre la primera nube de inteligencia de mercado del mundo
- Panel de análisis de datos interactivo
- Panel de análisis de empresas para oportunidades con alto potencial de crecimiento
- Acceso de analista de investigación para personalización y consultas
- Análisis de la competencia con panel interactivo
- Últimas noticias, actualizaciones y análisis de tendencias
- Aproveche el poder del análisis de referencia para un seguimiento integral de la competencia
Metodología de investigación
La recopilación de datos y el análisis del año base se realizan utilizando módulos de recopilación de datos con muestras de gran tamaño. La etapa incluye la obtención de información de mercado o datos relacionados a través de varias fuentes y estrategias. Incluye el examen y la planificación de todos los datos adquiridos del pasado con antelación. Asimismo, abarca el examen de las inconsistencias de información observadas en diferentes fuentes de información. Los datos de mercado se analizan y estiman utilizando modelos estadísticos y coherentes de mercado. Además, el análisis de la participación de mercado y el análisis de tendencias clave son los principales factores de éxito en el informe de mercado. Para obtener más información, solicite una llamada de un analista o envíe su consulta.
La metodología de investigación clave utilizada por el equipo de investigación de DBMR es la triangulación de datos, que implica la extracción de datos, el análisis del impacto de las variables de datos en el mercado y la validación primaria (experto en la industria). Los modelos de datos incluyen cuadrícula de posicionamiento de proveedores, análisis de línea de tiempo de mercado, descripción general y guía del mercado, cuadrícula de posicionamiento de la empresa, análisis de patentes, análisis de precios, análisis de participación de mercado de la empresa, estándares de medición, análisis global versus regional y de participación de proveedores. Para obtener más información sobre la metodología de investigación, envíe una consulta para hablar con nuestros expertos de la industria.
Personalización disponible
Data Bridge Market Research es líder en investigación formativa avanzada. Nos enorgullecemos de brindar servicios a nuestros clientes existentes y nuevos con datos y análisis que coinciden y se adaptan a sus objetivos. El informe se puede personalizar para incluir análisis de tendencias de precios de marcas objetivo, comprensión del mercado de países adicionales (solicite la lista de países), datos de resultados de ensayos clínicos, revisión de literatura, análisis de mercado renovado y base de productos. El análisis de mercado de competidores objetivo se puede analizar desde análisis basados en tecnología hasta estrategias de cartera de mercado. Podemos agregar tantos competidores sobre los que necesite datos en el formato y estilo de datos que esté buscando. Nuestro equipo de analistas también puede proporcionarle datos en archivos de Excel sin procesar, tablas dinámicas (libro de datos) o puede ayudarlo a crear presentaciones a partir de los conjuntos de datos disponibles en el informe.