Global Medical Device Testing Market
Tamaño del mercado en miles de millones de dólares
Tasa de crecimiento anual compuesta (CAGR) :
% 
 USD
5.20 Billion
USD
11.82 Billion
202
2032
USD
5.20 Billion
USD
11.82 Billion
202
2032
| 203 –2032 | |
| USD 5.20 Billion | |
| USD 11.82 Billion | |
|
|
|
|
Segmentación del mercado global de pruebas de dispositivos médicos por tipo de servicio (servicios de prueba, inspección y certificación), tipo de prueba (pruebas físicas, químicas y biológicas, ciberseguridad, microbiología y esterilidad, entre otras), fase (preclínica y clínica), tipo de abastecimiento (interno y externo), clase de dispositivo (clase I, clase II y clase III), producto (dispositivo médico de implante activo, dispositivo médico activo, dispositivo médico inactivo, dispositivo médico de diagnóstico in vitro, dispositivo médico oftálmico, dispositivo médico ortopédico y dental, dispositivo médico vascular, entre otros): tendencias y pronóstico del sector hasta 2032.
Tamaño del mercado de pruebas de dispositivos médicos
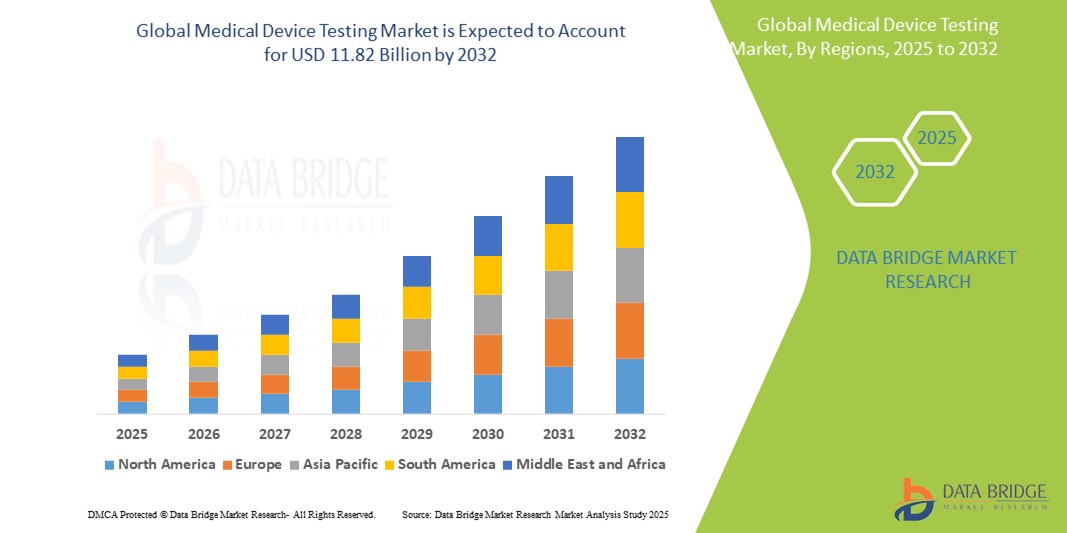
- El tamaño del mercado global de pruebas de dispositivos médicos se valoró en USD 5.20 mil millones en 2024 y se espera que alcance los USD 11.82 mil millones para 2032 , con una CAGR del 10,80% durante el período de pronóstico.
- Este crecimiento se debe a la creciente demanda de dispositivos médicos más seguros y fiables, a los avances tecnológicos en las metodologías de prueba y al creciente número de requisitos regulatorios para la aprobación de dispositivos médicos en todo el mundo. Además, el aumento de las enfermedades crónicas, el envejecimiento de la población y la expansión del sector sanitario contribuyen a la creciente necesidad de realizar pruebas integrales de dispositivos médicos.
Análisis del mercado de pruebas de dispositivos médicos
- Las pruebas de dispositivos médicos son una parte crucial del ciclo de desarrollo del producto, ya que garantizan que los dispositivos médicos cumplan con los estándares regulatorios, sean seguros para el uso del paciente y funcionen según lo previsto en diversas aplicaciones de atención médica, incluidos dispositivos de diagnóstico, monitoreo y terapéuticos.
- La demanda de pruebas de dispositivos médicos está impulsada principalmente por el creciente número de innovaciones en dispositivos médicos, los estrictos requisitos regulatorios y las crecientes preocupaciones con respecto a la seguridad del paciente.
- Norteamérica domina el mercado mundial de pruebas de dispositivos médicos, con una participación significativa en 2024, estimada en aproximadamente el 40,2 %. Este predominio se atribuye a la presencia de importantes fabricantes de dispositivos médicos y marcos regulatorios consolidados.
- La región Asia-Pacífico (APAC) es la de mayor crecimiento en el mercado global de pruebas de dispositivos médicos. Este crecimiento se atribuye a la rápida expansión de la infraestructura sanitaria, el aumento del gasto sanitario y la creciente demanda de tecnologías médicas avanzadas en países como China, India y Japón.
- Se proyecta que el segmento de pruebas de diagnóstico in vitro (IVD) domine el mercado global de pruebas de dispositivos médicos, con aproximadamente el 33 % de la cuota de mercado total. Este dominio se debe a la creciente demanda de herramientas de diagnóstico precisas, especialmente en respuesta a la creciente carga de enfermedades crónicas.
Alcance del informe y segmentación del mercado de pruebas de dispositivos médicos
|
Atributos |
Perspectivas clave del mercado de pruebas de dispositivos médicos |
|
Segmentos cubiertos |
|
|
Países cubiertos |
América del norte
Europa
Asia-Pacífico
Oriente Medio y África
Sudamerica
|
|
Actores clave del mercado |
|
|
Oportunidades de mercado |
|
|
Conjuntos de información de datos de valor añadido |
Además de los conocimientos sobre escenarios de mercado como valor de mercado, tasa de crecimiento, segmentación, cobertura geográfica y actores principales, los informes de mercado seleccionados por Data Bridge Market Research también incluyen análisis de importación y exportación, descripción general de la capacidad de producción, análisis del consumo de producción, análisis de tendencias de precios, escenario de cambio climático, análisis de la cadena de suministro, análisis de la cadena de valor, descripción general de materias primas/consumibles, criterios de selección de proveedores, análisis PESTLE, análisis de Porter y marco regulatorio. |
Tendencias del mercado de pruebas de dispositivos médicos
Integración de soluciones de salud digital e IA en las pruebas de dispositivos
- One prominent trend in the medical device testing market is the increasing integration of digital health solutions and artificial intelligence (AI) in the testing and validation processes. These innovations are enhancing the accuracy, efficiency, and speed of testing, while also improving patient safety
- The incorporation of AI-powered tools and advanced data analytics enables real-time monitoring, predictive testing, and faster regulatory compliance, making it easier for manufacturers to test devices across various stages of development
- For instance, In July 2023, Charles River Laboratories introduced AI-based testing services to speed up the evaluation of medical devices, enhancing testing precision and helping meet the evolving regulatory standards in the U.S.
- These advancements are transforming the medical device testing process, facilitating better decision-making, reducing the time to market for devices, and supporting manufacturers in adhering to stringent regulatory requirements
Medical Device Testing Market Dynamics
Driver
“Increasing Demand for High-Quality and Compliant Medical Devices”
- The growing demand for high-quality, reliable, and compliant medical devices is significantly driving the global medical device testing market. As medical device manufacturers strive to meet stringent regulatory standards and ensure patient safety, there is an increasing need for comprehensive testing solutions across various device categories, including diagnostics, monitoring, and therapeutic devices
- As healthcare systems globally expand, particularly in emerging markets, the demand for advanced medical technologies and devices is rising. This is driving manufacturers to adopt extensive testing protocols to comply with evolving regulations and meet market needs
- Manufacturers are also increasingly seeking specialized, regulatory-compliant, and customizable testing solutions to ensure their products meet both safety and performance standards in the healthcare sector
For instance,
- In March 2024, Charles River Laboratories partnered with a leading European medical device manufacturer to offer advanced testing services, ensuring regulatory compliance and product reliability for their new line of implantable devices
- As a result of the growing need for reliable and compliant medical devices, the demand for comprehensive medical device testing services is experiencing significant growth, especially in regions with expanding healthcare infrastructure and regulatory requirements
Opportunity
“Integration of AI and Automation in Medical Device Testing”
- The integration of AI and automation in medical device testing presents a significant opportunity to enhance efficiency, accuracy, and speed in the testing and validation processes. These technologies can streamline repetitive testing procedures, improve data analysis, and ensure that devices meet regulatory standards more effectively
- Los sistemas basados en IA pueden analizar continuamente los datos de las pruebas, predecir posibles fallos de los dispositivos y automatizar el proceso de documentación, reduciendo así el error humano y garantizando la consistencia de los resultados de las pruebas. Esta automatización permite una comercialización más rápida de los dispositivos médicos, a la vez que garantiza el cumplimiento de las estrictas normativas.
- Se espera que la capacidad de integrar análisis predictivos basados en IA en los sistemas de prueba impulse la demanda de soluciones de prueba de dispositivos médicos más avanzadas y rentables en todas las industrias.
Por ejemplo,
- En enero de 2024, Medistri SA se asoció con la empresa de tecnología centrada en IA Veeva Systems para presentar una nueva plataforma de pruebas impulsada por IA para dispositivos médicos, lo que permite verificaciones automatizadas de cumplimiento normativo y garantía de calidad predictiva para dispositivos de atención médica críticos.
- Se espera que la integración de IA y automatización en las pruebas de dispositivos médicos mejore significativamente la eficiencia de las pruebas, reduzca los costos operativos y mejore la confiabilidad de los dispositivos médicos, lo que lleve a una adopción generalizada de estas tecnologías avanzadas en el mercado global de pruebas de dispositivos médicos.
Restricción/Desafío
Altos costos de las pruebas y el cumplimiento normativo
- Los altos costos asociados con las pruebas de dispositivos médicos y el cumplimiento normativo representan un desafío importante para el crecimiento del mercado, en particular para las pequeñas y medianas empresas (PYME) en los mercados emergentes.
- Las pruebas de dispositivos médicos, especialmente las de dispositivos avanzados o de alto riesgo, requieren una inversión sustancial en equipos especializados, mano de obra cualificada y el cumplimiento de estrictas normativas internacionales. Esto puede suponer una carga financiera considerable para empresas con presupuestos limitados, especialmente cuando las pruebas implican procedimientos complejos como ensayos clínicos o evaluaciones de rendimiento a largo plazo.
- Los costos continuos, incluidas las pruebas para varias agencias reguladoras (por ejemplo, FDA, Marca CE), así como el mantenimiento del cumplimiento de los estándares de atención médica en evolución, pueden aumentar aún más los desafíos financieros para los fabricantes.
Por ejemplo,
- En marzo de 2024, un informe de Eurofins Scientific destacó que los pequeños fabricantes de dispositivos médicos en los mercados emergentes enfrentan desafíos para cumplir con los estándares regulatorios internacionales debido a los costos significativos que implican los procesos integrales de prueba y certificación.
- Estas barreras financieras pueden disuadir a las empresas de invertir en los procedimientos de prueba necesarios o de adoptar nuevas tecnologías, lo que provoca retrasos en el lanzamiento de productos o una menor entrada al mercado para las empresas más pequeñas. Como resultado, los altos costos asociados a las pruebas de dispositivos médicos podrían frenar el crecimiento del mercado a largo plazo.
Alcance del mercado de pruebas de dispositivos médicos
El mercado está segmentado según el tipo de servicio, tipo de prueba, fase, tipo de abastecimiento, clase de dispositivo y producto.
|
Segmentación |
Subsegmentación |
|
Por tipo de servicio |
|
|
Por tipo de prueba |
|
|
Por fase |
|
|
Por tipo de abastecimiento |
|
|
Por clase de dispositivo |
|
|
Por producto |
|
Se proyecta que en 2025, el segmento de diagnóstico in vitro dominará el mercado de calderas industriales con la mayor participación en el segmento de productos combustibles.
Se proyecta que el segmento de pruebas de diagnóstico in vitro (IVD) domine el mercado global de pruebas de dispositivos médicos, con aproximadamente el 33 % de la cuota de mercado total. Este dominio se atribuye a la creciente demanda de herramientas de diagnóstico precisas y rápidas, especialmente en respuesta a la creciente carga de enfermedades crónicas y la creciente necesidad de métodos de prueba no invasivos. Las soluciones de pruebas de IVD, como el diagnóstico molecular, las pruebas en el punto de atención y la medicina personalizada, ofrecen alta precisión, velocidad y comodidad, lo que las convierte en la opción preferida tanto para profesionales sanitarios como para pacientes. Además, los continuos avances en salud digital y automatización impulsan la adopción generalizada de soluciones de pruebas de IVD en diversos entornos sanitarios, desde hospitales hasta atención domiciliaria.
Se espera que las pruebas de ciberseguridad representen la mayor parte durante el período de pronóstico en los segmentos de tipo de prueba.
Se proyecta que el segmento de pruebas de ciberseguridad ocupe una cuota de mercado significativa, estimada en aproximadamente el 35% en 2025. Este predominio se debe a la creciente importancia de proteger los dispositivos médicos contra las amenazas de ciberseguridad a medida que los sistemas de salud se interconectan cada vez más mediante el Internet de las Cosas (IoT) y las tecnologías en la nube. Con el aumento de ciberataques dirigidos a instituciones sanitarias y dispositivos médicos, garantizar la seguridad de dispositivos como marcapasos, bombas de insulina y equipos de diagnóstico se ha convertido en una prioridad absoluta.
Análisis regional del mercado de pruebas de dispositivos médicos
Norteamérica posee la mayor participación en el mercado de pruebas de dispositivos médicos.
- América del Norte domina el mercado mundial de pruebas de dispositivos médicos, representando aproximadamente el 40,2% de la participación de mercado en 2024.
- The U.S. holds a significant share of approximately 35% of the global medical device testing market in 2024. This dominance is driven by the high demand for advanced medical devices, a well-established healthcare system, and continuous innovations in medical device technologies and testing solutions
- The availability of well-established regulatory frameworks, such as FDA approval processes, and growing investments in research & development by leading medical device manufacturers further strengthen the market in North America
- In addition, the increasing focus on patient safety, regulatory compliance, and the adoption of cutting-edge testing technologies, such as AI and automation, are fueling market expansion across the region
“Asia-Pacific is Projected to Register the Highest CAGR in the Medical Device Testing Market”
- The Asia-Pacific (APAC) region is expected to witness the highest growth rate in the global medical device testing market, driven by rapid healthcare infrastructure development, growing demand for medical devices, and increasing regulatory compliance requirements
- Countries such as China, India, and Japan are emerging as key markets due to their expanding healthcare systems, rising demand for advanced medical technologies, and increasing focus on patient safety and regulatory standards
- China, with its large healthcare sector and significant investments in medical device manufacturing, is driving substantial demand for medical device testing services. The country is also focusing on improving regulatory standards and enhancing the quality of healthcare, further propelling the adoption of advanced testing solutions
- India, with its burgeoning healthcare industry and growing demand for affordable and innovative medical devices, is experiencing rapid adoption of medical device testing solutions to meet rising patient needs
- Increased government initiatives and private sector investments in healthcare infrastructure are further contributing to the market growth in the region
Medical Device Testing Market Share
The market competitive landscape provides details by competitor. Details included are company overview, company financials, revenue generated, market potential, investment in research and development, new market initiatives, global presence, production sites and facilities, production capacities, company strengths and weaknesses, product launch, product width and breadth, application dominance. The above data points provided are only related to the companies' focus related to market.
The Major Market Leaders Operating in the Market Are:
- Intertek Group plc (U.K.)
- SGS SA (Switzerland)
- Bureau Veritas (France)
- TUV SUD (Germany)
- TUV Rheinland (Germany)
- Pace (U.S.)
- Charles River Laboratories (U.S.)
- Biomedical Device Labs (U.S.)
- UL LLC (U.S.)
- North American Science Associates, LLC (U.S.)
- Medistri SA (Switzerland)
- WuXi AppTec (China)
- NSF (U.S.)
- Labcorp (U.S.)
- Eurofins Scientific (Luxembourg)
- Nelson Laboratories, LLC - A Sotera Health company (U.S.)
- Gateway Analytical (U.S.)
- ITC ZLIN (Czech Republic)
- Element Materials Technology (U.K.)
- EndoLab Mechanical Engineering GmbH (Germany)
- Hohenstein (Germany)
- Medical Engineering Technologies Ltd. (U.K.)
- Bioneeds (India)
- Cigniti (India)
- Arbro Pharmaceuticals Private Limited & Auriga Research Private Limited (India)
- Q Laboratories (U.S.)
- IMR Test Labs (U.S.)
Latest Developments in Global Medical Device Testing Market
- In January 2025, IMQ Group entered the Indian market by launching Elettra Tech Labs, a joint venture focused on testing and inspection services for medical devices and electrical and electronic products. This expansion strengthens IMQ’s global presence, supporting Indian businesses in meeting rigorous quality and safety standards while facilitating international market access. The initiative aligns with India’s growing medical device sector, leveraging advanced testing technologies to enhance compliance and innovation
- In March 2024, Stryker expanded its prototype and testing facility in India, marking a significant milestone in its research and development footprint. The 55,600-square-foot facility integrates cutting-edge infrastructure and enhanced microbiology capabilities, strengthening product assurance and innovation. This expansion supports rigorous life cycle testing of medical devices, ensuring compliance with global regulatory standards. The facility also features advanced prototyping tools, including plastic 3D printing and metal machining, reinforcing Stryker’s commitment to medical technology advancements
- In March 2024, TidalSense, a UK-based respiratory device company, launched a pilot study to evaluate its N-Tidal device, designed to diagnose asthma in children. Conducted in partnership with the University of Nottingham and Nottingham University Hospitals NHS Trust, the study involves 75 children under five years old with asthma and viral wheeze. Unlike traditional spirometry tests, which require complex breathing maneuvers, N-Tidal uses capnography to measure CO₂ levels during normal breathing, making diagnosis easier and more accessible
- In June 2023, TÜV SÜD inaugurated a state-of-the-art microbiology and chemistry laboratory in New Brighton, Minnesota, reinforcing its commitment to high-quality medical device testing services. Accredited under ISO 17025, the facility specializes in biological and chemical testing, supporting medical device companies in accelerating research and development. Equipped with advanced technology, the lab offers microbiology, reusable device testing, chemistry, biocompatibility, and packaging assessments. This expansion strengthens TÜV SÜD’s global laboratory network, ensuring precision and compliance for medical innovation
- In July 2022, Eurofins Scientific acquired WESSLING Hungary, strengthening its environmental, food, and BioPharma product testing capabilities across Europe. WESSLING Hungary, a leading laboratory, generated €15 million in revenue in 2021 and employed over 300 staff, reinforcing Eurofins’ commitment to high-quality analytical services
SKU-
Obtenga acceso en línea al informe sobre la primera nube de inteligencia de mercado del mundo
- Panel de análisis de datos interactivo
- Panel de análisis de empresas para oportunidades con alto potencial de crecimiento
- Acceso de analista de investigación para personalización y consultas
- Análisis de la competencia con panel interactivo
- Últimas noticias, actualizaciones y análisis de tendencias
- Aproveche el poder del análisis de referencia para un seguimiento integral de la competencia
Metodología de investigación
La recopilación de datos y el análisis del año base se realizan utilizando módulos de recopilación de datos con muestras de gran tamaño. La etapa incluye la obtención de información de mercado o datos relacionados a través de varias fuentes y estrategias. Incluye el examen y la planificación de todos los datos adquiridos del pasado con antelación. Asimismo, abarca el examen de las inconsistencias de información observadas en diferentes fuentes de información. Los datos de mercado se analizan y estiman utilizando modelos estadísticos y coherentes de mercado. Además, el análisis de la participación de mercado y el análisis de tendencias clave son los principales factores de éxito en el informe de mercado. Para obtener más información, solicite una llamada de un analista o envíe su consulta.
La metodología de investigación clave utilizada por el equipo de investigación de DBMR es la triangulación de datos, que implica la extracción de datos, el análisis del impacto de las variables de datos en el mercado y la validación primaria (experto en la industria). Los modelos de datos incluyen cuadrícula de posicionamiento de proveedores, análisis de línea de tiempo de mercado, descripción general y guía del mercado, cuadrícula de posicionamiento de la empresa, análisis de patentes, análisis de precios, análisis de participación de mercado de la empresa, estándares de medición, análisis global versus regional y de participación de proveedores. Para obtener más información sobre la metodología de investigación, envíe una consulta para hablar con nuestros expertos de la industria.
Personalización disponible
Data Bridge Market Research es líder en investigación formativa avanzada. Nos enorgullecemos de brindar servicios a nuestros clientes existentes y nuevos con datos y análisis que coinciden y se adaptan a sus objetivos. El informe se puede personalizar para incluir análisis de tendencias de precios de marcas objetivo, comprensión del mercado de países adicionales (solicite la lista de países), datos de resultados de ensayos clínicos, revisión de literatura, análisis de mercado renovado y base de productos. El análisis de mercado de competidores objetivo se puede analizar desde análisis basados en tecnología hasta estrategias de cartera de mercado. Podemos agregar tantos competidores sobre los que necesite datos en el formato y estilo de datos que esté buscando. Nuestro equipo de analistas también puede proporcionarle datos en archivos de Excel sin procesar, tablas dinámicas (libro de datos) o puede ayudarlo a crear presentaciones a partir de los conjuntos de datos disponibles en el informe.