Global Rare Disease Api Orphan Drug Substance Market
Tamaño del mercado en miles de millones de dólares
Tasa de crecimiento anual compuesta (CAGR) :
% 
 USD
306.90 Million
USD
667.49 Million
2025
2033
USD
306.90 Million
USD
667.49 Million
2025
2033
| 2026 –2033 | |
| USD 306.90 Million | |
| USD 667.49 Million | |
|
|
|
|
Segmentación del mercado global de API/sustancias farmacológicas huérfanas para enfermedades raras, por tipo de API/sustancia farmacológica (API de productos biológicos, API de moléculas pequeñas, API de vectores virales, API basadas en ARN y sustancias farmacológicas relacionadas con la terapia celular), indicación terapéutica (oncología, trastornos hematológicos, trastornos neurológicos y neuromusculares, trastornos metabólicos y endocrinos, enfermedades inmunológicas e infecciosas raras, enfermedades cardiovasculares, oftálmicas y otras enfermedades raras), usuario final (empresas biofarmacéuticas, organizaciones de desarrollo y fabricación por contrato, e institutos de investigación y fabricantes especializados): tendencias de la industria y pronóstico hasta 2033.
Tamaño del mercado de fármacos huérfanos/API para enfermedades raras
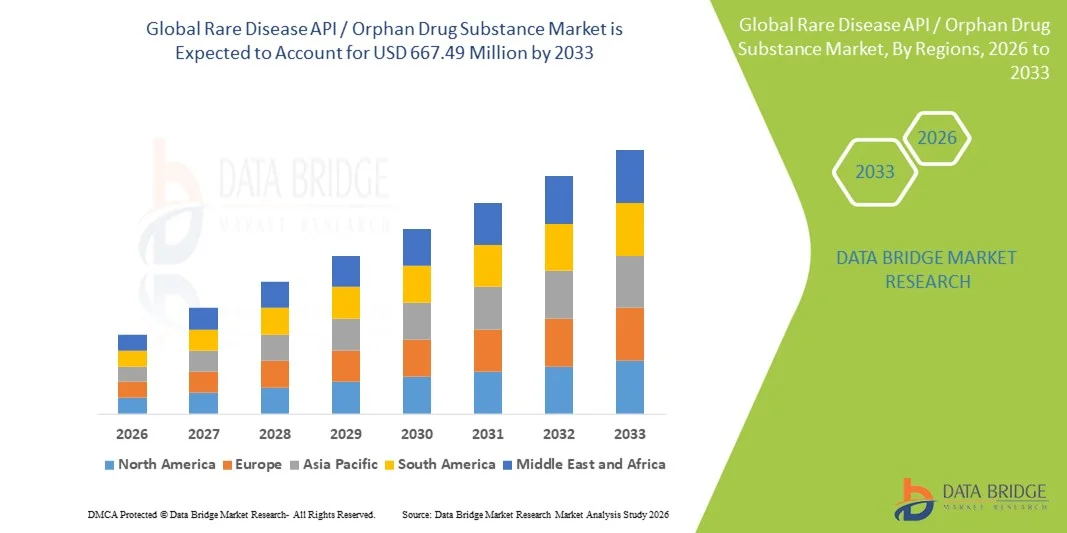
- El tamaño del mercado global de sustancias farmacológicas huérfanas/API para enfermedades raras se valoró en USD 306,90 millones en 2025 y se espera que alcance los USD 667,49 millones para 2033 , con una CAGR del 10,20 % durante el período de pronóstico.
- El crecimiento del mercado está impulsado en gran medida por la creciente prevalencia de enfermedades raras, la expansión de las líneas de medicamentos huérfanos y el aumento de los incentivos regulatorios que fomentan el desarrollo y la fabricación de ingredientes farmacéuticos activos especializados para enfermedades raras y ultra raras.
- Además, la creciente inversión en productos biológicos, terapias génicas y otras modalidades avanzadas, junto con la necesidad de fármacos de alta calidad, de lotes pequeños y de alta potencia, están consolidando los API huérfanos como un componente crucial del desarrollo farmacéutico moderno. Estos factores convergentes están acelerando la demanda de API para enfermedades raras, impulsando así significativamente el crecimiento de la industria.
Análisis del mercado de fármacos huérfanos/API para enfermedades raras
- Las API para enfermedades raras y las sustancias farmacológicas huérfanas, que comprenden ingredientes farmacéuticos activos altamente especializados para el tratamiento de enfermedades raras y ultra raras, son cada vez más cruciales para el desarrollo farmacéutico moderno debido a su función de permitir terapias dirigidas, precisas y que salvan vidas en múltiples áreas terapéuticas.
- La creciente demanda de API para enfermedades raras se debe principalmente a la creciente prevalencia de enfermedades raras, la expansión de las líneas de medicamentos huérfanos, incentivos regulatorios favorables y la creciente inversión en modalidades avanzadas como productos biológicos, terapias genéticas y tratamientos basados en ARN.
- América del Norte dominó el mercado de sustancias farmacológicas huérfanas/API para enfermedades raras con la mayor participación en los ingresos del 41,5 % en 2025, respaldada por un sólido marco regulatorio de medicamentos huérfanos, un alto gasto en I+D y una sólida presencia de empresas biofarmacéuticas y CDMO especializados, mientras que Estados Unidos fue testigo de un crecimiento significativo en la fabricación de API huérfanas tanto en etapa clínica como a escala comercial.
- Se espera que Asia-Pacífico sea la región de más rápido crecimiento en el mercado de API para enfermedades raras durante el período de pronóstico, impulsada por la creciente subcontratación de la fabricación de API, la expansión de los ecosistemas biotecnológicos, la mejora de la alineación regulatoria y el aumento de las inversiones en el desarrollo de medicamentos para enfermedades raras en China, Japón, Corea del Sur e India.
- Las API biológicas dominaron el mercado de sustancias farmacológicas huérfanas/API para enfermedades raras con una participación de mercado del 58,3 % en 2025, impulsadas por su uso generalizado en terapias de reemplazo enzimático, anticuerpos monoclonales y tratamientos basados en genes, junto con su fuerte eficacia para abordar enfermedades raras genéticas y metabólicas complejas.
Alcance del informe y segmentación del mercado de fármacos huérfanos/API para enfermedades raras
|
Atributos |
Información clave del mercado de fármacos huérfanos/API para enfermedades raras |
|
Segmentos cubiertos |
|
|
Países cubiertos |
América del norte
Europa
Asia-Pacífico
Oriente Medio y África
Sudamerica
|
|
Actores clave del mercado |
|
|
Oportunidades de mercado |
|
|
Conjuntos de información de datos de valor añadido |
Además de los conocimientos sobre escenarios de mercado como el valor de mercado, la tasa de crecimiento, la segmentación, la cobertura geográfica y los principales actores, los informes de mercado seleccionados por Data Bridge Market Research también incluyen un análisis profundo de expertos, epidemiología de pacientes, análisis de canalización, análisis de precios y marco regulatorio. |
Tendencias del mercado de fármacos huérfanos/API para enfermedades raras
Cambio hacia sustancias farmacológicas biológicas y genéticas avanzadas
- Una tendencia significativa y en aceleración en el mercado global de sustancias farmacológicas huérfanas/API para enfermedades raras es el cambio creciente hacia productos biológicos, terapias genéticas y sustancias farmacológicas basadas en ARN, impulsado por su capacidad de atacar las causas genéticas subyacentes de enfermedades raras y ultra raras con alta precisión.
- Por ejemplo, el creciente número de aprobaciones regulatorias para terapias genéticas y celulares dirigidas a trastornos raros está intensificando la demanda de API de vectores virales, proteínas recombinantes y sustancias farmacológicas biológicas altamente especializadas fabricadas bajo estrictos estándares de calidad.
- El avance de la biología molecular, la genómica y los diagnósticos complementarios está permitiendo el desarrollo de sustancias farmacológicas huérfanas altamente específicas, lo que permite a los fabricantes diseñar API adaptadas a mutaciones específicas o vías de enfermedad, mejorando así la eficacia del tratamiento y los resultados de los pacientes.
- La creciente adopción de enfoques de medicina de precisión está alentando a las compañías farmacéuticas a invertir en la producción de API compleja, de bajo volumen y alto valor, que requiere instalaciones especializadas, capacidades analíticas avanzadas y un estricto cumplimiento normativo.
- El auge de las tecnologías de fabricación basadas en plataformas está respaldando la producción flexible y escalable de API huérfanas, lo que permite a los fabricantes gestionar de manera eficiente múltiples programas de enfermedades raras simultáneamente.
- Esta tendencia hacia sustancias farmacológicas huérfanas más complejas y personalizadas está redefiniendo las estrategias de fabricación de API, con un mayor énfasis en la producción de lotes pequeños, el manejo de alta potencia y las capacidades de cambio rápido.
- En consecuencia, empresas como Lonza y Catalent están ampliando sus capacidades de API de productos biológicos y terapia génica para respaldar la creciente demanda de sustancias farmacológicas huérfanas avanzadas en múltiples indicaciones de enfermedades raras.
Dinámica del mercado de fármacos huérfanos/API para enfermedades raras
Conductor
Ampliación de la cartera de medicamentos huérfanos e incentivos regulatorios favorables
- El creciente número de designaciones y aprobaciones de medicamentos huérfanos, respaldados por incentivos regulatorios favorables como la exclusividad del mercado, los créditos fiscales y las vías de revisión aceleradas, es un factor clave que impulsa la demanda de API para enfermedades raras.
- Por ejemplo, los marcos regulatorios en los EE. UU., Europa y Japón han reducido significativamente los plazos de desarrollo de medicamentos huérfanos, alentando a las compañías biofarmacéuticas a expandir sus líneas de productos para enfermedades raras e invertir en la fabricación especializada de API.
- A medida que mejoran las tasas de concientización, detección y diagnóstico de enfermedades raras a nivel mundial, aumenta la necesidad de un suministro constante y de alta calidad de sustancias farmacológicas, lo que apoya directamente el crecimiento del mercado de API huérfanos.
- Además, el fuerte capital de riesgo y la financiación pública para la investigación de enfermedades raras están permitiendo a las empresas de biotecnología más pequeñas avanzar en sus programas clínicos, aumentando la dependencia de la fabricación de API subcontratada y de los CDMO especializados.
- El creciente enfoque en terapias de precisión y personalizadas, combinado con el potencial comercial a largo plazo debido a la competencia limitada, continúa impulsando una demanda sostenida de sustancias farmacológicas huérfanas.
- El aumento del apoyo gubernamental y de organizaciones sin fines de lucro al desarrollo de tratamientos para enfermedades raras está fortaleciendo la viabilidad a largo plazo de las inversiones en la fabricación de medicamentos huérfanos.
- La capacidad de los medicamentos huérfanos para alcanzar precios superiores está mejorando el retorno de la inversión, lo que fomenta aún más la expansión continua de la capacidad de producción de API huérfanos.
Restricción/Desafío
Complejidad de fabricación y barreras de cumplimiento normativo
- La producción de API para enfermedades raras a menudo implica procesos de fabricación complejos, requisitos de calidad estrictos y tamaños de lotes limitados, lo que puede aumentar significativamente los costos de producción y los riesgos técnicos.
- Por ejemplo, las sustancias farmacológicas de terapia biológica y genética requieren instalaciones especializadas, personal altamente calificado y sistemas de contención avanzados, lo que hace que la ampliación de la producción sea técnicamente desafiante y requiera mucho capital.
- El cumplimiento normativo en múltiples regiones agrega más complejidad, ya que las sustancias farmacológicas huérfanas deben cumplir con estándares diversos y en evolución relacionados con la seguridad, la trazabilidad y el control de calidad.
- Estos desafíos pueden limitar la cantidad de proveedores de API calificados, lo que podría generar restricciones de suministro y costos más altos, restringiendo así una expansión más amplia del mercado.
- La disponibilidad limitada de materias primas y reactivos especializados para API huérfanas avanzadas puede interrumpir aún más los plazos de producción y aumentar la dependencia de proveedores especializados.
- La necesidad de una validación extensa, plazos de entrega largos y estrictos controles de cambios posteriores a la aprobación pueden ralentizar la agilidad de fabricación y retrasar el suministro comercial de sustancias farmacológicas huérfanas.
Alcance del mercado de fármacos huérfanos/API para enfermedades raras
El mercado está segmentado según el tipo de API/sustancia farmacológica, la indicación terapéutica y el usuario final.
- Por API / Tipo de sustancia farmacológica
Según el tipo de fármaco/API, el mercado global de fármacos/API huérfanos para enfermedades raras se segmenta en fármacos biológicos/API de moléculas pequeñas, API de vectores virales, API basados en ARN y fármacos relacionados con la terapia celular. El segmento de fármacos biológicos/API dominó el mercado con la mayor participación en los ingresos, un 58,3%, en 2025, impulsado por el uso generalizado de anticuerpos monoclonales, terapias de reemplazo enzimático y proteínas recombinantes en el tratamiento de trastornos genéticos y metabólicos raros. Los fármacos biológicos ofrecen alta especificidad y eficacia clínica, lo que los convierte en la opción preferida para muchos programas de fármacos huérfanos. La fuerte presencia de fármacos biológicos huérfanos aprobados y la continua expansión de la cartera de productos respaldan aún más el dominio de este segmento. Además, los precios premium y los regímenes de tratamiento a largo plazo contribuyen a una mayor generación de ingresos. La experiencia consolidada en fabricación y la familiaridad regulatoria con los fármacos biológicos también refuerzan su posición de liderazgo.
Se espera que el segmento de API de vectores virales experimente el mayor crecimiento durante el período de pronóstico, impulsado por el rápido avance de las terapias génicas para enfermedades raras y ultrarraras. El aumento de las aprobaciones de terapias basadas en virus adenoasociados (VAA) y vectores lentivirales impulsa una fuerte demanda de producción especializada de vectores. La alta demanda médica no satisfecha, el potencial de tratamiento curativo y la creciente inversión en plataformas de terapia génica están acelerando la expansión de este segmento. La limitada disponibilidad de proveedores y los complejos requisitos de fabricación aumentan aún más la importancia estratégica y el impulso de crecimiento de las API de vectores virales.
- Por indicación terapéutica
Según la indicación terapéutica, el mercado se segmenta en oncología, trastornos hematológicos, trastornos neurológicos y neuromusculares, trastornos metabólicos y endocrinos, enfermedades inmunológicas e infecciosas raras, y enfermedades cardiovasculares, oftálmicas y otras enfermedades raras. El segmento de oncología dominó el mercado en 2025, gracias al elevado número de designaciones de medicamentos huérfanos para cánceres raros y a la inversión sostenida en terapias dirigidas contra el cáncer. Los fármacos oncológicos raros suelen depender de principios activos farmacéuticos (API) y productos biológicos de alta potencia, lo que contribuye significativamente a la demanda general de API. La solidez de las carteras de productos clínicos, la aceleración de las aprobaciones regulatorias y los mayores costes de tratamiento refuerzan aún más el liderazgo en ingresos de este segmento. Además, las compañías farmacéuticas priorizan la oncología rara debido a sus beneficios favorables de reembolso y exclusividad en el mercado.
Se proyecta que el segmento de trastornos neurológicos y neuromusculares crecerá al ritmo más rápido durante el período de pronóstico, impulsado por el aumento de la investigación en enfermedades neurológicas genéticas como la atrofia muscular espinal, la distrofia muscular de Duchenne y las epilepsias raras. Los avances en terapia génica, fármacos basados en ARN y medicina de precisión están transformando los enfoques terapéuticos en este ámbito. El aumento de las tasas de diagnóstico y el sólido apoyo a la promoción impulsan aún más la actividad de desarrollo. Dado que muchas de estas terapias requieren API complejos, la demanda de fármacos especializados está creciendo rápidamente en este segmento.
- Por el usuario final
En función del usuario final, el mercado global de API/sustancias farmacológicas huérfanas para enfermedades raras se segmenta en compañías biofarmacéuticas, organizaciones de desarrollo y fabricación por contrato (CDMO), e institutos de investigación y fabricantes de especialidades. El segmento de compañías biofarmacéuticas representó la mayor participación de mercado en 2025, impulsado por su propiedad de líneas de desarrollo de medicamentos huérfanos y el control directo sobre la fabricación comercial de terapias de alto valor. Las compañías biofarmacéuticas grandes y medianas invierten fuertemente en asegurar un suministro confiable de API para proteger los períodos de exclusividad y garantizar una calidad constante del producto. La fabricación interna de API críticos suele ser la preferida por razones estratégicas y de propiedad intelectual. El dominio de este segmento se ve reforzado por sólidas capacidades financieras y experiencia regulatoria.
Se espera que el segmento de CDMO registre el mayor crecimiento durante el período de pronóstico, impulsado por la creciente tendencia a la externalización entre las empresas biotecnológicas y farmacéuticas. La complejidad de los API huérfanos, sumada a los pequeños tamaños de lote y los elevados requisitos de capital, anima a los patrocinadores a recurrir a CDMO especializados. Los CDMO ofrecen fabricación flexible, apoyo regulatorio y tecnologías avanzadas adaptadas a los fármacos para enfermedades raras. A medida que las empresas biotecnológicas más pequeñas impulsan la innovación en medicamentos huérfanos, la dependencia de los CDMO para la producción escalable y conforme a las normativas de API se está acelerando rápidamente.
Análisis regional del mercado de fármacos huérfanos/API para enfermedades raras
- América del Norte dominó el mercado de sustancias farmacológicas huérfanas/API para enfermedades raras con la mayor participación en los ingresos del 41,5 % en 2025, respaldada por un sólido marco regulatorio de medicamentos huérfanos, un alto gasto en I+D y una sólida presencia de empresas biofarmacéuticas y CDMO especializados.
- Las empresas de la región valoran mucho las capacidades de fabricación avanzada, el estricto cumplimiento de la calidad y el suministro confiable de sustancias farmacológicas complejas, en particular para productos biológicos, terapias genéticas y otras API huérfanas de alto valor.
- Este liderazgo generalizado en el mercado está respaldado además por una alta concentración de aprobaciones de medicamentos huérfanos, una sólida financiación para la investigación de enfermedades raras y la presencia de empresas biofarmacéuticas líderes y CDMO especializados, lo que establece a América del Norte como el centro principal para el desarrollo y la producción de API para enfermedades raras.
Análisis del mercado estadounidense de fármacos huérfanos/API para enfermedades raras
El mercado estadounidense de API/sustancias farmacológicas huérfanas para enfermedades raras captó la mayor participación en los ingresos de Norteamérica en 2025, impulsado por un sólido marco regulatorio para medicamentos huérfanos, amplias inversiones en I+D y una alta concentración de empresas biofarmacéuticas y biotecnológicas. Los fabricantes priorizan cada vez más el desarrollo y el suministro seguro de API complejas para apoyar la expansión de las líneas de producción de medicamentos huérfanos. La existencia de incentivos favorables, como la exclusividad de mercado, los créditos fiscales y las vías de aprobación acelerada, continúa estimulando la demanda de sustancias farmacológicas especializadas. Además, el importante papel de las CDMO y la infraestructura de fabricación avanzada contribuyen significativamente al crecimiento sostenido del mercado.
Análisis del mercado europeo de fármacos huérfanos/API para enfermedades raras
Se prevé que el mercado europeo de fármacos antiinflamatorios no esteroideos (API)/sustancias farmacológicas huérfanas para enfermedades raras se expanda a una tasa de crecimiento anual compuesta (TCAC) sustancial durante el período de pronóstico, impulsado principalmente por las políticas de apoyo a los fármacos huérfanos de la EMA y el aumento de la inversión en la investigación de enfermedades raras. La mayor concienciación, la mejora de las tasas de diagnóstico y las colaboraciones transfronterizas están impulsando el desarrollo de fármacos huérfanos en toda la región. Los fabricantes europeos priorizan la calidad, la trazabilidad y el cumplimiento normativo, lo que impulsa una demanda constante de API de alto valor. Se observa crecimiento tanto en los modelos de fabricación impulsados por la innovación como en los externalizados, en particular para productos biológicos y terapias avanzadas.
Análisis del mercado de fármacos huérfanos/API para enfermedades raras en el Reino Unido
Se prevé que el mercado británico de fármacos antiinflamatorios no esteroideos (API) para enfermedades raras crezca a una tasa de crecimiento anual compuesta (TCAC) notable durante el período de pronóstico, gracias a la sólida colaboración entre la academia y la industria, así como a las iniciativas gubernamentales en el ámbito de las enfermedades raras. El ecosistema avanzado de ciencias de la vida del Reino Unido fomenta el desarrollo de fármacos huérfanos en fase inicial, lo que aumenta la demanda de API en fase clínica. La inversión continua en investigación de productos biológicos y terapia génica está fortaleciendo las perspectivas del mercado. Además, la armonización regulatoria con los estándares globales aumenta el atractivo del país para las colaboraciones en la fabricación y el desarrollo de API huérfanos.
Análisis del mercado alemán de fármacos huérfanos/API para enfermedades raras
Se espera que el mercado alemán de fármacos antiinflamatorios no esteroideos (API) para enfermedades raras crezca a una tasa de crecimiento anual compuesta (TCAC) considerable durante el período de pronóstico, impulsado por una sólida base de fabricación farmacéutica y un fuerte énfasis en la innovación y la calidad. El liderazgo de Alemania en la producción de productos biológicos y las tecnologías de fabricación avanzadas respalda la demanda constante de fármacos antiinflamatorios no esteroideos complejos. El enfoque del país en el cumplimiento normativo, la seguridad y la fabricación de precisión se ajusta a los estrictos requisitos de los API para enfermedades raras. El aumento de la inversión en terapias avanzadas fortalece aún más las perspectivas de crecimiento del mercado.
Análisis del mercado de fármacos huérfanos/API para enfermedades raras en Asia-Pacífico
Se prevé que el mercado de fármacos antiinflamatorios no esteroideos (API) para enfermedades raras en Asia-Pacífico crezca a la tasa de crecimiento anual compuesta (TCAC) más alta durante el período de pronóstico, impulsado por la expansión de las capacidades biotecnológicas, el aumento de la inversión en atención médica y la creciente externalización de los mercados occidentales. Países como China, Japón e India están fortaleciendo sus marcos regulatorios y su infraestructura de fabricación para enfermedades raras. Las ventajas de costos y la creciente experiencia técnica de la región atraen a empresas biofarmacéuticas globales que buscan una producción escalable de API. Esta tendencia está acelerando significativamente la expansión del mercado en Asia-Pacífico.
Análisis del mercado japonés de fármacos huérfanos/API para enfermedades raras
El mercado japonés de API/sustancias farmacológicas huérfanas para enfermedades raras está cobrando impulso gracias al sólido apoyo gubernamental al desarrollo de fármacos huérfanos y a las avanzadas capacidades de fabricación farmacéutica. Japón otorga gran importancia a la calidad, la seguridad y la innovación, lo que impulsa la demanda de sustancias farmacológicas altamente especializadas. La atención del país a las enfermedades raras genéticas y neurológicas está incrementando la necesidad de API complejas, incluyendo productos biológicos y sustancias basadas en ARN. El envejecimiento de la población y la creciente prevalencia de enfermedades raras impulsan aún más el crecimiento del mercado.
Análisis del mercado de fármacos huérfanos/API para enfermedades raras en India
El mercado indio de API/sustancias farmacológicas huérfanas para enfermedades raras representó una importante cuota de ingresos en Asia-Pacífico en 2025, gracias a su sólida experiencia en la fabricación de API, la competitividad en costes y la expansión de las inversiones en biotecnología. India se está consolidando como un proveedor clave de API huérfanas de moléculas pequeñas y, cada vez más, biológicas para los mercados globales. Las iniciativas gubernamentales que apoyan el desarrollo de tratamientos para enfermedades raras y la fabricación local están mejorando las perspectivas del mercado. La creciente presencia de CDMO y fabricantes por contrato nacionales está fortaleciendo aún más el papel de India en la cadena global de suministro de sustancias farmacológicas huérfanas.
Cuota de mercado de fármacos huérfanos/API para enfermedades raras
La industria de sustancias farmacológicas huérfanas/API para enfermedades raras está liderada principalmente por empresas bien establecidas, entre las que se incluyen:
- Lonza Ltd (Suiza)
- Catalent, Inc. (EE. UU.)
- WuXi AppTec Co., Ltd. (China)
- Pfizer Inc. (EE. UU.)
- Novartis AG (Suiza)
- F. Hoffmann-La Roche Ltd (Suiza)
- Bristol-Myers Squibb Company (EE. UU.)
- Amgen Inc. (EE. UU.)
- Sanofi (Francia)
- Takeda Pharmaceutical Company Limited (Japón)
- AbbVie Inc. (EE. UU.)
- GSK plc (Reino Unido)
- Bayer AG (Alemania)
- Vertex Pharmaceuticals Incorporated (EE. UU.)
- Biogen Inc. (EE. UU.)
- PTC Therapeutics, Inc. (EE. UU.)
- Huérfano sueco Biovitrum AB (Suecia)
- SOM Innovación Biotech, SA (España)
- Ultragenyx Pharmaceutical Inc. (EE. UU.)
¿Cuáles son los desarrollos recientes en el mercado global de sustancias farmacológicas huérfanas/API para enfermedades raras?
- En agosto de 2025, la FDA de EE. UU. otorgó la aprobación a Papzimeos (zopapogene imadenovec), la primera inmunoterapia para la papilomatosis respiratoria recurrente (PRR), una enfermedad rara designada como huérfana, lo que subraya los avances inmunoterapéuticos basados en genes para enfermedades raras.
- En abril de 2025, la organización sin fines de lucro Orphan Therapeutics Accelerator anunció asociaciones clave destinadas a impulsar las vías de desarrollo y comercialización de terapias para enfermedades ultra raras, abordar los desafíos históricos en materia de financiación y presentar candidatos a fármacos huérfanos.
- En enero de 2024, el panorama de medicamentos huérfanos de la FDA experimentó una expansión significativa con un número récord de aprobaciones (28 medicamentos huérfanos nuevos), incluidas terapias de primera clase para afecciones como la ataxia de Friedreich y el síndrome de Rett, lo que destaca el rápido crecimiento en el desarrollo terapéutico de enfermedades raras.
- En agosto de 2023, la FDA de EE. UU. aprobó pozelimab (Veopoz) como el primer tratamiento para la enfermedad CHAPLE, un trastorno ultra raro del sistema del complemento, lo que representa una nueva terapia con anticuerpos monoclonales recombinantes que aborda una afección que de otro modo sería mortal.
- En mayo de 2023, la FDA de EE. UU. aprobó Adzynma (apadamtasa alfa), una terapia de reemplazo enzimático recombinante ADAMTS13 para la púrpura trombocitopénica trombótica congénita (PTTPc), lo que marca el primer producto biológico aprobado que aborda este trastorno de coagulación sanguínea ultra raro y amplía las opciones de reemplazo enzimático para pacientes con enfermedades raras.
SKU-
Obtenga acceso en línea al informe sobre la primera nube de inteligencia de mercado del mundo
- Panel de análisis de datos interactivo
- Panel de análisis de empresas para oportunidades con alto potencial de crecimiento
- Acceso de analista de investigación para personalización y consultas
- Análisis de la competencia con panel interactivo
- Últimas noticias, actualizaciones y análisis de tendencias
- Aproveche el poder del análisis de referencia para un seguimiento integral de la competencia
Metodología de investigación
La recopilación de datos y el análisis del año base se realizan utilizando módulos de recopilación de datos con muestras de gran tamaño. La etapa incluye la obtención de información de mercado o datos relacionados a través de varias fuentes y estrategias. Incluye el examen y la planificación de todos los datos adquiridos del pasado con antelación. Asimismo, abarca el examen de las inconsistencias de información observadas en diferentes fuentes de información. Los datos de mercado se analizan y estiman utilizando modelos estadísticos y coherentes de mercado. Además, el análisis de la participación de mercado y el análisis de tendencias clave son los principales factores de éxito en el informe de mercado. Para obtener más información, solicite una llamada de un analista o envíe su consulta.
La metodología de investigación clave utilizada por el equipo de investigación de DBMR es la triangulación de datos, que implica la extracción de datos, el análisis del impacto de las variables de datos en el mercado y la validación primaria (experto en la industria). Los modelos de datos incluyen cuadrícula de posicionamiento de proveedores, análisis de línea de tiempo de mercado, descripción general y guía del mercado, cuadrícula de posicionamiento de la empresa, análisis de patentes, análisis de precios, análisis de participación de mercado de la empresa, estándares de medición, análisis global versus regional y de participación de proveedores. Para obtener más información sobre la metodología de investigación, envíe una consulta para hablar con nuestros expertos de la industria.
Personalización disponible
Data Bridge Market Research es líder en investigación formativa avanzada. Nos enorgullecemos de brindar servicios a nuestros clientes existentes y nuevos con datos y análisis que coinciden y se adaptan a sus objetivos. El informe se puede personalizar para incluir análisis de tendencias de precios de marcas objetivo, comprensión del mercado de países adicionales (solicite la lista de países), datos de resultados de ensayos clínicos, revisión de literatura, análisis de mercado renovado y base de productos. El análisis de mercado de competidores objetivo se puede analizar desde análisis basados en tecnología hasta estrategias de cartera de mercado. Podemos agregar tantos competidores sobre los que necesite datos en el formato y estilo de datos que esté buscando. Nuestro equipo de analistas también puede proporcionarle datos en archivos de Excel sin procesar, tablas dinámicas (libro de datos) o puede ayudarlo a crear presentaciones a partir de los conjuntos de datos disponibles en el informe.