Asia Pacific Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Taille du marché en milliards USD
TCAC :
% 
 USD
130.00 Million
USD
403.24 Million
2025
2033
USD
130.00 Million
USD
403.24 Million
2025
2033
| 2026 –2033 | |
| USD 130.00 Million | |
| USD 403.24 Million | |
|
|
|
|
Segmentation du marché des solutions électroniques d'évaluation des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique, par produit (solutions sur site, solutions cloud et solutions web), approche (évaluation des résultats rapportés par le clinicien (ClinRO), évaluation des résultats rapportés par le patient (PRO), évaluation des résultats rapportés par l'observateur (ObsRO) et évaluation des résultats de performance (PerfO)), utilisateur final (prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements d'enseignement supérieur), plateforme (organismes de recherche sous contrat, entreprises pharmaceutiques et biopharmaceutiques, fabricants de dispositifs médicaux, hôpitaux et laboratoires d'analyses, sociétés de conseil, recherche et enseignement supérieur, et autres) - Tendances du secteur et prévisions jusqu'en 2033
Taille du marché de l'évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence en Asie-Pacifique
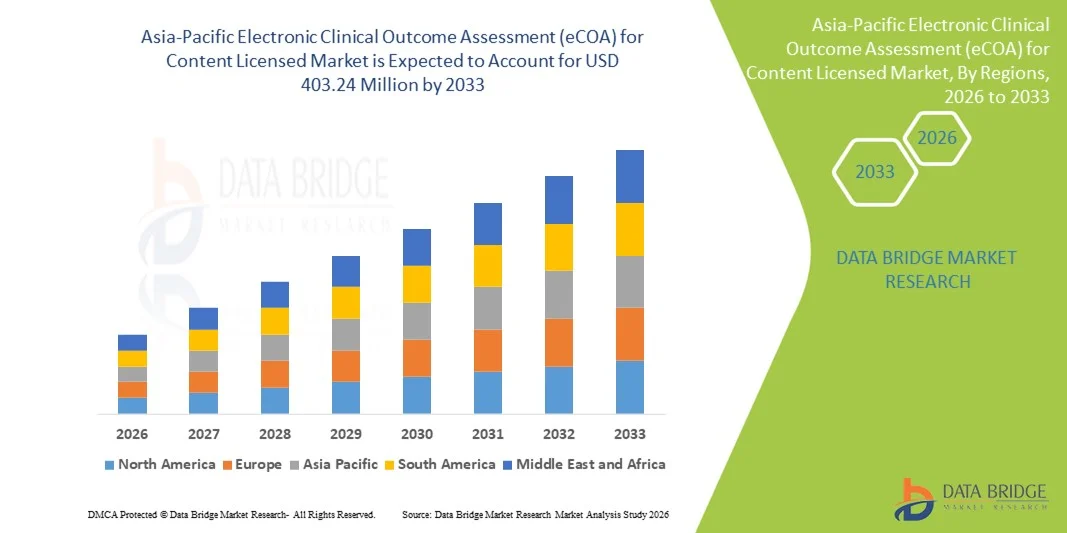
- Le marché des systèmes d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique était évalué à 130 millions de dollars américains en 2025 et devrait atteindre 403,24 millions de dollars américains d'ici 2033 , soit un taux de croissance annuel composé (TCAC) de 15,2 % au cours de la période de prévision.
- La croissance du marché est largement alimentée par l'adoption croissante des technologies de santé numérique dans les essais cliniques, les incitations réglementaires à la saisie électronique des données et la demande croissante de solutions de suivi des résultats centrées sur le patient et à distance. Ces tendances poussent les promoteurs de recherches cliniques et les CRO à abandonner les méthodes traditionnelles sur papier au profit de plateformes numériques d'évaluation des résultats en temps réel.
- De plus, l'expansion rapide des essais cliniques sur les principaux marchés d'Asie-Pacifique, la hausse des investissements dans les plateformes eCOA cloud/mobiles et l'accent mis sur l'exactitude des données, la conformité et l'intégration aux systèmes eCliniques plus vastes accélèrent l'adoption de l'eCOA. Ces facteurs convergents positionnent l'eCOA comme un élément essentiel de l'infrastructure moderne de la recherche clinique, stimulant ainsi considérablement la croissance du secteur.
Analyse du marché des évaluations électroniques des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique
- Les solutions d'évaluation électronique des résultats cliniques (eCOA), qui fournissent des plateformes numériques pour la collecte des résultats rapportés par les patients, les cliniciens et les observateurs, deviennent des outils essentiels dans les essais cliniques, tant dans le secteur pharmaceutique que dans celui des dispositifs médicaux, grâce à leur capacité à améliorer la précision des données, à permettre un suivi en temps réel et à s'intégrer parfaitement aux systèmes eCliniques.
- L'adoption croissante des certificats d'analyse électroniques (eCOA) est principalement due à l'importance accrue accordée aux essais cliniques centrés sur le patient, aux incitations réglementaires à la saisie électronique des données et à la demande croissante de solutions d'essais à distance et décentralisées qui minimisent les visites sur site tout en améliorant l'observance et l'engagement.
- En 2025, le Japon dominait le marché Asie-Pacifique des solutions électroniques d'évaluation des résultats cliniques (eCOA) pour les contenus sous licence, avec la plus grande part de revenus (38,5 %). Cette domination s'explique par une infrastructure de santé numérique avancée, un grand nombre d'essais cliniques en cours et la présence de fournisseurs de technologies de pointe proposant des plateformes eCOA intégrées.
- La Chine devrait être le pays connaissant la croissance la plus rapide sur ce marché au cours de la période de prévision, en raison de l'augmentation des essais cliniques, des investissements croissants dans les plateformes mobiles et cloud, du renforcement du soutien réglementaire à la saisie électronique des données et de l'adoption croissante de solutions numériques centrées sur le patient.
- Le segment des résultats rapportés par les patients (PRO) a dominé le marché des systèmes d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique avec une part de marché de 45,2 % en 2025, grâce à son rôle essentiel dans la collecte des commentaires des patients en temps réel, la garantie de la conformité aux normes réglementaires et la fourniture d'informations exploitables aux promoteurs d'essais cliniques.
Portée du rapport et segmentation du marché des contenus sous licence en Asie-Pacifique concernant l'évaluation électronique des résultats cliniques (eCOA)
|
Attributs |
Évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence : principaux enseignements du marché en Asie-Pacifique |
|
Segments couverts |
|
|
Pays couverts |
Asie-Pacifique
|
|
Acteurs clés du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
Outre les informations sur les scénarios de marché tels que la valeur du marché, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché élaborés par Data Bridge Market Research incluent également une analyse approfondie par des experts, des données épidémiologiques sur les patients, une analyse des projets en développement, une analyse des prix et un aperçu du cadre réglementaire. |
Tendances du marché de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique
Intégration numérique et mobile pour les essais cliniques centrés sur le patient
- Une tendance importante et croissante sur le marché des certificats électroniques d'accès au contenu sous licence en Asie-Pacifique est l'intégration des appareils mobiles, des plateformes cloud et des applications destinées aux patients, permettant la collecte en temps réel des résultats cliniques tout en améliorant l'engagement des patients et l'adhésion aux essais cliniques.
- Par exemple, des plateformes comme Medidata eCOA Mobile permettent aux patients de soumettre des données PRO et des résultats rapportés par les cliniciens via smartphones et tablettes, facilitant ainsi la saisie de données à distance et améliorant l'observance du traitement.
- L'intégration des plateformes numériques et mobiles aux dossiers médicaux électroniques (DME) et aux systèmes eCliniques plus vastes permet une surveillance des données en temps réel, une réduction des erreurs et une simplification des rapports réglementaires. Par exemple, cela permet aux promoteurs de suivre instantanément les réponses des patients et d'ajuster les protocoles en conséquence.
- L'adoption croissante des dispositifs et capteurs portables pour la surveillance continue des patients complète les plateformes eCOA, permettant la collecte de données objectives à haute fréquence parallèlement aux résultats subjectifs pour une vision plus globale de la santé du patient.
- Cette tendance vers une évaluation des résultats numériques plus intégrée, plus conviviale pour le patient et en temps réel, remodèle en profondeur les processus des essais cliniques. Par exemple, des entreprises comme CRF Health et ERT développent des solutions eCOA mobiles avec des interfaces personnalisables et des rappels automatisés pour améliorer l'observance des patients.
- La demande de plateformes eCOA numériques, mobiles et intégrées au cloud croît rapidement dans les essais cliniques pharmaceutiques et de dispositifs médicaux, les promoteurs privilégiant une collecte de données efficace, précise et centrée sur le patient.
- L'utilisation d'interfaces eCOA multilingues et adaptées aux spécificités culturelles se généralise afin de mieux prendre en charge les populations de patients diverses dans les pays d'Asie-Pacifique. Par exemple, les plateformes intègrent désormais les langues locales et des formats de questions adaptés aux contextes culturels pour améliorer l'observance et la qualité des données.
Dynamique du marché des évaluations électroniques des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique
Conducteur
Demande croissante d'essais cliniques centrés sur le patient et à distance
- L'accent croissant mis sur les essais cliniques centrés sur le patient, associé à l'évolution vers des essais cliniques décentralisés et hybrides, est un facteur clé du marché des certificats électroniques d'autorisation (eCOA) pour les contenus sous licence en Asie-Pacifique.
- Par exemple, en 2025, Medrio a lancé un module eCOA conçu pour les essais à distance en Inde et en Chine, permettant aux promoteurs de recueillir des résultats sans nécessiter de visites fréquentes sur site.
- Alors que les promoteurs d'essais cliniques cherchent à améliorer l'engagement et l'observance des patients, les plateformes eCOA offrent un suivi en temps réel, des alertes et des rappels, ce qui réduit les données manquantes et améliore la qualité globale des essais.
- De plus, l'adoption croissante des technologies numériques et mobiles sur les sites de recherche clinique fait des solutions eCOA un choix privilégié, offrant une intégration transparente avec d'autres outils et systèmes de données eCliniques.
- La possibilité de recueillir à distance les résultats rapportés par les patients, les cliniciens et les observateurs via des smartphones ou des tablettes est un facteur clé qui accélère l'adoption de ces méthodes dans les essais cliniques portant sur les produits pharmaceutiques et les dispositifs médicaux.
- L'expansion des essais hybrides et décentralisés en Asie-Pacifique, conjuguée à un encouragement réglementaire croissant en faveur de la saisie électronique des données, soutient davantage la forte croissance des solutions eCOA.
- L'augmentation des investissements des multinationales pharmaceutiques dans les essais cliniques en Asie-Pacifique accroît la demande de plateformes eCOA évolutives et standardisées. Par exemple, les promoteurs déploient des plateformes unifiées dans plusieurs pays afin d'améliorer l'efficacité et la conformité.
- L'importance croissante accordée à la prise de décision fondée sur les données et à l'accélération des essais cliniques incite les promoteurs à adopter des solutions eCOA fournissant des analyses et des rapports instantanés. Par exemple, des tableaux de bord en temps réel permettent aux responsables d'essais de suivre les réponses des patients et d'ajuster les protocoles de manière proactive.
Retenue/Défi
Préoccupations liées à la confidentialité des données et obstacles à la conformité réglementaire
- Les préoccupations liées à la sécurité, à la confidentialité et à la conformité réglementaire des données des patients constituent des défis importants pour une adoption plus large des plateformes eCOA en Asie-Pacifique.
- Par exemple, des rapports très médiatisés concernant des violations de données de santé électroniques ont rendu certains commanditaires et patients prudents quant à la collecte de données numériques à distance.
- Garantir la conformité aux réglementations régionales, telles que la loi japonaise sur la protection des renseignements personnels (APPI) et la loi chinoise sur la protection des renseignements personnels (PIPL), exige un chiffrement robuste, une authentification sécurisée et des logiciels validés, dont la mise en œuvre peut s'avérer complexe et coûteuse.
- De plus, les différences de normes et d'exigences réglementaires entre les pays de la région Asie-Pacifique peuvent ralentir le déploiement et l'adoption des plateformes, nécessitant des efforts supplémentaires de localisation et de validation.
- Bien que les plateformes eCOA cloud et mobiles améliorent la commodité et l'efficacité, le risque perçu de violations de la cybersécurité et de non-conformité peut freiner leur adoption, notamment auprès des petits promoteurs ou des CRO disposant de ressources informatiques limitées.
- Pour une croissance durable du marché, il est essentiel de surmonter ces défis grâce à des mesures robustes de sécurité des données, au respect des directives réglementaires et à une communication claire des pratiques de conformité.
- Le manque d'expertise technique et d'infrastructures dans les petits centres cliniques de certains pays d'Asie-Pacifique peut freiner l'adoption des solutions eCOA avancées. Par exemple, ces centres peuvent ne pas disposer du soutien informatique nécessaire pour mettre en œuvre efficacement des systèmes eCOA basés sur le cloud ou mobiles.
- La variabilité du niveau de compétences numériques des patients peut également constituer un obstacle, certains participants pouvant éprouver des difficultés avec les plateformes mobiles ou web. Par exemple, les promoteurs doivent proposer des formations et des interfaces intuitives afin de garantir une collecte de données précise et complète.
Évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence dans la région Asie-Pacifique
Le marché est segmenté en fonction du produit, de l'approche, de l'utilisateur final et de la plateforme.
- Sous-produit
En fonction du type de produit, le marché des certificats d'analyse électronique (eCOA) pour les contenus sous licence en Asie-Pacifique se segmente en solutions sur site, solutions cloud et solutions web. Les solutions cloud ont dominé le marché en 2025, générant la plus grande part de revenus grâce à leur flexibilité, leur évolutivité et leur capacité à prendre en charge les essais cliniques à distance sur plusieurs sites. Les promoteurs privilégient de plus en plus les plateformes cloud, car elles permettent un accès en temps réel aux résultats rapportés par les patients (PRO), aux résultats rapportés par les cliniciens (ClinRO) et aux autres données eCOA, sans nécessiter d'infrastructure informatique importante sur chaque site. Les solutions cloud facilitent également l'intégration avec d'autres systèmes eCliniques, réduisant ainsi les incohérences de données et accélérant l'analyse. Leur adoption est par ailleurs encouragée par l'acceptation réglementaire de la saisie électronique des données dans les essais décentralisés. La compatibilité avec les appareils mobiles, les tablettes et les objets connectés améliore l'engagement et l'observance des patients. Les solutions cloud permettent également des mises à jour logicielles transparentes et une gestion centralisée des données d'essai, réduisant ainsi les coûts opérationnels pour les promoteurs.
Les solutions web devraient connaître la croissance la plus rapide entre 2026 et 2033, portée par le besoin croissant de plateformes accessibles via navigateur et ne nécessitant pas l'installation de logiciels lourds. Les outils eCOA web permettent aux centres cliniques et aux patients de saisir des données depuis n'importe quel appareil connecté à Internet, améliorant ainsi la participation aux essais décentralisés. Ils sont particulièrement intéressants pour les établissements universitaires et les petites structures de recherche à la recherche de solutions économiques et évolutives. Les solutions web prennent également en charge des interfaces multilingues et adaptées aux spécificités culturelles, un atout essentiel pour les essais menés dans plusieurs pays de la région Asie-Pacifique. La facilité d'utilisation, les faibles besoins de maintenance et la compatibilité avec divers systèmes d'exploitation sont des facteurs clés de leur adoption. La préférence croissante pour les essais hybrides, combinant visites sur site et saisie de données à distance, accélère encore davantage le développement des solutions web.
- Par approche
Selon l'approche adoptée, le marché est segmenté en quatre catégories : évaluation des résultats rapportés par les cliniciens (ClinRO), évaluation des résultats rapportés par les patients (PRO), évaluation des résultats rapportés par les observateurs (ObsRO) et évaluation des performances (PerfO). En 2025, l'évaluation des résultats rapportés par les patients (PRO) dominait le marché, représentant 45,2 % des revenus, grâce à l'importance croissante accordée aux essais cliniques centrés sur le patient. Les plateformes PRO permettent aux patients de déclarer directement leurs symptômes, leur qualité de vie et leurs réponses au traitement, offrant ainsi aux promoteurs des informations authentiques et en temps réel. L'adoption de plateformes PRO mobiles et accessibles via le cloud a amélioré l'observance et réduit les données manquantes, notamment dans les essais décentralisés ou hybrides. Les agences réglementaires, telles que la PMDA au Japon et la NMPA en Chine, encouragent de plus en plus la collecte électronique des données PRO pour des critères d'évaluation précis. Les solutions PRO permettent également une surveillance en temps réel et des alertes automatisées, permettant aux équipes cliniques de réagir rapidement aux événements indésirables ou aux cas de non-observance. Leur position dominante est soutenue par une demande croissante dans des domaines thérapeutiques tels que l'oncologie, la neurologie et les maladies chroniques, où les retours des patients sont essentiels.
L’évaluation des résultats rapportés par les observateurs (ObsRO) devrait connaître la croissance la plus rapide entre 2026 et 2033, notamment dans les essais cliniques pédiatriques, gériatriques et portant sur les maladies rares. Les plateformes ObsRO permettent aux soignants ou au personnel de l’étude de rapporter les résultats des patients lorsque ceux-ci ne peuvent pas le faire eux-mêmes, garantissant ainsi une collecte de données exhaustive et précise. L’essor de la télésurveillance et des plateformes mobiles a favorisé l’adoption de l’ObsRO, simplifiant la soumission des données en temps réel par les observateurs. Les solutions ObsRO gagnent également en popularité en raison de l’importance accordée par les autorités réglementaires à l’inclusion des populations de patients vulnérables dans les essais. La complexité croissante des études cliniques et la nécessité de valider les données provenant de sources multiples stimulent encore davantage l’adoption de l’ObsRO. L’intégration avec d’autres approches d’évaluation électronique des résultats (eCOA), telles que les PRO et les ClinRO, améliore la qualité des données et offre aux promoteurs une vision globale.
- Par l'utilisateur final
En fonction de l'utilisateur final, le marché est segmenté en prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements d'enseignement supérieur. Les prestataires de services commerciaux ont dominé le marché en 2025, générant la plus grande part de revenus grâce à leur expertise dans la fourniture de solutions eCOA évolutives et validées pour de multiples promoteurs et essais cliniques. Ces prestataires proposent des services complets incluant le déploiement de logiciels, la formation, le support technique et l'accompagnement en matière de conformité réglementaire. Leur position dominante est confortée par la tendance croissante à l'externalisation au sein des entreprises pharmaceutiques et biotechnologiques, qui privilégient les prestataires commerciaux pour la gestion d'essais cliniques décentralisés complexes. Le déploiement dans le cloud et les services de surveillance en temps réel améliorent l'efficacité et l'observance des patients. Les prestataires de services commerciaux offrent également des solutions personnalisables, adaptées aux domaines thérapeutiques, à la taille des études et aux réglementations régionales, ce qui en fait le choix privilégié pour les essais multinationaux. Leur capacité d'intégration avec d'autres plateformes eCliniques garantit une gestion centralisée des données et des délais d'essais plus courts.
Les établissements universitaires devraient connaître la croissance la plus rapide entre 2026 et 2033, portée par l'essor de la recherche clinique dans les universités et les centres hospitaliers universitaires de la région Asie-Pacifique. Ces établissements ont besoin de solutions eCOA économiques et flexibles qui prennent en charge les protocoles de recherche, l'implication des patients et la conformité réglementaire. L'adoption de plateformes eCOA web et mobiles facilite la participation aux essais multicentriques et aux études collaboratives. Les utilisateurs finaux du secteur académique bénéficient également de plateformes qui permettent l'anonymisation des données et leur partage sécurisé à des fins de recherche. L'augmentation des financements publics et les initiatives de numérisation de la recherche clinique dans des pays comme l'Inde, la Chine et le Japon accélèrent encore cette adoption. Le besoin de rapports en temps réel et d'analyses des résultats pour les publications scientifiques contribue également à la croissance de ce segment.
- Par plateforme
En fonction de la plateforme, le marché est segmenté en organismes de recherche sous contrat (CRO), entreprises pharmaceutiques et biopharmaceutiques, fabricants de dispositifs médicaux, hôpitaux et laboratoires d'analyses médicales, sociétés de conseil, établissements de recherche et universités, et autres. Les CRO ont dominé le marché en 2025, générant la plus grande part de revenus grâce à leur capacité à gérer de multiples essais cliniques dans différentes régions géographiques via des systèmes eCOA centralisés et validés. Les CRO offrent aux promoteurs l'avantage d'externaliser les complexités techniques et réglementaires, notamment la configuration du système, la formation et les audits de conformité. Leurs plateformes cloud permettent un accès en temps réel aux données cliniques, améliorant ainsi le suivi et accélérant la prise de décision. Les CRO exploitent également l'analyse de données basée sur l'IA pour identifier les tendances, contrôler l'observance des patients et signaler les incohérences. Leur position dominante est renforcée par des partenariats solides avec des entreprises pharmaceutiques et biotechnologiques menant des essais à grande échelle en Asie-Pacifique. La standardisation des plateformes eCOA des CRO facilite également les soumissions réglementaires multinationales.
Les entreprises pharmaceutiques et biopharmaceutiques devraient connaître la croissance la plus rapide entre 2026 et 2033, grâce à l'adoption croissante de plateformes eCOA internes. Ces plateformes permettent de rationaliser les essais cliniques et d'améliorer la collecte de données centrées sur le patient. Le déploiement direct permet aux promoteurs de conserver la maîtrise de l'intégrité et de la conformité des données, tout en réduisant leur dépendance aux prestataires de services tiers. Cette croissance est alimentée par l'augmentation des investissements dans les solutions mobiles et cloud, qui prennent en charge les modèles d'essais hybrides et décentralisés. Les entreprises tirent également parti des plateformes eCOA pour accélérer les essais, renforcer l'engagement des patients et se conformer aux exigences réglementaires en matière de collecte électronique de données. L'intégration avec d'autres systèmes numériques, tels que les dossiers médicaux électroniques et la gestion des données de laboratoire, favorise encore davantage l'adoption de ces plateformes par les entreprises pharmaceutiques et biotechnologiques.
Analyse régionale du marché des évaluations électroniques des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique
- En 2025, le Japon dominait le marché Asie-Pacifique des solutions électroniques d'évaluation des résultats cliniques (eCOA) pour les contenus sous licence, avec la plus grande part de revenus (38,5 %). Cette domination s'explique par une infrastructure de santé numérique avancée, un grand nombre d'essais cliniques en cours et la présence de fournisseurs de technologies de pointe proposant des plateformes eCOA intégrées.
- Au Japon, les promoteurs et les centres cliniques apprécient particulièrement l'efficacité, le suivi en temps réel et la conformité réglementaire des plateformes eCOA, qui permettent une saisie précise et rapide des résultats rapportés par les patients, les cliniciens et les observateurs.
- Cette adoption généralisée est également favorisée par des réseaux de recherche clinique bien établis, un soutien gouvernemental croissant aux technologies de santé numérique et un intérêt grandissant des entreprises pharmaceutiques et biopharmaceutiques pour les modèles d'essais décentralisés et hybrides, faisant de l'eCOA une solution privilégiée pour la collecte des résultats cliniques.
Analyse du marché japonais de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence
Le marché japonais des solutions d'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence connaît une forte croissance grâce à l'infrastructure de santé numérique avancée du pays, à l'activité intense des essais cliniques et à l'accent mis sur la recherche centrée sur le patient. L'adoption des plateformes mobiles PRO et ClinRO est stimulée par le nombre croissant d'hôpitaux intelligents et de centres de recherche clinique connectés. L'intégration aux systèmes de dossiers médicaux électroniques (DME) et aux plateformes eCliniques plus vastes améliore le suivi en temps réel, la conformité réglementaire et l'efficacité opérationnelle. Le vieillissement de la population japonaise alimente également la demande de solutions conviviales pour les patients et de solutions d'évaluation des résultats rapportés par les observateurs (ObsRO) dans les essais menés à domicile et en milieu hospitalier. Par ailleurs, les promoteurs exploitent l'intelligence artificielle et l'analyse de données dans les plateformes eCOA pour améliorer la qualité des données et optimiser la prise de décision dans les essais.
Analyse du marché chinois de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence
Le marché chinois des solutions électroniques d'évaluation des résultats cliniques (eCOA) pour les contenus sous licence devrait connaître la croissance la plus rapide de la région Asie-Pacifique au cours de la période de prévision. Cette croissance est alimentée par une forte augmentation des essais cliniques, les incitations gouvernementales à l'adoption de la santé numérique et l'utilisation croissante des plateformes d'évaluation des résultats mobiles et basées sur le cloud. Les promoteurs mettent de plus en plus en œuvre des essais décentralisés afin d'atteindre des populations de patients plus larges, en tirant parti des solutions eCOA pour le suivi des patients en temps réel. L'intégration avec les dispositifs portables et les outils de télédéclaration améliore la précision des données et la conformité. Cette croissance est également soutenue par le développement des services des CRO et des fournisseurs de plateformes nationaux proposant des solutions évolutives et rentables. Par ailleurs, la reconnaissance réglementaire des données électroniques PRO, ClinRO et ObsRO encourage leur adoption par les entreprises pharmaceutiques et biotechnologiques.
Analyse du marché indien de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence
Le marché indien des solutions d'évaluation électronique des résultats cliniques (eCOA) sous licence a représenté la plus grande part de revenus de la région Asie-Pacifique en 2025. Cette performance s'explique par la croissance du secteur de l'externalisation de la recherche clinique, l'amélioration des compétences numériques des patients et l'adoption rapide des technologies de santé mobile. L'essor des essais décentralisés, associé à des plateformes eCOA abordables et évolutives basées sur le cloud, favorise une adoption plus large dans les hôpitaux, les établissements universitaires et les CRO. L'écosystème des essais cliniques en Inde, en pleine expansion et soutenu par un cadre réglementaire incitatif en faveur de la saisie électronique des résultats, permet une collecte de données plus rapide et une meilleure observance des patients. Par ailleurs, les promoteurs multinationaux privilégient de plus en plus l'Inde pour leurs études multinationales en raison de son rapport coût-efficacité et de la disponibilité de personnel qualifié. L'adoption de solutions PRO (résultats rapportés par le patient) et ObsRO (résultats observés) centrées sur le patient contribue à améliorer la qualité des essais et les capacités de suivi en temps réel.
Analyse du marché australien de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence
Le marché australien des solutions électroniques d'évaluation des résultats cliniques (eCOA) pour les contenus sous licence connaît une croissance soutenue grâce à l'infrastructure de santé avancée du pays, à l'adoption généralisée des technologies de santé numérique et au nombre croissant d'essais cliniques menés dans les hôpitaux et les instituts de recherche. Les promoteurs et les CRO apprécient l'Australie pour son cadre réglementaire conforme aux normes internationales, ce qui facilite la mise en œuvre des plateformes électroniques PRO, ClinRO, ObsRO et PerfO. L'utilisation généralisée des solutions eCOA mobiles et web améliore l'engagement et l'observance des patients, notamment dans les essais décentralisés ou hybrides. L'intégration aux dossiers médicaux électroniques (DME) et autres systèmes numériques améliore la précision des données et rationalise la gestion des essais. Par ailleurs, le personnel clinique qualifié australien et l'accent mis sur la recherche centrée sur le patient favorisent l'adoption de plateformes eCOA innovantes dans les essais pharmaceutiques, biopharmaceutiques et de dispositifs médicaux.
Part de marché en Asie-Pacifique de l'évaluation électronique des résultats cliniques (eCOA) pour le contenu sous licence
Le secteur de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique est principalement dirigé par des entreprises bien établies, notamment :
- Veeva Systems (États-Unis)
- Kayentis (France)
- Signant Health (États-Unis)
- IQVIA Holdings, Inc. (États-Unis)
- Clinical Ink, Inc. (États-Unis)
- Medidata Solutions (États-Unis)
- eCOA GmbH (Allemagne)
- CRF Santé (Royaume-Uni)
- Motentia, LLC (États-Unis)
- Bracket Global LLC (États-Unis)
- SHYFT Analytics (États-Unis)
- Solutions Mednet (Australie)
- SureClinical (États-Unis)
- Relypsa (États-Unis)
- OpenClinica, LLC (États-Unis)
- Clario (États-Unis)
- Datacubed Santé (États-Unis)
- Florence Healthcare (États-Unis)
- bloqcube (États-Unis)
- Clinique en temps réel (États-Unis)
Quels sont les développements récents sur le marché de l'évaluation électronique des résultats cliniques (eCOA) pour les contenus sous licence en Asie-Pacifique ?
- En mars 2024, d'importants prestataires de services de recherche clinique, tels que PPD (Thermo Fisher Scientific), ont publiquement mis en avant leurs écosystèmes d'essais cliniques numériques et décentralisés, en insistant sur les outils et méthodologies qui soutiennent la saisie numérique des résultats, notamment les eCOA, conçus pour améliorer la qualité des données, réduire la charge pesant sur les patients et accroître la participation aux essais dans différentes régions, y compris l'Asie-Pacifique.
- En décembre 2023, ObvioHealth a annoncé le lancement de sa solution innovante d'évaluation électronique des résultats cliniques (eCOA), intégrée à sa plateforme ObvioGo®, permettant une création rapide des eCOA, une implication accrue des patients et des délais de mise en œuvre jusqu'à 70 % plus courts pour les essais cliniques.
- En août 2023, l’Administration nationale chinoise des produits médicaux (NMPA) et le Centre d’évaluation des médicaments (CDE) ont publié les Lignes directrices techniques pour la mise en œuvre d’essais cliniques de médicaments centrés sur le patient, reconnaissant officiellement les outils électroniques tels que le certificat électronique d’analyse (eCOA), le consentement électronique et la collecte de données à distance pour moderniser les pratiques des essais cliniques. Cette clarification réglementaire favorise l’utilisation accrue des technologies eCOA dans les essais cliniques de la région Asie-Pacifique.
- En juin 2023, ICON plc a annoncé une mise à jour majeure de sa plateforme numérique ICON, intégrant un module eCOA préchargé de bibliothèques d'évaluation validées. La plateforme facilite l'implication des patients, le consentement électronique, l'eCOA et la saisie de données à distance dans le cadre d'essais cliniques traditionnels et décentralisés, réduisant ainsi le temps de mise en place et améliorant la cohérence des données de résultats.
- En avril 2023, Almac Clinical Technologies a annoncé le lancement de son réseau de partenariat IXRS®3, permettant aux promoteurs biopharmaceutiques et aux CRO de partager des données et des technologies cliniques interopérables, notamment des modules eCOA, afin de créer des expériences d'essais cliniques plus fluides et inclusives pour les centres et les patients. Cette initiative met l'accent sur l'interopérabilité et la collaboration pour rationaliser la saisie des données d'essais et améliorer l'intégration des eCOA dans les études multicentriques.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.