Asia Pacific Electronic Clinical Outcome Assessment Ecoa Market
Taille du marché en milliards USD
TCAC :
% 
 USD
265.11 million
USD
924.58 million
2024
2032
USD
265.11 million
USD
924.58 million
2024
2032
| 2025 –2032 | |
| USD 265.11 million | |
| USD 924.58 million | |
|
|
|
|
Segmentation du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique, par produit (solutions sur site, solutions cloud et solutions web), approche (évaluation des résultats rapportés par le clinicien (CLINRO), évaluation des résultats rapportés par le patient (PRO), évaluation des résultats rapportés par l'observateur (OBSRO) et évaluation des résultats de performance (PERFO)), utilisateur final (prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements universitaires), plateforme (organismes de recherche sous contrat, sociétés pharmaceutiques et biopharmaceutiques, fabricants de dispositifs médicaux, hôpitaux et laboratoires cliniques, sociétés de services de conseil, recherche et universités, etc.) - Tendances et prévisions du secteur jusqu'en 2032
Taille du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
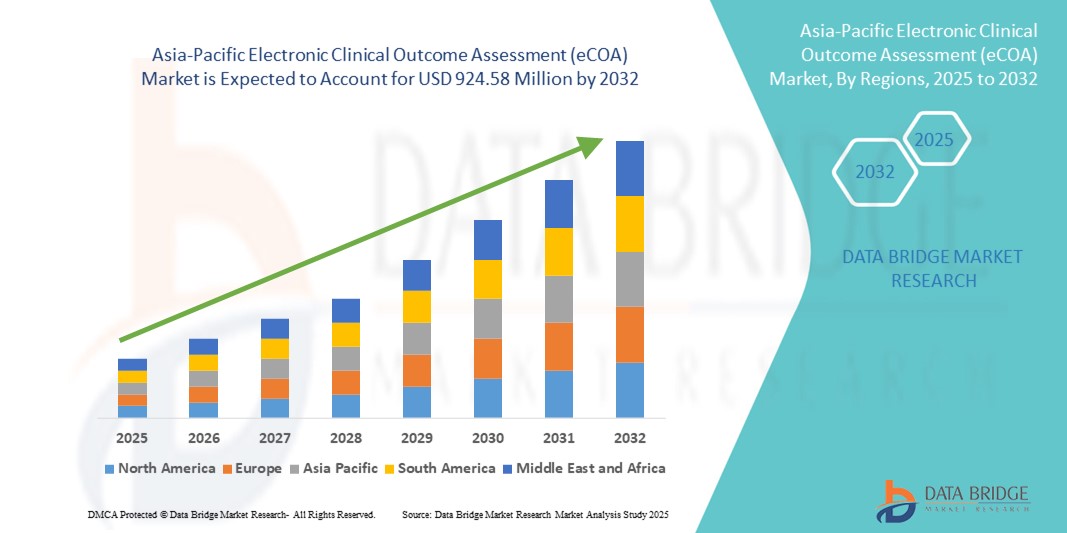
- La taille du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique était évaluée à 265,11 millions USD en 2024 et devrait atteindre 924,58 millions USD d'ici 2032 , à un TCAC de 16,90 % au cours de la période de prévision.
- La croissance du marché est principalement tirée par l'adoption croissante des technologies de santé numériques, l'encouragement réglementaire à la saisie électronique des données dans les essais cliniques et la demande croissante de solutions de surveillance à distance et centrées sur le patient dans toute la région.
- De plus, l'accent croissant mis sur l'amélioration de la précision des données, de la conformité et de l'information en temps réel sur les patients positionne les plateformes eCOA comme un élément essentiel de la recherche clinique moderne. Ces facteurs accélèrent l'adoption des solutions eCOA, propulsant ainsi significativement l'expansion du marché en Asie-Pacifique.
Analyse du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
- Les plateformes eCOA, qui permettent la capture électronique des résultats rapportés par les patients, les cliniciens et les observateurs dans les essais cliniques, deviennent des outils essentiels dans le développement de médicaments et la recherche clinique modernes en raison de leur précision accrue des données, de leurs capacités de surveillance en temps réel et de leur intégration transparente avec d'autres solutions de santé numériques.
- L'adoption croissante des solutions eCOA est principalement motivée par la numérisation croissante des essais cliniques, l'encouragement réglementaire à la collecte électronique de données et le besoin croissant de conceptions d'essais centrées sur le patient, à distance et décentralisées.
- La Chine a dominé le marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique avec la plus grande part de revenus de 39 % en 2024, caractérisée par une augmentation des activités d'essais cliniques, une adoption rapide de la santé numérique et la présence d'acteurs clés de l'industrie, avec une adoption significative des solutions eCOA dans les essais cliniques multicentriques et décentralisés.
- L'Inde devrait être le pays connaissant la croissance la plus rapide sur le marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique au cours de la période de prévision en raison de l'augmentation des investissements dans la recherche clinique, du soutien gouvernemental aux initiatives de santé numérique et de l'adoption croissante de solutions eCOA centrées sur le patient et basées sur le mobile.
- Le segment de l'évaluation des résultats rapportés par les patients (PRO) a dominé le marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique avec une part de marché de 42,8 % en 2024, grâce à son rôle essentiel dans la capture des expériences réelles des patients, l'amélioration de la conformité des essais et l'amélioration de la fiabilité globale des données.
Portée du rapport et segmentation du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
|
Attributs |
Informations clés sur le marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique |
|
Segments couverts |
|
|
Pays couverts |
Asie-Pacifique
|
|
Principaux acteurs du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
Outre les informations sur les scénarios de marché tels que la valeur marchande, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché organisés par Data Bridge Market Research comprennent également une analyse approfondie des experts, une analyse des prix, une analyse de la part de marque, une enquête auprès des consommateurs, une analyse démographique, une analyse de la chaîne d'approvisionnement, une analyse de la chaîne de valeur, un aperçu des matières premières/consommables, des critères de sélection des fournisseurs, une analyse PESTLE, une analyse Porter et un cadre réglementaire. |
Tendances du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
Transformation numérique et solutions eCOA basées sur le mobile
- Une tendance significative et croissante sur le marché eCOA de la région Asie-Pacifique est l'adoption croissante de plateformes mobiles et basées sur le cloud qui permettent la capture de données de patients en temps réel dans les essais cliniques, améliorant ainsi la précision et l'efficacité.
- Par exemple, en 2024, CRF Health (désormais Medidata Solutions) a étendu ses offres eCOA mobiles à travers la Chine et l'Inde, permettant aux patients de signaler les résultats via des smartphones et des tablettes, augmentant ainsi la conformité des essais et la fiabilité des données.
- L'intégration avec l'IA et les outils d'analyse améliore les fonctionnalités des plateformes eCOA, permettant des analyses prédictives, des contrôles automatisés de la qualité des données et l'identification précoce des écarts de protocole. Certaines plateformes peuvent analyser les résultats rapportés par les patients en temps réel afin de signaler les incohérences ou les tendances inhabituelles, améliorant ainsi la supervision globale des essais.
- L'interopérabilité des systèmes eCOA avec les dossiers médicaux électroniques (DME) et d'autres systèmes de gestion des essais cliniques (CTMS) permet une gestion centralisée des données des essais, facilitant une surveillance plus efficace, une prise de décision plus rapide et une charge administrative réduite.
- Cette tendance vers des solutions eCOA plus intelligentes, centrées sur le patient et connectées transforme l'exécution des essais cliniques en Asie-Pacifique, incitant des fournisseurs tels que Signant Health et Oracle Health Sciences à améliorer les fonctionnalités mobiles, cloud et basées sur l'IA pour les opérations d'essais locales.
- La demande de plateformes eCOA adaptées aux appareils mobiles, intégrées et axées sur l'analyse augmente rapidement dans les essais cliniques menés par les sociétés pharmaceutiques et les CRO, car les sponsors et les chercheurs accordent la priorité à l'exactitude des données, à la conformité des patients et à l'efficacité opérationnelle.
Dynamique du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
Conducteur
Augmentation de l'activité des essais cliniques et adoption de la santé numérique
- Le nombre croissant d'essais cliniques en Asie-Pacifique, ainsi que l'adoption rapide de solutions de santé numériques, constituent un moteur majeur de la croissance du marché de l'eCOA.
- Par exemple, en mars 2024, PPD a annoncé le déploiement de plateformes eCOA pour les essais cliniques décentralisés en Inde, permettant le suivi des patients et la collecte de données à distance. De telles initiatives, menées par des entreprises clés, devraient accélérer l'expansion du marché au cours de la période de prévision.
- Alors que les sociétés pharmaceutiques se concentrent sur les essais centrés sur le patient, les solutions eCOA offrent des avantages tels que la capture de données en temps réel, des rappels de conformité automatisés et des visites sur site réduites, améliorant ainsi à la fois la qualité des essais et l'engagement des participants.
- En outre, les initiatives gouvernementales soutenant la santé numérique et les directives réglementaires encourageant la collecte électronique des résultats rapportés par les patients favorisent l'adoption des plateformes eCOA.
- La flexibilité des rapports sur mobile et tablette, combinée à l'intégration dans des flux de travail de gestion d'essais cliniques plus larges, fait d'eCOA un outil indispensable dans les essais locaux et multinationaux en Asie-Pacifique.
Retenue/Défi
Variations réglementaires et préoccupations en matière de confidentialité des données
- Les différences entre les cadres réglementaires et les lois sur la confidentialité des données des pays d'Asie-Pacifique constituent un obstacle majeur à l'adoption généralisée des solutions eCOA. La conformité aux réglementations locales en matière de stockage des données, de consentement des patients et de transfert transfrontalier de données exige une planification et des investissements rigoureux.
- Par exemple, les essais en Chine et en Corée du Sud doivent respecter des exigences strictes en matière de localisation des données, ce qui peut compliquer le déploiement de systèmes eCOA basés sur le cloud.
- Assurer la sécurité des données grâce à un chiffrement robuste, des protocoles d'authentification sécurisés et le respect des réglementations locales est essentiel pour instaurer la confiance entre les sponsors, les CRO et les participants. Des entreprises comme Medidata et CRF Health mettent l'accent sur la conformité réglementaire et les mesures de sécurité avancées dans leurs offres en Asie-Pacifique afin d'atténuer ces préoccupations.
- En outre, les limitations d’infrastructure dans certaines régions, telles qu’une connectivité Internet irrégulière ou une faible culture numérique parmi les patients, peuvent entraver la mise en œuvre efficace des solutions eCOA.
- Surmonter ces défis grâce à des stratégies de déploiement localisées, à la formation des patients, à l'alignement réglementaire et à l'investissement dans des plateformes sécurisées et adaptables est essentiel pour une croissance soutenue du marché eCOA en Asie-Pacifique.
Portée du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
Le marché est segmenté sur la base du produit, de l’approche, de l’utilisateur final et de la plateforme.
- Par produit
En termes de produits, le marché Asie-Pacifique de l'évaluation électronique des résultats cliniques (eCOA) est segmenté en solutions sur site, solutions cloud et solutions web. Le segment des solutions cloud a dominé le marché avec la plus grande part de chiffre d'affaires (45,6 %) en 2024, grâce à l'adoption croissante des plateformes d'essais cliniques numériques et à la flexibilité offerte pour les essais à distance et décentralisés. Les plateformes eCOA cloud permettent aux promoteurs, aux CRO et aux hôpitaux d'accéder en temps réel aux données rapportées par les patients et aux résultats cliniques, améliorant ainsi l'efficacité opérationnelle et réduisant les erreurs de saisie. Ces plateformes facilitent également la collaboration entre les essais cliniques multicentriques, permettant aux responsables d'études et aux investigateurs de suivre l'avancement, de contrôler la conformité et de répondre instantanément aux questions. Le marché constate une forte demande pour les solutions cloud en raison de leur évolutivité, de leurs exigences minimales en matière d'infrastructure informatique et de leur rentabilité, tant pour les essais à grande échelle que pour les essais à petite échelle.
Le segment des solutions web devrait connaître la croissance la plus rapide, soit 23,4 % entre 2025 et 2032, alimenté par le besoin croissant de plateformes accessibles par navigateur prenant en charge divers environnements d'essais. Ces plateformes offrent des interfaces conviviales pour les patients, les cliniciens et les coordinateurs d'études, réduisant ainsi la courbe d'apprentissage liée à la saisie électronique des données. Les systèmes eCOA web permettent également l'accès à distance aux données d'essai, un atout particulièrement important pour les essais cliniques décentralisés et hybrides, améliorant ainsi l'engagement et l'observance des patients. La flexibilité des plateformes web permet de mener des essais dans des régions aux infrastructures technologiques variées. L'adoption de solutions web est également encouragée par les organismes de réglementation qui privilégient la saisie électronique des données pour les résultats rapportés par les patients.
- Par approche
En fonction de l'approche, le marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique est segmenté en deux catégories : l'évaluation des résultats rapportés par les cliniciens (CLINRO), l'évaluation des résultats rapportés par les patients (PRO), l'évaluation des résultats rapportés par les observateurs (OBSRO) et l'évaluation des résultats de performance (PERFO). Le segment de l'évaluation des résultats rapportés par les patients (PRO) a dominé le marché avec une part de chiffre d'affaires significative de 42,8 % en 2024, grâce à son importance pour recueillir l'expérience réelle des patients et leur niveau de satisfaction. Les solutions PRO permettent aux participants de signaler directement leurs symptômes, leurs effets secondaires et leurs mesures de qualité de vie, réduisant ainsi le recours aux intermédiaires et minimisant les biais de déclaration. Cette approche est particulièrement utile dans les essais sur les maladies chroniques et les études à long terme, où le retour des patients est essentiel à l'évaluation de l'efficacité et de la sécurité. Les données PRO aident les promoteurs et les autorités de réglementation à prendre des décisions éclairées tout en améliorant l'engagement et l'observance des patients. De plus, l'intégration croissante des modules PRO avec les appareils mobiles et les tablettes améliore la précision et la commodité de la collecte de données pour les participants.
Le segment de l'évaluation des résultats rapportés par l'observateur (OBSRO) devrait connaître le TCAC le plus rapide entre 2025 et 2032, car les essais cliniques portent de plus en plus sur des populations pédiatriques, gériatriques et spécifiques qui ne peuvent pas autodéclarer les résultats de manière fiable. Les solutions OBSRO permettent aux soignants, aux parents ou aux observateurs formés de recueillir des données cliniques et comportementales essentielles pour le compte du patient. Cette méthode garantit une collecte de données standardisée et de haute qualité, tout en préservant la sécurité et la conformité des patients. Ce segment bénéficie du développement de plateformes OBSRO mobiles et portables, permettant la saisie et l'analyse des données en temps réel. L'accent accru mis par la réglementation sur les essais centrés sur le patient et la collecte précise des données soutient également la croissance du segment OBSRO.
- Par utilisateur final
En fonction de l'utilisateur final, le marché Asie-Pacifique de l'évaluation électronique des résultats cliniques (eCOA) est segmenté entre prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements universitaires. Ce segment a dominé le marché avec la plus grande part de chiffre d'affaires (39,8 %) en 2024, grâce à son rôle essentiel dans la conduite d'essais cliniques externalisés pour les entreprises pharmaceutiques et biotechnologiques. Ces prestataires exploitent les plateformes eCOA pour garantir une collecte de données cohérente, précise et conforme lors d'essais multicentriques, améliorant ainsi l'efficacité et réduisant les délais. Ils bénéficient également de solutions eCOA cloud et mobiles permettant un suivi centralisé et des rapports en temps réel. Les prestataires de services commerciaux adoptent de plus en plus de solutions eCOA intégrées pour offrir des services complets, incluant le recrutement des patients, leur engagement et le suivi des essais. De plus, leur capacité à gérer des essais à grande échelle et à fournir une infrastructure de support robuste encourage les investissements continus dans des systèmes eCOA avancés.
Les hôpitaux et les centres de transplantation devraient connaître la croissance la plus rapide, soit 22,1 % entre 2025 et 2032, grâce à l'adoption croissante des systèmes eCOA pour le suivi des patients, la tenue des dossiers médicaux électroniques et l'intégration aux systèmes d'information hospitaliers. Ces établissements participent de plus en plus à des essais cliniques multicentriques et ont besoin de plateformes standardisées pour la collecte et le reporting des données. Les solutions eCOA permettent aux cliniciens de suivre les patients à distance, de saisir les résultats en temps réel et d'améliorer la conformité. L'intégration aux dossiers médicaux électroniques (DME) garantit un transfert fluide des données cliniques tout en maintenant la conformité réglementaire. Les hôpitaux bénéficient également d'un engagement accru des patients grâce aux modules PRO mobiles, qui améliorent la rétention des données des essais et la fiabilité des données.
- Par plateforme
En termes de plateforme, le marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique est segmenté en organisations de recherche sous contrat (CRO), sociétés pharmaceutiques et biopharmaceutiques, fabricants de dispositifs médicaux, hôpitaux et laboratoires cliniques, sociétés de conseil, chercheurs et universitaires, entre autres. Le segment des CRO a dominé le marché avec une part de chiffre d'affaires de 41,5 % en 2024, porté par l'externalisation croissante des essais cliniques et leur recours aux plateformes eCOA pour la collecte de données centrées sur le patient, la conformité réglementaire et l'efficacité opérationnelle. Les CRO privilégient de plus en plus les solutions d'essais numériques intégrées combinant eCOA, eConsent et fonctionnalités de surveillance à distance. Cette approche réduit les délais des essais, améliore la qualité des données et permet une collaboration fluide avec les promoteurs et les sites répartis dans plusieurs régions. De plus, les CRO investissent dans des solutions eCOA cloud et mobiles pour prendre en charge les modèles d'essais décentralisés et hybrides. Le besoin de surveillance, d'analyse et de reporting en temps réel renforce l'adoption des solutions eCOA dans les opérations des CRO.
Les sociétés pharmaceutiques et biopharmaceutiques devraient enregistrer le TCAC le plus rapide entre 2025 et 2032, grâce à l'importance croissante accordée aux solutions d'essais cliniques numériques et aux résultats rapportés par les patients pour accélérer le développement des médicaments. Ces entreprises exploitent les plateformes eCOA pour recueillir des données précises sur l'efficacité et la sécurité, optimiser la conception des essais et améliorer la préparation aux soumissions réglementaires. L'intégration avec d'autres solutions numériques, telles que les systèmes de gestion des essais cliniques (CTMS) et les systèmes de saisie électronique des données (EDC), améliore l'efficacité opérationnelle. Par ailleurs, les promoteurs pharmaceutiques adoptent de plus en plus des modèles d'essais centrés sur le patient, qui nécessitent des systèmes eCOA robustes pour collecter des données de haute qualité en temps réel.
Analyse régionale du marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
- La Chine a dominé le marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique avec la plus grande part de revenus de 39 % en 2024, caractérisée par une augmentation des activités d'essais cliniques, une adoption rapide de la santé numérique et la présence d'acteurs clés de l'industrie, avec une adoption significative des solutions eCOA dans les essais cliniques multicentriques et décentralisés.
- Les chercheurs cliniques et les sponsors de la région apprécient grandement la précision, l'accès aux données en temps réel et les capacités centrées sur le patient offertes par les plateformes eCOA, qui rationalisent la capture des données et améliorent la conformité dans les essais en milieu hospitalier et décentralisés.
- Cette adoption généralisée est également soutenue par l'augmentation des investissements dans les infrastructures de santé, la collaboration croissante entre les sociétés pharmaceutiques et les CRO, et un nombre croissant d'essais cliniques décentralisés et hybrides, faisant des solutions eCOA un outil privilégié pour la recherche clinique dans la région Asie-Pacifique.
Aperçu du marché chinois de l'eCOA
Le marché chinois de l'évaluation électronique des résultats cliniques (eCOA) a représenté la plus grande part de chiffre d'affaires en 2024 en Asie-Pacifique, avec 38,5 %, grâce à la croissance rapide des essais cliniques, à l'adoption croissante des technologies de santé numériques et aux initiatives gouvernementales encourageant la collecte électronique des résultats rapportés par les patients. Les chercheurs cliniques et les promoteurs privilégient de plus en plus la saisie de données en temps réel, précises et centrées sur le patient afin de rationaliser les essais. De plus, l'intégration de plateformes mobiles et de solutions cloud améliore l'accessibilité et l'efficacité opérationnelle des essais multicentriques.
Aperçu du marché japonais de l'eCOA
Le marché japonais de l'évaluation électronique des résultats cliniques (eCOA) prend de l'ampleur grâce à des infrastructures de santé avancées, à l'adoption de technologies de pointe et à l'importance croissante accordée aux essais cliniques centrés sur le patient. Ce marché privilégie des solutions de saisie électronique de données sécurisées, précises et faciles à utiliser, notamment pour les essais en milieu hospitalier et décentralisés. L'intégration avec les appareils mobiles et les outils d'analyse améliore l'efficacité et la conformité, tandis que le vieillissement de la population accroît la demande de plateformes simplifiant la création de rapports pour les patients âgés.
Aperçu du marché indien de l'eCOA
Le marché indien de l'évaluation électronique des résultats cliniques (eCOA) a représenté une part significative du chiffre d'affaires en Asie-Pacifique en 2024, grâce à l'expansion de l'écosystème de recherche clinique du pays, à la hausse des investissements dans les technologies de santé numérique et à l'adoption rapide de solutions de reporting mobiles et web. L'Inde devient une plaque tournante pour les essais cliniques multinationaux et locaux, et la disponibilité croissante de plateformes eCOA rentables, conjuguée aux initiatives gouvernementales en faveur de la santé numérique, stimule la croissance du marché.
Aperçu du marché australien de l'eCOA
Le marché australien de l'évaluation électronique des résultats cliniques (eCOA) devrait connaître une croissance régulière grâce à l'importance croissante accordée aux essais décentralisés, à l'engagement numérique des patients et à l'adoption de plateformes eCOA en ligne et dans le cloud. La robuste infrastructure de santé du pays et l'importance accordée à la conformité réglementaire encouragent l'utilisation d'outils électroniques d'évaluation des résultats sécurisés et performants. L'intégration aux systèmes d'information hospitaliers et aux plateformes de gestion des essais cliniques soutient également l'expansion du marché.
Aperçu du marché eCOA en Corée du Sud
Le marché sud-coréen de l'évaluation électronique des résultats cliniques (eCOA) connaît une croissance soutenue par les avancées technologiques dans les essais cliniques, le fort soutien gouvernemental à l'adoption de la santé numérique et la demande croissante de recueil des résultats rapportés par les patients. Les hôpitaux et les instituts de recherche utilisent de plus en plus les solutions eCOA mobiles et cloud pour renforcer l'engagement des patients, améliorer la qualité des données et accélérer les essais. L'accent mis sur la conformité réglementaire et la sécurité des données renforce encore la confiance du marché.
Part de marché de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique
Le secteur de l'évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique est principalement dirigé par des entreprises bien établies, notamment :
- IQVIA (États-Unis)
- Medidata Solutions, Inc. (États-Unis)
- Clario (États-Unis)
- ArisGlobal (États-Unis)
- Signant Health (États-Unis)
- TransPerfect (États-Unis)
- Cloudbyz (États-Unis)
- Climedo Health GmbH (Allemagne)
- ClinCapture (États-Unis)
- Veeva Systems (États-Unis)
- ObvioHealth (États-Unis)
- Novotech (Australie)
- Parexel International (MA) Corporation (États-Unis)
- Anju Software, Inc. (États-Unis)
- Kayentis (France)
- The Diary Pte. Ltd (Singapour)
- Bracket Global LLC (États-Unis)
- Dassault Systèmes SE (France)
- CRF Health (États-Unis)
- ERT Clinical (États-Unis)
Quels sont les développements récents sur le marché de l’évaluation électronique des résultats cliniques (eCOA) en Asie-Pacifique ?
- En mai 2025, Clario a annoncé la finalisation de l'acquisition de l'activité d'évaluation électronique des résultats cliniques (eCOA) de WCG. Cette acquisition stratégique renforce la capacité de Clario à fournir des solutions de données numériques pour les points finaux, notamment dans le domaine des neurosciences, en intégrant l'expertise et la technologie de WCG. Cette opération devrait renforcer la position de Clario sur le marché mondial, notamment en Asie-Pacifique, en proposant des solutions plus complètes à ses clients.
- En février 2024, un article de blog d'IQVIA a présenté les stratégies de l'entreprise pour accélérer la mise en œuvre de l'eCOA afin de soutenir l'essor des essais cliniques décentralisés (ECD). L'article mettait en avant les avantages de sa vaste bibliothèque d'évaluations pré-construites et pré-validées, qui permet de réduire les délais de démarrage des études de plusieurs mois à quelques semaines. Cette priorité accordée à l'agilité et à l'efficacité est devenue un pilier de l'approche d'IQVIA sur le marché Asie-Pacifique, où les ECD gagnent en popularité.
- En août 2023, l'Administration nationale des produits médicaux (NMPA) et le Centre d'évaluation des médicaments (CDE) de Chine ont officiellement publié les « Directives techniques pour la mise en œuvre d'essais cliniques de médicaments centrés sur le patient ». Ces directives fournissent un cadre pour l'utilisation d'outils numériques tels que l'eCOA, le consentement éclairé électronique et la collecte de données à distance, témoignant du soutien officiel du gouvernement chinois à la modernisation des pratiques d'essais cliniques. Cette clarification réglementaire devrait favoriser l'adoption accrue des technologies d'eCOA dans le pays.
- En avril 2023, Almac Clinical Technologies, membre du groupe Almac, a annoncé le lancement de son réseau de partenariat IXRS3. Cette initiative vise à étendre les capacités de l'entreprise à fournir des solutions avancées d'évaluation électronique des résultats cliniques (eCOA) dans la région Asie-Pacifique. Ce réseau vise à accélérer les essais cliniques en intégrant des technologies et une expertise innovantes, améliorant ainsi l'efficacité et l'efficience des mises en œuvre de l'eCOA dans la région.
- En mars 2021, Veeva Systems a annoncé que LSK Global Pharma Services Co. Ltd., une importante CRO coréenne, avait adopté Veeva Vault eTMF, Veeva Vault CTMS et Veeva SiteVault Free. Cette décision s'inscrivait dans la stratégie globale de Veeva visant à étendre ses solutions cliniques intégrées basées sur le cloud à la région Asie-Pacifique, aidant ainsi les entreprises locales à rationaliser la gestion des essais et à collaborer plus efficacement à l'échelle mondiale.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.