Europe Electronic Clinical Outcome Assessment Ecoa Market
Taille du marché en milliards USD
TCAC :
% 
 USD
1.92 Billion
USD
6.42 Billion
2024
2032
USD
1.92 Billion
USD
6.42 Billion
2024
2032
| 2025 –2032 | |
| USD 1.92 Billion | |
| USD 6.42 Billion | |
|
|
|
|
Segmentation du marché européen de l'évaluation électronique des résultats cliniques (eCOA), par produit (solutions sur site, cloud et web), approche (évaluation des résultats rapportés par le clinicien (CLINRO), évaluation des résultats rapportés par le patient (PRO), évaluation des résultats rapportés par l'observateur (OBSRO) et évaluation des résultats de performance (PERFO)), utilisateur final (prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements universitaires), plateforme (organismes de recherche sous contrat, sociétés pharmaceutiques et biopharmaceutiques, fabricants de dispositifs médicaux, hôpitaux et laboratoires cliniques, sociétés de conseil, recherche et universités, etc.) - Tendances et prévisions du secteur jusqu'en 2032
Taille du marché européen de l'évaluation électronique des résultats cliniques (eCOA)
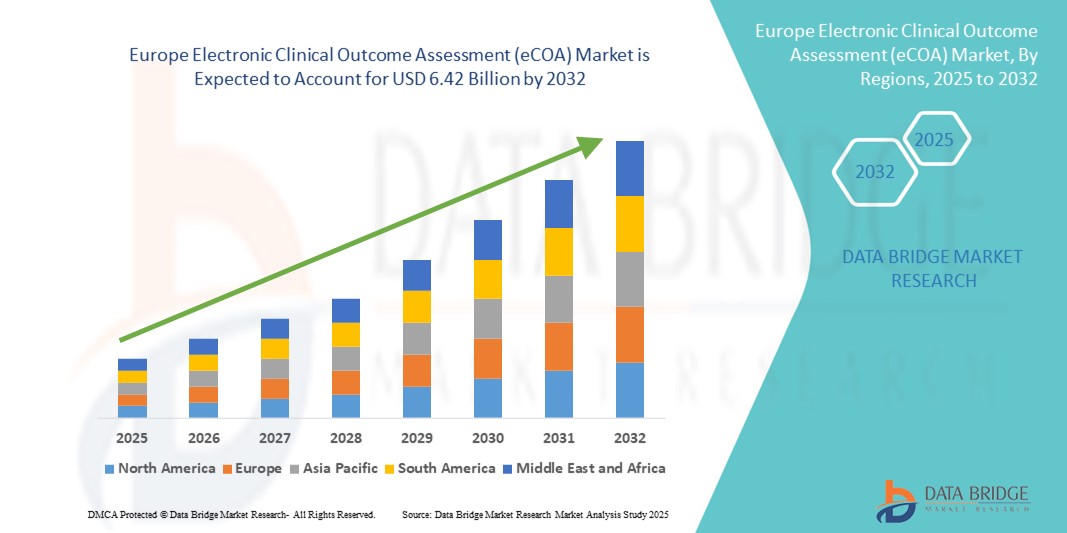
- La taille du marché européen de l'évaluation électronique des résultats cliniques (eCOA) était évaluée à 1,92 milliard USD en 2024 et devrait atteindre 6,42 milliards USD d'ici 2032 , à un TCAC de 16,30 % au cours de la période de prévision.
- La croissance du marché est en grande partie tirée par l’adoption croissante de solutions de santé numériques, la modernisation des essais cliniques et le soutien réglementaire à la saisie électronique des données, permettant des résultats rapportés par les patients plus efficaces et plus précis.
- Par ailleurs, la demande croissante des entreprises pharmaceutiques et biotechnologiques pour une collecte et une analyse de données en temps réel et centrées sur le patient positionne les solutions eCOA comme un élément essentiel de la recherche clinique. Ces facteurs convergents accélèrent l'adoption des plateformes eCOA, stimulant ainsi significativement la croissance du secteur.
Analyse du marché européen de l'évaluation électronique des résultats cliniques (eCOA)
- Les solutions eCOA, permettant la capture électronique des résultats rapportés par les patients, les cliniciens et les observateurs, deviennent des outils essentiels dans les essais cliniques à travers l'Europe en raison de leur capacité à améliorer la précision des données, la surveillance en temps réel et l'engagement des patients.
- L'adoption croissante des plateformes eCOA est principalement motivée par la numérisation croissante des essais cliniques, la nécessité d'une collecte de données centrée sur le patient et l'encouragement réglementaire à la saisie électronique des données pour garantir la conformité et réduire les erreurs.
- L'Allemagne a dominé le marché européen de l'évaluation électronique des résultats cliniques (eCOA) avec la plus grande part de revenus de 42,8 % en 2024, soutenue par une industrie pharmaceutique et biotechnologique forte, une infrastructure de soins de santé avancée et une adoption précoce des technologies d'essais numériques, avec des entreprises locales et multinationales mettant activement en œuvre des solutions eCOA
- Le Royaume-Uni devrait être le pays connaissant la croissance la plus rapide sur le marché européen de l'évaluation électronique des résultats cliniques (eCOA) au cours de la période de prévision en raison d'un volume élevé d'essais cliniques en cours, de l'adoption progressive d'outils de santé numériques et de l'augmentation des investissements dans les plateformes de recherche centrées sur le patient.
- Le segment des résultats rapportés par les patients (PRO) a dominé le marché européen de l'évaluation électronique des résultats cliniques (eCOA) avec une part de marché de 47 % en 2024, grâce à l'importance croissante accordée aux essais centrés sur le patient, à la facilité de collecte de données électroniques et à la capacité améliorée de capturer efficacement les commentaires des patients en temps réel.
Portée du rapport et segmentation du marché européen de l'évaluation électronique des résultats cliniques (eCOA)
|
Attributs |
Évaluation électronique des résultats cliniques (eCOA) : principales perspectives du marché européen |
|
Segments couverts |
|
|
Pays couverts |
Europe
|
|
Principaux acteurs du marché |
|
|
Opportunités de marché |
|
|
Ensembles d'informations de données à valeur ajoutée |
Outre les informations sur les scénarios de marché tels que la valeur marchande, le taux de croissance, la segmentation, la couverture géographique et les principaux acteurs, les rapports de marché organisés par Data Bridge Market Research comprennent également une analyse approfondie des experts, une analyse des prix, une analyse de la part de marque, une enquête auprès des consommateurs, une analyse démographique, une analyse de la chaîne d'approvisionnement, une analyse de la chaîne de valeur, un aperçu des matières premières/consommables, des critères de sélection des fournisseurs, une analyse PESTLE, une analyse Porter et un cadre réglementaire. |
Tendances du marché européen de l'évaluation électronique des résultats cliniques (eCOA)
Une approche centrée sur le patient améliorée grâce à l'intégration mobile et à distance
- Une tendance significative sur le marché européen de l'eCOA est l'intégration croissante des appareils mobiles, des tablettes et des outils de surveillance à distance des patients dans les essais cliniques, permettant une capture transparente et en temps réel des résultats rapportés par les patients (PRO), des résultats rapportés par les cliniciens (ClinRO) et des résultats rapportés par les observateurs (ObsRO).
- Par exemple, des plateformes telles que Medidata Rave eCOA et ClinPhone d'ERT permettent aux patients de réaliser des évaluations à distance via des smartphones ou des tablettes, augmentant ainsi l'observance et la fiabilité des données.
- L'intégration mobile permet des fonctionnalités telles que des rappels automatisés, des interfaces d'enquête interactives et une validation des données en temps réel, améliorant ainsi la précision et l'exhaustivité des données des essais cliniques.
- L'accès à distance facilite également les essais cliniques décentralisés, réduisant ainsi la charge des patients et élargissant la participation à travers des régions géographiquement dispersées, tout en permettant aux sponsors de suivre les progrès des patients en temps quasi réel.
- La connectivité transparente des plateformes eCOA avec les dossiers médicaux électroniques (DME) et les systèmes de gestion des essais cliniques (CTMS) permet une surveillance centralisée des données des patients, améliorant ainsi l'efficacité et la conformité.
- Cette tendance vers des solutions d’essai centrées sur le patient et basées sur la technologie remodèle les attentes en matière de collecte de données en Europe, stimulant la demande de plateformes eCOA flexibles et conviviales
Dynamique du marché européen de l'évaluation électronique des résultats cliniques (eCOA)
Conducteur
Demande croissante de données cliniques précises et en temps réel
- Le besoin croissant de données de haute qualité, opportunes et centrées sur le patient dans les essais cliniques est un facteur clé de l'adoption de l'eCOA en Europe.
- Par exemple, en mars 2024, ERT a étendu ses offres eCOA en Europe avec des capacités de surveillance mobile et à distance améliorées, visant à soutenir l'engagement des patients et l'intégrité des données dans les essais multinationaux.
- Les plateformes eCOA offrent des fonctionnalités améliorées telles que la notation automatisée, le suivi de la conformité et l'accès immédiat aux données d'essai, qui sont essentielles pour les soumissions réglementaires et la prise de décision fondée sur des preuves.
- Le volume croissant d’essais cliniques et l’importance croissante accordée aux résultats rapportés par les patients pour étayer les évaluations de l’efficacité et de la sécurité des traitements favorisent encore davantage l’adoption
- L'intégration avec les systèmes de santé électroniques et les tableaux de bord centralisés simplifie la gestion des données pour les sponsors, les CRO et les équipes cliniques, rendant les solutions eCOA indispensables dans la recherche clinique moderne
- Les investissements croissants dans les infrastructures de santé numérique et l'évolution vers des modèles d'essais cliniques décentralisés et hybrides stimulent davantage la demande de solutions eCOA à travers l'Europe.
- La sensibilisation croissante des prestataires de soins de santé et des sponsors aux avantages de l’analyse en temps réel et à l’amélioration de l’engagement des patients dans les essais cliniques accélère également l’adoption de l’eCOA.
Retenue/Défi
Conformité réglementaire et préoccupations en matière de confidentialité des données
- Les plateformes eCOA en Europe sont confrontées à des défis liés aux exigences réglementaires strictes, notamment la conformité au RGPD et aux réglementations régionales sur les essais cliniques, qui peuvent compliquer la collecte et le stockage des données.
- Par exemple, les différences dans les interprétations nationales des lois sur la confidentialité des données nécessitent parfois une personnalisation supplémentaire des solutions eCOA pour garantir une conformité totale.
- Assurer une transmission sécurisée des données, un cryptage et une authentification des utilisateurs est essentiel pour maintenir la confiance des patients et respecter les normes réglementaires.
- En outre, la variabilité des connaissances numériques parmi les patients et le personnel clinique peut limiter l’adoption ou conduire à des incohérences dans les données, en particulier dans les essais décentralisés.
- Surmonter ces obstacles grâce à des mesures de cybersécurité robustes, des solutions de conformité localisées et des initiatives de formation pour les patients et le personnel du site est essentiel pour la croissance continue du marché européen de l'eCOA.
- Les coûts élevés de mise en œuvre et de maintenance des plates-formes eCOA avancées peuvent constituer un obstacle, en particulier pour les petites CRO ou les institutions de recherche universitaires disposant de budgets limités.
- La résistance au changement des méthodes traditionnelles sur papier dans certains contextes cliniques peut ralentir l’adoption, nécessitant une formation et une démonstration des avantages évidents des systèmes électroniques.
Portée du marché européen de l'évaluation électronique des résultats cliniques (eCOA)
Le marché est segmenté sur la base du produit, de l’approche, de l’utilisateur final et de la plateforme.
- Par produit
En termes de produits, le marché européen de l'évaluation électronique des résultats cliniques (eCOA) est segmenté en solutions sur site, en solutions cloud et en solutions web. Le segment des solutions cloud a dominé le marché avec la plus grande part de chiffre d'affaires en 2024, grâce à son évolutivité, ses coûts initiaux réduits et son accessibilité en temps réel pour les promoteurs, les CRO et les centres d'essais cliniques. Les plateformes cloud permettent une collecte transparente des données depuis plusieurs sites d'essais, tout en respectant le RGPD et les autres réglementations régionales. Elles prennent en charge les modèles d'essais décentralisés et hybrides, permettant aux patients de communiquer leurs résultats à distance sans se déplacer sur les sites d'essais.
Le segment des solutions web devrait connaître la croissance la plus rapide entre 2025 et 2032, grâce à sa facilité de déploiement sur de multiples appareils, notamment les ordinateurs de bureau, les tablettes et les smartphones. Les plateformes web eCOA offrent des fonctionnalités de suivi et de reporting des patients en temps réel, améliorant ainsi l'efficacité et la conformité des essais. Elles sont de plus en plus privilégiées pour les essais décentralisés, permettant aux patients des régions éloignées de participer sans contraintes de déplacement. Des fonctionnalités telles que les rappels automatiques, les interfaces d'enquête interactives et la validation en temps réel améliorent la précision et l'exhaustivité des données.
- Par approche
En fonction de l'approche, le marché européen de l'évaluation électronique des résultats cliniques (eCOA) est segmenté en deux catégories : évaluation des résultats rapportés par les cliniciens (ClinRO), évaluation des résultats rapportés par les patients (PRO), évaluation des résultats rapportés par les observateurs (ObsRO) et évaluation des résultats de performance (PerfO). Le segment PRO a dominé le marché avec la plus grande part de chiffre d'affaires (47 %) en 2024, grâce à l'importance croissante accordée aux essais cliniques centrés sur le patient. Les outils PRO permettent aux patients de signaler directement leurs symptômes, leur qualité de vie et leur réponse au traitement, améliorant ainsi la fiabilité des essais. L'intégration aux plateformes mobiles et web améliore l'observance et la génération de rapports en temps réel. Les promoteurs s'appuient de plus en plus sur les données PRO pour étayer leurs demandes d'autorisation de mise sur le marché et démontrer l'efficacité des traitements du point de vue du patient.
Le segment PerfO devrait connaître la croissance la plus rapide au cours de la période de prévision, grâce à l'adoption croissante des dispositifs portables et des outils numériques d'évaluation des performances dans les essais cliniques, notamment en neurologie, en orthopédie et dans les études sur les maladies rares. Les segments ClinRO et ObsRO connaissent également une croissance constante, car ils fournissent des résultats cliniquement validés et observés par les soignants. Cependant, la capacité de PerfO à fournir des mesures fonctionnelles objectives le positionne comme un segment à forte croissance.
- Par utilisateur final
En fonction de l'utilisateur final, le marché européen de l'évaluation électronique des résultats cliniques (eCOA) est segmenté entre prestataires de services commerciaux, hôpitaux et centres de transplantation, laboratoires de recherche et établissements universitaires. En 2024, ces derniers ont dominé le marché, s'appuyant sur leur expertise dans la mise en œuvre de solutions eCOA pour les essais multinationaux. Ils offrent des services complets, incluant la collecte, le suivi et l'analyse des données, très prisés par les promoteurs pharmaceutiques. Les hôpitaux et les centres de transplantation adoptent les solutions eCOA pour suivre les résultats des patients dans les études cliniques et en situation réelle, améliorant ainsi la qualité des soins et de la recherche. Les laboratoires de recherche utilisent eCOA pour les essais cliniques dirigés par des investigateurs et les études spécialisées, garantissant ainsi la conformité et l'intégrité des données. Les établissements universitaires intègrent de plus en plus les plateformes eCOA dans les essais collaboratifs et les programmes de formation, soutenant ainsi la formation aux méthodes modernes de recherche clinique.
Le secteur des hôpitaux et des centres de transplantation devrait connaître la croissance la plus rapide au cours de la période de prévision, grâce à la participation croissante aux essais cliniques décentralisés, à l'adoption croissante des outils de santé numériques et à la prise de conscience croissante des avantages de la collecte de données centrée sur le patient. Les hôpitaux exploitent ces technologies pour optimiser l'efficacité des essais cliniques et renforcer l'engagement des patients. Cette prise de conscience croissante des avantages de la collecte de données centrée sur le patient encourage une adoption plus large des solutions eCOA.
- Par plateforme
En termes de plateforme, le marché européen de l'évaluation électronique des résultats cliniques (eCOA) est segmenté entre les organismes de recherche sous contrat (CRO), les sociétés pharmaceutiques et biopharmaceutiques, les fabricants de dispositifs médicaux, les hôpitaux et laboratoires cliniques, les sociétés de conseil, le monde de la recherche et le monde universitaire, entre autres. Le segment des CRO a dominé le marché en 2024 en raison de son rôle central dans la gestion d'essais multicentriques à grande échelle et de son recours aux solutions numériques pour une gestion efficace des essais. Les CRO mettent en œuvre des plateformes eCOA pour assurer le suivi des patients en temps réel, l'observance et l'analyse centralisée des données.
Les entreprises pharmaceutiques et biopharmaceutiques devraient connaître la croissance la plus rapide au cours de la période de prévision, grâce à l'augmentation des investissements dans les essais décentralisés, les technologies d'engagement des patients et le respect des normes réglementaires. Les fabricants de dispositifs médicaux adoptent l'eCOA pour capturer les résultats fonctionnels et de performance lors des essais. Les hôpitaux, les sociétés de conseil et les établissements universitaires bénéficient également de plateformes eCOA intégrées pour optimiser la saisie, l'analyse et le reporting des données.
Analyse régionale du marché européen de l'évaluation électronique des résultats cliniques (eCOA)
- L'Allemagne a dominé le marché européen de l'évaluation électronique des résultats cliniques (eCOA) avec la plus grande part de revenus de 42,8 % en 2024, soutenue par une industrie pharmaceutique et biotechnologique forte, une infrastructure de soins de santé avancée et une adoption précoce des technologies d'essais numériques, avec des entreprises locales et multinationales mettant activement en œuvre des solutions eCOA
- Les promoteurs et les CRO en Allemagne privilégient la collecte électronique des résultats rapportés par les patients afin d'améliorer la précision des données, de rationaliser la gestion des essais et de se conformer aux exigences réglementaires strictes, notamment le RGPD et les directives de l'EMA.
- L’adoption généralisée des solutions eCOA est également soutenue par des investissements importants dans l’infrastructure de santé numérique, une main-d’œuvre de santé experte en technologie et une participation croissante aux essais cliniques décentralisés et hybrides.
Aperçu du marché allemand de l'évaluation électronique des résultats cliniques (eCOA)
Le marché allemand de l'évaluation électronique des résultats cliniques (eCOA) a dominé l'Europe en 2024, porté par une industrie pharmaceutique et biotechnologique robuste, une infrastructure de santé de pointe et l'adoption précoce des technologies d'essais cliniques numériques. Les promoteurs et les CRO privilégient la saisie électronique des données pour améliorer la précision, la conformité et la génération de rapports en temps réel. L'intégration aux systèmes hospitaliers et cliniques, combinée au soutien réglementaire, a accéléré l'adoption. La multiplication des essais décentralisés et des initiatives de recherche collaborative alimente également la croissance. L'accent mis par l'Allemagne sur l'innovation, la recherche centrée sur le patient et le respect des réglementations strictes en matière de confidentialité des données en fait un marché clé pour les solutions eCOA. Le pays est également leader en matière de partenariats universitaires et industriels, favorisant un déploiement plus large des plateformes eCOA avancées.
Aperçu du marché britannique de l'évaluation électronique des résultats cliniques (eCOA)
Le marché britannique de l'évaluation électronique des résultats cliniques (eCOA) devrait connaître une croissance annuelle moyenne (TCAC) remarquable au cours de la période de prévision, portée par l'augmentation des essais cliniques et l'adoption massive des technologies de santé numérique. Le système de santé bien établi du pays et son environnement réglementaire progressiste encouragent le recours aux évaluations électroniques des résultats. La prise de conscience croissante des avantages des essais centrés sur le patient et la nécessité d'une collecte de données en temps réel dans les études décentralisées stimulent l'expansion du marché. L'intégration de l'eCOA aux applications mobiles et aux plateformes web améliore l'observance et l'engagement des patients. Le Royaume-Uni bénéficie également d'une forte présence d'organismes de recherche clinique (CRO) et de pôles de recherche clinique, ce qui accélère la mise en œuvre des solutions eCOA. De plus, les collaborations entre les laboratoires pharmaceutiques et les établissements universitaires favorisent des conceptions d'essais cliniques innovantes, stimulant ainsi la demande de plateformes eCOA.
Analyse du marché français de l'évaluation électronique des résultats cliniques (eCOA)
Le marché français de l'évaluation électronique des résultats cliniques (eCOA) connaît une croissance soutenue par l'augmentation du volume des essais cliniques et l'importance croissante accordée aux résultats rapportés par les patients. L'adoption de solutions eCOA, cloud et web, est en plein essor pour garantir une collecte de données sécurisée et conforme. L'accent réglementaire mis sur la saisie électronique des données et les approches centrées sur le patient stimule également le marché. Les hôpitaux, les instituts de recherche et les CRO français déploient activement des plateformes eCOA pour améliorer la qualité des données et l'efficacité des essais. L'intégration des systèmes eCOA à l'infrastructure informatique clinique existante permet un suivi et un reporting fluides. De plus, les initiatives gouvernementales en cours en faveur des solutions de santé numérique devraient accélérer leur adoption sur le marché au cours de la période de prévision.
Analyse du marché italien de l'évaluation électronique des résultats cliniques (eCOA)
Le marché italien de l'évaluation électronique des résultats cliniques (eCOA) est voué à une croissance soutenue, porté par la multiplication des essais cliniques et le besoin d'une collecte de données en temps réel et centrée sur le patient. Les prestataires de soins et les organismes de recherche italiens adoptent des solutions eCOA mobiles et web pour améliorer l'efficacité des essais et l'observance des patients. Le soutien réglementaire aux évaluations électroniques des résultats et l'importance accordée à l'intégrité des données encouragent leur adoption. Le marché est également porté par la tendance croissante aux essais cliniques décentralisés et hybrides, qui allègent la charge des patients et augmentent leur participation. L'intégration aux systèmes d'information hospitaliers permet un suivi et une analyse centralisés. De plus, les collaborations entre les CRO et les établissements universitaires locaux accélèrent le déploiement de plateformes eCOA avancées.
Part de marché de l'évaluation électronique des résultats cliniques (eCOA) en Europe
Le secteur européen de l'évaluation électronique des résultats cliniques (eCOA) est principalement dirigé par des entreprises bien établies, notamment :
- IQVIA (États-Unis)
- Medidata (États-Unis)
- Signant Health (États-Unis)
- Clario (États-Unis)
- ICON plc (Irlande)
- Parexel International (MA) Corporation (États-Unis)
- Kayentis (France)
- Veeva Systems (États-Unis)
- Castor (Pays-Bas)
- Medable (États-Unis)
- YPrime (États-Unis)
- WCG Clinical (États-Unis)
- Cloudbyz (États-Unis)
- Climedo Health GmbH (Allemagne)
- TransPerfect (États-Unis)
- Curebase Inc. (États-Unis)
- EvidentIQ (Allemagne)
- ArisGlobal (États-Unis)
- Oracle (États-Unis)
- OmniComm Systems (États-Unis)
Quels sont les développements récents sur le marché européen de l’évaluation électronique des résultats cliniques (eCOA) ?
- En juin 2025, Medable Inc. a annoncé le lancement de son programme de partenariat visant à accélérer le démarrage des essais cliniques. L'un des principaux avantages de ce programme est l'accès à Studio, la solution d'IA de Medable pour la création, le stockage et la réutilisation des instruments eCOA. Cette initiative vise à offrir aux organismes de recherche sous contrat (ORC) davantage de contrôle et de flexibilité pour étendre leurs opérations.
- En mai 2025, Clario, fournisseur leader de solutions numériques de points finaux pour les essais cliniques, a annoncé la finalisation de l'acquisition de l'activité eCOA de WCG Clinical. Cette acquisition stratégique renforce considérablement l'expertise scientifique et l'offre de Clario dans le domaine des neurosciences, consolidant ainsi sa position d'acteur clé dans la collecte et l'analyse de données fiables et de haute qualité pour les essais cliniques complexes.
- En mars 2025, le Critical Path Institute (C-Path) a annoncé la conclusion réussie de son initiative eCOA : Getting Better Together. Cette collaboration visait à promouvoir le développement de médicaments centrés sur le patient et a entraîné des changements significatifs et durables au bénéfice de toutes les parties prenantes de l'écosystème eCOA.
- En avril 2021, Veeva Systems et Parexel, une organisation de recherche clinique (CRO) de premier plan, ont annoncé un partenariat stratégique visant à accélérer les essais cliniques grâce à l'innovation technologique et procédurale. Dans le cadre de cette collaboration, Parexel a adopté la suite d'applications cliniques de Veeva, notamment ses solutions de gestion électronique des données, afin d'améliorer l'efficacité des études.
- En février 2021, ERT (désormais Clario) a lancé sa solution multimédia eCOA, qui permet la collecte, le traitement et l'analyse de photos et d'enregistrements audio dans le cadre des évaluations eCOA. Cette innovation permet aux patients de photographier leurs affections cutanées ou d'enregistrer des sons de leur voix depuis leur domicile, offrant ainsi une vision plus globale de leur état et allégeant les consultations en présentiel.
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.