Asia Pacific Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Размер рынка в млрд долларов США
CAGR :
% 
 USD
130.00 Million
USD
403.24 Million
2025
2033
USD
130.00 Million
USD
403.24 Million
2025
2033
| 2026 –2033 | |
| USD 130.00 Million | |
| USD 403.24 Million | |
|
|
|
|
Сегментация рынка электронных систем оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе по лицензированному контенту: по продуктам (локальные решения, облачные решения и веб-решения), подходам (оценка результатов, сообщаемых врачами (ClinRO), оценка результатов, сообщаемых пациентами (PRO), оценка результатов, сообщаемых наблюдателями (ObsRO) и оценка результатов эффективности (PerfO)), конечным пользователям (коммерческие поставщики услуг, больницы и трансплантационные центры, исследовательские лаборатории и академические учреждения), платформам (контрактные исследовательские организации, фармацевтические и биофармацевтические компании, производители медицинских изделий, больницы и клинические лаборатории, консалтинговые компании, научно-исследовательские и академические учреждения и другие) — отраслевые тенденции и прогноз до 2033 года.
Размер рынка лицензирования электронных клинических оценок результатов лечения (eCOA) в Азиатско-Тихоокеанском регионе
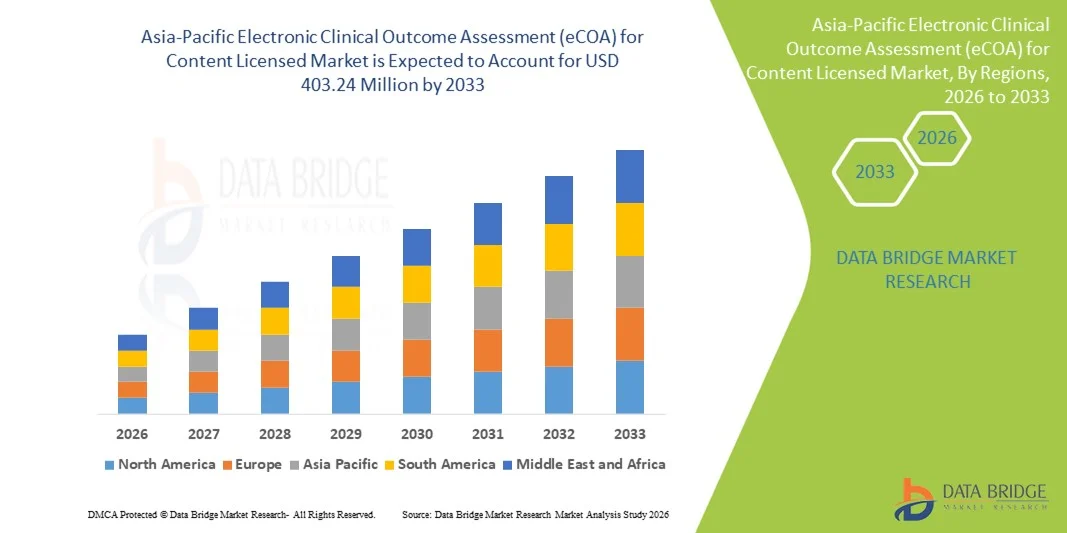
- Объем рынка электронных систем оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе, по данным лицензирования контента, в 2025 году оценивался в 130,00 млн долларов США и, как ожидается, достигнет 403,24 млн долларов США к 2033 году , демонстрируя среднегодовой темп роста в 15,2% в течение прогнозируемого периода.
- Рост рынка в значительной степени обусловлен растущим внедрением цифровых медицинских технологий в клинических исследованиях, регуляторными стимулами к электронному сбору данных и растущим спросом на ориентированные на пациента решения для дистанционного мониторинга результатов. Эти тенденции подталкивают спонсоров клинических исследований и CRO к переходу от традиционных методов, основанных на бумажных документах, к цифровым платформам оценки результатов в режиме реального времени.
- Кроме того, быстрое расширение активности клинических исследований на ключевых рынках Азиатско-Тихоокеанского региона, растущие инвестиции в облачные/мобильные платформы электронного сбора данных о результатах лечения (eCOA), а также сильный акцент на точности данных, соблюдении нормативных требований и интеграции с более широкими электронными клиническими системами ускоряют внедрение eCOA. Эти факторы в совокупности позиционируют eCOA как важнейший компонент современной инфраструктуры клинических исследований, что значительно стимулирует рост отрасли.
Анализ рынка лицензирования электронных клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе
- Электронные решения для оценки клинических результатов (eCOA), предоставляющие цифровые платформы для сбора данных о результатах, сообщаемых пациентами, врачами и наблюдателями, становятся незаменимыми инструментами в клинических испытаниях как в фармацевтической, так и в медицинской отраслях благодаря своей способности повышать точность данных, обеспечивать мониторинг в режиме реального времени и беспрепятственно интегрироваться с более широкими электронными клиническими системами.
- Растущее внедрение электронных систем сбора и анализа данных (eCOA) в первую очередь обусловлено усилением внимания к клиническим исследованиям, ориентированным на пациента, поощрением регулирующих органов к электронному сбору данных, а также растущим спросом на дистанционные и децентрализованные решения для проведения исследований, которые минимизируют посещения исследовательских центров, одновременно повышая уровень соблюдения требований и вовлеченности участников.
- В 2025 году Япония доминировала на рынке электронных систем оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе, занимая наибольшую долю выручки в 38,5%. Это обусловлено развитой цифровой инфраструктурой здравоохранения, большим количеством проводимых клинических исследований и присутствием ведущих поставщиков технологий, предлагающих интегрированные платформы eCOA.
- Ожидается, что в прогнозируемый период Китай станет самой быстрорастущей страной на рынке благодаря увеличению активности клинических испытаний, росту инвестиций в мобильные и облачные платформы, расширению нормативной поддержки электронного сбора данных и растущему внедрению цифровых решений, ориентированных на пациента.
- Сегмент электронных систем оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе доминировал на рынке лицензированного контента, предоставляя 45,2% рынка в 2025 году, благодаря своей важной роли в сборе отзывов пациентов в режиме реального времени, обеспечении соответствия нормативным стандартам и предоставлении полезной информации для спонсоров клинических испытаний.
Обзор отчета и сегментация рынка лицензированного контента в Азиатско-Тихоокеанском регионе в отношении электронной оценки клинических результатов (eCOA)
|
Атрибуты |
Ключевые рыночные тенденции в сфере электронной оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе: лицензирование контента. |
|
Охваченные сегменты |
|
|
Охваченные страны |
Азиатско-Тихоокеанский регион
|
|
Ключевые игроки рынка |
|
|
Рыночные возможности |
|
|
Информационные наборы данных, представляющие добавленную стоимость |
Помимо анализа рыночных сценариев, таких как рыночная стоимость, темпы роста, сегментация, географический охват и основные игроки, отчеты о рынке, подготовленные Data Bridge Market Research, также включают углубленный экспертный анализ, эпидемиологию пациентов, анализ перспективных разработок, анализ ценообразования и нормативно-правовую базу. |
Тенденции рынка электронной оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе для лицензированного контента.
Интеграция цифровых и мобильных технологий для клинических исследований, ориентированных на пациента.
- В Азиатско-Тихоокеанском регионе наблюдается значительная и быстро набирающая обороты тенденция интеграции электронных отчетов о результатах лечения (eCOA) для лицензированного контента, позволяющая осуществлять сбор клинических результатов в режиме реального времени, одновременно повышая вовлеченность пациентов и соблюдение ими режима лечения.
- Например, такие платформы, как Medidata eCOA Mobile, позволяют пациентам отправлять данные о результатах лечения, сообщаемых пациентами, и данные, сообщаемые врачами, через смартфоны и планшеты, обеспечивая беспрепятственный удаленный сбор данных и улучшение соблюдения рекомендаций врача.
- Интеграция цифровых и мобильных платформ с электронными медицинскими картами (ЭМК) и более широкими электронными клиническими системами обеспечивает мониторинг данных в режиме реального времени, снижение количества ошибок и упрощение отчетности перед регулирующими органами. Например, это позволяет спонсорам мгновенно отслеживать реакцию пациентов и корректировать протоколы по мере необходимости.
- Растущее внедрение носимых устройств и датчиков для непрерывного мониторинга состояния пациентов дополняет платформы eCOA, позволяя собирать высокочастотные объективные данные наряду с субъективными результатами для более целостного представления о здоровье пациента.
- Тенденция к более интегрированной, удобной для пациентов и осуществляемой в режиме реального времени цифровой оценке результатов коренным образом меняет процессы клинических испытаний. Например, такие компании, как CRF Health и ERT, разрабатывают мобильные решения для электронной оценки результатов с настраиваемыми интерфейсами и автоматическими напоминаниями для повышения приверженности пациентов лечению.
- Спрос на цифровые, мобильные и облачные интегрированные платформы электронного сбора данных о результатах лечения (eCOA) быстро растет как в фармацевтических исследованиях, так и в исследованиях медицинских изделий, поскольку спонсоры отдают приоритет эффективному, точному и ориентированному на пациента сбору данных.
- Использование многоязычных и адаптированных к культурным особенностям интерфейсов электронных систем сбора и анализа данных (eCOA) становится все более распространенным для поддержки различных групп пациентов в странах Азиатско-Тихоокеанского региона. Например, платформы теперь включают местные языки и форматы вопросов, учитывающие культурные особенности, для повышения уровня соответствия требованиям и качества данных.
Динамика рынка лицензирования контента в сфере электронной оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе
Водитель
Растущий спрос на клинические исследования, ориентированные на пациента и проводимые дистанционно.
- Усиление внимания к клиническим испытаниям, ориентированным на пациента, в сочетании с переходом к децентрализованным и гибридным клиническим испытаниям, является ключевым фактором развития рынка электронных сертификатов соответствия (eCOA) для лицензирования контента в Азиатско-Тихоокеанском регионе.
- Например, в 2025 году компания Medrio запустила модуль eCOA, разработанный для дистанционных клинических исследований в Индии и Китае, позволяющий спонсорам фиксировать результаты без необходимости частых посещений исследовательских центров.
- Поскольку спонсоры клинических испытаний стремятся повысить вовлеченность пациентов и их приверженность лечению, платформы eCOA обеспечивают мониторинг в режиме реального времени, оповещения и напоминания, что уменьшает количество пропущенных данных и повышает общее качество испытаний.
- Кроме того, растущее внедрение цифровых и мобильных технологий в клинических исследовательских центрах делает решения eCOA предпочтительным выбором, обеспечивая бесшовную интеграцию с другими инструментами и системами обработки данных в области электронных клинических исследований.
- Возможность удаленного сбора данных о результатах лечения, сообщаемых пациентами, врачами и наблюдателями, с помощью смартфонов или планшетов является ключевым фактором, ускоряющим внедрение этой технологии как в фармацевтических, так и в клинических испытаниях медицинских изделий.
- Расширение гибридных и децентрализованных клинических исследований в Азиатско-Тихоокеанском регионе в сочетании с растущим регуляторным стимулированием электронного сбора данных еще больше способствует устойчивому росту решений eCOA.
- Рост инвестиций транснациональных фармацевтических компаний в клинические исследования в Азиатско-Тихоокеанском регионе увеличивает спрос на масштабируемые и стандартизированные платформы электронного анализа результатов лечения (eCOA). Например, спонсоры внедряют унифицированные платформы в разных странах для повышения эффективности и соответствия требованиям.
- Растущее внимание к принятию решений на основе данных и ускорение сроков проведения клинических испытаний побуждают спонсоров внедрять решения eCOA, обеспечивающие мгновенный анализ и отчетность. Например, панели мониторинга в режиме реального времени позволяют руководителям испытаний отслеживать реакцию пациентов и заблаговременно корректировать протоколы.
Сдержанность/Вызов
Проблемы защиты данных и препятствия на пути к соблюдению нормативных требований
- Обеспокоенность по поводу безопасности, конфиденциальности и соблюдения нормативных требований в отношении данных пациентов создает серьезные препятствия для более широкого внедрения платформ eCOA в Азиатско-Тихоокеанском регионе.
- Например, громкие сообщения об утечках электронных медицинских данных заставили некоторых спонсоров и пациентов с осторожностью относиться к удаленному сбору цифровых данных.
- Для обеспечения соответствия региональным нормативным актам, таким как японский Закон о защите персональных данных (APPI) и китайский Закон о защите персональных данных (PIPL), необходимы надежное шифрование, безопасная аутентификация и проверенное программное обеспечение, внедрение которых может быть сложным и дорогостоящим процессом.
- Кроме того, различия в нормативных стандартах и требованиях между странами Азиатско-Тихоокеанского региона могут замедлить развертывание и внедрение платформы, требуя дополнительных усилий по локализации и валидации.
- Хотя облачные и мобильные платформы eCOA повышают удобство и эффективность, предполагаемый риск киберугроз и несоблюдения требований может препятствовать их внедрению, особенно среди небольших спонсоров или CRO с ограниченными ИТ-ресурсами.
- Преодоление этих проблем за счет надежных мер защиты данных, соблюдения нормативных требований и четкого информирования о правилах соответствия будет иметь решающее значение для устойчивого роста рынка.
- Ограниченная техническая экспертиза и недостаточная инфраструктура в небольших клинических центрах в некоторых странах Азиатско-Тихоокеанского региона могут замедлять внедрение передовых решений eCOA. Например, центрам может не хватать ИТ-поддержки для эффективного внедрения облачных или мобильных систем eCOA.
- Различия в уровне цифровой грамотности пациентов также могут стать препятствием, поскольку некоторые участники могут испытывать трудности с использованием мобильных или веб-платформ. Например, спонсоры должны обеспечить обучение и интуитивно понятные интерфейсы для обеспечения точного и полного сбора данных.
Обзор рынка лицензирования электронных систем оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе.
Рынок сегментирован по продукту, подходу, конечному пользователю и платформе.
- По продукту
В зависимости от продукта, рынок электронных отчетов о результатах исследований (eCOA) в Азиатско-Тихоокеанском регионе, основанный на лицензировании контента, сегментируется на локальные решения, облачные решения и веб-решения. Облачные решения доминировали на рынке, занимая наибольшую долю выручки в 2025 году, благодаря своей гибкости, масштабируемости и возможности поддержки удаленных клинических исследований на нескольких площадках. Спонсоры все чаще отдают предпочтение облачным платформам, поскольку они обеспечивают доступ в режиме реального времени к результатам, сообщаемым пациентами (PRO), результатам, сообщаемым врачами (ClinRO), и другим данным eCOA без необходимости создания обширной ИТ-инфраструктуры на отдельных площадках. Облачные решения также облегчают интеграцию с другими электронными клиническими системами, уменьшая расхождения в данных и ускоряя анализ. Их внедрение дополнительно поддерживается разрешением регулирующих органов на электронный сбор данных в децентрализованных исследованиях. Возможность поддержки мобильных устройств, планшетов и носимых устройств повышает вовлеченность пациентов и соблюдение ими рекомендаций. Облачные решения также обеспечивают бесперебойные обновления программного обеспечения и централизованное управление данными исследований, снижая операционные затраты для спонсоров.
Ожидается, что веб-решения продемонстрируют самый быстрый рост в период с 2026 по 2033 год, чему способствует растущая потребность в платформах, доступных через браузер и не требующих установки ресурсоемкого программного обеспечения. Веб-инструменты eCOA позволяют клиническим центрам и пациентам вводить данные с любого устройства с подключением к интернету, что повышает участие в децентрализованных исследованиях. Они особенно привлекательны для академических учреждений и небольших исследовательских организаций, которые ищут экономически эффективные и масштабируемые решения. Веб-решения также поддерживают многоязычные и адаптированные к культурным особенностям интерфейсы, что крайне важно для исследований, охватывающих несколько стран Азиатско-Тихоокеанского региона. Простота использования, низкие требования к техническому обслуживанию и совместимость с различными операционными системами являются ключевыми факторами их внедрения. Растущая популярность гибридных исследований, сочетающих посещения исследовательских центров с удаленным сбором данных, еще больше ускоряет внедрение веб-решений.
- По подходу
В зависимости от подхода рынок сегментируется на оценку результатов, сообщаемых врачами (Clinician-Reported Outcome Assessment, ClinRO), оценку результатов, сообщаемых пациентами (Patient-Reported Outcome Assessment, PRO), оценку результатов, сообщаемых наблюдателями (Observer-Reported Outcome Assessment, ObsRO), и оценку результатов эффективности (PerfO). Оценка результатов, сообщаемых пациентами (Patient-Reported Outcome Assessment, PRO), доминировала на рынке, занимая наибольшую долю выручки в 45,2% в 2025 году, что обусловлено растущим акцентом на клинические исследования, ориентированные на пациента. Платформы PRO позволяют пациентам напрямую сообщать о своих симптомах, качестве жизни и реакции на лечение, предоставляя спонсорам достоверную информацию в режиме реального времени. Внедрение мобильных и облачных платформ PRO повысило уровень соответствия требованиям и сократило количество пропущенных данных, особенно в децентрализованных или гибридных исследованиях. Регулирующие органы, включая японское PMDA и китайское NMPA, все чаще поощряют электронный сбор данных PRO для получения точных конечных точек. Решения PRO также обеспечивают мониторинг в режиме реального времени и автоматические оповещения, позволяя клиническим группам быстро реагировать на нежелательные явления или несоответствия требованиям. Их доминирование подкрепляется растущим спросом в таких терапевтических областях, как онкология, неврология и хронические заболевания, где отзывы пациентов имеют решающее значение.
Ожидается, что оценка результатов, сообщаемых наблюдателями (ObsRO), будет демонстрировать самый быстрый рост в период с 2026 по 2033 год, особенно в педиатрических, гериатрических и исследованиях редких заболеваний. Платформы ObsRO позволяют лицам, осуществляющим уход за пациентами, или сотрудникам исследования сообщать о результатах лечения пациентов в случаях, когда пациенты не могут сообщить об этом самостоятельно, обеспечивая всесторонний и точный сбор данных. Развитие дистанционного мониторинга и мобильных платформ способствовало расширению использования ObsRO, упрощая для наблюдателей предоставление данных в режиме реального времени. Решения ObsRO также набирают популярность в связи с регуляторным акцентом на включение уязвимых групп пациентов в исследования. Растущая сложность клинических исследований и необходимость проверки данных из нескольких источников еще больше стимулируют внедрение ObsRO. Интеграция с другими подходами к оценке электронных результатов лечения, такими как PRO и ClinRO, повышает качество данных и предоставляет спонсорам целостную информацию.
- Конечным пользователем
В зависимости от конечного пользователя рынок сегментируется на коммерческих поставщиков услуг, больницы и трансплантационные центры, исследовательские лаборатории и академические учреждения. Коммерческие поставщики услуг доминировали на рынке, занимая наибольшую долю выручки в 2025 году, благодаря своему опыту в предоставлении масштабируемых, проверенных решений eCOA для множества спонсоров и исследований. Эти поставщики предлагают комплексные услуги, включая развертывание программного обеспечения, обучение, техническую поддержку и консультации по соблюдению нормативных требований. Их доминирование дополнительно подкрепляется растущей тенденцией аутсорсинга среди фармацевтических и биотехнологических компаний, которые предпочитают коммерческих поставщиков для управления сложными децентрализованными исследованиями. Облачное развертывание и услуги мониторинга в режиме реального времени повышают эффективность и соблюдение пациентами режима лечения. Коммерческие поставщики услуг также предлагают настраиваемые решения, адаптированные к терапевтическим областям, размеру исследования и региональным правилам, что делает их предпочтительным выбором для многонациональных исследований. Их способность интегрироваться с другими платформами eClinical обеспечивает централизованное управление данными и более быстрые сроки проведения исследований.
Ожидается, что в период с 2026 по 2033 год академические учреждения продемонстрируют самый быстрый рост, обусловленный увеличением активности клинических исследований в университетах и учебных больницах Азиатско-Тихоокеанского региона. Эти учреждения нуждаются в экономически эффективных и гибких решениях eCOA, которые поддерживают исследовательские протоколы, взаимодействие с пациентами и соблюдение нормативных требований. Внедрение веб-платформ и мобильных приложений eCOA облегчает участие в многоцентровых исследованиях и совместных проектах. Академические пользователи также получают выгоду от платформ, поддерживающих анонимизацию данных и безопасный обмен данными в исследовательских целях. Увеличение государственного финансирования и инициативы по цифровизации клинических исследований в таких странах, как Индия, Китай и Япония, еще больше ускоряют внедрение. Потребность в отчетности в режиме реального времени и анализе результатов для академических публикаций также стимулирует рост в этом сегменте.
- По платформе
В зависимости от платформы рынок сегментируется на контрактные исследовательские организации, фармацевтические и биофармацевтические компании, производителей медицинских изделий, больницы и клинические лаборатории, консалтинговые компании, научно-исследовательские и академические учреждения и другие. Контрактные исследовательские организации (CRO) доминировали на рынке, занимая наибольшую долю выручки в 2025 году, благодаря своей способности управлять множеством клинических испытаний в различных регионах с использованием централизованных, проверенных электронных систем сбора и анализа результатов (eCOA). CRO предоставляют спонсорам преимущество аутсорсинга технических и нормативных сложностей, включая настройку системы, обучение и аудит соответствия. Их облачные платформы обеспечивают доступ к данным о клинических результатах в режиме реального времени, улучшая мониторинг и ускоряя принятие решений. CRO также используют аналитику на основе искусственного интеллекта для выявления тенденций, мониторинга соблюдения пациентами режима лечения и выявления несоответствий. Их доминирование подкрепляется прочными партнерскими отношениями с фармацевтическими и биотехнологическими компаниями, проводящими крупномасштабные испытания в Азиатско-Тихоокеанском регионе. Стандартизированные платформы eCOA, используемые CRO, также упрощают подачу заявок в регулирующие органы разных стран.
Ожидается, что фармацевтические и биофармацевтические компании продемонстрируют самый быстрый рост в период с 2026 по 2033 год, поскольку они все чаще внедряют собственные платформы электронного сбора данных (eCOA) для оптимизации клинических испытаний и улучшения сбора данных, ориентированного на пациента. Прямое внедрение позволяет спонсорам сохранять контроль над целостностью данных и соответствием нормативным требованиям, одновременно снижая зависимость от сторонних поставщиков услуг. Рост обусловлен увеличением инвестиций в мобильные и облачные решения, поддерживающие гибридные и децентрализованные модели испытаний. Компании также используют платформы eCOA для ускорения сроков проведения испытаний, повышения вовлеченности пациентов и соблюдения нормативных требований к электронному сбору данных. Интеграция с другими цифровыми системами, такими как электронные медицинские карты (EHR) и системы управления лабораторными данными, еще больше способствует внедрению этих платформ среди фармацевтических и биотехнологических компаний.
Региональный анализ рынка лицензированного контента в сфере электронной оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе
- В 2025 году Япония доминировала на рынке электронных систем оценки клинических результатов (eCOA) в Азиатско-Тихоокеанском регионе, занимая наибольшую долю выручки в 38,5%. Это обусловлено развитой цифровой инфраструктурой здравоохранения, большим количеством проводимых клинических исследований и присутствием ведущих поставщиков технологий, предлагающих интегрированные платформы eCOA.
- В Японии спонсоры и клинические центры высоко ценят эффективность, мониторинг в режиме реального времени и соответствие нормативным требованиям, которые предлагают платформы eCOA, обеспечивая точный и своевременный сбор данных о результатах лечения, сообщаемых пациентами, врачами и наблюдателями.
- This widespread adoption is further supported by well-established clinical research networks, increasing government support for digital health technologies, and growing interest from pharmaceutical and biopharmaceutical companies in decentralized and hybrid trial models, establishing eCOA as a preferred solution for clinical outcome capture
Japan Electronic Clinical Outcome Assessment (eCOA) for Content Licensed Market Insight
The Japan Electronic Clinical Outcome Assessment (eCOA) for content licensed market is gaining momentum due to the country’s advanced digital healthcare infrastructure, high clinical trial activity, and focus on patient-centric research. The adoption of mobile-enabled PRO and ClinRO platforms is driven by the increasing number of smart hospitals and connected clinical research sites. Integration with EHR systems and broader eClinical platforms is improving real-time monitoring, regulatory compliance, and operational efficiency. Japan’s aging population is also driving demand for patient-friendly and observer-reported outcome (ObsRO) solutions in both residential and hospital-based trials. Furthermore, sponsors are leveraging AI and analytics in eCOA platforms to enhance data quality and optimize trial decision-making.
China Electronic Clinical Outcome Assessment (eCOA) for Content Licensed Market Insight
The China Electronic Clinical Outcome Assessment (eCOA) for content licensed market is expected to grow at the fastest rate in the Asia-Pacific region during the forecast period, fueled by a surge in clinical trials, government incentives for digital health adoption, and increasing use of mobile and cloud-based outcome assessment platforms. Sponsors are increasingly implementing decentralized trials to reach broader patient populations, leveraging eCOA solutions for real-time patient monitoring. Integration with wearable devices and remote reporting tools is enhancing data accuracy and compliance. The growth is also supported by expanding CRO services and domestic platform providers offering scalable, cost-effective solutions. In addition, regulatory acceptance for electronic PRO, ClinRO, and ObsRO data is encouraging adoption among pharmaceutical and biotech companies.
India Electronic Clinical Outcome Assessment (eCOA) for Content Licensed Market Insight
The India Electronic Clinical Outcome Assessment (eCOA) for content licensed market accounted for the largest revenue share in Asia-Pacific in 2025, attributed to the country’s growing clinical research outsourcing industry, increasing digital literacy among patients, and rapid adoption of mobile health technologies. The rise of decentralized trials, coupled with affordable and scalable cloud-based eCOA platforms, is facilitating broader adoption in hospitals, academic institutions, and CROs. India’s expanding clinical trial ecosystem, supported by regulatory encouragement for electronic outcome capture, is enabling faster data collection and improved patient compliance. Furthermore, multinational sponsors are increasingly selecting India for multi-country studies due to cost efficiency and availability of skilled personnel. The adoption of patient-centric PRO and ObsRO solutions is further enhancing trial quality and real-time monitoring capabilities.
Australia Electronic Clinical Outcome Assessment (eCOA) for Content Licensed Market Insight
The Australia Electronic Clinical Outcome Assessment (eCOA) for content licensed market is witnessing steady growth due to the country’s advanced healthcare infrastructure, high adoption of digital health technologies, and increasing number of clinical trials conducted in hospitals and research institutions. Sponsors and CROs value Australia for its regulatory alignment with global standards, making it easier to implement electronic PRO, ClinRO, ObsRO, and PerfO platforms. The widespread use of mobile and web-based eCOA solutions enhances patient engagement and compliance, particularly in decentralized or hybrid trials. Integration with electronic health records (EHR) and other digital systems improves data accuracy and streamlines trial management. Furthermore, Australia’s skilled clinical workforce and emphasis on patient-centric research drive the adoption of innovative eCOA platforms across pharmaceutical, biopharmaceutical, and medical device trials.
Asia-Pacific Electronic Clinical Outcome Assessment (eCOA) for Content Licensed Market Share
The Asia-Pacific Electronic Clinical Outcome Assessment (eCOA) for Content Licensed industry is primarily led by well-established companies, including:
- Veeva Systems (U.S.)
- Kayentis (France)
- Signant Health (U.S.)
- IQVIA Holdings, Inc. (U.S.)
- Clinical Ink, Inc. (U.S.)
- Medidata Solutions (U.S.)
- eCOA GmbH (Germany)
- CRF Health (U.K.)
- Motentia, LLC (U.S.)
- Bracket Global LLC (U.S.)
- SHYFT Analytics (U.S.)
- Mednet Solutions (Australia)
- SureClinical (U.S.)
- Relypsa (U.S.)
- OpenClinica, LLC (U.S.)
- Clario (U.S.)
- Datacubed Health (U.S.)
- Florence Healthcare (U.S.)
- bloqcube (U.S.)
- Realtime Clinical (U.S.)
What are the Recent Developments in Asia-Pacific Electronic Clinical Outcome Assessment (eCOA) for Content Licensed Market?
- В марте 2024 года крупные поставщики услуг в области клинических исследований, такие как PPD (Thermo Fisher Scientific), публично представили свои цифровые и децентрализованные экосистемы для проведения клинических испытаний, подчеркнув инструменты и методологии, поддерживающие цифровой сбор данных о результатах, включая электронные системы сбора данных (eCOA), разработанные для повышения качества данных, снижения нагрузки на пациентов и увеличения участия в испытаниях в различных регионах, включая Азиатско-Тихоокеанский регион.
- В декабре 2023 года компания ObvioHealth объявила о запуске своего инновационного электронного решения для оценки клинических результатов (eCOA), интегрированного в платформу ObvioGo®, что позволяет быстро создавать eCOA, повышать вовлеченность пациентов и сокращать сроки внедрения клинических исследований до 70%.
- В августе 2023 года Национальное управление по медицинским продуктам Китая (NMPA) и Центр оценки лекарственных средств (CDE) опубликовали Технические рекомендации по проведению ориентированных на пациента клинических испытаний лекарственных препаратов, официально признав электронные инструменты, такие как eCOA, eConsent и дистанционный сбор данных, для модернизации практики клинических испытаний. Эта нормативная ясность способствует расширению использования технологий eCOA в клинических испытаниях в Азиатско-Тихоокеанском регионе.
- В июне 2023 года компания ICON plc объявила о крупном обновлении своей цифровой платформы ICON Digital Platform, которое включает в себя интегрированный модуль eCOA с предварительно загруженными проверенными библиотеками оценок. Платформа поддерживает взаимодействие с пациентами, электронное согласие, eCOA и удаленный сбор данных в традиционных и децентрализованных исследованиях, сокращая время настройки и повышая согласованность данных о результатах.
- В апреле 2023 года компания Almac Clinical Technologies объявила о запуске своей партнерской сети IXRS®3, позволяющей спонсорам биофармацевтических компаний и CRO обмениваться данными и совместимыми клиническими технологиями, включая модули eCOA, для создания более удобного и инклюзивного опыта проведения клинических испытаний для исследовательских центров и пациентов. Эта инициатива подчеркивает совместимость и сотрудничество для оптимизации сбора данных в ходе испытаний и улучшения интеграции eCOA в многоцентровых исследованиях.
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Интерактивная панель анализа данных
- Панель анализа компании для возможностей с высоким потенциалом роста
- Доступ аналитика-исследователя для настройки и запросов
- Анализ конкурентов с помощью интерактивной панели
- Последние новости, обновления и анализ тенденций
- Используйте возможности сравнительного анализа для комплексного отслеживания конкурентов
Методология исследования
Сбор данных и анализ базового года выполняются с использованием модулей сбора данных с большими размерами выборки. Этап включает получение рыночной информации или связанных данных из различных источников и стратегий. Он включает изучение и планирование всех данных, полученных из прошлого заранее. Он также охватывает изучение несоответствий информации, наблюдаемых в различных источниках информации. Рыночные данные анализируются и оцениваются с использованием статистических и последовательных моделей рынка. Кроме того, анализ доли рынка и анализ ключевых тенденций являются основными факторами успеха в отчете о рынке. Чтобы узнать больше, пожалуйста, запросите звонок аналитика или оставьте свой запрос.
Ключевой методологией исследования, используемой исследовательской группой DBMR, является триангуляция данных, которая включает в себя интеллектуальный анализ данных, анализ влияния переменных данных на рынок и первичную (отраслевую экспертную) проверку. Модели данных включают сетку позиционирования поставщиков, анализ временной линии рынка, обзор рынка и руководство, сетку позиционирования компании, патентный анализ, анализ цен, анализ доли рынка компании, стандарты измерения, глобальный и региональный анализ и анализ доли поставщика. Чтобы узнать больше о методологии исследования, отправьте запрос, чтобы поговорить с нашими отраслевыми экспертами.
Доступна настройка
Data Bridge Market Research является лидером в области передовых формативных исследований. Мы гордимся тем, что предоставляем нашим существующим и новым клиентам данные и анализ, которые соответствуют и подходят их целям. Отчет можно настроить, включив в него анализ ценовых тенденций целевых брендов, понимание рынка для дополнительных стран (запросите список стран), данные о результатах клинических испытаний, обзор литературы, обновленный анализ рынка и продуктовой базы. Анализ рынка целевых конкурентов можно проанализировать от анализа на основе технологий до стратегий портфеля рынка. Мы можем добавить столько конкурентов, о которых вам нужны данные в нужном вам формате и стиле данных. Наша команда аналитиков также может предоставить вам данные в сырых файлах Excel, сводных таблицах (книга фактов) или помочь вам в создании презентаций из наборов данных, доступных в отчете.