Global In Vitro Diagnostic Ivd Regulatory Affairs Outsourcing Market
Taille du marché en milliards USD
TCAC :
% 
 USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
| 2022 –2029 | |
| USD 674,277.97 Thousand | |
| USD 1,830,957.45 Thousand | |
|
|
|
|
Marché mondial de l'externalisation des affaires réglementaires du diagnostic in vitro (DIV), par service (rédaction et soumissions réglementaires, enregistrement réglementaire et demandes d'essais cliniques , conseil réglementaire, représentation juridique, services de gestion des données, services de fabrication et de contrôle de produits chimiques (CMC) et autres), indication (oncologie, neurologie, cardiologie, chimie clinique et immuno-essais, médecine de précision, maladies infectieuses, diabète, tests génétiques, VIH/SIDA, hématologie, tests de médicaments/pharmacogénomique, transfusion sanguine, point de service et autres), mode de déploiement (cloud et sur site), taille de l'organisation (petites et moyennes entreprises (PME) et grandes entreprises), stade (clinique, préclinique et PMA (autorisation post-commercialisation)), classe (classe I, classe II et classe III), utilisateur final (sociétés pharmaceutiques, sociétés de dispositifs médicaux, sociétés de biotechnologie et autres) - Tendances et prévisions du secteur 2029
Analyse du marché et taille
Les entreprises de santé ont rencontré des difficultés pour se conformer aux normes réglementaires, notamment en raison de la pandémie de COVID-19 (coronavirus). Pour instaurer une culture axée sur la qualité au sein des entreprises de technologies médicales, les cabinets de conseil utilisent des logiciels de gestion de la qualité (SGQ). Les entreprises impliquées dans l' externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) offrent un accompagnement personnalisé aux établissements de santé.
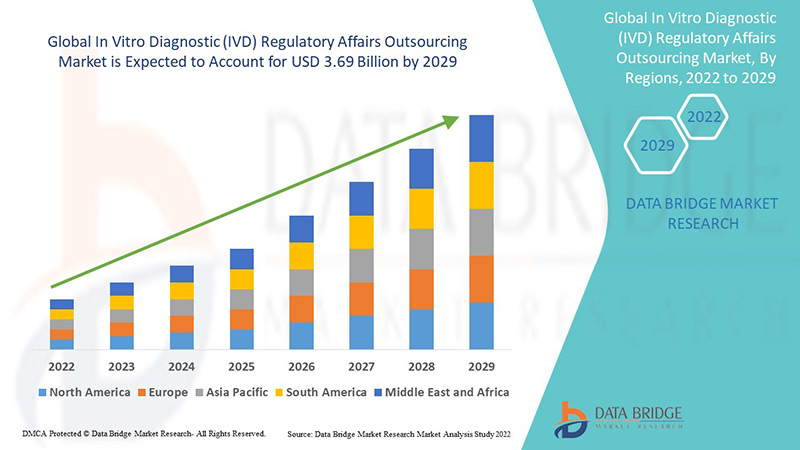
Le déploiement de l'externalisation se traduit par la conclusion d'accords d'externalisation à long terme. Le marché mondial de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) était évalué à 1,6 milliard USD en 2021 et devrait atteindre 3,69 milliards USD d'ici 2029, enregistrant un TCAC de 11 % sur la période de prévision 2022-2029. Les sociétés pharmaceutiques devraient connaître une forte croissance grâce à l'augmentation du nombre d'approbations cliniques.
Définition du marché
Les affaires réglementaires jouent un rôle crucial dans le secteur des dispositifs de diagnostic in vitro (DIV). Elles concernent le cycle de vie de divers produits de santé et offrent un soutien et une orientation stratégiques, tactiques et opérationnels aux fabricants pour les aider à respecter le cadre réglementaire.
Portée du rapport et segmentation du marché
|
Rapport métrique |
Détails |
|
Période de prévision |
2022 à 2029 |
|
Année de base |
2021 |
|
Années historiques |
2020 (personnalisable de 2019 à 2014) |
|
Unités quantitatives |
Chiffre d'affaires en millions USD, volumes en unités, prix en USD |
|
Segments couverts |
Service (rédaction et soumissions réglementaires, demandes d'enregistrement réglementaire et d'essais cliniques, conseil réglementaire, représentation juridique, services de gestion des données, services de fabrication et de contrôle de produits chimiques (CMC) et autres), indication (oncologie, neurologie, cardiologie, chimie clinique et immuno-essais, médecine de précision, maladies infectieuses, diabète, tests génétiques, VIH/SIDA, hématologie, tests de médicaments/pharmacogénomique, transfusion sanguine, point de service et autres), mode de déploiement (cloud et sur site), taille de l'organisation (petites et moyennes entreprises [PME] et grandes entreprises), stade (clinique, préclinique et PMA (autorisation post-commercialisation)), classe (classe I, classe II et classe III), utilisateur final (sociétés pharmaceutiques, sociétés de dispositifs médicaux, sociétés de biotechnologie et autres) |
|
Pays couverts |
États-Unis, Canada et Mexique en Amérique du Nord, Allemagne, France, Royaume-Uni, Pays-Bas, Suisse, Belgique, Russie, Italie, Espagne, Turquie, reste de l'Europe en Europe, Chine, Japon, Inde, Corée du Sud, Singapour, Malaisie, Australie, Thaïlande, Indonésie, Philippines, reste de l'Asie-Pacifique (APAC) en Asie-Pacifique (APAC), Arabie saoudite, Émirats arabes unis, Afrique du Sud, Égypte, Israël, reste du Moyen-Orient et de l'Afrique (MEA) en tant que partie du Moyen-Orient et de l'Afrique (MEA), Brésil, Argentine et reste de l'Amérique du Sud en tant que partie de l'Amérique du Sud. |
|
Acteurs du marché couverts |
Freyr Solutions (Inde), PPD Inc. (États-Unis), EMERGO (États-Unis), ICON (Santé), Parexel International Corporation (États-Unis), CRITERIUM, INC. (États-Unis), Groupe ProductLife SA (France), Labcorp Drug Development (États-Unis), WuXi AppTec (Chine), Genpact (États-Unis), Medpace (États-Unis), Dor Pharmaceutical Services (Israël), Qserve (Pays-Bas), entre autres |
|
Opportunités de marché |
|
Dynamique du marché de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV)
Cette section vise à comprendre les moteurs, les avantages, les opportunités, les contraintes et les défis du marché. Tous ces éléments sont détaillés ci-dessous :
- Utilisation intensive dans le secteur de la santé
L'essor des services d'externalisation dans le secteur de la santé est l'un des principaux moteurs de la croissance du marché de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV). L'essor des activités d'expansion géographique visant à accélérer les approbations sur les marchés locaux contribue également à cette croissance.
- Recherche et développement
L’augmentation des activités de recherche et développement, qui augmente le volume des demandes d’essais cliniques et l’enregistrement des produits, accélère la croissance du marché.
- Approbations cliniques
On observe une augmentation de la demande d'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV), les entreprises étant soumises à une pression constante pour obtenir rapidement les autorisations cliniques des autorités réglementaires. La demande de services d'affaires réglementaires augmente donc en raison de ces mesures.
Opportunités
En outre, le développement de biomarqueurs et de tests spécifiques à la maladie et l'importance des diagnostics compagnons étendent les opportunités rentables aux acteurs du marché au cours de la période de prévision de 2022 à 2029. De plus, l'augmentation des investissements élargira encore le marché.
Contraintes/Défis
D'autre part, l'évolution de la réglementation concernant l'externalisation des affaires réglementaires pour les dispositifs médicaux et les diagnostics in vitro (DIV) devrait freiner la croissance du marché. De plus, le manque d'infrastructures dans les services de santé devrait constituer un défi pour le marché de l'externalisation des affaires réglementaires pour les diagnostics in vitro (DIV) sur la période de prévision 2022-2029.
Ce rapport sur le marché de l'externalisation des affaires réglementaires pour le diagnostic in vitro (DIV) détaille les évolutions récentes, la réglementation commerciale, l'analyse des importations et exportations, l'analyse de la production, l'optimisation de la chaîne de valeur, la part de marché, l'impact des acteurs nationaux et locaux, l'analyse des opportunités de revenus émergents, l'évolution de la réglementation, l'analyse stratégique de la croissance du marché, la taille du marché, la croissance des catégories de marché, les niches d'application et la domination du marché, les homologations et les lancements de produits, les expansions géographiques et les innovations technologiques. Pour plus d'informations sur le marché de l'externalisation des affaires réglementaires pour le diagnostic in vitro (DIV), contactez Data Bridge Market Research pour obtenir un briefing d'analyste. Notre équipe vous aidera à prendre une décision éclairée et à stimuler votre croissance.
Impact du Covid-19 sur le marché des tests de diagnostic
La COVID-19 a eu un impact négatif sur le secteur de la santé. Les principaux acteurs ont adopté des stratégies innovantes face à l'évolution rapide de la situation pendant l'épidémie. Les pays ont adopté des changements cruciaux dans le système de santé jusqu'à ce que la crise passe au second plan. Les réformes du système de santé devraient permettre de maîtriser les coûts, d'améliorer l'accès aux soins et de progresser technologiquement dans les années à venir. Une augmentation de la demande d'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) a été constatée en raison de l'importance accordée au diagnostic, aux soins et aux consultations à distance. Ces services allègent la charge des hôpitaux dans le contexte post-pandémique.
Développements récents
- Le magazine technologique USA-9 a classé Freyr parmi les « 10 meilleurs fournisseurs de solutions technologiques de 2021 » en novembre 2021. USA-9.com, un magazine technologique, a classé Freyr Solutions, leader mondial des solutions et services réglementaires, parmi les « 10 meilleurs fournisseurs de solutions technologiques de 2021 ». Fryer continue de concevoir des solutions logicielles innovantes et d'accompagner ses clients dans leurs objectifs de conformité. Cela a contribué à accroître la popularité de l'entreprise.
Portée et taille du marché mondial de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV)
Le marché de l'externalisation des affaires réglementaires pour le diagnostic in vitro (DIV) est segmenté selon les services, l'indication, le mode de déploiement, la taille de l'organisation, le stade d'avancement, la classe et l'utilisateur final. La croissance de ces segments vous permettra d'analyser les segments à faible croissance des industries et de fournir aux utilisateurs une vue d'ensemble et des informations précieuses sur le marché, facilitant ainsi la prise de décisions stratégiques pour identifier les applications clés.
Services
- Rédaction et soumissions réglementaires
- Enregistrement réglementaire et demandes d'essais cliniques
- Conseil réglementaire
- Représentation juridique
- Services de gestion des données
- Services de fabrication et de contrôle de produits chimiques (CMC)
- Autres
Sur la base des services, le marché mondial de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) est segmenté en rédaction et soumissions réglementaires, enregistrement réglementaire et demandes d'essais cliniques, conseil réglementaire, représentation juridique, services de gestion de données, services de fabrication et de contrôle de produits chimiques (CMC) et autres.
Indication
- Oncologie
- Neurologie
- Cardiologie
- Chimie clinique et immuno-essais
- Médecine de précision
- Maladies infectieuses
- Diabète
- Tests génétiques
- VIH/SIDA
- Hématologie
- Tests de médicaments/Pharmacogénomique
- Transfusion sanguine
- Point de service
- Autres
Sur la base des indications, le marché mondial de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) est segmenté en oncologie, neurologie, cardiologie, chimie clinique et immuno-essais, médecine de précision, maladies infectieuses, diabète, tests génétiques, VIH/SIDA, hématologie, tests de médicaments/pharmacogénomique, transfusion sanguine, point de service et autres.
Mode de déploiement
- Nuage
- Sur site
Sur la base du mode de déploiement, le marché mondial de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) est segmenté en cloud et sur site.
Taille de l'organisation
- Petites et moyennes entreprises (PME)
- Grandes entreprises
Sur la base de la taille de l'organisation, le marché mondial de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) est segmenté en petites et moyennes entreprises (PME) et grandes entreprises.
Scène
- Clinique
- Préclinique
- PMA (Autorisation Post-Mise sur le Marché)
Sur la base du stade, le marché mondial de l'externalisation des affaires réglementaires du diagnostic in vitro (DIV) est segmenté en clinique, préclinique et PMA (autorisation post-commercialisation).
Classe
- Classe I
- Classe II
- Classe III
Sur la base de la classe, le marché mondial de l'externalisation des affaires réglementaires du diagnostic in vitro (DIV) est segmenté en classe I, classe II et classe III.
Utilisateur final
- sociétés pharmaceutiques
- entreprises de dispositifs médicaux
- entreprises de biotechnologie
- Autres
Sur la base de l'utilisateur final, le marché mondial de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) est segmenté en sociétés pharmaceutiques, sociétés de dispositifs médicaux, sociétés de biotechnologie et autres.
Analyse et perspectives régionales du marché de l'externalisation des affaires réglementaires du diagnostic in vitro (DIV)
Le marché de l'externalisation des affaires réglementaires du diagnostic in vitro (IVD) est analysé et des informations et tendances sur la taille du marché sont fournies par pays, services, indication, mode de déploiement, taille de l'organisation, étape, classe et utilisateur final comme référencé ci-dessus.
Français Les pays couverts dans le rapport sur le marché de l'externalisation des affaires réglementaires du diagnostic in vitro (DIV) sont les États-Unis, le Canada et le Mexique en Amérique du Nord, l'Allemagne, la France, le Royaume-Uni, les Pays-Bas, la Suisse, la Belgique, la Russie, l'Italie, l'Espagne, la Turquie, le reste de l'Europe en Europe, la Chine, le Japon, l'Inde, la Corée du Sud, Singapour, la Malaisie, l'Australie, la Thaïlande, l'Indonésie, les Philippines, le reste de l'Asie-Pacifique (APAC) dans l'Asie-Pacifique (APAC), l'Arabie saoudite, les Émirats arabes unis, l'Afrique du Sud, l'Égypte, Israël, le reste du Moyen-Orient et de l'Afrique (MEA) dans le cadre du Moyen-Orient et de l'Afrique (MEA), le Brésil, l'Argentine et le reste de l'Amérique du Sud dans le cadre de l'Amérique du Sud.
L'Asie-Pacifique (APAC) domine le marché de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) en raison de l'augmentation du nombre d'essais cliniques et du nombre croissant d'entreprises dans la région.
L’Amérique du Nord devrait connaître une croissance significative au cours de la période de prévision de 2022 à 2029 en raison de la présence de sociétés pharmaceutiques et de dispositifs médicaux clés et de l’augmentation des dépenses de recherche et développement dans la région.
La section nationale du rapport présente également les facteurs d'impact sur les marchés individuels et les évolutions réglementaires nationales qui influencent les tendances actuelles et futures du marché. Des données telles que l'analyse des chaînes de valeur en aval et en amont, les tendances techniques, l'analyse des cinq forces de Porter et les études de cas sont quelques-uns des indicateurs utilisés pour prévoir le scénario de marché pour chaque pays. De plus, la présence et la disponibilité des marques mondiales et les défis auxquels elles sont confrontées en raison de la forte ou de la faible concurrence des marques locales et nationales, l'impact des tarifs douaniers nationaux et les routes commerciales sont pris en compte lors de l'analyse prévisionnelle des données nationales.
Croissance des infrastructures de santé Base installée et pénétration des nouvelles technologies
Le marché de l'externalisation des affaires réglementaires du diagnostic in vitro (DIV) vous propose également une analyse détaillée de chaque pays : croissance des dépenses de santé en biens d'équipement, parc installé de différents types de produits, impact des technologies (courbes de vie), évolution des scénarios réglementaires de santé et impact sur le marché de l'externalisation des affaires réglementaires du diagnostic in vitro (DIV). Les données sont disponibles pour la période 2010-2020.
Analyse du paysage concurrentiel et des parts de marché de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV)
Le paysage concurrentiel du marché de l'externalisation des affaires réglementaires pour le diagnostic in vitro (DIV) est détaillé par concurrent. Il comprend une présentation de l'entreprise, ses données financières, son chiffre d'affaires, son potentiel de marché, ses investissements en recherche et développement, ses nouvelles initiatives, sa présence mondiale, ses sites et installations de production, ses capacités de production, ses forces et faiblesses, le lancement de nouveaux produits, leur ampleur et leur portée, ainsi que la prédominance de ses applications. Les données ci-dessus concernent uniquement les entreprises du marché de l'externalisation des affaires réglementaires pour le diagnostic in vitro (DIV).
Certains des principaux acteurs opérant sur le marché de l'externalisation des affaires réglementaires en matière de diagnostic in vitro (DIV) sont :
- Freyr Solutions (Inde)
- PPD Inc. (États-Unis)
- EMERGO (États-Unis)
- ICÔNE (Santé)
- Parexel International Corporation (États-Unis)
- CRITERIUM, INC. (États-Unis)
- Groupe ProductLife SA (France)
- Labcorp Drug Development (États-Unis)
- WuXi AppTec (Chine)
- Genpact (États-Unis)
- Medpace (États-Unis)
- Dor Pharmaceutical Services (Israël)
- Qserve (Pays-Bas)
SKU-
Accédez en ligne au rapport sur le premier cloud mondial de veille économique
- Tableau de bord d'analyse de données interactif
- Tableau de bord d'analyse d'entreprise pour les opportunités à fort potentiel de croissance
- Accès d'analyste de recherche pour la personnalisation et les requêtes
- Analyse de la concurrence avec tableau de bord interactif
- Dernières actualités, mises à jour et analyse des tendances
- Exploitez la puissance de l'analyse comparative pour un suivi complet de la concurrence
Table des matières
1. INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2. MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 MULTIVARIATE MODELLING
2.2.4 TOP TO BOTTOM ANALYSIS
2.2.5 STANDARDS OF MEASUREMENT
2.2.6 VENDOR SHARE ANALYSIS
2.2.7 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.8 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3. MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4. PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTER’S FIVE FORCES MODEL
5. INDUSTRY INSIGHTS
5.1 MICRO AND MACRO ECONOMIC FACTORS
5.2 PENETRATION AND GROWTH PROSPECT MAPPING
5.3 KEY PRICING STRATEGIES
5.4 INTERVIEWS WITH SPECIALIST
5.5 ANALYIS AND RECOMMENDATION
6. INTELLECTUAL PROPERTY (IP) PORTFOLIO
6.1 PATENT QUALITY AND STRENGTH
6.2 PATENT FAMILIES
6.3 LICENSING AND COLLABORATIONS
6.4 COMPETITIVE LANDSCAPE
6.5 IP STRATEGY AND MANAGEMENT
6.6 OTHER
7. COST ANALYSIS BREAKDOWN
8. TECHNONLOGY ROADMAP
9. INNOVATION TRACKER AND STRATEGIC ANALYSIS
9.1 MAJOR DEALS AND STRATEGIC ALLIANCES ANALYSIS
9.1.1 JOINT VENTURES
9.1.2 MERGERS AND ACQUISITIONS
9.1.3 LICENSING AND PARTNERSHIP
9.1.4 TECHNOLOGY COLLABORATIONS
9.1.5 STRATEGIC DIVESTMENTS
9.2 NUMBER OF PRODUCTS IN DEVELOPMENT
9.3 STAGE OF DEVELOPMENT
9.4 TIMELINES AND MILESTONES
9.5 INNOVATION STRATEGIES AND METHODOLOGIES
9.6 RISK ASSESSMENT AND MITIGATION
9.7 FUTURE OUTLOOK
10. REGULATORY COMPLIANCE
10.1 REGULATORY AUTHORITIES
10.2 REGULATORY CLASSIFICATIONS
10.2.1 CLASS I
10.2.2 CLASS II
10.2.3 CLASS III
10.3 REGULATORY SUBMISSIONS
10.4 INTERNATIONAL HARMONIZATION
10.5 COMPLIANCE AND QUALITY MANAGEMENT SYSTEMS
10.6 REGULATORY CHALLENGES AND STRATEGIES
11. REIMBURSEMENT FRAMEWORK
12. OPPUTUNITY MAP ANALYSIS
13. INSTALLED BASE DATA
14. VALUE CHAIN ANALYSIS
15. HEALTHCARE ECONOMY
15.1 HEALTHCARE EXPENDITURE
15.2 CAPITAL EXPENDITURE
15.3 CAPEX TRENDS
15.4 CAPEX ALLOCATION
15.5 FUNDING SOURCES
15.6 INDUSTRY BENCHMARKS
15.7 GDP RATION IN OVERALL GDP
15.8 HEALTHCARE SYSTEM STRUCTURE
15.9 GOVERNMENT POLICIES
15.10 ECONOMIC DEVELOPMENT
16. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY SERVICE
16.1 OVERVIEW
16.2 REGULATORY WRITING & SUBMISSIONS
16.3 REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
16.4 REGULATORY CONSULTING
16.5 LEGAL REPRESENTATION
16.6 DATA MANAGEMENT SERVICES
16.7 CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
16.8 OTHERS
17. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY INDICATION
17.1 OVERVIEW
17.2 ONCOLOGY
17.3 NEUROLOGY
17.4 CARDIOLOGY
17.5 CLINICAL CHEMISTRY AND IMMUNOASSAYS
17.6 PRECISION MEDICINE
17.7 INFECTIOUS DISEASES
17.7.1 SEPSIS
17.7.2 VIROLOGY
17.7.3 BACTERIOLOGY
17.7.4 MICROBIOLOGY AND MYCOLOGY
17.7.5 HEPATITIS B
17.7.6 HEPATITIS C
17.7.7 SYPHILIS
17.7.8 TUBERCULOSIS
17.7.9 MALARIA
17.7.10 HUMAN PAPILLOMAVIRUS (HPV) INFECTION
17.7.11 OTHERS
17.8 DIABETES
17.9 GENETIC TESTING
17.10 HIV/AIDS
17.11 HAEMATOLOGY
17.12 DRUG TESTING/PHARMACOGENOMICS
17.13 BLOOD TRANSFUSION
17.14 OTHERS
18. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY STAGE
18.1 OVERVIEW
18.2 PRECLINICAL
18.3 CLINICAL
18.4 PMA (POST MARKET AUTHORIZATION)
19. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY CLASS
19.1 OVERVIEW
19.2 CLASS I
19.3 CLASS II
19.4 CLASS III
20. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY TYPE
20.1 OVERVIEW
20.2 POINT-OF-CARE (POC) IVD PRODUCT
20.3 LABORATORY-DEVELOPED TESTS (LDTS) IVD PRODUCT
20.4 COMPANION DIAGNOSTICS IVD PRODUCT
20.5 DIRECT-TO-CONSUMER (DTC) TESTING IVD PRODUCT
20.6 OTHERS IVD PRODUCT
21. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY DEPLOYMENT MODE
21.1 OVERVIEW
21.2 CLOUD
21.3 ON-PREMISES
22. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY ORGANIZARION SIZE
22.1 OVERVIEW
22.2 SMALL & MEDIUM ENTERPRISES (SMES)
22.3 LARGE ENTERPRISES
23. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY END USER
23.1 OVERVIEW
23.2 PHARMACEUTICAL COMPANIES
23.2.1 BY ORGANIZATION SIZE
23.2.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.2.1.2. LARGE ENTERPRISES
23.2.2 BY SERVICE
23.2.2.1. REGULATORY WRITING & SUBMISSIONS
23.2.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.2.2.3. REGULATORY CONSULTING
23.2.2.4. LEGAL REPRESENTATION
23.2.2.5. DATA MANAGEMENT SERVICES
23.2.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.2.2.7. OTHERS
23.3 MEDICAL DEVICE COMPANIES
23.3.1 BY ORGANIZATION SIZE
23.3.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.3.1.2. LARGE ENTERPRISES
23.3.2 BY SERVICE
23.3.2.1. REGULATORY WRITING & SUBMISSIONS
23.3.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.3.2.3. REGULATORY CONSULTING
23.3.2.4. LEGAL REPRESENTATION
23.3.2.5. DATA MANAGEMENT SERVICES
23.3.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.3.2.7. OTHERS
23.4 BIOTECHNOLOGY COMPANIES
23.4.1 BY ORGANIZATION SIZE
23.4.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.4.1.2. LARGE ENTERPRISES
23.4.2 BY SERVICE
23.4.2.1. REGULATORY WRITING & SUBMISSIONS
23.4.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.4.2.3. REGULATORY CONSULTING
23.4.2.4. LEGAL REPRESENTATION
23.4.2.5. DATA MANAGEMENT SERVICES
23.4.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.4.2.7. OTHERS
23.5 OTHERS
24. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY REGION
24.1 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
24.1.1 NORTH AMERICA
24.1.1.1. U.S.
24.1.1.2. CANADA
24.1.1.3. MEXICO
24.1.2 EUROPE
24.1.2.1. GERMANY
24.1.2.2. FRANCE
24.1.2.3. U.K.
24.1.2.4. ITALY
24.1.2.5. SPAIN
24.1.2.6. RUSSIA
24.1.2.7. TURKEY
24.1.2.8. BELGIUM
24.1.2.9. NETHERLANDS
24.1.2.10. SWITZERLAND
24.1.2.11. REST OF EUROPE
24.1.3 ASIA-PACIFIC
24.1.3.1. JAPAN
24.1.3.2. CHINA
24.1.3.3. SOUTH KOREA
24.1.3.4. INDIA
24.1.3.5. AUSTRALIA
24.1.3.6. SINGAPORE
24.1.3.7. THAILAND
24.1.3.8. MALAYSIA
24.1.3.9. INDONESIA
24.1.3.10. PHILIPPINES
24.1.3.11. REST OF ASIA-PACIFIC
24.1.4 SOUTH AMERICA
24.1.4.1. BRAZIL
24.1.4.2. ARGENTINA
24.1.4.3. REST OF SOUTH AMERICA
24.1.5 MIDDLE EAST AND AFRICA
24.1.5.1. SOUTH AFRICA
24.1.5.2. EGYPT
24.1.5.3. ISRAEL
24.1.5.4. UAE
24.1.5.5. SAUDI ARABIA
24.1.5.6. REST OF MIDDLE EAST AND AFRICA
24.1.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
25. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY LANDSCAPE
25.1 COMPANY SHARE ANALYSIS: GLOBAL
25.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
25.3 COMPANY SHARE ANALYSIS: EUROPE
25.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
25.5 MERGERS & ACQUISITIONS
25.6 NEW PRODUCT DEVELOPMENT & APPROVALS
25.7 EXPANSIONS
25.8 REGULATORY CHANGES
25.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
26. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY PROFILE
26.1 FREYR SOLUTIONS
26.1.1 COMPANY OVERVIEW
26.1.2 COMPANY SNAPSHOT
26.1.3 REVENUE ANALYSIS
26.1.4 PRODUCT PORTFOLIO
26.1.5 RECENT DEVELOPMENTS
26.2 AXSOURCE CONSULTING INC.
26.2.1 COMPANY OVERVIEW
26.2.2 COMPANY SNAPSHOT
26.2.3 REVENUE ANALYSIS
26.2.4 PRODUCT PORTFOLIO
26.2.5 RECENT DEVELOPMENTS
26.3 LORENZ LIFE SCIENCES GROUP
26.3.1 COMPANY OVERVIEW
26.3.2 COMPANY SNAPSHOT
26.3.3 REVENUE ANALYSIS
26.3.4 PRODUCT PORTFOLIO
26.3.5 RECENT DEVELOPMENTS
26.4 LABORATORY CORPORATION OF AMERICA HOLDINGS
26.4.1 COMPANY OVERVIEW
26.4.2 COMPANY SNAPSHOT
26.4.3 REVENUE ANALYSIS
26.4.4 PRODUCT PORTFOLIO
26.4.5 RECENT DEVELOPMENTS
26.5 REG IQ PTY LTD.
26.5.1 COMPANY OVERVIEW
26.5.2 COMPANY SNAPSHOT
26.5.3 REVENUE ANALYSIS
26.5.4 PRODUCT PORTFOLIO
26.5.5 RECENT DEVELOPMENTS
26.6 PROMEDICA INTERNATIONAL, A CALIFORNIA CORPORATION (IUVO BIOSCIENCES)
26.6.1 COMPANY OVERVIEW
26.6.2 COMPANY SNAPSHOT
26.6.3 REVENUE ANALYSIS
26.6.4 PRODUCT PORTFOLIO
26.6.5 RECENT DEVELOPMENTS
26.7 MAKROCARE
26.7.1 COMPANY OVERVIEW
26.7.2 COMPANY SNAPSHOT
26.7.3 REVENUE ANALYSIS
26.7.4 PRODUCT PORTFOLIO
26.7.5 RECENT DEVELOPMENTS
26.8 EMERGO BY UL
26.8.1 COMPANY OVERVIEW
26.8.2 COMPANY SNAPSHOT
26.8.3 REVENUE ANALYSIS
26.8.4 PRODUCT PORTFOLIO
26.8.5 RECENT DEVELOPMENTS
26.9 ICON PLC
26.9.1 COMPANY OVERVIEW
26.9.2 COMPANY SNAPSHOT
26.9.3 REVENUE ANALYSIS
26.9.4 PRODUCT PORTFOLIO
26.9.5 RECENT DEVELOPMENTS
26.10 WUXI APPTEC
26.10.1 COMPANY OVERVIEW
26.10.2 COMPANY SNAPSHOT
26.10.3 REVENUE ANALYSIS
26.10.4 PRODUCT PORTFOLIO
26.10.5 RECENT DEVELOPMENTS
26.11 THERMO FISHER SCIENTIFIC INC.
26.11.1 COMPANY OVERVIEW
26.11.2 COMPANY SNAPSHOT
26.11.3 REVENUE ANALYSIS
26.11.4 PRODUCT PORTFOLIO
26.11.5 RECENT DEVELOPMENTS
26.12 CHARLES RIVER LABORATORIES.
26.12.1 COMPANY OVERVIEW
26.12.2 COMPANY SNAPSHOT
26.12.3 REVENUE ANALYSIS
26.12.4 PRODUCT PORTFOLIO
26.12.5 RECENT DEVELOPMENTS
26.13 ACCELL CLINICAL RESEARCH, LLC
26.13.1 COMPANY OVERVIEW
26.13.2 COMPANY SNAPSHOT
26.13.3 REVENUE ANALYSIS
26.13.4 PRODUCT PORTFOLIO
26.13.5 RECENT DEVELOPMENTS
26.14 PAREXEL INTERNATIONAL (MA) CORPORATION
26.14.1 COMPANY OVERVIEW
26.14.2 COMPANY SNAPSHOT
26.14.3 REVENUE ANALYSIS
26.14.4 PRODUCT PORTFOLIO
26.14.5 RECENT DEVELOPMENTS
26.15 METECON GMBH
26.15.1 COMPANY OVERVIEW
26.15.2 COMPANY SNAPSHOT
26.15.3 REVENUE ANALYSIS
26.15.4 PRODUCT PORTFOLIO
26.15.5 RECENT DEVELOPMENTS
26.16 GENPACT
26.16.1 COMPANY OVERVIEW
26.16.2 COMPANY SNAPSHOT
26.16.3 REVENUE ANALYSIS
26.16.4 PRODUCT PORTFOLIO
26.16.5 RECENT DEVELOPMENTS
26.17 CRITERIUM, INC
26.17.1 COMPANY OVERVIEW
26.17.2 COMPANY SNAPSHOT
26.17.3 REVENUE ANALYSIS
26.17.4 PRODUCT PORTFOLIO
26.17.5 RECENT DEVELOPMENTS
26.18 MEDPACE
26.18.1 COMPANY OVERVIEW
26.18.2 COMPANY SNAPSHOT
26.18.3 REVENUE ANALYSIS
26.18.4 PRODUCT PORTFOLIO
26.18.5 RECENT DEVELOPMENTS
26.19 GROUPE PRODUCTLIFE S.A.
26.19.1 COMPANY OVERVIEW
26.19.2 COMPANY SNAPSHOT
26.19.3 REVENUE ANALYSIS
26.19.4 PRODUCT PORTFOLIO
26.19.5 RECENT DEVELOPMENTS
26.20 DOR PHARMACEUTICAL SERVICES
26.20.1 COMPANY OVERVIEW
26.20.2 COMPANY SNAPSHOT
26.20.3 REVENUE ANALYSIS
26.20.4 PRODUCT PORTFOLIO
26.20.5 RECENT DEVELOPMENTS
26.21 QSERVE
26.21.1 COMPANY OVERVIEW
26.21.2 COMPANY SNAPSHOT
26.21.3 REVENUE ANALYSIS
26.21.4 PRODUCT PORTFOLIO
26.21.5 RECENT DEVELOPMENTS
26.22 ORTHO CLINICAL DIAGNOSTICS.
26.22.1 COMPANY OVERVIEW
26.22.2 COMPANY SNAPSHOT
26.22.3 REVENUE ANALYSIS
26.22.4 PRODUCT PORTFOLIO
26.22.5 RECENT DEVELOPMENTS
26.23 ANGSTROM BIOTECH PVT. LTD.
26.23.1 COMPANY OVERVIEW
26.23.2 COMPANY SNAPSHOT
26.23.3 REVENUE ANALYSIS
26.23.4 PRODUCT PORTFOLIO
26.23.5 RECENT DEVELOPMENTS
26.24 RQM+
26.24.1 COMPANY OVERVIEW
26.24.2 COMPANY SNAPSHOT
26.24.3 REVENUE ANALYSIS
26.24.4 PRODUCT PORTFOLIO
26.24.5 RECENT DEVELOPMENTS
26.25 REGULATORY COMPLIANCES ASSOCIATES (SOTERA HEALTH)
26.25.1 COMPANY OVERVIEW
26.25.2 COMPANY SNAPSHOT
26.25.3 REVENUE ANALYSIS
26.25.4 PRODUCT PORTFOLIO
26.25.5 RECENT DEVELOPMENTS
26.26 RESEARCHDX
26.26.1 COMPANY OVERVIEW
26.26.2 COMPANY SNAPSHOT
26.26.3 REVENUE ANALYSIS
26.26.4 PRODUCT PORTFOLIO
26.26.5 RECENT DEVELOPMENTS
26.27 CMIC HOLDINGS CO., LTD.
26.27.1 COMPANY OVERVIEW
26.27.2 COMPANY SNAPSHOT
26.27.3 REVENUE ANALYSIS
26.27.4 PRODUCT PORTFOLIO
26.27.5 RECENT DEVELOPMENTS
26.28 NORTH AMERICAN SCIENCE ASSOCIATES, LLC
26.28.1 COMPANY OVERVIEW
26.28.2 COMPANY SNAPSHOT
26.28.3 REVENUE ANALYSIS
26.28.4 PRODUCT PORTFOLIO
26.28.5 RECENT DEVELOPMENTS
26.29 QARAD BV
26.29.1 COMPANY OVERVIEW
26.29.2 COMPANY SNAPSHOT
26.29.3 REVENUE ANALYSIS
26.29.4 PRODUCT PORTFOLIO
26.29.5 RECENT DEVELOPMENTS
26.30 TRANSCRIP
26.30.1 COMPANY OVERVIEW
26.30.2 COMPANY SNAPSHOT
26.30.3 REVENUE ANALYSIS
26.30.4 PRODUCT PORTFOLIO
26.30.5 RECENT DEVELOPMENTS
26.31 CLIN-R+
26.31.1 COMPANY OVERVIEW
26.31.2 COMPANY SNAPSHOT
26.31.3 REVENUE ANALYSIS
26.31.4 PRODUCT PORTFOLIO
26.31.5 RECENT DEVELOPMENTS
26.32 VCLS
26.32.1 COMPANY OVERVIEW
26.32.2 COMPANY SNAPSHOT
26.32.3 REVENUE ANALYSIS
26.32.4 PRODUCT PORTFOLIO
26.32.5 RECENT DEVELOPMENTS
26.33 PROPHARMA GROUP
26.33.1 COMPANY OVERVIEW
26.33.2 COMPANY SNAPSHOT
26.33.3 REVENUE ANALYSIS
26.33.4 PRODUCT PORTFOLIO
26.33.5 RECENT DEVELOPMENTS
26.34 ARRIELLO IRELAND LIMITED
26.34.1 COMPANY OVERVIEW
26.34.2 COMPANY SNAPSHOT
26.34.3 REVENUE ANALYSIS
26.34.4 PRODUCT PORTFOLIO
26.34.5 RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
27. RELATED REPORTS
28. QUESTIONNAIRE
29. ABOUT DATA BRIDGE MARKET RESEARCH
Méthodologie de recherche
La collecte de données et l'analyse de l'année de base sont effectuées à l'aide de modules de collecte de données avec des échantillons de grande taille. L'étape consiste à obtenir des informations sur le marché ou des données connexes via diverses sources et stratégies. Elle comprend l'examen et la planification à l'avance de toutes les données acquises dans le passé. Elle englobe également l'examen des incohérences d'informations observées dans différentes sources d'informations. Les données de marché sont analysées et estimées à l'aide de modèles statistiques et cohérents de marché. De plus, l'analyse des parts de marché et l'analyse des tendances clés sont les principaux facteurs de succès du rapport de marché. Pour en savoir plus, veuillez demander un appel d'analyste ou déposer votre demande.
La méthodologie de recherche clé utilisée par l'équipe de recherche DBMR est la triangulation des données qui implique l'exploration de données, l'analyse de l'impact des variables de données sur le marché et la validation primaire (expert du secteur). Les modèles de données incluent la grille de positionnement des fournisseurs, l'analyse de la chronologie du marché, l'aperçu et le guide du marché, la grille de positionnement des entreprises, l'analyse des brevets, l'analyse des prix, l'analyse des parts de marché des entreprises, les normes de mesure, l'analyse globale par rapport à l'analyse régionale et des parts des fournisseurs. Pour en savoir plus sur la méthodologie de recherche, envoyez une demande pour parler à nos experts du secteur.
Personnalisation disponible
Data Bridge Market Research est un leader de la recherche formative avancée. Nous sommes fiers de fournir à nos clients existants et nouveaux des données et des analyses qui correspondent à leurs objectifs. Le rapport peut être personnalisé pour inclure une analyse des tendances des prix des marques cibles, une compréhension du marché pour d'autres pays (demandez la liste des pays), des données sur les résultats des essais cliniques, une revue de la littérature, une analyse du marché des produits remis à neuf et de la base de produits. L'analyse du marché des concurrents cibles peut être analysée à partir d'une analyse basée sur la technologie jusqu'à des stratégies de portefeuille de marché. Nous pouvons ajouter autant de concurrents que vous le souhaitez, dans le format et le style de données que vous recherchez. Notre équipe d'analystes peut également vous fournir des données sous forme de fichiers Excel bruts, de tableaux croisés dynamiques (Fact book) ou peut vous aider à créer des présentations à partir des ensembles de données disponibles dans le rapport.