Asia Pacific Drug Safety Solutions And Pharmacovigilance Market
Размер рынка в млрд долларов США
CAGR :
% 
 USD
1.42 Billion
USD
2.65 Billion
2024
2032
USD
1.42 Billion
USD
2.65 Billion
2024
2032
| 2025 –2032 | |
| USD 1.42 Billion | |
| USD 2.65 Billion | |
|
|
|
|
Сегментация рынка решений по обеспечению безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе по типу (программное обеспечение и услуги), продукту (стандартная форма и настраиваемая форма), функциональности (программное обеспечение для отчетности о нежелательных явлениях, программное обеспечение для аудита безопасности лекарственных средств и программное обеспечение для отслеживания проблем), доставке (локальный режим доставки и режим доставки по запросу/в облаке (SAAS)), конечным пользователям (биотехнологии и фармацевтика, контрактно-исследовательские организации (CROS), больницы, KPO/BPO и поставщики медицинских услуг), каналу сбыта (прямые продажи и розничные продажи) — тенденции отрасли и прогноз до 2032 года
Размер рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
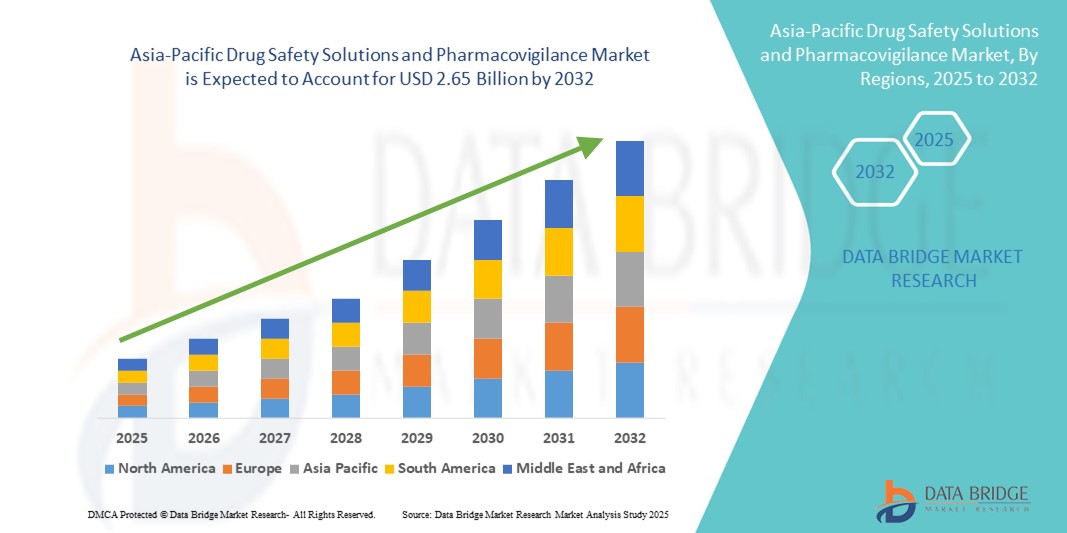
- Объем рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе оценивался в 1,42 млрд долларов США в 2024 году и, как ожидается , достигнет 2,65 млрд долларов США к 2032 году при среднегодовом темпе роста 8,10% в течение прогнозируемого периода.
- Рост рынка во многом обусловлен расширением деятельности в области фармацевтических исследований и разработок, более строгими нормативными требованиями к отчетности о побочных эффектах и все более широким внедрением современных инструментов мониторинга безопасности в секторах здравоохранения и естественных наук региона.
- Более того, растущий спрос на анализ данных о безопасности в режиме реального времени в сочетании с растущими инвестициями в платформы фармаконадзора на базе искусственного интеллекта позиционируют эти решения как критически важные компоненты для обеспечения эффективности лекарственных препаратов и безопасности пациентов. Эти факторы ускоряют внедрение на рынке, тем самым значительно стимулируя рост отрасли.
Анализ рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
- Решения по обеспечению безопасности лекарственных средств и системы фармаконадзора, позволяющие выявлять, оценивать и предотвращать побочные реакции на лекарственные средства, становятся важнейшими компонентами фармацевтического и биотехнологического секторов в Азиатско-Тихоокеанском регионе из-за строгих нормативных требований, расширения деятельности по разработке лекарственных средств и растущей потребности в мониторинге безопасности в режиме реального времени.
- Растущий спрос на эти решения обусловлен, прежде всего, ростом активности клинических испытаний, ростом распространенности хронических заболеваний, требующих длительного приема лекарств, и растущим вниманием к соблюдению международных стандартов безопасности лекарственных средств среди поставщиков медицинских услуг и производителей.
- Китай доминировал на рынке решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе с наибольшей долей выручки в 36,9% в 2024 году, чему способствовало быстрое расширение фармацевтической производственной базы, большое количество пациентов, значительные государственные инвестиции в цифровизацию здравоохранения и быстрое внедрение платформ фармаконадзора на базе искусственного интеллекта , а также заметный рост как внутренних, так и внешних услуг по мониторингу безопасности.
- Ожидается, что Индия станет самым быстрорастущим рынком решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе в течение прогнозируемого периода благодаря увеличению инвестиций в НИОКР, модернизации нормативно-правовой базы и более широкому использованию облачных систем управления данными о безопасности.
- Сегмент программного обеспечения доминировал на рынке решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе с долей 49,2% в 2024 году благодаря масштабируемости, функциям автоматизации и бесперебойной интеграции с существующей ИТ-инфраструктурой здравоохранения для эффективной обработки данных о нежелательных явлениях.
Область применения отчета и сегментация рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
|
Атрибуты |
Ключевые аспекты рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе |
|
Охваченные сегменты |
|
|
Охваченные страны |
Азиатско-Тихоокеанский регион
|
|
Ключевые игроки рынка |
|
|
Рыночные возможности |
|
|
Информационные наборы данных с добавленной стоимостью |
Помимо информации о рыночных сценариях, таких как рыночная стоимость, темпы роста, сегментация, географический охват и основные игроки, отчеты о рынке, подготовленные Data Bridge Market Research, также включают в себя углубленный экспертный анализ, анализ цен, анализ доли бренда, опрос потребителей, демографический анализ, анализ цепочки поставок, анализ цепочки создания стоимости, обзор сырья/расходных материалов, критерии выбора поставщиков, анализ PESTLE, анализ Портера и нормативную базу. |
Тенденции рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
Автоматизация на основе искусственного интеллекта и облачные платформы безопасности
- Значимой и набирающей обороты тенденцией на рынке решений для обеспечения безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе является растущее внедрение искусственного интеллекта (ИИ) и передовой аналитики в рамках облачных платформ для оптимизации выявления нежелательных явлений, отчетности и соблюдения требований. Эта интеграция повышает скорость, точность и масштабируемость мер по обеспечению безопасности в регионе.
- Например, платформы Oracle Argus Safety и LifeSphere Safety от ArisGlobal развертываются в нескольких странах Азиатско-Тихоокеанского региона, предлагая возможности обработки случаев на базе искусственного интеллекта, автоматического обнаружения сигналов и многоязычной отчетности о нежелательных событиях, адаптированные к местным нормативным требованиям.
- Интеграция ИИ позволяет получать прогнозные данные о безопасности, анализируя большие объёмы структурированных и неструктурированных данных клинических испытаний, электронных медицинских карт и реестров пациентов. Например, некоторые решения используют алгоритмы машинного обучения для выявления новых сигналов безопасности до того, как они перерастут в серьёзные проблемы общественного здравоохранения, что повышает эффективность принятия упреждающих решений.
- Развертывание облачных технологий позволяет географически распределенным группам, включая организации по контрактным исследованиям (CRO) и партнеров по аутсорсингу фармаконадзора, эффективно взаимодействовать, обеспечивая при этом безопасный обмен данными и подачу нормативных документов в режиме реального времени в такие органы, как NMPA Китая или CDSCO Индии.
- Эта тенденция к интеллектуальным, автоматизированным и взаимосвязанным системам управления безопасностью меняет ландшафт фармаконадзора в Азиатско-Тихоокеанском регионе, побуждая ведущих поставщиков, таких как IQVIA и Cognizant, расширять предложения услуг на базе ИИ с помощью встроенных инструментов обеспечения соответствия требованиям.
- Спрос на платформы, сочетающие в себе ИИ, автоматизацию и доступ к облаку, стремительно растет, поскольку фармацевтические компании, биотехнологические компании и регулирующие органы в Азиатско-Тихоокеанском регионе уделяют первостепенное внимание безопасности пациентов и операционной эффективности.
Динамика рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
Водитель
Ужесточение нормативных требований и расширение клинических испытаний
- Ужесточение правил безопасности лекарственных средств в Азиатско-Тихоокеанском регионе в сочетании с ростом активности клинических испытаний обуславливают спрос на передовые решения в области фармаконадзора.
- Например, в феврале 2024 года Национальное управление по контролю за лекарственными средствами Китая (NMPA) объявило об обновлении руководящих принципов пострегистрационного мониторинга безопасности лекарственных средств, предписывающих более оперативное информирование о нежелательных явлениях и интеграцию с централизованными базами данных по безопасности. Эти меры подталкивают фармацевтические компании к модернизации своей инфраструктуры безопасности.
- Растущее количество методов лечения хронических заболеваний, биологических препаратов и персонализированных лекарственных средств, поступающих на рынок, еще больше усиливает потребность в эффективном управлении побочными эффектами, поскольку эти методы лечения часто требуют долгосрочного мониторинга безопасности.
- Кроме того, глобальные фармацевтические компании, расширяющие свое присутствие в сфере исследований и разработок в Азиатско-Тихоокеанском регионе, все чаще сотрудничают с местными CRO и внедряют региональные системы безопасности для обеспечения соответствия требованиям и доступа к рынкам.
- Сочетание мер регулирующего контроля, растущего числа пациентов и расширяющихся сетей испытаний делает системы безопасности лекарственных средств незаменимыми для поддержания как соответствия требованиям, так и конкурентного преимущества.
Сдержанность/Вызов
Правила конфиденциальности данных и нехватка квалифицированной рабочей силы
- Сложные и разнообразные законы о конфиденциальности данных в Азиатско-Тихоокеанском регионе, такие как Закон о защите персональных данных Китая (PIPL) и Закон о защите цифровых персональных данных Индии, создают значительные трудности для управления данными трансграничного фармаконадзора. Эти правила часто требуют локализации хранения данных и строгих протоколов согласия, что усложняет операционную деятельность.
- Например, многонациональные компании должны адаптировать свои базы данных по безопасности и рабочие процессы в соответствии с правилами управления данными каждой страны, что может замедлить внедрение и увеличить затраты на соблюдение требований.
- Более того, нехватка квалифицированных специалистов по фармаконадзору на развивающихся рынках Азиатско-Тихоокеанского региона ограничивает скорость масштабирования организациями передовых операций по обеспечению безопасности. Хотя аутсорсинг специализированным поставщикам услуг помогает преодолеть этот пробел, спрос на квалифицированных аналитиков и врачей по безопасности продолжает опережать предложение.
- Внедрение платформ фармаконадзора на базе ИИ и облачных решений по безопасности часто требует значительных первоначальных инвестиций в программное обеспечение, оборудование и интеграцию с существующей ИТ-инфраструктурой. Небольшие фармацевтические компании или новые биотехнологические компании могут столкнуться с бюджетными ограничениями, что ограничивает их широкое внедрение.
- Преодоление этих проблем потребует стратегических инвестиций в обучение персонала, гармонизацию региональных стандартов данных и развертывание гибких технологических платформ, способных соответствовать как глобальным, так и локальным требованиям соответствия.
Рынок решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
Рынок сегментирован по типу, продукту, функциональности, способу доставки, конечным пользователям и каналу сбыта.
- По типу
Рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе сегментируется на программное обеспечение и услуги. Сегмент программного обеспечения доминировал на рынке с наибольшей долей выручки в 49,2% в 2024 году, что обусловлено растущим внедрением автоматизации на основе искусственного интеллекта, оповещением о нежелательных явлениях в режиме реального времени, предиктивной аналитикой и бесшовной интеграцией с существующей ИТ-инфраструктурой здравоохранения. Фармацевтические компании и организации, занимающиеся клиническими исследованиями, отдают предпочтение программным решениям благодаря их способности оптимизировать процессы фармаконадзора, обеспечивать соблюдение нормативных требований и предоставлять комплексные панели мониторинга для мониторинга данных по безопасности в рамках многочисленных исследований и пострегистрационных исследований.
Ожидается, что сегмент услуг продемонстрирует самые высокие темпы роста в период с 2025 по 2032 год, чему будет способствовать растущая тенденция к передаче функций фармаконадзора специализированным поставщикам услуг на аутсорсинг. Это позволяет компаниям сократить операционные расходы, привлечь высококвалифицированных специалистов по безопасности и эффективно соблюдать местные и международные нормативные требования. Услуги включают в себя обработку дел, медицинскую экспертизу, обнаружение сигналов, управление рисками и поддержку подачи заявок в регулирующие органы, которые пользуются всё большим спросом у компаний, расширяющих свою деятельность в Азиатско-Тихоокеанском регионе.
- По продукту
Рынок решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе сегментируется по видам продукции на стандартные и индивидуальные решения. В 2024 году сегмент стандартных решений доминировал на рынке благодаря своей готовности к внедрению, соблюдению нормативных требований и пригодности для малых и средних фармацевтических компаний, которым требуется быстрое внедрение. Стандартные решения предлагают предварительно настроенные рабочие процессы, шаблоны для отчётности о нежелательных явлениях и соответствие международным стандартам, таким как ICH-GCP, и местным регулирующим органам, что сокращает время и стоимость внедрения.
Ожидается, что сегмент индивидуальных решений будет расти наиболее быстрыми темпами в течение прогнозируемого периода благодаря крупным фармацевтическим и биотехнологическим компаниям, которым требуются индивидуальные рабочие процессы, интеграция с существующими системами, расширенные форматы отчетности и специализированные функции, соответствующие уникальным дизайнам клинических исследований или терапевтическим областям. Индивидуально разработанные платформы обеспечивают гибкость, улучшенную визуализацию данных и специализированную отчетность для подачи заявок в регулирующие органы разных стран, удовлетворяя сложные потребности в области фармаконадзора.
- По функциональности
По функциональности рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе сегментируется на программное обеспечение для отчётности о нежелательных явлениях, программное обеспечение для аудита безопасности лекарственных средств и программное обеспечение для отслеживания проблем. Сегмент программного обеспечения для отчётности о нежелательных явлениях доминировал на рынке в 2024 году благодаря своей важнейшей роли в соблюдении нормативных требований, обеспечивая своевременное сообщение о нежелательных явлениях в ходе клинических исследований и пострегистрационного наблюдения. Это программное обеспечение помогает компаниям стандартизировать приём пациентов, сортировку, оценку и отчётность, минимизируя при этом человеческий фактор.
Ожидается, что сегменты программного обеспечения для аудита безопасности лекарственных средств и отслеживания проблем будут демонстрировать наиболее быстрый рост, что обусловлено усилением контроля со стороны регулирующих органов, необходимостью упреждающего выявления рисков и обеспечения качества при разработке и коммерциализации лекарственных средств. Эти решения обеспечивают непрерывный мониторинг соответствия требованиям, выявление пробелов в процессах обеспечения безопасности и структурированное отслеживание последующих действий, тем самым повышая безопасность пациентов и снижая регуляторные риски.
- По способу доставки
По принципу предоставления услуг рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе сегментирован на локальные решения и решения по запросу/в облаке ( SaaS) . В 2024 году сегмент решений по запросу/в облаке доминировал, чему способствовало растущее внедрение облачной инфраструктуры для масштабируемой, безопасной и экономичной деятельности по фармаконадзору. Облачные платформы обеспечивают взаимодействие в режиме реального времени между географически распределенными командами, ускоряют подачу заявок в регулирующие органы и снижают потребность в обслуживании внутренних ИТ-систем и инвестициях в инфраструктуру.
Ожидается, что локальный вариант доставки будет расти самыми быстрыми темпами в течение прогнозируемого периода, особенно в организациях и регионах со строгими требованиями к конфиденциальности данных и локализации. Локальные решения обеспечивают более высокий уровень контроля над конфиденциальными данными безопасности, позволяют настраивать внутренние параметры и обеспечивают соблюдение местного законодательства, что делает их подходящими для крупных фармацевтических компаний и многонациональных корпораций, работающих в нескольких юрисдикциях.
- Конечными пользователями
По типу конечных пользователей рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе сегментируется на следующие сегменты: биотехнологии и фармацевтика, контрактные исследовательские организации (CRO), больницы, KPO/BPO и поставщики медицинских услуг. Сегмент биотехнологий и фармацевтики доминировал на рынке в 2024 году благодаря большому объему клинических исследований, обширному пострегистрационному надзору и строгим требованиям к соблюдению нормативных требований, которые требуют надежных систем мониторинга безопасности.
Ожидается, что сегмент CRO и больниц продемонстрирует наиболее быстрый рост, поскольку эти организации всё чаще внедряют решения по фармаконадзору для управления аутсорсинговым клиническим мониторингом безопасности, поддержки многоцентровых исследований и внедрения систем отчётности о нежелательных явлениях в больницах. Растущий спрос на специализированные услуги в сочетании с расширением клинических исследований в Азиатско-Тихоокеанском регионе стимулирует внедрение решений среди этих конечных пользователей.
- По каналу распространения
По каналам сбыта рынок решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе сегментируется на сегменты прямых продаж и розничных продаж. В 2024 году сегмент прямых продаж доминировал благодаря долгосрочным контрактам с фармацевтическими компаниями, контрактными исследовательскими организациями (CRO) и организациями здравоохранения, что обеспечивало постоянную поддержку, обновление программного обеспечения, обучение и помощь в соблюдении требований.
Ожидается, что сегмент розничных продаж будет расти наиболее быстрыми темпами, особенно в сегменте стандартизированных программных пакетов и облачных решений, поскольку небольшие компании всё чаще приобретают готовые к внедрению продукты через онлайн-площадки или у авторизованных дистрибьюторов. Розничные каналы обеспечивают экономичный и быстрый доступ к инструментам фармаконадзора, способствуя их более широкому внедрению среди развивающихся биотехнологических компаний и небольших медицинских учреждений.
Анализ рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
- Китай доминировал на рынке решений по обеспечению безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе, завоевав наибольшую долю выручки в 36,9% в 2024 году, чему способствовали быстрорастущая фармацевтическая производственная база, большое количество пациентов и значительные государственные инвестиции в цифровизацию здравоохранения.
- Фармацевтические компании и организации здравоохранения в регионе высоко ценят мониторинг безопасности в режиме реального времени, автоматизированное оповещение о нежелательных явлениях и полную интеграцию программных решений с существующей ИТ-инфраструктурой. Это обеспечивает более быструю подачу заявок в регулирующие органы, проактивное управление рисками и повышение безопасности пациентов.
- Широкое внедрение также поддерживается государственными инициативами по развитию инфраструктуры цифрового здравоохранения, увеличением инвестиций в НИОКР и повышением осведомлённости о требованиях безопасности лекарственных средств. В совокупности эти факторы делают решения в области фармаконадзора критически важными инструментами для биотехнологических и фармацевтических компаний, контрактных исследовательских организаций, больниц и других поставщиков медицинских услуг в Азиатско-Тихоокеанском регионе.
Обзор рынка решений по безопасности лекарственных средств в Китае
Рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Китае в 2024 году обеспечил наибольшую долю выручки в Азиатско-Тихоокеанском регионе – 36,9%. Росту способствовали быстрорастущий сектор фармацевтического производства, большая численность пациентов и увеличение числа клинических исследований. Рост рынка обусловлен ужесточением нормативных требований Национального управления по контролю за лекарственными средствами (NMPA) и внедрением платформ фармаконадзора на базе искусственного интеллекта. Фармацевтические компании и контрактные исследовательские организации уделяют первостепенное внимание отчетности о нежелательных явлениях в режиме реального времени, автоматизированному мониторингу безопасности и облачным решениям для обеспечения соответствия требованиям и повышения безопасности пациентов.
Обзор рынка решений по обеспечению безопасности лекарственных средств в Японии
Рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Японии набирает обороты благодаря развитой инфраструктуре здравоохранения, акценту на соблюдении нормативных требований и широкому внедрению цифровых медицинских технологий. Японские компании всё чаще используют платформы фармаконадзора на базе искусственного интеллекта и облачных технологий для управления клиническими исследованиями и пострегистрационным наблюдением. Акцент на безопасности пациентов в сочетании со строгими требованиями к отчётности стимулирует внедрение этих решений в биотехнологических, фармацевтических компаниях и больницах.
Обзор рынка решений по обеспечению безопасности лекарственных средств в Индии
В 2024 году рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Индии стал одним из самых быстрорастущих в Азиатско-Тихоокеанском регионе, что обусловлено ростом числа клинических исследований, развитием фармацевтического сектора и государственными инициативами по продвижению цифровых систем здравоохранения. Рост аутсорсинга услуг фармаконадзора в CRO и KPO, а также растущее внедрение экономически эффективных облачных решений, стимулируют рост рынка. Наличие большого числа квалифицированных специалистов и стремление к внедрению интеллектуальных решений для мониторинга безопасности на основе данных дополнительно стимулируют рост рынка.
Обзор рынка решений по безопасности лекарственных средств в Австралии
Рынок решений по безопасности лекарственных средств и фармаконадзора в Австралии демонстрирует устойчивый рост, чему способствуют расширение исследований в области биотехнологий и фармацевтики, растущее внимание к пострегистрационному надзору и соблюдение рекомендаций Управления по контролю за оборотом лекарственных средств (TGA). Больницы, клинические исследовательские организации (CRO) и поставщики медицинских услуг всё чаще используют облачные платформы и сервисы для обеспечения безопасности лекарственных средств, чтобы оптимизировать отчётность о нежелательных явлениях и улучшить мониторинг безопасности пациентов.
Обзор рынка решений по безопасности лекарственных средств в Южной Корее
Ожидается, что рынок решений для обеспечения безопасности лекарственных средств и фармаконадзора в Южной Корее будет расти значительными среднегодовыми темпами, чему будет способствовать внедрение технологий, значительные инвестиции в НИОКР и особое внимание правительства к безопасности пациентов. Интеграция ИИ и автоматизации в рабочие процессы фармаконадзора, наряду с нормативными требованиями к электронной отчетности о нежелательных явлениях, способствует их внедрению фармацевтическими компаниями и контрактными исследовательскими организациями.
Доля рынка решений по безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе
В Азиатско-Тихоокеанском регионе сектор решений по безопасности лекарственных средств и фармаконадзора в первую очередь представлен хорошо зарекомендовавшими себя компаниями, среди которых:
- Clinquest Group BV (Нидерланды)
- Take Solutions Limited (Индия)
- Wipro Limited (Индия)
- Fosun Pharma (Китай)
- Sinopharm (Китай)
- Sinovac Biotech (Китай)
- ALTEOGEN Inc. (Южная Корея)
- ANB Laboratories Co., Ltd. (Южная Корея)
- Biopharm Chemicals Co., Ltd. (Таиланд)
- Берингер Ингельхайм Интернешнл ГмбХ (Германия)
- Accenture (Ирландия)
- Компания Bristol-Myers Squibb (США)
- Labcorp (США)
- ICON plc (Ирландия)
- Parexel International (MA) Corporation (США)
- United BioSource LLC (США)
- Cognizant (США)
Каковы последние события на рынке решений по обеспечению безопасности лекарственных средств и фармаконадзора в Азиатско-Тихоокеанском регионе?
- В августе 2025 года компания Selta Square внедрила Oracle Argus Safety, комплексную платформу безопасности, для автоматизации и управления процессами фармаконадзора. Ожидается, что это внедрение улучшит соблюдение требований, оценку рисков и масштабируемость для фармацевтических клиентов в Азиатско-Тихоокеанском регионе.
- В июле 2025 года компания EVERSANA представила EVERSANA ORCHESTRATE PV — решение на базе искусственного интеллекта, предназначенное для оптимизации рабочих процессов обеспечения безопасности лекарственных средств. Эта платформа использует искусственный интеллект для повышения скорости, точности и качества процессов фармаконадзора, стремясь сформировать будущее мониторинга безопасности лекарственных средств в Азиатско-Тихоокеанском регионе.
- В июле 2025 года компания Southern Star Research внедрила Oracle Argus Safety для повышения эффективности процессов обеспечения безопасности лекарственных препаратов. Это внедрение отражает стремление компании к расширению клинических возможностей и обеспечению надежных и соответствующих требованиям систем безопасности и медицинского мониторинга в связи с ростом объемов исследований.
- В мае 2025 года Управление по контролю за лекарственными средствами (TGA) Австралии запросило общественное мнение по предлагаемым международным рекомендациям по клиническим исследованиям и фармаконадзору. Эта инициатива отражает стремление Австралии привести свою практику регулирования в соответствие с мировыми стандартами, обеспечивая безопасность и эффективность лекарственных средств. Усилия TGA направлены на укрепление сотрудничества и гармонизацию клинических исследований и пострегистрационного надзора в Азиатско-Тихоокеанском регионе.
- В июле 2021 года Управление по контролю за оборотом терапевтических товаров (TGA) Австралии опубликовало свою Стратегию международного взаимодействия на 2021–2025 годы. Стратегия ориентирована на сотрудничество с международными регулирующими органами для создания более согласованной на глобальном уровне нормативной базы. Приоритеты TGA включают согласование глобальной политики, глобальный мониторинг до и после выхода на рынок, а также расширение возможностей регионального регулирования.
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Интерактивная панель анализа данных
- Панель анализа компании для возможностей с высоким потенциалом роста
- Доступ аналитика-исследователя для настройки и запросов
- Анализ конкурентов с помощью интерактивной панели
- Последние новости, обновления и анализ тенденций
- Используйте возможности сравнительного анализа для комплексного отслеживания конкурентов
Методология исследования
Сбор данных и анализ базового года выполняются с использованием модулей сбора данных с большими размерами выборки. Этап включает получение рыночной информации или связанных данных из различных источников и стратегий. Он включает изучение и планирование всех данных, полученных из прошлого заранее. Он также охватывает изучение несоответствий информации, наблюдаемых в различных источниках информации. Рыночные данные анализируются и оцениваются с использованием статистических и последовательных моделей рынка. Кроме того, анализ доли рынка и анализ ключевых тенденций являются основными факторами успеха в отчете о рынке. Чтобы узнать больше, пожалуйста, запросите звонок аналитика или оставьте свой запрос.
Ключевой методологией исследования, используемой исследовательской группой DBMR, является триангуляция данных, которая включает в себя интеллектуальный анализ данных, анализ влияния переменных данных на рынок и первичную (отраслевую экспертную) проверку. Модели данных включают сетку позиционирования поставщиков, анализ временной линии рынка, обзор рынка и руководство, сетку позиционирования компании, патентный анализ, анализ цен, анализ доли рынка компании, стандарты измерения, глобальный и региональный анализ и анализ доли поставщика. Чтобы узнать больше о методологии исследования, отправьте запрос, чтобы поговорить с нашими отраслевыми экспертами.
Доступна настройка
Data Bridge Market Research является лидером в области передовых формативных исследований. Мы гордимся тем, что предоставляем нашим существующим и новым клиентам данные и анализ, которые соответствуют и подходят их целям. Отчет можно настроить, включив в него анализ ценовых тенденций целевых брендов, понимание рынка для дополнительных стран (запросите список стран), данные о результатах клинических испытаний, обзор литературы, обновленный анализ рынка и продуктовой базы. Анализ рынка целевых конкурентов можно проанализировать от анализа на основе технологий до стратегий портфеля рынка. Мы можем добавить столько конкурентов, о которых вам нужны данные в нужном вам формате и стиле данных. Наша команда аналитиков также может предоставить вам данные в сырых файлах Excel, сводных таблицах (книга фактов) или помочь вам в создании презентаций из наборов данных, доступных в отчете.