Global In Vitro Diagnostic Ivd Regulatory Affairs Outsourcing Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
| 2022 –2029 | |
| USD 674,277.97 Thousand | |
| USD 1,830,957.45 Thousand | |
|
|
|
|
Globaler Markt für das Outsourcing von regulatorischen Angelegenheiten im Bereich In-vitro -Diagnostik (IVD), nach Dienstleistung (Erstellung und Einreichung von Zulassungsanträgen, Zulassungsregistrierung und Anträge auf klinische Studien, regulatorische Beratung, Rechtsvertretung, Datenverwaltungsdienste, Dienstleistungen zur Herstellung und Kontrolle chemischer Substanzen (CMC) und andere), Indikation (Onkologie, Neurologie, Kardiologie, Klinische Chemie und Immunoassays, Präzisionsmedizin, Infektionskrankheiten, Diabetes, Gentests, HIV/AIDS, Hämatologie, Arzneimitteltests/Pharmakogenomik, Bluttransfusion, Point of Care und andere), Bereitstellungsmodus (Cloud und vor Ort), Unternehmensgröße (kleine und mittlere Unternehmen (KMU) und große Unternehmen), Phase (klinisch, präklinisch und PMA (Post-Market Authorization)), Klasse (Klasse I, Klasse II und Klasse III), Endbenutzer (Pharmaunternehmen, Medizinprodukteunternehmen, Biotechnologieunternehmen und andere) – Branchentrends und Prognose bis 2029
Marktanalyse und Größe
Gesundheitsunternehmen standen insbesondere aufgrund der COVID-19-Pandemie (Coronavirus) vor der Herausforderung, regulatorische Standards einzuhalten. Um eine qualitätsorientierte Unternehmenskultur in Medizintechnikunternehmen zu fördern, setzen Beratungsfirmen Qualitätsmanagementsystem-Software (QMS) ein. Unternehmen, die im Outsourcing regulatorischer Angelegenheiten im Bereich In- vitro-Diagnostik (IVD) tätig sind, bieten Gesundheitsorganisationen projektbasierte Unterstützung.
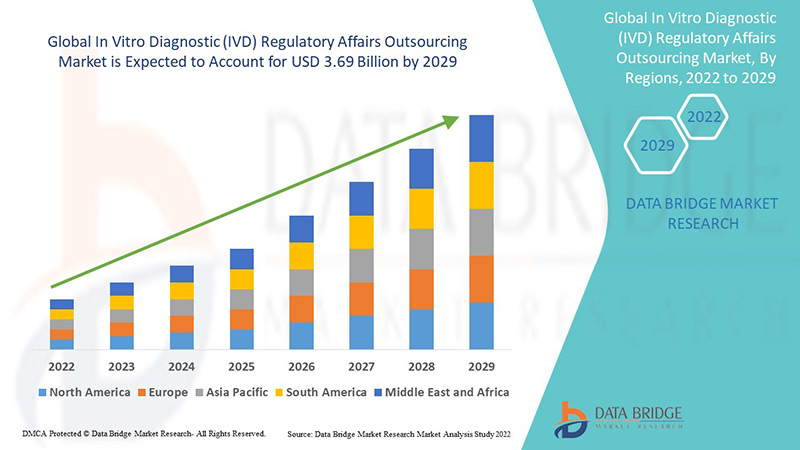
Der Einsatz des Outsourcings führt zum Abschluss langfristiger Outsourcing-Vereinbarungen. Der globale Markt für regulatorische Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) wurde 2021 auf 1,6 Milliarden US-Dollar geschätzt und soll bis 2029 3,69 Milliarden US-Dollar erreichen, was einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 11 % im Prognosezeitraum 2022–2029 entspricht. Für Pharmaunternehmen wird aufgrund der steigenden Anzahl klinischer Zulassungen ein hohes Wachstum erwartet.
Marktdefinition
Regulatorische Angelegenheiten spielen in der IVD -Branche eine entscheidende Rolle . Sie befassen sich mit dem Lebenszyklus verschiedener Gesundheitsprodukte und bieten produzierenden Unternehmen strategische, taktische und operative Unterstützung und Orientierung bei der Einhaltung der regulatorischen Rahmenbedingungen.
Berichtsumfang und Marktsegmentierung
|
Berichtsmetrik |
Details |
|
Prognosezeitraum |
2022 bis 2029 |
|
Basisjahr |
2021 |
|
Historische Jahre |
2020 (Anpassbar auf 2019 – 2014) |
|
Quantitative Einheiten |
Umsatz in Millionen USD, Mengen in Einheiten, Preise in USD |
|
Abgedeckte Segmente |
Service (Erstellung und Einreichung von Zulassungsanträgen, Zulassungsregistrierung und Anträge auf klinische Studien, Zulassungsberatung, Rechtsvertretung, Datenverwaltungsdienste, Dienste zur Herstellung und Kontrolle chemischer Substanzen (CMC) und andere), Indikation (Onkologie, Neurologie, Kardiologie, klinische Chemie und Immunassays, Präzisionsmedizin, Infektionskrankheiten, Diabetes, Gentests, HIV/AIDS, Hämatologie, Arzneimitteltests/Pharmakogenomik, Bluttransfusion, Point of Care und andere), Bereitstellungsmodus (Cloud und vor Ort), Unternehmensgröße (kleine und mittlere Unternehmen (KMU) und große Unternehmen), Phase (klinisch, präklinisch und PMA (Post-Market Authorization)), Klasse (Klasse I, Klasse II und Klasse III), Endbenutzer (Pharmaunternehmen, Hersteller medizinischer Geräte, Biotechnologieunternehmen und andere) |
|
Abgedeckte Länder |
USA, Kanada und Mexiko in Nordamerika, Deutschland, Frankreich, Großbritannien, Niederlande, Schweiz, Belgien, Russland, Italien, Spanien, Türkei, Restliches Europa in Europa, China, Japan, Indien, Südkorea, Singapur, Malaysia, Australien, Thailand, Indonesien, Philippinen, Restlicher Asien-Pazifik-Raum (APAC) im Asien-Pazifik-Raum (APAC), Saudi-Arabien, Vereinigte Arabische Emirate, Südafrika, Ägypten, Israel, Restlicher Naher Osten und Afrika (MEA) als Teil des Nahen Ostens und Afrikas (MEA), Brasilien, Argentinien und Restliches Südamerika als Teil von Südamerika. |
|
Abgedeckte Marktteilnehmer |
Freyr Solutions (Indien), PPD Inc. (USA), EMERGO (USA), ICON (Gesundheitswesen), Parexel International Corporation (USA), CRITERIUM, INC. (USA), Groupe ProductLife SA (Frankreich), Labcorp Drug Development (USA), WuXi AppTec (China), Genpact (USA), Medpace (USA), Dor Pharmaceutical Services (Israel), Qserve (Niederlande) und andere |
|
Marktchancen |
|
Marktdynamik für das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD)
In diesem Abschnitt geht es um das Verständnis der Markttreiber, Vorteile, Chancen, Einschränkungen und Herausforderungen. All dies wird im Folgenden ausführlich erläutert:
- Hoher Einsatz in der Gesundheitsbranche
Der zunehmende Einsatz von Outsourcing-Dienstleistungen im Gesundheitssektor ist einer der Hauptfaktoren für das Wachstum des Outsourcing-Marktes für regulatorische Angelegenheiten im Bereich In-vitro-Diagnostik (IVD). Die verstärkte geografische Expansion mit dem Ziel schneller Zulassungen in lokalen Märkten trägt zusätzlich zum Wachstum bei.
- Forschung und Entwicklung
Der Anstieg der Forschungs- und Entwicklungsaktivitäten sowie die zunehmende Anzahl von Anträgen für klinische Studien und Produktregistrierungen beschleunigen das Marktwachstum.
- Klinische Zulassungen
Die Nachfrage nach Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) steigt, da Unternehmen unter ständigem Druck stehen, rechtzeitig klinische Zulassungen von den Aufsichtsbehörden einzuholen. Die Nachfrage nach regulatorischen Dienstleistungen steigt daher.
Gelegenheiten
Darüber hinaus eröffnen die Entwicklung krankheitsspezifischer Biomarker und Tests sowie die Bedeutung der Begleitdiagnostik den Marktteilnehmern im Prognosezeitraum 2022 bis 2029 lukrative Möglichkeiten. Auch ein Anstieg der Investitionen wird den Markt weiter ausbauen.
Einschränkungen/Herausforderungen
Andererseits dürften sich ändernde Vorschriften für Medizinprodukte und das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) das Marktwachstum behindern. Auch die mangelnde Infrastruktur im Gesundheitswesen dürfte den Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) im Prognosezeitraum 2022–2029 vor Herausforderungen stellen.
Dieser Marktbericht zum Outsourcing von regulatorischen Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) enthält Details zu aktuellen Entwicklungen, Handelsbestimmungen, Import-Export-Analysen, Produktionsanalysen, Wertschöpfungskettenoptimierung, Marktanteilen, dem Einfluss inländischer und lokaler Marktteilnehmer, analysiert Chancen hinsichtlich neuer Umsatzfelder, Änderungen der Marktregulierung, strategische Marktwachstumsanalysen, Marktgröße, Kategoriewachstum, Anwendungsnischen und Marktdominanz, Produktzulassungen, Produkteinführungen, geografischer Expansion und technologischen Innovationen. Für weitere Informationen zum Outsourcing von regulatorischen Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) kontaktieren Sie Data Bridge Market Research für ein Analysten-Briefing. Unser Team unterstützt Sie bei fundierten Marktentscheidungen und unterstützt Sie bei Ihrem Marktwachstum.
Auswirkungen von Covid-19 auf den Markt für Diagnosetests
COVID-19 hatte negative Auswirkungen auf den Gesundheitssektor. Wichtige Akteure passten während des COVID-19-Ausbruchs innovative Strategien an die sich rasch verändernde Situation an. Die Länder führten kritische Veränderungen im Gesundheitswesen durch, bis die Krise in den Hintergrund trat. Es wird erwartet, dass Gesundheitsreformen in den kommenden Jahren zu Kostensenkungen, verbessertem Zugang und technologischem Fortschritt führen werden. Aufgrund der zunehmenden Bedeutung von Ferndiagnose, -versorgung und -beratung stieg die Nachfrage nach Outsourcing von regulatorischen Angelegenheiten im Bereich In-vitro-Diagnostik (IVD). Diese Dienstleistungen entlasten die Krankenhäuser nach der Pandemie.
Jüngste Entwicklungen
- Das Technologiemagazin USA-9 hat Freyr im November 2021 unter die „10 besten Technologielösungsanbieter des Jahres 2021“ gewählt. USA-9.com ist ein Technologiemagazin, das Freyr Solutions, einen führenden globalen Anbieter von regulatorischen Lösungen und Dienstleistungen, unter die „10 besten Technologielösungsanbieter des Jahres 2021“ gewählt hat, da Fryer weiterhin innovative Softwarelösungen entwickelt und Kunden bei ihren Compliance-Zielen unterstützt. Dies hat dem Unternehmen zu einer gesteigerten Popularität verholfen.
Globaler Outsourcing-Markt für In-vitro-Diagnostik (IVD) Regulatory Affairs – Umfang und Marktgröße
Der Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) ist nach Dienstleistungen, Indikation, Bereitstellungsmodus, Unternehmensgröße, Entwicklungsstadium, Klasse und Endnutzer segmentiert. Das Wachstum dieser Segmente hilft Ihnen, schwach wachsende Branchensegmente zu analysieren und bietet Ihnen einen wertvollen Marktüberblick und Markteinblicke, die Ihnen helfen, strategische Entscheidungen zur Identifizierung zentraler Marktanwendungen zu treffen.
Leistungen
- Verfassen von behördlichen Anträgen und Einreichungen
- Zulassungs- und klinische Studienanträge
- Regulatorische Beratung
- Rechtsvertretung
- Datenverwaltungsdienste
- Dienstleistungen im Bereich Chemieherstellung und -kontrolle (CMC)
- Sonstiges
Auf der Grundlage der Dienstleistungen ist der globale Outsourcing-Markt für regulatorische Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) in die Bereiche Verfassen und Einreichen von Vorschriften, Registrierung von Vorschriften und Anträge auf klinische Studien, regulatorische Beratung, Rechtsvertretung, Datenverwaltungsdienste, Dienste zur Herstellung und Kontrolle chemischer Stoffe (CMC) und andere unterteilt.
Anzeige
- Onkologie
- Neurologie
- Kardiologie
- Klinische Chemie und Immunassays
- Präzisionsmedizin
- Infektionskrankheiten
- Diabetes
- Genetische Tests
- HIV/AIDS
- Hämatologie
- Arzneimittelprüfung/Pharmakogenomik
- Bluttransfusion
- Behandlungsort
- Sonstiges
Auf der Grundlage der Indikation ist der globale Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) in die Bereiche Onkologie, Neurologie, Kardiologie, klinische Chemie und Immunassays, Präzisionsmedizin, Infektionskrankheiten, Diabetes, genetische Tests, HIV/AIDS, Hämatologie, Arzneimitteltests/Pharmakogenomik, Bluttransfusion, Point of Care und andere unterteilt.
Bereitstellungsmodus
- Wolke
- Vor Ort
Auf der Grundlage des Bereitstellungsmodus ist der globale Outsourcing-Markt für regulatorische Angelegenheiten im Bereich der In-vitro-Diagnostik (IVD) in Cloud und On-Premises segmentiert.
Unternehmensgröße
- Kleine und mittlere Unternehmen (KMU)
- Große Unternehmen
Auf der Grundlage der Unternehmensgröße ist der globale Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich der In-vitro-Diagnostik (IVD) in kleine und mittlere Unternehmen (KMU) und große Unternehmen segmentiert.
Bühne
- Klinisch
- Präklinisch
- PMA (Post-Market-Authorization)
Der globale Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich der In-vitro-Diagnostik (IVD) ist auf der Grundlage der Phase in die Bereiche Klinik, Präklinik und PMA (Post-Market Authorization) unterteilt.
Klasse
- Klasse I
- Klasse II
- Klasse III
Auf der Grundlage der Klasse ist der globale Outsourcing-Markt für regulatorische Angelegenheiten im Bereich der In-vitro-Diagnostik (IVD) in Klasse I, Klasse II und Klasse III segmentiert.
Endbenutzer
- Pharmaunternehmen
- Hersteller medizinischer Geräte
- Biotechnologieunternehmen
- Sonstiges
Auf der Grundlage des Endbenutzers ist der globale Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) in Pharmaunternehmen, Unternehmen für medizinische Geräte, Biotechnologieunternehmen und andere segmentiert.
Regionale Analyse/Einblicke zum Outsourcing des Marktes für regulatorische Angelegenheiten im Bereich In-vitro-Diagnostik (IVD)
Der Outsourcing-Markt für regulatorische Angelegenheiten im Bereich der In-vitro-Diagnostik (IVD) wird analysiert und es werden Einblicke in die Marktgröße und Trends nach Land, Diensten, Indikation, Bereitstellungsmodus, Organisationsgröße, Phase, Klasse und Endbenutzer wie oben angegeben bereitgestellt.
Die im Marktbericht zum Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) abgedeckten Länder sind die USA, Kanada und Mexiko in Nordamerika, Deutschland, Frankreich, Großbritannien, Niederlande, Schweiz, Belgien, Russland, Italien, Spanien, Türkei, Restliches Europa in Europa, China, Japan, Indien, Südkorea, Singapur, Malaysia, Australien, Thailand, Indonesien, Philippinen, Restlicher Asien-Pazifik-Raum (APAC) in der Asien-Pazifik-Region (APAC), Saudi-Arabien, Vereinigte Arabische Emirate, Südafrika, Ägypten, Israel, Restlicher Naher Osten und Afrika (MEA) als Teil des Nahen Ostens und Afrikas (MEA), Brasilien, Argentinien und Restliches Südamerika als Teil von Südamerika.
Der asiatisch-pazifische Raum (APAC) dominiert den Outsourcing-Markt für regulatorische Angelegenheiten im Bereich der In-vitro-Diagnostik (IVD) aufgrund der steigenden Zahl klinischer Studien und der zunehmenden Anzahl von Unternehmen in der Region.
In Nordamerika wird im Prognosezeitraum von 2022 bis 2029 aufgrund der Präsenz wichtiger Pharmaunternehmen und Medizintechnikunternehmen sowie steigender Ausgaben für Forschung und Entwicklung in der Region ein deutliches Wachstum erwartet.
Der Länderteil des Berichts enthält zudem Informationen zu einzelnen marktbeeinflussenden Faktoren und regulatorischen Veränderungen im Inland, die sich auf die aktuellen und zukünftigen Markttrends auswirken. Datenpunkte wie die Analyse der nachgelagerten und vorgelagerten Wertschöpfungskette, technische Trends, die Fünf-Kräfte-Analyse nach Porter sowie Fallstudien dienen unter anderem der Prognose des Marktszenarios für einzelne Länder. Auch die Präsenz und Verfügbarkeit globaler Marken und ihre Herausforderungen aufgrund starker oder geringer Konkurrenz durch lokale und inländische Marken sowie die Auswirkungen inländischer Zölle und Handelsrouten werden bei der Prognoseanalyse der Länderdaten berücksichtigt.
Wachstum der Gesundheitsinfrastruktur, installierte Basis und Durchdringung neuer Technologien
Der Markt für das Outsourcing von regulatorischen Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) bietet Ihnen außerdem detaillierte Marktanalysen für jedes Land, das Wachstum der Gesundheitsausgaben für Investitionsgüter, die installierte Basis verschiedener Produkte für das Outsourcing von regulatorischen Angelegenheiten im Bereich In-vitro-Diagnostik (IVD), den Einfluss der Technologie anhand von Lebenslinienkurven sowie Änderungen der regulatorischen Szenarien im Gesundheitswesen und deren Auswirkungen auf den Outsourcing-Markt für regulatorische Angelegenheiten im Bereich In-vitro-Diagnostik (IVD). Die Daten sind für den historischen Zeitraum 2010–2020 verfügbar.
Wettbewerbsumfeld und Outsourcing der regulatorischen Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) Analyse der Marktanteile
Die Wettbewerbslandschaft im Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD) bietet detaillierte Informationen zu den einzelnen Wettbewerbern. Zu den Details gehören Unternehmensübersicht, Unternehmensfinanzen, Umsatz, Marktpotenzial, Investitionen in Forschung und Entwicklung, neue Marktinitiativen, globale Präsenz, Produktionsstandorte und -anlagen, Produktionskapazitäten, Stärken und Schwächen des Unternehmens, Produkteinführung, Produktbreite und -umfang sowie Anwendungsdominanz. Die oben genannten Datenpunkte beziehen sich ausschließlich auf den Fokus der Unternehmen im Markt für das Outsourcing regulatorischer Angelegenheiten im Bereich In-vitro-Diagnostik (IVD).
Zu den wichtigsten Akteuren auf dem Outsourcing-Markt für regulatorische Angelegenheiten im Bereich der In-vitro-Diagnostik (IVD) zählen:
- Freyr Solutions (Indien)
- PPD Inc. (USA)
- EMERGO (USA)
- ICON (Gesundheitswesen)
- Parexel International Corporation (USA)
- CRITERIUM, INC. (USA)
- Groupe ProductLife SA (Frankreich)
- Labcorp Arzneimittelentwicklung (USA)
- WuXi AppTec (China)
- Genpact (USA)
- Medpace (USA)
- Dor Pharmaceutical Services (Israel)
- Qserve (Niederlande)
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Inhaltsverzeichnis
1. INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2. MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 MULTIVARIATE MODELLING
2.2.4 TOP TO BOTTOM ANALYSIS
2.2.5 STANDARDS OF MEASUREMENT
2.2.6 VENDOR SHARE ANALYSIS
2.2.7 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.8 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3. MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4. PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTER’S FIVE FORCES MODEL
5. INDUSTRY INSIGHTS
5.1 MICRO AND MACRO ECONOMIC FACTORS
5.2 PENETRATION AND GROWTH PROSPECT MAPPING
5.3 KEY PRICING STRATEGIES
5.4 INTERVIEWS WITH SPECIALIST
5.5 ANALYIS AND RECOMMENDATION
6. INTELLECTUAL PROPERTY (IP) PORTFOLIO
6.1 PATENT QUALITY AND STRENGTH
6.2 PATENT FAMILIES
6.3 LICENSING AND COLLABORATIONS
6.4 COMPETITIVE LANDSCAPE
6.5 IP STRATEGY AND MANAGEMENT
6.6 OTHER
7. COST ANALYSIS BREAKDOWN
8. TECHNONLOGY ROADMAP
9. INNOVATION TRACKER AND STRATEGIC ANALYSIS
9.1 MAJOR DEALS AND STRATEGIC ALLIANCES ANALYSIS
9.1.1 JOINT VENTURES
9.1.2 MERGERS AND ACQUISITIONS
9.1.3 LICENSING AND PARTNERSHIP
9.1.4 TECHNOLOGY COLLABORATIONS
9.1.5 STRATEGIC DIVESTMENTS
9.2 NUMBER OF PRODUCTS IN DEVELOPMENT
9.3 STAGE OF DEVELOPMENT
9.4 TIMELINES AND MILESTONES
9.5 INNOVATION STRATEGIES AND METHODOLOGIES
9.6 RISK ASSESSMENT AND MITIGATION
9.7 FUTURE OUTLOOK
10. REGULATORY COMPLIANCE
10.1 REGULATORY AUTHORITIES
10.2 REGULATORY CLASSIFICATIONS
10.2.1 CLASS I
10.2.2 CLASS II
10.2.3 CLASS III
10.3 REGULATORY SUBMISSIONS
10.4 INTERNATIONAL HARMONIZATION
10.5 COMPLIANCE AND QUALITY MANAGEMENT SYSTEMS
10.6 REGULATORY CHALLENGES AND STRATEGIES
11. REIMBURSEMENT FRAMEWORK
12. OPPUTUNITY MAP ANALYSIS
13. INSTALLED BASE DATA
14. VALUE CHAIN ANALYSIS
15. HEALTHCARE ECONOMY
15.1 HEALTHCARE EXPENDITURE
15.2 CAPITAL EXPENDITURE
15.3 CAPEX TRENDS
15.4 CAPEX ALLOCATION
15.5 FUNDING SOURCES
15.6 INDUSTRY BENCHMARKS
15.7 GDP RATION IN OVERALL GDP
15.8 HEALTHCARE SYSTEM STRUCTURE
15.9 GOVERNMENT POLICIES
15.10 ECONOMIC DEVELOPMENT
16. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY SERVICE
16.1 OVERVIEW
16.2 REGULATORY WRITING & SUBMISSIONS
16.3 REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
16.4 REGULATORY CONSULTING
16.5 LEGAL REPRESENTATION
16.6 DATA MANAGEMENT SERVICES
16.7 CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
16.8 OTHERS
17. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY INDICATION
17.1 OVERVIEW
17.2 ONCOLOGY
17.3 NEUROLOGY
17.4 CARDIOLOGY
17.5 CLINICAL CHEMISTRY AND IMMUNOASSAYS
17.6 PRECISION MEDICINE
17.7 INFECTIOUS DISEASES
17.7.1 SEPSIS
17.7.2 VIROLOGY
17.7.3 BACTERIOLOGY
17.7.4 MICROBIOLOGY AND MYCOLOGY
17.7.5 HEPATITIS B
17.7.6 HEPATITIS C
17.7.7 SYPHILIS
17.7.8 TUBERCULOSIS
17.7.9 MALARIA
17.7.10 HUMAN PAPILLOMAVIRUS (HPV) INFECTION
17.7.11 OTHERS
17.8 DIABETES
17.9 GENETIC TESTING
17.10 HIV/AIDS
17.11 HAEMATOLOGY
17.12 DRUG TESTING/PHARMACOGENOMICS
17.13 BLOOD TRANSFUSION
17.14 OTHERS
18. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY STAGE
18.1 OVERVIEW
18.2 PRECLINICAL
18.3 CLINICAL
18.4 PMA (POST MARKET AUTHORIZATION)
19. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY CLASS
19.1 OVERVIEW
19.2 CLASS I
19.3 CLASS II
19.4 CLASS III
20. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY TYPE
20.1 OVERVIEW
20.2 POINT-OF-CARE (POC) IVD PRODUCT
20.3 LABORATORY-DEVELOPED TESTS (LDTS) IVD PRODUCT
20.4 COMPANION DIAGNOSTICS IVD PRODUCT
20.5 DIRECT-TO-CONSUMER (DTC) TESTING IVD PRODUCT
20.6 OTHERS IVD PRODUCT
21. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY DEPLOYMENT MODE
21.1 OVERVIEW
21.2 CLOUD
21.3 ON-PREMISES
22. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY ORGANIZARION SIZE
22.1 OVERVIEW
22.2 SMALL & MEDIUM ENTERPRISES (SMES)
22.3 LARGE ENTERPRISES
23. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY END USER
23.1 OVERVIEW
23.2 PHARMACEUTICAL COMPANIES
23.2.1 BY ORGANIZATION SIZE
23.2.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.2.1.2. LARGE ENTERPRISES
23.2.2 BY SERVICE
23.2.2.1. REGULATORY WRITING & SUBMISSIONS
23.2.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.2.2.3. REGULATORY CONSULTING
23.2.2.4. LEGAL REPRESENTATION
23.2.2.5. DATA MANAGEMENT SERVICES
23.2.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.2.2.7. OTHERS
23.3 MEDICAL DEVICE COMPANIES
23.3.1 BY ORGANIZATION SIZE
23.3.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.3.1.2. LARGE ENTERPRISES
23.3.2 BY SERVICE
23.3.2.1. REGULATORY WRITING & SUBMISSIONS
23.3.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.3.2.3. REGULATORY CONSULTING
23.3.2.4. LEGAL REPRESENTATION
23.3.2.5. DATA MANAGEMENT SERVICES
23.3.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.3.2.7. OTHERS
23.4 BIOTECHNOLOGY COMPANIES
23.4.1 BY ORGANIZATION SIZE
23.4.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.4.1.2. LARGE ENTERPRISES
23.4.2 BY SERVICE
23.4.2.1. REGULATORY WRITING & SUBMISSIONS
23.4.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.4.2.3. REGULATORY CONSULTING
23.4.2.4. LEGAL REPRESENTATION
23.4.2.5. DATA MANAGEMENT SERVICES
23.4.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.4.2.7. OTHERS
23.5 OTHERS
24. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY REGION
24.1 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
24.1.1 NORTH AMERICA
24.1.1.1. U.S.
24.1.1.2. CANADA
24.1.1.3. MEXICO
24.1.2 EUROPE
24.1.2.1. GERMANY
24.1.2.2. FRANCE
24.1.2.3. U.K.
24.1.2.4. ITALY
24.1.2.5. SPAIN
24.1.2.6. RUSSIA
24.1.2.7. TURKEY
24.1.2.8. BELGIUM
24.1.2.9. NETHERLANDS
24.1.2.10. SWITZERLAND
24.1.2.11. REST OF EUROPE
24.1.3 ASIA-PACIFIC
24.1.3.1. JAPAN
24.1.3.2. CHINA
24.1.3.3. SOUTH KOREA
24.1.3.4. INDIA
24.1.3.5. AUSTRALIA
24.1.3.6. SINGAPORE
24.1.3.7. THAILAND
24.1.3.8. MALAYSIA
24.1.3.9. INDONESIA
24.1.3.10. PHILIPPINES
24.1.3.11. REST OF ASIA-PACIFIC
24.1.4 SOUTH AMERICA
24.1.4.1. BRAZIL
24.1.4.2. ARGENTINA
24.1.4.3. REST OF SOUTH AMERICA
24.1.5 MIDDLE EAST AND AFRICA
24.1.5.1. SOUTH AFRICA
24.1.5.2. EGYPT
24.1.5.3. ISRAEL
24.1.5.4. UAE
24.1.5.5. SAUDI ARABIA
24.1.5.6. REST OF MIDDLE EAST AND AFRICA
24.1.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
25. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY LANDSCAPE
25.1 COMPANY SHARE ANALYSIS: GLOBAL
25.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
25.3 COMPANY SHARE ANALYSIS: EUROPE
25.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
25.5 MERGERS & ACQUISITIONS
25.6 NEW PRODUCT DEVELOPMENT & APPROVALS
25.7 EXPANSIONS
25.8 REGULATORY CHANGES
25.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
26. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY PROFILE
26.1 FREYR SOLUTIONS
26.1.1 COMPANY OVERVIEW
26.1.2 COMPANY SNAPSHOT
26.1.3 REVENUE ANALYSIS
26.1.4 PRODUCT PORTFOLIO
26.1.5 RECENT DEVELOPMENTS
26.2 AXSOURCE CONSULTING INC.
26.2.1 COMPANY OVERVIEW
26.2.2 COMPANY SNAPSHOT
26.2.3 REVENUE ANALYSIS
26.2.4 PRODUCT PORTFOLIO
26.2.5 RECENT DEVELOPMENTS
26.3 LORENZ LIFE SCIENCES GROUP
26.3.1 COMPANY OVERVIEW
26.3.2 COMPANY SNAPSHOT
26.3.3 REVENUE ANALYSIS
26.3.4 PRODUCT PORTFOLIO
26.3.5 RECENT DEVELOPMENTS
26.4 LABORATORY CORPORATION OF AMERICA HOLDINGS
26.4.1 COMPANY OVERVIEW
26.4.2 COMPANY SNAPSHOT
26.4.3 REVENUE ANALYSIS
26.4.4 PRODUCT PORTFOLIO
26.4.5 RECENT DEVELOPMENTS
26.5 REG IQ PTY LTD.
26.5.1 COMPANY OVERVIEW
26.5.2 COMPANY SNAPSHOT
26.5.3 REVENUE ANALYSIS
26.5.4 PRODUCT PORTFOLIO
26.5.5 RECENT DEVELOPMENTS
26.6 PROMEDICA INTERNATIONAL, A CALIFORNIA CORPORATION (IUVO BIOSCIENCES)
26.6.1 COMPANY OVERVIEW
26.6.2 COMPANY SNAPSHOT
26.6.3 REVENUE ANALYSIS
26.6.4 PRODUCT PORTFOLIO
26.6.5 RECENT DEVELOPMENTS
26.7 MAKROCARE
26.7.1 COMPANY OVERVIEW
26.7.2 COMPANY SNAPSHOT
26.7.3 REVENUE ANALYSIS
26.7.4 PRODUCT PORTFOLIO
26.7.5 RECENT DEVELOPMENTS
26.8 EMERGO BY UL
26.8.1 COMPANY OVERVIEW
26.8.2 COMPANY SNAPSHOT
26.8.3 REVENUE ANALYSIS
26.8.4 PRODUCT PORTFOLIO
26.8.5 RECENT DEVELOPMENTS
26.9 ICON PLC
26.9.1 COMPANY OVERVIEW
26.9.2 COMPANY SNAPSHOT
26.9.3 REVENUE ANALYSIS
26.9.4 PRODUCT PORTFOLIO
26.9.5 RECENT DEVELOPMENTS
26.10 WUXI APPTEC
26.10.1 COMPANY OVERVIEW
26.10.2 COMPANY SNAPSHOT
26.10.3 REVENUE ANALYSIS
26.10.4 PRODUCT PORTFOLIO
26.10.5 RECENT DEVELOPMENTS
26.11 THERMO FISHER SCIENTIFIC INC.
26.11.1 COMPANY OVERVIEW
26.11.2 COMPANY SNAPSHOT
26.11.3 REVENUE ANALYSIS
26.11.4 PRODUCT PORTFOLIO
26.11.5 RECENT DEVELOPMENTS
26.12 CHARLES RIVER LABORATORIES.
26.12.1 COMPANY OVERVIEW
26.12.2 COMPANY SNAPSHOT
26.12.3 REVENUE ANALYSIS
26.12.4 PRODUCT PORTFOLIO
26.12.5 RECENT DEVELOPMENTS
26.13 ACCELL CLINICAL RESEARCH, LLC
26.13.1 COMPANY OVERVIEW
26.13.2 COMPANY SNAPSHOT
26.13.3 REVENUE ANALYSIS
26.13.4 PRODUCT PORTFOLIO
26.13.5 RECENT DEVELOPMENTS
26.14 PAREXEL INTERNATIONAL (MA) CORPORATION
26.14.1 COMPANY OVERVIEW
26.14.2 COMPANY SNAPSHOT
26.14.3 REVENUE ANALYSIS
26.14.4 PRODUCT PORTFOLIO
26.14.5 RECENT DEVELOPMENTS
26.15 METECON GMBH
26.15.1 COMPANY OVERVIEW
26.15.2 COMPANY SNAPSHOT
26.15.3 REVENUE ANALYSIS
26.15.4 PRODUCT PORTFOLIO
26.15.5 RECENT DEVELOPMENTS
26.16 GENPACT
26.16.1 COMPANY OVERVIEW
26.16.2 COMPANY SNAPSHOT
26.16.3 REVENUE ANALYSIS
26.16.4 PRODUCT PORTFOLIO
26.16.5 RECENT DEVELOPMENTS
26.17 CRITERIUM, INC
26.17.1 COMPANY OVERVIEW
26.17.2 COMPANY SNAPSHOT
26.17.3 REVENUE ANALYSIS
26.17.4 PRODUCT PORTFOLIO
26.17.5 RECENT DEVELOPMENTS
26.18 MEDPACE
26.18.1 COMPANY OVERVIEW
26.18.2 COMPANY SNAPSHOT
26.18.3 REVENUE ANALYSIS
26.18.4 PRODUCT PORTFOLIO
26.18.5 RECENT DEVELOPMENTS
26.19 GROUPE PRODUCTLIFE S.A.
26.19.1 COMPANY OVERVIEW
26.19.2 COMPANY SNAPSHOT
26.19.3 REVENUE ANALYSIS
26.19.4 PRODUCT PORTFOLIO
26.19.5 RECENT DEVELOPMENTS
26.20 DOR PHARMACEUTICAL SERVICES
26.20.1 COMPANY OVERVIEW
26.20.2 COMPANY SNAPSHOT
26.20.3 REVENUE ANALYSIS
26.20.4 PRODUCT PORTFOLIO
26.20.5 RECENT DEVELOPMENTS
26.21 QSERVE
26.21.1 COMPANY OVERVIEW
26.21.2 COMPANY SNAPSHOT
26.21.3 REVENUE ANALYSIS
26.21.4 PRODUCT PORTFOLIO
26.21.5 RECENT DEVELOPMENTS
26.22 ORTHO CLINICAL DIAGNOSTICS.
26.22.1 COMPANY OVERVIEW
26.22.2 COMPANY SNAPSHOT
26.22.3 REVENUE ANALYSIS
26.22.4 PRODUCT PORTFOLIO
26.22.5 RECENT DEVELOPMENTS
26.23 ANGSTROM BIOTECH PVT. LTD.
26.23.1 COMPANY OVERVIEW
26.23.2 COMPANY SNAPSHOT
26.23.3 REVENUE ANALYSIS
26.23.4 PRODUCT PORTFOLIO
26.23.5 RECENT DEVELOPMENTS
26.24 RQM+
26.24.1 COMPANY OVERVIEW
26.24.2 COMPANY SNAPSHOT
26.24.3 REVENUE ANALYSIS
26.24.4 PRODUCT PORTFOLIO
26.24.5 RECENT DEVELOPMENTS
26.25 REGULATORY COMPLIANCES ASSOCIATES (SOTERA HEALTH)
26.25.1 COMPANY OVERVIEW
26.25.2 COMPANY SNAPSHOT
26.25.3 REVENUE ANALYSIS
26.25.4 PRODUCT PORTFOLIO
26.25.5 RECENT DEVELOPMENTS
26.26 RESEARCHDX
26.26.1 COMPANY OVERVIEW
26.26.2 COMPANY SNAPSHOT
26.26.3 REVENUE ANALYSIS
26.26.4 PRODUCT PORTFOLIO
26.26.5 RECENT DEVELOPMENTS
26.27 CMIC HOLDINGS CO., LTD.
26.27.1 COMPANY OVERVIEW
26.27.2 COMPANY SNAPSHOT
26.27.3 REVENUE ANALYSIS
26.27.4 PRODUCT PORTFOLIO
26.27.5 RECENT DEVELOPMENTS
26.28 NORTH AMERICAN SCIENCE ASSOCIATES, LLC
26.28.1 COMPANY OVERVIEW
26.28.2 COMPANY SNAPSHOT
26.28.3 REVENUE ANALYSIS
26.28.4 PRODUCT PORTFOLIO
26.28.5 RECENT DEVELOPMENTS
26.29 QARAD BV
26.29.1 COMPANY OVERVIEW
26.29.2 COMPANY SNAPSHOT
26.29.3 REVENUE ANALYSIS
26.29.4 PRODUCT PORTFOLIO
26.29.5 RECENT DEVELOPMENTS
26.30 TRANSCRIP
26.30.1 COMPANY OVERVIEW
26.30.2 COMPANY SNAPSHOT
26.30.3 REVENUE ANALYSIS
26.30.4 PRODUCT PORTFOLIO
26.30.5 RECENT DEVELOPMENTS
26.31 CLIN-R+
26.31.1 COMPANY OVERVIEW
26.31.2 COMPANY SNAPSHOT
26.31.3 REVENUE ANALYSIS
26.31.4 PRODUCT PORTFOLIO
26.31.5 RECENT DEVELOPMENTS
26.32 VCLS
26.32.1 COMPANY OVERVIEW
26.32.2 COMPANY SNAPSHOT
26.32.3 REVENUE ANALYSIS
26.32.4 PRODUCT PORTFOLIO
26.32.5 RECENT DEVELOPMENTS
26.33 PROPHARMA GROUP
26.33.1 COMPANY OVERVIEW
26.33.2 COMPANY SNAPSHOT
26.33.3 REVENUE ANALYSIS
26.33.4 PRODUCT PORTFOLIO
26.33.5 RECENT DEVELOPMENTS
26.34 ARRIELLO IRELAND LIMITED
26.34.1 COMPANY OVERVIEW
26.34.2 COMPANY SNAPSHOT
26.34.3 REVENUE ANALYSIS
26.34.4 PRODUCT PORTFOLIO
26.34.5 RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
27. RELATED REPORTS
28. QUESTIONNAIRE
29. ABOUT DATA BRIDGE MARKET RESEARCH
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.