Global In Vitro Diagnostic Ivd Regulatory Affairs Outsourcing Market
Tamaño del mercado en miles de millones de dólares
Tasa de crecimiento anual compuesta (CAGR) :
% 
 USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
| 2022 –2029 | |
| USD 674,277.97 Thousand | |
| USD 1,830,957.45 Thousand | |
|
|
|
|
Mercado global de externalización de asuntos regulatorios para diagnóstico in vitro (IVD), por servicio (redacción y presentación de solicitudes regulatorias, registro regulatorio y solicitudes de ensayos clínicos , consultoría regulatoria, representación legal, servicios de gestión de datos, servicios de fabricación y control de productos químicos (CMC) y otros), indicación (oncología, neurología, cardiología, química clínica e inmunoensayos, medicina de precisión, enfermedades infecciosas, diabetes, pruebas genéticas, VIH/sida, hematología, pruebas de fármacos/farmacogenómica, transfusión sanguínea, punto de atención y otros), modo de implementación (nube y local), tamaño de la organización (pequeñas y medianas empresas [PYMES] y grandes empresas), etapa (clínica, preclínica y PMA [autorización poscomercialización]), clase (clase I, clase II y clase III), usuario final (empresas farmacéuticas, empresas de dispositivos médicos, empresas de biotecnología y otras) – Tendencias de la industria y pronóstico hasta 2029
Análisis y tamaño del mercado
Las empresas de atención médica se enfrentaron a desafíos para cumplir con los estándares regulatorios, especialmente debido a la pandemia de COVID-19 (coronavirus). Para fomentar una cultura de calidad en las empresas de tecnología médica, las consultoras utilizan software de sistemas de gestión de calidad (SGC). Las empresas dedicadas a la externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) brindan apoyo a las organizaciones de atención médica en función de sus proyectos.
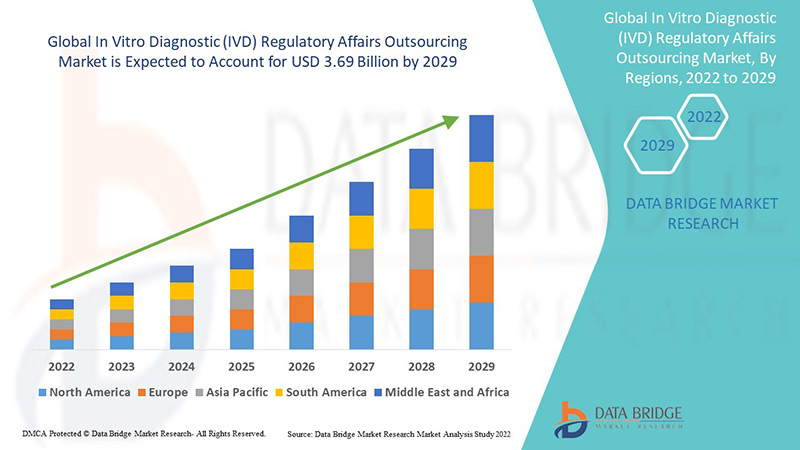
La implementación de la externalización está dando lugar a la firma de contratos de externalización a largo plazo. El mercado global de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) se valoró en 1600 millones de dólares estadounidenses en 2021 y se espera que alcance los 3690 millones de dólares estadounidenses para 2029, registrando una tasa de crecimiento anual compuesta (TCAC) del 11 % durante el período de pronóstico 2022-2029. Se prevé un alto crecimiento para las compañías farmacéuticas gracias al aumento en el número de aprobaciones clínicas.
Definición de mercado
Los asuntos regulatorios desempeñan un papel crucial en la industria de dispositivos de diagnóstico in vitro (IVD). Estos asuntos se ocupan del ciclo de vida de diversos productos sanitarios y ofrecen apoyo y orientación estratégica, táctica y operativa a las empresas manufactureras para que trabajen dentro del marco regulatorio.
Alcance del informe y segmentación del mercado
|
Métrica del informe |
Detalles |
|
Período de pronóstico |
2022 a 2029 |
|
Año base |
2021 |
|
Años históricos |
2020 (personalizable para 2019-2014) |
|
Unidades cuantitativas |
Ingresos en millones de USD, volúmenes en unidades, precios en USD |
|
Segmentos cubiertos |
Servicio (Redacción y presentaciones regulatorias, Registro regulatorio y solicitudes de ensayos clínicos, Consultoría regulatoria, Representación legal, Servicios de gestión de datos, Servicios de fabricación y control de productos químicos (CMC) y otros), Indicación (Oncología, Neurología, Cardiología, Química clínica e inmunoensayos, Medicina de precisión, Enfermedades infecciosas, Diabetes, Pruebas genéticas, VIH/SIDA, Hematología, Pruebas de fármacos/Farmacogenómica, Transfusión de sangre, Punto de atención y otros), Modo de implementación (Nube y Local), Tamaño de la organización (Pequeñas y medianas empresas (PYMES) y Grandes empresas), Etapa (Clínica, Preclínica y PMA (Autorización poscomercialización)), Clase (Clase I, Clase II y Clase III), Usuario final (Compañías farmacéuticas, Compañías de dispositivos médicos, Compañías de biotecnología y otras) |
|
Países cubiertos |
EE. UU., Canadá y México en América del Norte, Alemania, Francia, Reino Unido, Países Bajos, Suiza, Bélgica, Rusia, Italia, España, Turquía, Resto de Europa en Europa, China, Japón, India, Corea del Sur, Singapur, Malasia, Australia, Tailandia, Indonesia, Filipinas, Resto de Asia-Pacífico (APAC) en Asia-Pacífico (APAC), Arabia Saudita, Emiratos Árabes Unidos, Sudáfrica, Egipto, Israel, Resto de Medio Oriente y África (MEA) como parte de Medio Oriente y África (MEA), Brasil, Argentina y Resto de América del Sur como parte de América del Sur. |
|
Actores del mercado cubiertos |
Freyr Solutions (India), PPD Inc. (EE. UU.), EMERGO (EE. UU.), ICON (Salud), Parexel International Corporation (EE. UU.), CRITERIUM, INC. (EE. UU.), Groupe ProductLife SA (Francia), Labcorp Drug Development (EE. UU.), WuXi AppTec (China), Genpact (EE. UU.), Medpace (EE. UU.), Dor Pharmaceutical Services (Israel), Qserve (Países Bajos), entre otros. |
|
Oportunidades de mercado |
|
Dinámica del mercado de subcontratación de asuntos regulatorios para diagnóstico in vitro (IVD)
Esta sección aborda la comprensión de los factores impulsores, las ventajas, las oportunidades, las limitaciones y los desafíos del mercado. Todo esto se analiza en detalle a continuación:
- Alto uso en la industria de la salud
El aumento en la implementación de servicios de externalización en el sector sanitario es uno de los principales factores que impulsan el crecimiento del mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD). El auge de las actividades de expansión geográfica, con el objetivo de obtener aprobaciones rápidas en los mercados locales, contribuye aún más a este crecimiento.
- Investigación y desarrollo
El aumento de las actividades de investigación y desarrollo que incrementan el volumen de solicitudes de ensayos clínicos y el registro de productos aceleran el crecimiento del mercado.
- Aprobaciones clínicas
Se observa un aumento en la demanda de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD), ya que las empresas se ven sometidas a una presión constante para obtener las aprobaciones clínicas oportunas de los organismos reguladores. La demanda de servicios de asuntos regulatorios está en aumento debido a estas medidas.
Oportunidades
Además, el desarrollo de biomarcadores y pruebas específicos de enfermedades , y la importancia de los diagnósticos complementarios amplían las oportunidades rentables para los actores del mercado en el período de pronóstico de 2022 a 2029. Asimismo, el aumento de las inversiones expandirá aún más el mercado.
Restricciones/Desafíos
Por otro lado, se prevé que los cambios en la normativa sobre dispositivos médicos y la externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) obstaculicen el crecimiento del mercado. Asimismo, se prevé que la falta de infraestructura en los servicios de salud suponga un reto para el mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) en el período de pronóstico 2022-2029.
Este informe de mercado sobre externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) proporciona detalles sobre los últimos desarrollos, regulaciones comerciales, análisis de importación y exportación, análisis de producción, optimización de la cadena de valor, cuota de mercado, impacto de los actores del mercado nacional y local, análisis de oportunidades en términos de nuevas fuentes de ingresos, cambios en la regulación del mercado, análisis estratégico del crecimiento del mercado, tamaño del mercado, crecimiento de la categoría, nichos de aplicación y dominio, aprobaciones y lanzamientos de productos, expansiones geográficas e innovaciones tecnológicas en el mercado. Para obtener más información sobre el mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD), contacte con Data Bridge Market Research para obtener un informe analítico. Nuestro equipo le ayudará a tomar decisiones informadas para impulsar el crecimiento del mercado.
Impacto de la COVID-19 en el mercado de pruebas diagnósticas
La COVID-19 tuvo un impacto negativo en el sector sanitario. Los principales actores clave adaptaron estrategias innovadoras a la rápida evolución de la situación durante el brote de COVID-19. Los países implementaron cambios cruciales en la atención sanitaria hasta que la crisis pasó a un segundo plano. Se prevé que las reformas sanitarias se caractericen por la contención de costes, un mayor acceso y avances tecnológicos en los próximos años. Se observó un aumento en la demanda de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) debido a la importancia del diagnóstico, la atención y la consulta a distancia. Estos servicios reducen la carga de trabajo de los hospitales en el escenario pospandémico.
Desarrollos recientes
- La revista tecnológica USA-9 incluyó a Freyr entre los "10 Mejores Proveedores de Soluciones Tecnológicas de 2021" en noviembre de 2021. USA-9.com, una revista tecnológica, incluyó a Freyr Solutions, proveedor líder mundial de soluciones y servicios regulatorios, entre los "10 Mejores Proveedores de Soluciones Tecnológicas de 2021", gracias a su continuo diseño de soluciones de software innovadoras y al apoyo a sus clientes en sus respectivos objetivos de cumplimiento normativo. Esto ha contribuido a aumentar la popularidad de la empresa.
Alcance y tamaño del mercado global de subcontratación de asuntos regulatorios para diagnóstico in vitro (IVD)
El mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) se segmenta según los servicios, la indicación, el modo de implementación, el tamaño de la organización, la etapa, la clase y el usuario final. El crecimiento de estos segmentos le permitirá analizar los segmentos con menor crecimiento en las industrias y brindar a los usuarios una valiosa visión general del mercado y perspectivas que les permitan tomar decisiones estratégicas para identificar las principales aplicaciones del mercado.
Servicios
- Redacción y presentaciones regulatorias
- Solicitudes de registro reglamentario y ensayos clínicos
- Consultoría Regulatoria
- Representación legal
- Servicios de gestión de datos
- Servicios de fabricación y control de productos químicos (CMC)
- Otros
Sobre la base de los servicios, el mercado global de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) se segmenta en redacción y presentaciones regulatorias, registro regulatorio y solicitudes de ensayos clínicos, consultoría regulatoria, representación legal, servicios de gestión de datos, servicios de fabricación y control de productos químicos (CMC) y otros.
Indicación
- Oncología
- Neurología
- Cardiología
- Química clínica e inmunoensayos
- Medicina de precisión
- Enfermedades infecciosas
- Diabetes
- Pruebas genéticas
- VIH/SIDA
- Hematología
- Pruebas de fármacos/farmacogenómica
- Transfusión de sangre
- Punto de atención
- Otros
Sobre la base de la indicación, el mercado global de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) está segmentado en oncología, neurología, cardiología, química clínica e inmunoensayos, medicina de precisión, enfermedades infecciosas, diabetes, pruebas genéticas, VIH/SIDA, hematología, pruebas de drogas/farmacogenómica, transfusión de sangre, punto de atención y otros.
Modo de implementación
- Nube
- En las instalaciones
Sobre la base del modo de implementación, el mercado global de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) se segmenta en nube y en instalaciones locales.
Tamaño de la organización
- Pequeñas y Medianas Empresas (PYMES)
- Grandes empresas
Sobre la base del tamaño de la organización, el mercado global de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) está segmentado en pequeñas y medianas empresas (PYMES) y grandes empresas.
Escenario
- Clínico
- Preclínico
- PMA (Autorización Post-comercialización)
Sobre la base de la etapa, el mercado global de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) se segmenta en clínico, preclínico y PMA (autorización posterior a la comercialización).
Clase
- Clase I
- Clase II
- Clase III
Sobre la base de la clase, el mercado global de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) se segmenta en clase I, clase II y clase III.
Usuario final
- Compañías farmacéuticas
- Empresas de dispositivos médicos
- Empresas de biotecnología
- Otros
Sobre la base del usuario final, el mercado global de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) está segmentado en compañías farmacéuticas, compañías de dispositivos médicos, compañías de biotecnología y otras.
Análisis regional del mercado de subcontratación de asuntos regulatorios para diagnóstico in vitro (IVD)
Se analiza el mercado de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) y se brindan información y tendencias del tamaño del mercado por país, servicios, indicación, modo de implementación, tamaño de la organización, etapa, clase y usuario final como se mencionó anteriormente.
Los países cubiertos en el informe del mercado de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) son EE. UU., Canadá y México en América del Norte, Alemania, Francia, Reino Unido, Países Bajos, Suiza, Bélgica, Rusia, Italia, España, Turquía, Resto de Europa en Europa, China, Japón, India, Corea del Sur, Singapur, Malasia, Australia, Tailandia, Indonesia, Filipinas, Resto de Asia-Pacífico (APAC) en Asia-Pacífico (APAC), Arabia Saudita, Emiratos Árabes Unidos, Sudáfrica, Egipto, Israel, Resto de Medio Oriente y África (MEA) como parte de Medio Oriente y África (MEA), Brasil, Argentina y Resto de América del Sur como parte de América del Sur.
Asia-Pacífico (APAC) domina el mercado de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) debido al aumento en la cantidad de ensayos clínicos y al creciente número de empresas dentro de la región.
Se espera que América del Norte sea testigo de un crecimiento significativo durante el período de pronóstico de 2022 a 2029 debido a la presencia de empresas clave de productos farmacéuticos y dispositivos médicos y al aumento del gasto en investigación y desarrollo en la región.
La sección de países del informe también presenta los factores que impactan en cada mercado y los cambios en la regulación nacional que impactan las tendencias actuales y futuras del mercado. Datos como el análisis de la cadena de valor aguas abajo y aguas arriba, las tendencias técnicas, el análisis de las cinco fuerzas de Porter y los estudios de caso son algunos de los indicadores utilizados para pronosticar el escenario del mercado en cada país. Asimismo, se consideran la presencia y disponibilidad de marcas globales y los desafíos que enfrentan debido a la alta o escasa competencia de marcas locales y nacionales, el impacto de los aranceles nacionales y las rutas comerciales, al proporcionar un análisis de pronóstico de los datos nacionales.
Crecimiento de la infraestructura de salud Base instalada y penetración de nuevas tecnologías
El mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) también ofrece un análisis detallado del mercado para cada país: el crecimiento del gasto sanitario en bienes de capital, la base instalada de diferentes tipos de productos para el mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD), el impacto de la tecnología mediante curvas de línea de vida y los cambios en los escenarios regulatorios de la salud, así como su impacto en dicho mercado. Los datos están disponibles para el período histórico 2010-2020.
Análisis del panorama competitivo y la cuota de mercado de la subcontratación de asuntos regulatorios para el diagnóstico in vitro (IVD)
El panorama competitivo del mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD) ofrece información detallada por competidor. Se incluye información general de la empresa, sus estados financieros, ingresos generados, potencial de mercado, inversión en investigación y desarrollo, nuevas iniciativas de mercado, presencia global, plantas de producción, capacidad de producción, fortalezas y debilidades de la empresa, lanzamiento de productos, alcance y variedad de productos, y dominio de las aplicaciones. Los datos anteriores se refieren únicamente al enfoque de las empresas en el mercado de externalización de asuntos regulatorios para el diagnóstico in vitro (IVD).
Algunos de los principales actores que operan en el mercado de subcontratación de asuntos regulatorios de diagnóstico in vitro (IVD) son:
- Soluciones Freyr (India)
- PPD Inc. (EE. UU.)
- EMERGO (EE. UU.)
- ICON (Atención sanitaria)
- Parexel International Corporation (EE. UU.)
- CRITERIUM, INC. (EE. UU.)
- Grupo ProductLife SA (Francia)
- Desarrollo de fármacos de Labcorp (EE. UU.)
- WuXi AppTec (China)
- Genpact (EE. UU.)
- Medpace (EE. UU.)
- Servicios farmacéuticos Dor (Israel)
- Qserve (Países Bajos)
SKU-
Obtenga acceso en línea al informe sobre la primera nube de inteligencia de mercado del mundo
- Panel de análisis de datos interactivo
- Panel de análisis de empresas para oportunidades con alto potencial de crecimiento
- Acceso de analista de investigación para personalización y consultas
- Análisis de la competencia con panel interactivo
- Últimas noticias, actualizaciones y análisis de tendencias
- Aproveche el poder del análisis de referencia para un seguimiento integral de la competencia
Tabla de contenido
1. INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2. MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 MULTIVARIATE MODELLING
2.2.4 TOP TO BOTTOM ANALYSIS
2.2.5 STANDARDS OF MEASUREMENT
2.2.6 VENDOR SHARE ANALYSIS
2.2.7 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.8 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3. MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4. PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTER’S FIVE FORCES MODEL
5. INDUSTRY INSIGHTS
5.1 MICRO AND MACRO ECONOMIC FACTORS
5.2 PENETRATION AND GROWTH PROSPECT MAPPING
5.3 KEY PRICING STRATEGIES
5.4 INTERVIEWS WITH SPECIALIST
5.5 ANALYIS AND RECOMMENDATION
6. INTELLECTUAL PROPERTY (IP) PORTFOLIO
6.1 PATENT QUALITY AND STRENGTH
6.2 PATENT FAMILIES
6.3 LICENSING AND COLLABORATIONS
6.4 COMPETITIVE LANDSCAPE
6.5 IP STRATEGY AND MANAGEMENT
6.6 OTHER
7. COST ANALYSIS BREAKDOWN
8. TECHNONLOGY ROADMAP
9. INNOVATION TRACKER AND STRATEGIC ANALYSIS
9.1 MAJOR DEALS AND STRATEGIC ALLIANCES ANALYSIS
9.1.1 JOINT VENTURES
9.1.2 MERGERS AND ACQUISITIONS
9.1.3 LICENSING AND PARTNERSHIP
9.1.4 TECHNOLOGY COLLABORATIONS
9.1.5 STRATEGIC DIVESTMENTS
9.2 NUMBER OF PRODUCTS IN DEVELOPMENT
9.3 STAGE OF DEVELOPMENT
9.4 TIMELINES AND MILESTONES
9.5 INNOVATION STRATEGIES AND METHODOLOGIES
9.6 RISK ASSESSMENT AND MITIGATION
9.7 FUTURE OUTLOOK
10. REGULATORY COMPLIANCE
10.1 REGULATORY AUTHORITIES
10.2 REGULATORY CLASSIFICATIONS
10.2.1 CLASS I
10.2.2 CLASS II
10.2.3 CLASS III
10.3 REGULATORY SUBMISSIONS
10.4 INTERNATIONAL HARMONIZATION
10.5 COMPLIANCE AND QUALITY MANAGEMENT SYSTEMS
10.6 REGULATORY CHALLENGES AND STRATEGIES
11. REIMBURSEMENT FRAMEWORK
12. OPPUTUNITY MAP ANALYSIS
13. INSTALLED BASE DATA
14. VALUE CHAIN ANALYSIS
15. HEALTHCARE ECONOMY
15.1 HEALTHCARE EXPENDITURE
15.2 CAPITAL EXPENDITURE
15.3 CAPEX TRENDS
15.4 CAPEX ALLOCATION
15.5 FUNDING SOURCES
15.6 INDUSTRY BENCHMARKS
15.7 GDP RATION IN OVERALL GDP
15.8 HEALTHCARE SYSTEM STRUCTURE
15.9 GOVERNMENT POLICIES
15.10 ECONOMIC DEVELOPMENT
16. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY SERVICE
16.1 OVERVIEW
16.2 REGULATORY WRITING & SUBMISSIONS
16.3 REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
16.4 REGULATORY CONSULTING
16.5 LEGAL REPRESENTATION
16.6 DATA MANAGEMENT SERVICES
16.7 CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
16.8 OTHERS
17. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY INDICATION
17.1 OVERVIEW
17.2 ONCOLOGY
17.3 NEUROLOGY
17.4 CARDIOLOGY
17.5 CLINICAL CHEMISTRY AND IMMUNOASSAYS
17.6 PRECISION MEDICINE
17.7 INFECTIOUS DISEASES
17.7.1 SEPSIS
17.7.2 VIROLOGY
17.7.3 BACTERIOLOGY
17.7.4 MICROBIOLOGY AND MYCOLOGY
17.7.5 HEPATITIS B
17.7.6 HEPATITIS C
17.7.7 SYPHILIS
17.7.8 TUBERCULOSIS
17.7.9 MALARIA
17.7.10 HUMAN PAPILLOMAVIRUS (HPV) INFECTION
17.7.11 OTHERS
17.8 DIABETES
17.9 GENETIC TESTING
17.10 HIV/AIDS
17.11 HAEMATOLOGY
17.12 DRUG TESTING/PHARMACOGENOMICS
17.13 BLOOD TRANSFUSION
17.14 OTHERS
18. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY STAGE
18.1 OVERVIEW
18.2 PRECLINICAL
18.3 CLINICAL
18.4 PMA (POST MARKET AUTHORIZATION)
19. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY CLASS
19.1 OVERVIEW
19.2 CLASS I
19.3 CLASS II
19.4 CLASS III
20. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY TYPE
20.1 OVERVIEW
20.2 POINT-OF-CARE (POC) IVD PRODUCT
20.3 LABORATORY-DEVELOPED TESTS (LDTS) IVD PRODUCT
20.4 COMPANION DIAGNOSTICS IVD PRODUCT
20.5 DIRECT-TO-CONSUMER (DTC) TESTING IVD PRODUCT
20.6 OTHERS IVD PRODUCT
21. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY DEPLOYMENT MODE
21.1 OVERVIEW
21.2 CLOUD
21.3 ON-PREMISES
22. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY ORGANIZARION SIZE
22.1 OVERVIEW
22.2 SMALL & MEDIUM ENTERPRISES (SMES)
22.3 LARGE ENTERPRISES
23. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY END USER
23.1 OVERVIEW
23.2 PHARMACEUTICAL COMPANIES
23.2.1 BY ORGANIZATION SIZE
23.2.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.2.1.2. LARGE ENTERPRISES
23.2.2 BY SERVICE
23.2.2.1. REGULATORY WRITING & SUBMISSIONS
23.2.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.2.2.3. REGULATORY CONSULTING
23.2.2.4. LEGAL REPRESENTATION
23.2.2.5. DATA MANAGEMENT SERVICES
23.2.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.2.2.7. OTHERS
23.3 MEDICAL DEVICE COMPANIES
23.3.1 BY ORGANIZATION SIZE
23.3.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.3.1.2. LARGE ENTERPRISES
23.3.2 BY SERVICE
23.3.2.1. REGULATORY WRITING & SUBMISSIONS
23.3.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.3.2.3. REGULATORY CONSULTING
23.3.2.4. LEGAL REPRESENTATION
23.3.2.5. DATA MANAGEMENT SERVICES
23.3.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.3.2.7. OTHERS
23.4 BIOTECHNOLOGY COMPANIES
23.4.1 BY ORGANIZATION SIZE
23.4.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.4.1.2. LARGE ENTERPRISES
23.4.2 BY SERVICE
23.4.2.1. REGULATORY WRITING & SUBMISSIONS
23.4.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.4.2.3. REGULATORY CONSULTING
23.4.2.4. LEGAL REPRESENTATION
23.4.2.5. DATA MANAGEMENT SERVICES
23.4.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.4.2.7. OTHERS
23.5 OTHERS
24. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY REGION
24.1 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
24.1.1 NORTH AMERICA
24.1.1.1. U.S.
24.1.1.2. CANADA
24.1.1.3. MEXICO
24.1.2 EUROPE
24.1.2.1. GERMANY
24.1.2.2. FRANCE
24.1.2.3. U.K.
24.1.2.4. ITALY
24.1.2.5. SPAIN
24.1.2.6. RUSSIA
24.1.2.7. TURKEY
24.1.2.8. BELGIUM
24.1.2.9. NETHERLANDS
24.1.2.10. SWITZERLAND
24.1.2.11. REST OF EUROPE
24.1.3 ASIA-PACIFIC
24.1.3.1. JAPAN
24.1.3.2. CHINA
24.1.3.3. SOUTH KOREA
24.1.3.4. INDIA
24.1.3.5. AUSTRALIA
24.1.3.6. SINGAPORE
24.1.3.7. THAILAND
24.1.3.8. MALAYSIA
24.1.3.9. INDONESIA
24.1.3.10. PHILIPPINES
24.1.3.11. REST OF ASIA-PACIFIC
24.1.4 SOUTH AMERICA
24.1.4.1. BRAZIL
24.1.4.2. ARGENTINA
24.1.4.3. REST OF SOUTH AMERICA
24.1.5 MIDDLE EAST AND AFRICA
24.1.5.1. SOUTH AFRICA
24.1.5.2. EGYPT
24.1.5.3. ISRAEL
24.1.5.4. UAE
24.1.5.5. SAUDI ARABIA
24.1.5.6. REST OF MIDDLE EAST AND AFRICA
24.1.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
25. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY LANDSCAPE
25.1 COMPANY SHARE ANALYSIS: GLOBAL
25.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
25.3 COMPANY SHARE ANALYSIS: EUROPE
25.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
25.5 MERGERS & ACQUISITIONS
25.6 NEW PRODUCT DEVELOPMENT & APPROVALS
25.7 EXPANSIONS
25.8 REGULATORY CHANGES
25.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
26. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY PROFILE
26.1 FREYR SOLUTIONS
26.1.1 COMPANY OVERVIEW
26.1.2 COMPANY SNAPSHOT
26.1.3 REVENUE ANALYSIS
26.1.4 PRODUCT PORTFOLIO
26.1.5 RECENT DEVELOPMENTS
26.2 AXSOURCE CONSULTING INC.
26.2.1 COMPANY OVERVIEW
26.2.2 COMPANY SNAPSHOT
26.2.3 REVENUE ANALYSIS
26.2.4 PRODUCT PORTFOLIO
26.2.5 RECENT DEVELOPMENTS
26.3 LORENZ LIFE SCIENCES GROUP
26.3.1 COMPANY OVERVIEW
26.3.2 COMPANY SNAPSHOT
26.3.3 REVENUE ANALYSIS
26.3.4 PRODUCT PORTFOLIO
26.3.5 RECENT DEVELOPMENTS
26.4 LABORATORY CORPORATION OF AMERICA HOLDINGS
26.4.1 COMPANY OVERVIEW
26.4.2 COMPANY SNAPSHOT
26.4.3 REVENUE ANALYSIS
26.4.4 PRODUCT PORTFOLIO
26.4.5 RECENT DEVELOPMENTS
26.5 REG IQ PTY LTD.
26.5.1 COMPANY OVERVIEW
26.5.2 COMPANY SNAPSHOT
26.5.3 REVENUE ANALYSIS
26.5.4 PRODUCT PORTFOLIO
26.5.5 RECENT DEVELOPMENTS
26.6 PROMEDICA INTERNATIONAL, A CALIFORNIA CORPORATION (IUVO BIOSCIENCES)
26.6.1 COMPANY OVERVIEW
26.6.2 COMPANY SNAPSHOT
26.6.3 REVENUE ANALYSIS
26.6.4 PRODUCT PORTFOLIO
26.6.5 RECENT DEVELOPMENTS
26.7 MAKROCARE
26.7.1 COMPANY OVERVIEW
26.7.2 COMPANY SNAPSHOT
26.7.3 REVENUE ANALYSIS
26.7.4 PRODUCT PORTFOLIO
26.7.5 RECENT DEVELOPMENTS
26.8 EMERGO BY UL
26.8.1 COMPANY OVERVIEW
26.8.2 COMPANY SNAPSHOT
26.8.3 REVENUE ANALYSIS
26.8.4 PRODUCT PORTFOLIO
26.8.5 RECENT DEVELOPMENTS
26.9 ICON PLC
26.9.1 COMPANY OVERVIEW
26.9.2 COMPANY SNAPSHOT
26.9.3 REVENUE ANALYSIS
26.9.4 PRODUCT PORTFOLIO
26.9.5 RECENT DEVELOPMENTS
26.10 WUXI APPTEC
26.10.1 COMPANY OVERVIEW
26.10.2 COMPANY SNAPSHOT
26.10.3 REVENUE ANALYSIS
26.10.4 PRODUCT PORTFOLIO
26.10.5 RECENT DEVELOPMENTS
26.11 THERMO FISHER SCIENTIFIC INC.
26.11.1 COMPANY OVERVIEW
26.11.2 COMPANY SNAPSHOT
26.11.3 REVENUE ANALYSIS
26.11.4 PRODUCT PORTFOLIO
26.11.5 RECENT DEVELOPMENTS
26.12 CHARLES RIVER LABORATORIES.
26.12.1 COMPANY OVERVIEW
26.12.2 COMPANY SNAPSHOT
26.12.3 REVENUE ANALYSIS
26.12.4 PRODUCT PORTFOLIO
26.12.5 RECENT DEVELOPMENTS
26.13 ACCELL CLINICAL RESEARCH, LLC
26.13.1 COMPANY OVERVIEW
26.13.2 COMPANY SNAPSHOT
26.13.3 REVENUE ANALYSIS
26.13.4 PRODUCT PORTFOLIO
26.13.5 RECENT DEVELOPMENTS
26.14 PAREXEL INTERNATIONAL (MA) CORPORATION
26.14.1 COMPANY OVERVIEW
26.14.2 COMPANY SNAPSHOT
26.14.3 REVENUE ANALYSIS
26.14.4 PRODUCT PORTFOLIO
26.14.5 RECENT DEVELOPMENTS
26.15 METECON GMBH
26.15.1 COMPANY OVERVIEW
26.15.2 COMPANY SNAPSHOT
26.15.3 REVENUE ANALYSIS
26.15.4 PRODUCT PORTFOLIO
26.15.5 RECENT DEVELOPMENTS
26.16 GENPACT
26.16.1 COMPANY OVERVIEW
26.16.2 COMPANY SNAPSHOT
26.16.3 REVENUE ANALYSIS
26.16.4 PRODUCT PORTFOLIO
26.16.5 RECENT DEVELOPMENTS
26.17 CRITERIUM, INC
26.17.1 COMPANY OVERVIEW
26.17.2 COMPANY SNAPSHOT
26.17.3 REVENUE ANALYSIS
26.17.4 PRODUCT PORTFOLIO
26.17.5 RECENT DEVELOPMENTS
26.18 MEDPACE
26.18.1 COMPANY OVERVIEW
26.18.2 COMPANY SNAPSHOT
26.18.3 REVENUE ANALYSIS
26.18.4 PRODUCT PORTFOLIO
26.18.5 RECENT DEVELOPMENTS
26.19 GROUPE PRODUCTLIFE S.A.
26.19.1 COMPANY OVERVIEW
26.19.2 COMPANY SNAPSHOT
26.19.3 REVENUE ANALYSIS
26.19.4 PRODUCT PORTFOLIO
26.19.5 RECENT DEVELOPMENTS
26.20 DOR PHARMACEUTICAL SERVICES
26.20.1 COMPANY OVERVIEW
26.20.2 COMPANY SNAPSHOT
26.20.3 REVENUE ANALYSIS
26.20.4 PRODUCT PORTFOLIO
26.20.5 RECENT DEVELOPMENTS
26.21 QSERVE
26.21.1 COMPANY OVERVIEW
26.21.2 COMPANY SNAPSHOT
26.21.3 REVENUE ANALYSIS
26.21.4 PRODUCT PORTFOLIO
26.21.5 RECENT DEVELOPMENTS
26.22 ORTHO CLINICAL DIAGNOSTICS.
26.22.1 COMPANY OVERVIEW
26.22.2 COMPANY SNAPSHOT
26.22.3 REVENUE ANALYSIS
26.22.4 PRODUCT PORTFOLIO
26.22.5 RECENT DEVELOPMENTS
26.23 ANGSTROM BIOTECH PVT. LTD.
26.23.1 COMPANY OVERVIEW
26.23.2 COMPANY SNAPSHOT
26.23.3 REVENUE ANALYSIS
26.23.4 PRODUCT PORTFOLIO
26.23.5 RECENT DEVELOPMENTS
26.24 RQM+
26.24.1 COMPANY OVERVIEW
26.24.2 COMPANY SNAPSHOT
26.24.3 REVENUE ANALYSIS
26.24.4 PRODUCT PORTFOLIO
26.24.5 RECENT DEVELOPMENTS
26.25 REGULATORY COMPLIANCES ASSOCIATES (SOTERA HEALTH)
26.25.1 COMPANY OVERVIEW
26.25.2 COMPANY SNAPSHOT
26.25.3 REVENUE ANALYSIS
26.25.4 PRODUCT PORTFOLIO
26.25.5 RECENT DEVELOPMENTS
26.26 RESEARCHDX
26.26.1 COMPANY OVERVIEW
26.26.2 COMPANY SNAPSHOT
26.26.3 REVENUE ANALYSIS
26.26.4 PRODUCT PORTFOLIO
26.26.5 RECENT DEVELOPMENTS
26.27 CMIC HOLDINGS CO., LTD.
26.27.1 COMPANY OVERVIEW
26.27.2 COMPANY SNAPSHOT
26.27.3 REVENUE ANALYSIS
26.27.4 PRODUCT PORTFOLIO
26.27.5 RECENT DEVELOPMENTS
26.28 NORTH AMERICAN SCIENCE ASSOCIATES, LLC
26.28.1 COMPANY OVERVIEW
26.28.2 COMPANY SNAPSHOT
26.28.3 REVENUE ANALYSIS
26.28.4 PRODUCT PORTFOLIO
26.28.5 RECENT DEVELOPMENTS
26.29 QARAD BV
26.29.1 COMPANY OVERVIEW
26.29.2 COMPANY SNAPSHOT
26.29.3 REVENUE ANALYSIS
26.29.4 PRODUCT PORTFOLIO
26.29.5 RECENT DEVELOPMENTS
26.30 TRANSCRIP
26.30.1 COMPANY OVERVIEW
26.30.2 COMPANY SNAPSHOT
26.30.3 REVENUE ANALYSIS
26.30.4 PRODUCT PORTFOLIO
26.30.5 RECENT DEVELOPMENTS
26.31 CLIN-R+
26.31.1 COMPANY OVERVIEW
26.31.2 COMPANY SNAPSHOT
26.31.3 REVENUE ANALYSIS
26.31.4 PRODUCT PORTFOLIO
26.31.5 RECENT DEVELOPMENTS
26.32 VCLS
26.32.1 COMPANY OVERVIEW
26.32.2 COMPANY SNAPSHOT
26.32.3 REVENUE ANALYSIS
26.32.4 PRODUCT PORTFOLIO
26.32.5 RECENT DEVELOPMENTS
26.33 PROPHARMA GROUP
26.33.1 COMPANY OVERVIEW
26.33.2 COMPANY SNAPSHOT
26.33.3 REVENUE ANALYSIS
26.33.4 PRODUCT PORTFOLIO
26.33.5 RECENT DEVELOPMENTS
26.34 ARRIELLO IRELAND LIMITED
26.34.1 COMPANY OVERVIEW
26.34.2 COMPANY SNAPSHOT
26.34.3 REVENUE ANALYSIS
26.34.4 PRODUCT PORTFOLIO
26.34.5 RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
27. RELATED REPORTS
28. QUESTIONNAIRE
29. ABOUT DATA BRIDGE MARKET RESEARCH
Metodología de investigación
La recopilación de datos y el análisis del año base se realizan utilizando módulos de recopilación de datos con muestras de gran tamaño. La etapa incluye la obtención de información de mercado o datos relacionados a través de varias fuentes y estrategias. Incluye el examen y la planificación de todos los datos adquiridos del pasado con antelación. Asimismo, abarca el examen de las inconsistencias de información observadas en diferentes fuentes de información. Los datos de mercado se analizan y estiman utilizando modelos estadísticos y coherentes de mercado. Además, el análisis de la participación de mercado y el análisis de tendencias clave son los principales factores de éxito en el informe de mercado. Para obtener más información, solicite una llamada de un analista o envíe su consulta.
La metodología de investigación clave utilizada por el equipo de investigación de DBMR es la triangulación de datos, que implica la extracción de datos, el análisis del impacto de las variables de datos en el mercado y la validación primaria (experto en la industria). Los modelos de datos incluyen cuadrícula de posicionamiento de proveedores, análisis de línea de tiempo de mercado, descripción general y guía del mercado, cuadrícula de posicionamiento de la empresa, análisis de patentes, análisis de precios, análisis de participación de mercado de la empresa, estándares de medición, análisis global versus regional y de participación de proveedores. Para obtener más información sobre la metodología de investigación, envíe una consulta para hablar con nuestros expertos de la industria.
Personalización disponible
Data Bridge Market Research es líder en investigación formativa avanzada. Nos enorgullecemos de brindar servicios a nuestros clientes existentes y nuevos con datos y análisis que coinciden y se adaptan a sus objetivos. El informe se puede personalizar para incluir análisis de tendencias de precios de marcas objetivo, comprensión del mercado de países adicionales (solicite la lista de países), datos de resultados de ensayos clínicos, revisión de literatura, análisis de mercado renovado y base de productos. El análisis de mercado de competidores objetivo se puede analizar desde análisis basados en tecnología hasta estrategias de cartera de mercado. Podemos agregar tantos competidores sobre los que necesite datos en el formato y estilo de datos que esté buscando. Nuestro equipo de analistas también puede proporcionarle datos en archivos de Excel sin procesar, tablas dinámicas (libro de datos) o puede ayudarlo a crear presentaciones a partir de los conjuntos de datos disponibles en el informe.