Global In Vitro Diagnostic Ivd Regulatory Affairs Outsourcing Market
Размер рынка в млрд долларов США
CAGR :
% 
 USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
USD
674,277.97 Thousand
USD
1,830,957.45 Thousand
2021
2029
| 2022 –2029 | |
| USD 674,277.97 Thousand | |
| USD 1,830,957.45 Thousand | |
|
|
|
|
Глобальный рынок аутсорсинга нормативно-правовых вопросов диагностики in vitro (IVD), по услугам (нормативное написание и подача документов, нормативная регистрация и заявки на клинические испытания, нормативный консалтинг, юридическое представительство, услуги по управлению данными, услуги по производству и контролю химии (CMC) и другие), показания (онкология, неврология, кардиология, клиническая химия и иммуноанализы, прецизионная медицина, инфекционные заболевания, диабет, генетическое тестирование, ВИЧ/СПИД, гематология, тестирование на наркотики/фармакогеномика, переливание крови, точка оказания медицинской помощи и другие), режим развертывания (облачный и локальный), размер организации (малые и средние предприятия (SMES) и крупные предприятия), стадия (клиническая, доклиническая и PMA (пострегистрационная авторизация)), класс (класс I, класс II и класс III), конечный пользователь (фармацевтические компании, компании по производству медицинских приборов, биотехнологические компании и Другие) – Тенденции отрасли и прогноз до 2029 г.
Анализ и размер рынка
Компании здравоохранения столкнулись с трудностями в соблюдении нормативных стандартов, особенно из-за пандемии COVID-19 (коронавируса). Чтобы обеспечить культуру, ориентированную на качество, для компаний в сфере медицинских технологий консалтинговые фирмы используют программное обеспечение для систем управления качеством (QMS). Компании, занимающиеся аутсорсингом регуляторных вопросов диагностики in vitro (IVD), оказывают организациям здравоохранения поддержку на основе проектов.
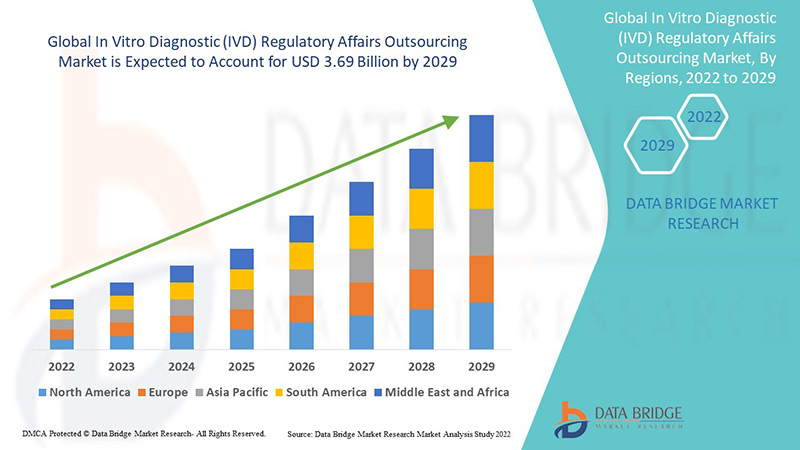
Развертывание аутсорсинга приводит к заключению долгосрочных соглашений об аутсорсинге. Глобальный рынок аутсорсинга нормативно-правовых вопросов диагностики in vitro (IVD) оценивался в 1,6 млрд долларов США в 2021 году и, как ожидается, достигнет 3,69 млрд долларов США к 2029 году, зарегистрировав среднегодовой темп роста в 11% в прогнозируемый период 2022-2029 годов. Ожидается, что фармацевтические компании будут свидетелями высокого роста в связи с увеличением числа клинических одобрений.
Определение рынка
Нормативные вопросы играют крайне важную роль в отрасли диагностических устройств для ЭКО (IVD). Эти вопросы касаются жизненного цикла различных медицинских продуктов и предлагают стратегическую, тактическую и операционную поддержку и направление для производственных компаний для работы в рамках нормативной базы.
Область отчета и сегментация рынка
|
Отчет Метрика |
Подробности |
|
Прогнозируемый период |
2022-2029 |
|
Базовый год |
2021 |
|
Исторические годы |
2020 (Можно настроить на 2019 - 2014) |
|
Количественные единицы |
Доход в млн. долл. США, объемы в единицах, цены в долл. США |
|
Охваченные сегменты |
Услуга (написание и подача нормативных документов, нормативная регистрация и заявки на клинические испытания, нормативный консалтинг, юридическое представительство, услуги по управлению данными, услуги по производству и контролю химии (CMC) и другие), Показания (онкология, неврология, кардиология, клиническая химия и иммуноанализы, прецизионная медицина, инфекционные заболевания, диабет, генетическое тестирование, ВИЧ/СПИД, гематология, тестирование лекарств/фармакогеномика, переливание крови, точка оказания медицинской помощи и другие), Режим развертывания (облачный и локальный), Размер организации (малые и средние предприятия (SMES) и крупные предприятия), Стадия (клиническая, доклиническая и PMA (пострегистрационная авторизация)), Класс (класс I, класс II и класс III), Конечный пользователь (фармацевтические компании, компании по производству медицинских приборов, биотехнологические компании и другие) |
|
Страны, охваченные |
США, Канада и Мексика в Северной Америке, Германия, Франция, Великобритания, Нидерланды, Швейцария, Бельгия, Россия, Италия, Испания, Турция, Остальная Европа в Европе, Китай, Япония, Индия, Южная Корея, Сингапур, Малайзия, Австралия, Таиланд, Индонезия, Филиппины, Остальная часть Азиатско-Тихоокеанского региона (APAC) в Азиатско-Тихоокеанском регионе (APAC), Саудовская Аравия, ОАЭ, Южная Африка, Египет, Израиль, Остальной Ближний Восток и Африка (MEA) как часть Ближнего Востока и Африки (MEA), Бразилия, Аргентина и Остальная часть Южной Америки как часть Южной Америки. |
|
Охваченные участники рынка |
Freyr Solutions (Индия), PPD Inc. (США), EMERGO (США), ICON (здравоохранение), Parexel International Corporation (США), CRITERIUM, INC. (США), Groupe ProductLife SA (Франция), Labcorp Drug Development (США), WuXi AppTec (Китай), Genpact (США), Medpace (США), Dor Pharmaceutical Services (Израиль), Qserve (Нидерланды) и другие |
|
Возможности рынка |
|
Динамика рынка аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD)
В этом разделе рассматривается понимание движущих сил рынка, преимуществ, возможностей, ограничений и проблем. Все это подробно обсуждается ниже:
- Широкое применение в сфере здравоохранения
Рост использования аутсорсинговых услуг в секторе здравоохранения является одним из основных факторов, способствующих росту рынка аутсорсинга регуляторных вопросов диагностики in vitro (IVD). Рост активности по географическому расширению, направленной на быстрые одобрения на местных рынках, еще больше способствует росту.
- Исследования и разработки
Рост научно-исследовательской деятельности, увеличение объема заявок на клинические испытания и регистрацию продуктов ускоряют рост рынка.
- Клинические одобрения
Наблюдается рост спроса на аутсорсинг регуляторных вопросов in vitro диагностики (IVD), поскольку компании находятся под постоянным давлением, требующим своевременных клинических одобрений от регулирующих органов. Спрос на услуги регуляторных вопросов растет из-за таких действий.
Возможности
Кроме того, разработка биомаркеров и тестов, специфичных для заболеваний, а также значимость сопутствующей диагностики расширяют прибыльные возможности для участников рынка в прогнозируемый период с 2022 по 2029 год. Кроме того, резкий рост инвестиций будет способствовать дальнейшему расширению рынка.
Ограничения/Проблемы
С другой стороны, ожидается, что изменяющиеся правила, касающиеся медицинских приборов и аутсорсинга вопросов регулирования диагностики in vitro (IVD), будут препятствовать росту рынка. Кроме того, ожидается, что отсутствие инфраструктуры в сфере услуг здравоохранения осложнит рынок аутсорсинга вопросов регулирования диагностики in vitro (IVD) в прогнозируемый период 2022-2029 гг.
В этом отчете по аутсорсингу рынка регуляторных вопросов диагностики in vitro (IVD) содержатся сведения о последних новых разработках, правилах торговли, анализе импорта-экспорта, анализе производства, оптимизации цепочки создания стоимости, доле рынка, влиянии внутренних и локальных игроков рынка, анализируются возможности с точки зрения новых источников дохода, изменений в правилах рынка, анализ стратегического роста рынка, размер рынка, рост рынка категорий, ниши приложений и доминирование, одобрение продуктов, запуск продуктов, географическое расширение, технологические инновации на рынке. Чтобы получить больше информации о рынке аутсорсинга регуляторных вопросов диагностики in vitro (IVD), свяжитесь с Data Bridge Market Research для получения аналитического обзора, наша команда поможет вам принять обоснованное рыночное решение для достижения роста рынка.
Влияние COVID-19 на рынок диагностических тестов
COVID-19 оказал негативное влияние на сектор здравоохранения. Основные ключевые игроки адаптировали инновационные стратегии к быстро меняющейся ситуации во время вспышки COVID-19. Страны принимали критические изменения в здравоохранении, пока кризис не отошел на второй план. Ожидается, что реформы здравоохранения станут свидетелями сдерживания расходов, расширения доступа и технологического прогресса в ближайшие годы. Рост спроса на аутсорсинг регуляторных вопросов диагностики in vitro (IVD) был отмечен из-за акцента на важности удаленной диагностики, ухода и консультаций. Эти услуги снижают нагрузку на больницы в постпандемическом сценарии.
Последние события
- Журнал USA-9 Technology Magazine включил Freyr в список «10 лучших поставщиков технологических решений 2021 года» в ноябре 2021 года. USA-9.com — это технологический журнал, который включил Freyr Solutions, ведущего мирового поставщика решений и услуг в области регулирования, в список «10 лучших поставщиков технологических решений 2021 года», поскольку Fryer продолжает разрабатывать инновационные программные решения и оказывать поддержку клиентам в достижении их соответствующих целей по обеспечению соответствия. Это помогло компании повысить свою популярность.
Масштаб и размер мирового рынка аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD)
Рынок аутсорсинга регуляторных вопросов диагностики in vitro (IVD) сегментирован на основе услуг, показаний, способа развертывания, размера организации, стадии, класса и конечного пользователя. Рост среди этих сегментов поможет вам проанализировать сегменты с незначительным ростом в отраслях и предоставить пользователям ценный обзор рынка и рыночные идеи, которые помогут им принимать стратегические решения для определения основных рыночных приложений.
Услуги
- Нормативные документы и документы
- Регуляторная регистрация и заявки на клинические испытания
- Нормативный консалтинг
- Юридическое представительство
- Услуги по управлению данными
- Услуги по производству и контролю химии (CMC)
- Другие
На основе услуг глобальный рынок аутсорсинга нормативно-правовых вопросов диагностики in vitro (IVD) сегментируется на написание и подачу нормативных документов, нормативную регистрацию и заявки на клинические испытания, нормативный консалтинг, юридическое представительство, услуги по управлению данными, услуги по химическому производству и контролю (CMC) и другие.
Индикация
- Онкология
- Неврология
- Кардиология
- Клиническая химия и иммуноферментный анализ
- Точная медицина
- Инфекционные заболевания
- Диабет
- Генетическое Тестирование
- ВИЧ/СПИД
- Гематология
- Тестирование лекарств/Фармакогеномика
- Переливание крови
- Точка ухода
- Другие
На основе показаний глобальный рынок аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD) сегментирован на онкологию, неврологию, кардиологию, клиническую химию и иммуноанализы, прецизионную медицину, инфекционные заболевания, диабет, генетическое тестирование, ВИЧ/СПИД, гематологию, тестирование на наркотики/фармакогеномику, переливание крови, оказание медицинской помощи на месте и другие.
Режим развертывания
- Облако
- Локально
По способу развертывания глобальный рынок аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD) сегментируется на облачный и локальный.
Размер организации
- Малые и средние предприятия (МСП)
- Крупные предприятия
В зависимости от размера организации глобальный рынок аутсорсинга нормативно-правовых вопросов диагностики in vitro (IVD) сегментируется на малые и средние предприятия (МСП) и крупные предприятия.
Этап
- Клинический
- Доклинические
- PMA (Пострегистрационное разрешение)
В зависимости от стадии глобальный рынок аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD) сегментируется на клинический, доклинический и PMA (пострегистрационный).
Сорт
- Класс I
- Класс II
- Класс III
На основе класса глобальный рынок аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD) сегментируется на класс I, класс II и класс III.
Конечный пользователь
- Фармацевтические компании
- Компании по производству медицинского оборудования
- Биотехнологические компании
- Другие
В зависимости от конечного пользователя глобальный рынок аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD) сегментируется на фармацевтические компании, компании по производству медицинских приборов, биотехнологические компании и другие.
Региональный анализ/информация о рынке аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD)
Проанализирован рынок аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD), а также предоставлены сведения о размерах рынка и тенденциях по странам, услугам, показаниям, режиму развертывания, размеру организации, стадии, классу и конечному пользователю, как указано выше.
Страны, охваченные отчетом о рынке аутсорсинга нормативно-правового регулирования диагностики in vitro (IVD): США, Канада и Мексика в Северной Америке, Германия, Франция, Великобритания, Нидерланды, Швейцария, Бельгия, Россия, Италия, Испания, Турция, остальные страны Европы в Европе, Китай, Япония, Индия, Южная Корея, Сингапур, Малайзия, Австралия, Таиланд, Индонезия, Филиппины, остальные страны Азиатско-Тихоокеанского региона (APAC) в Азиатско-Тихоокеанском регионе (APAC), Саудовская Аравия, ОАЭ, Южная Африка, Египет, Израиль, остальные страны Ближнего Востока и Африки (MEA) как часть Ближнего Востока и Африки (MEA), Бразилия, Аргентина и остальные страны Южной Америки как часть Южной Америки.
Азиатско-Тихоокеанский регион (APAC) доминирует на рынке аутсорсинга нормативно-правовых вопросов в области диагностики in vitro (IVD) из-за роста числа клинических испытаний и увеличения числа компаний в регионе.
Ожидается, что в прогнозируемый период с 2022 по 2029 год в Северной Америке будет наблюдаться значительный рост за счет присутствия ключевых компаний по производству фармацевтических препаратов и медицинских приборов, а также увеличения расходов на исследования и разработки в регионе.
Раздел отчета по странам также содержит отдельные факторы, влияющие на рынок, и изменения в регулировании на внутреннем рынке, которые влияют на текущие и будущие тенденции рынка. Такие данные, как анализ цепочки создания стоимости вверх и вниз по течению, технические тенденции и анализ пяти сил Портера, тематические исследования, являются некоторыми из указателей, используемых для прогнозирования рыночного сценария для отдельных стран. Кроме того, при предоставлении прогнозного анализа данных по странам учитываются наличие и доступность глобальных брендов и их проблемы, связанные с большой или малой конкуренцией со стороны местных и внутренних брендов, влияние внутренних тарифов и торговых путей.
Рост инфраструктуры здравоохранения Установленная база и проникновение новых технологий
Рынок аутсорсинга регуляторных вопросов диагностики in vitro (IVD) также предоставляет вам подробный анализ рынка для каждой страны по росту расходов на здравоохранение на капитальное оборудование, установленной базы различных видов продукции для рынка аутсорсинга регуляторных вопросов диагностики in vitro (IVD), влияния технологий с использованием кривых жизненной линии и изменений в сценариях регулирования здравоохранения и их влияния на рынок аутсорсинга регуляторных вопросов диагностики in vitro (IVD). Данные доступны за исторический период 2010-2020 гг.
Анализ доли рынка аутсорсинга в сфере аутсорсинга в сфере диагностики in vitro (IVD) и конкурентной среды
Конкурентная среда рынка аутсорсинга регуляторных вопросов диагностики in vitro (IVD) содержит сведения по конкурентам. Включены сведения о компании, ее финансах, полученном доходе, рыночном потенциале, инвестициях в исследования и разработки, новых рыночных инициативах, глобальном присутствии, производственных площадках и объектах, производственных мощностях, сильных и слабых сторонах компании, запуске продукта, широте и широте продукта, доминировании приложений. Приведенные выше данные касаются только фокуса компаний, связанного с рынком аутсорсинга регуляторных вопросов диагностики in vitro (IVD).
Некоторые из основных игроков, работающих на рынке аутсорсинга нормативно-правовых вопросов в области диагностики in vitro (IVD):
- Freyr Solutions (Индия)
- PPD Inc. (США)
- ЭМЕРГО (США)
- ЗНАЧОК (Здравоохранение)
- Parexel International Corporation (США)
- CRITERIUM, INC. (США)
- Groupe ProductLife SA (Франция)
- Labcorp Drug Development (США)
- WuXi AppTec (Китай)
- Генпакт (США)
- Медпейс (США)
- Dor Pharmaceutical Services (Израиль)
- Qserve (Нидерланды)
SKU-
Get online access to the report on the World's First Market Intelligence Cloud
- Интерактивная панель анализа данных
- Панель анализа компании для возможностей с высоким потенциалом роста
- Доступ аналитика-исследователя для настройки и запросов
- Анализ конкурентов с помощью интерактивной панели
- Последние новости, обновления и анализ тенденций
- Используйте возможности сравнительного анализа для комплексного отслеживания конкурентов
Содержание
1. INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET
1.4 CURRENCY AND PRICING
1.5 LIMITATION
1.6 MARKETS COVERED
2. MARKET SEGMENTATION
2.1 KEY TAKEAWAYS
2.2 ARRIVING AT THE GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET SIZE
2.2.1 VENDOR POSITIONING GRID
2.2.2 TECHNOLOGY LIFE LINE CURVE
2.2.3 MULTIVARIATE MODELLING
2.2.4 TOP TO BOTTOM ANALYSIS
2.2.5 STANDARDS OF MEASUREMENT
2.2.6 VENDOR SHARE ANALYSIS
2.2.7 DATA POINTS FROM KEY PRIMARY INTERVIEWS
2.2.8 DATA POINTS FROM KEY SECONDARY DATABASES
2.3 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET: RESEARCH SNAPSHOT
2.4 ASSUMPTIONS
3. MARKET OVERVIEW
3.1 DRIVERS
3.2 RESTRAINTS
3.3 OPPORTUNITIES
3.4 CHALLENGES
4. PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTER’S FIVE FORCES MODEL
5. INDUSTRY INSIGHTS
5.1 MICRO AND MACRO ECONOMIC FACTORS
5.2 PENETRATION AND GROWTH PROSPECT MAPPING
5.3 KEY PRICING STRATEGIES
5.4 INTERVIEWS WITH SPECIALIST
5.5 ANALYIS AND RECOMMENDATION
6. INTELLECTUAL PROPERTY (IP) PORTFOLIO
6.1 PATENT QUALITY AND STRENGTH
6.2 PATENT FAMILIES
6.3 LICENSING AND COLLABORATIONS
6.4 COMPETITIVE LANDSCAPE
6.5 IP STRATEGY AND MANAGEMENT
6.6 OTHER
7. COST ANALYSIS BREAKDOWN
8. TECHNONLOGY ROADMAP
9. INNOVATION TRACKER AND STRATEGIC ANALYSIS
9.1 MAJOR DEALS AND STRATEGIC ALLIANCES ANALYSIS
9.1.1 JOINT VENTURES
9.1.2 MERGERS AND ACQUISITIONS
9.1.3 LICENSING AND PARTNERSHIP
9.1.4 TECHNOLOGY COLLABORATIONS
9.1.5 STRATEGIC DIVESTMENTS
9.2 NUMBER OF PRODUCTS IN DEVELOPMENT
9.3 STAGE OF DEVELOPMENT
9.4 TIMELINES AND MILESTONES
9.5 INNOVATION STRATEGIES AND METHODOLOGIES
9.6 RISK ASSESSMENT AND MITIGATION
9.7 FUTURE OUTLOOK
10. REGULATORY COMPLIANCE
10.1 REGULATORY AUTHORITIES
10.2 REGULATORY CLASSIFICATIONS
10.2.1 CLASS I
10.2.2 CLASS II
10.2.3 CLASS III
10.3 REGULATORY SUBMISSIONS
10.4 INTERNATIONAL HARMONIZATION
10.5 COMPLIANCE AND QUALITY MANAGEMENT SYSTEMS
10.6 REGULATORY CHALLENGES AND STRATEGIES
11. REIMBURSEMENT FRAMEWORK
12. OPPUTUNITY MAP ANALYSIS
13. INSTALLED BASE DATA
14. VALUE CHAIN ANALYSIS
15. HEALTHCARE ECONOMY
15.1 HEALTHCARE EXPENDITURE
15.2 CAPITAL EXPENDITURE
15.3 CAPEX TRENDS
15.4 CAPEX ALLOCATION
15.5 FUNDING SOURCES
15.6 INDUSTRY BENCHMARKS
15.7 GDP RATION IN OVERALL GDP
15.8 HEALTHCARE SYSTEM STRUCTURE
15.9 GOVERNMENT POLICIES
15.10 ECONOMIC DEVELOPMENT
16. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY SERVICE
16.1 OVERVIEW
16.2 REGULATORY WRITING & SUBMISSIONS
16.3 REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
16.4 REGULATORY CONSULTING
16.5 LEGAL REPRESENTATION
16.6 DATA MANAGEMENT SERVICES
16.7 CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
16.8 OTHERS
17. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY INDICATION
17.1 OVERVIEW
17.2 ONCOLOGY
17.3 NEUROLOGY
17.4 CARDIOLOGY
17.5 CLINICAL CHEMISTRY AND IMMUNOASSAYS
17.6 PRECISION MEDICINE
17.7 INFECTIOUS DISEASES
17.7.1 SEPSIS
17.7.2 VIROLOGY
17.7.3 BACTERIOLOGY
17.7.4 MICROBIOLOGY AND MYCOLOGY
17.7.5 HEPATITIS B
17.7.6 HEPATITIS C
17.7.7 SYPHILIS
17.7.8 TUBERCULOSIS
17.7.9 MALARIA
17.7.10 HUMAN PAPILLOMAVIRUS (HPV) INFECTION
17.7.11 OTHERS
17.8 DIABETES
17.9 GENETIC TESTING
17.10 HIV/AIDS
17.11 HAEMATOLOGY
17.12 DRUG TESTING/PHARMACOGENOMICS
17.13 BLOOD TRANSFUSION
17.14 OTHERS
18. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY STAGE
18.1 OVERVIEW
18.2 PRECLINICAL
18.3 CLINICAL
18.4 PMA (POST MARKET AUTHORIZATION)
19. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY CLASS
19.1 OVERVIEW
19.2 CLASS I
19.3 CLASS II
19.4 CLASS III
20. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY TYPE
20.1 OVERVIEW
20.2 POINT-OF-CARE (POC) IVD PRODUCT
20.3 LABORATORY-DEVELOPED TESTS (LDTS) IVD PRODUCT
20.4 COMPANION DIAGNOSTICS IVD PRODUCT
20.5 DIRECT-TO-CONSUMER (DTC) TESTING IVD PRODUCT
20.6 OTHERS IVD PRODUCT
21. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY DEPLOYMENT MODE
21.1 OVERVIEW
21.2 CLOUD
21.3 ON-PREMISES
22. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY ORGANIZARION SIZE
22.1 OVERVIEW
22.2 SMALL & MEDIUM ENTERPRISES (SMES)
22.3 LARGE ENTERPRISES
23. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY END USER
23.1 OVERVIEW
23.2 PHARMACEUTICAL COMPANIES
23.2.1 BY ORGANIZATION SIZE
23.2.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.2.1.2. LARGE ENTERPRISES
23.2.2 BY SERVICE
23.2.2.1. REGULATORY WRITING & SUBMISSIONS
23.2.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.2.2.3. REGULATORY CONSULTING
23.2.2.4. LEGAL REPRESENTATION
23.2.2.5. DATA MANAGEMENT SERVICES
23.2.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.2.2.7. OTHERS
23.3 MEDICAL DEVICE COMPANIES
23.3.1 BY ORGANIZATION SIZE
23.3.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.3.1.2. LARGE ENTERPRISES
23.3.2 BY SERVICE
23.3.2.1. REGULATORY WRITING & SUBMISSIONS
23.3.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.3.2.3. REGULATORY CONSULTING
23.3.2.4. LEGAL REPRESENTATION
23.3.2.5. DATA MANAGEMENT SERVICES
23.3.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.3.2.7. OTHERS
23.4 BIOTECHNOLOGY COMPANIES
23.4.1 BY ORGANIZATION SIZE
23.4.1.1. SMALL & MEDIUM ENTERPRISES (SMES)
23.4.1.2. LARGE ENTERPRISES
23.4.2 BY SERVICE
23.4.2.1. REGULATORY WRITING & SUBMISSIONS
23.4.2.2. REGULATORY REGISTRATION & CLINICAL TRIAL APPLICATIONS
23.4.2.3. REGULATORY CONSULTING
23.4.2.4. LEGAL REPRESENTATION
23.4.2.5. DATA MANAGEMENT SERVICES
23.4.2.6. CHEMISTRY MANUFACTURING AND CONTROLS (CMC) SERVICES
23.4.2.7. OTHERS
23.5 OTHERS
24. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, BY REGION
24.1 GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, (ALL SEGMENTATION PROVIDED ABOVE IS REPRESENTED IN THIS CHAPTER BY COUNTRY)
24.1.1 NORTH AMERICA
24.1.1.1. U.S.
24.1.1.2. CANADA
24.1.1.3. MEXICO
24.1.2 EUROPE
24.1.2.1. GERMANY
24.1.2.2. FRANCE
24.1.2.3. U.K.
24.1.2.4. ITALY
24.1.2.5. SPAIN
24.1.2.6. RUSSIA
24.1.2.7. TURKEY
24.1.2.8. BELGIUM
24.1.2.9. NETHERLANDS
24.1.2.10. SWITZERLAND
24.1.2.11. REST OF EUROPE
24.1.3 ASIA-PACIFIC
24.1.3.1. JAPAN
24.1.3.2. CHINA
24.1.3.3. SOUTH KOREA
24.1.3.4. INDIA
24.1.3.5. AUSTRALIA
24.1.3.6. SINGAPORE
24.1.3.7. THAILAND
24.1.3.8. MALAYSIA
24.1.3.9. INDONESIA
24.1.3.10. PHILIPPINES
24.1.3.11. REST OF ASIA-PACIFIC
24.1.4 SOUTH AMERICA
24.1.4.1. BRAZIL
24.1.4.2. ARGENTINA
24.1.4.3. REST OF SOUTH AMERICA
24.1.5 MIDDLE EAST AND AFRICA
24.1.5.1. SOUTH AFRICA
24.1.5.2. EGYPT
24.1.5.3. ISRAEL
24.1.5.4. UAE
24.1.5.5. SAUDI ARABIA
24.1.5.6. REST OF MIDDLE EAST AND AFRICA
24.1.6 KEY PRIMARY INSIGHTS: BY MAJOR COUNTRIES
25. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY LANDSCAPE
25.1 COMPANY SHARE ANALYSIS: GLOBAL
25.2 COMPANY SHARE ANALYSIS: NORTH AMERICA
25.3 COMPANY SHARE ANALYSIS: EUROPE
25.4 COMPANY SHARE ANALYSIS: ASIA-PACIFIC
25.5 MERGERS & ACQUISITIONS
25.6 NEW PRODUCT DEVELOPMENT & APPROVALS
25.7 EXPANSIONS
25.8 REGULATORY CHANGES
25.9 PARTNERSHIP AND OTHER STRATEGIC DEVELOPMENTS
26. GLOBAL IN VITRO DIAGNOSTIC (IVD) REGULATORY AFFAIRS OUTSOURCING MARKET, COMPANY PROFILE
26.1 FREYR SOLUTIONS
26.1.1 COMPANY OVERVIEW
26.1.2 COMPANY SNAPSHOT
26.1.3 REVENUE ANALYSIS
26.1.4 PRODUCT PORTFOLIO
26.1.5 RECENT DEVELOPMENTS
26.2 AXSOURCE CONSULTING INC.
26.2.1 COMPANY OVERVIEW
26.2.2 COMPANY SNAPSHOT
26.2.3 REVENUE ANALYSIS
26.2.4 PRODUCT PORTFOLIO
26.2.5 RECENT DEVELOPMENTS
26.3 LORENZ LIFE SCIENCES GROUP
26.3.1 COMPANY OVERVIEW
26.3.2 COMPANY SNAPSHOT
26.3.3 REVENUE ANALYSIS
26.3.4 PRODUCT PORTFOLIO
26.3.5 RECENT DEVELOPMENTS
26.4 LABORATORY CORPORATION OF AMERICA HOLDINGS
26.4.1 COMPANY OVERVIEW
26.4.2 COMPANY SNAPSHOT
26.4.3 REVENUE ANALYSIS
26.4.4 PRODUCT PORTFOLIO
26.4.5 RECENT DEVELOPMENTS
26.5 REG IQ PTY LTD.
26.5.1 COMPANY OVERVIEW
26.5.2 COMPANY SNAPSHOT
26.5.3 REVENUE ANALYSIS
26.5.4 PRODUCT PORTFOLIO
26.5.5 RECENT DEVELOPMENTS
26.6 PROMEDICA INTERNATIONAL, A CALIFORNIA CORPORATION (IUVO BIOSCIENCES)
26.6.1 COMPANY OVERVIEW
26.6.2 COMPANY SNAPSHOT
26.6.3 REVENUE ANALYSIS
26.6.4 PRODUCT PORTFOLIO
26.6.5 RECENT DEVELOPMENTS
26.7 MAKROCARE
26.7.1 COMPANY OVERVIEW
26.7.2 COMPANY SNAPSHOT
26.7.3 REVENUE ANALYSIS
26.7.4 PRODUCT PORTFOLIO
26.7.5 RECENT DEVELOPMENTS
26.8 EMERGO BY UL
26.8.1 COMPANY OVERVIEW
26.8.2 COMPANY SNAPSHOT
26.8.3 REVENUE ANALYSIS
26.8.4 PRODUCT PORTFOLIO
26.8.5 RECENT DEVELOPMENTS
26.9 ICON PLC
26.9.1 COMPANY OVERVIEW
26.9.2 COMPANY SNAPSHOT
26.9.3 REVENUE ANALYSIS
26.9.4 PRODUCT PORTFOLIO
26.9.5 RECENT DEVELOPMENTS
26.10 WUXI APPTEC
26.10.1 COMPANY OVERVIEW
26.10.2 COMPANY SNAPSHOT
26.10.3 REVENUE ANALYSIS
26.10.4 PRODUCT PORTFOLIO
26.10.5 RECENT DEVELOPMENTS
26.11 THERMO FISHER SCIENTIFIC INC.
26.11.1 COMPANY OVERVIEW
26.11.2 COMPANY SNAPSHOT
26.11.3 REVENUE ANALYSIS
26.11.4 PRODUCT PORTFOLIO
26.11.5 RECENT DEVELOPMENTS
26.12 CHARLES RIVER LABORATORIES.
26.12.1 COMPANY OVERVIEW
26.12.2 COMPANY SNAPSHOT
26.12.3 REVENUE ANALYSIS
26.12.4 PRODUCT PORTFOLIO
26.12.5 RECENT DEVELOPMENTS
26.13 ACCELL CLINICAL RESEARCH, LLC
26.13.1 COMPANY OVERVIEW
26.13.2 COMPANY SNAPSHOT
26.13.3 REVENUE ANALYSIS
26.13.4 PRODUCT PORTFOLIO
26.13.5 RECENT DEVELOPMENTS
26.14 PAREXEL INTERNATIONAL (MA) CORPORATION
26.14.1 COMPANY OVERVIEW
26.14.2 COMPANY SNAPSHOT
26.14.3 REVENUE ANALYSIS
26.14.4 PRODUCT PORTFOLIO
26.14.5 RECENT DEVELOPMENTS
26.15 METECON GMBH
26.15.1 COMPANY OVERVIEW
26.15.2 COMPANY SNAPSHOT
26.15.3 REVENUE ANALYSIS
26.15.4 PRODUCT PORTFOLIO
26.15.5 RECENT DEVELOPMENTS
26.16 GENPACT
26.16.1 COMPANY OVERVIEW
26.16.2 COMPANY SNAPSHOT
26.16.3 REVENUE ANALYSIS
26.16.4 PRODUCT PORTFOLIO
26.16.5 RECENT DEVELOPMENTS
26.17 CRITERIUM, INC
26.17.1 COMPANY OVERVIEW
26.17.2 COMPANY SNAPSHOT
26.17.3 REVENUE ANALYSIS
26.17.4 PRODUCT PORTFOLIO
26.17.5 RECENT DEVELOPMENTS
26.18 MEDPACE
26.18.1 COMPANY OVERVIEW
26.18.2 COMPANY SNAPSHOT
26.18.3 REVENUE ANALYSIS
26.18.4 PRODUCT PORTFOLIO
26.18.5 RECENT DEVELOPMENTS
26.19 GROUPE PRODUCTLIFE S.A.
26.19.1 COMPANY OVERVIEW
26.19.2 COMPANY SNAPSHOT
26.19.3 REVENUE ANALYSIS
26.19.4 PRODUCT PORTFOLIO
26.19.5 RECENT DEVELOPMENTS
26.20 DOR PHARMACEUTICAL SERVICES
26.20.1 COMPANY OVERVIEW
26.20.2 COMPANY SNAPSHOT
26.20.3 REVENUE ANALYSIS
26.20.4 PRODUCT PORTFOLIO
26.20.5 RECENT DEVELOPMENTS
26.21 QSERVE
26.21.1 COMPANY OVERVIEW
26.21.2 COMPANY SNAPSHOT
26.21.3 REVENUE ANALYSIS
26.21.4 PRODUCT PORTFOLIO
26.21.5 RECENT DEVELOPMENTS
26.22 ORTHO CLINICAL DIAGNOSTICS.
26.22.1 COMPANY OVERVIEW
26.22.2 COMPANY SNAPSHOT
26.22.3 REVENUE ANALYSIS
26.22.4 PRODUCT PORTFOLIO
26.22.5 RECENT DEVELOPMENTS
26.23 ANGSTROM BIOTECH PVT. LTD.
26.23.1 COMPANY OVERVIEW
26.23.2 COMPANY SNAPSHOT
26.23.3 REVENUE ANALYSIS
26.23.4 PRODUCT PORTFOLIO
26.23.5 RECENT DEVELOPMENTS
26.24 RQM+
26.24.1 COMPANY OVERVIEW
26.24.2 COMPANY SNAPSHOT
26.24.3 REVENUE ANALYSIS
26.24.4 PRODUCT PORTFOLIO
26.24.5 RECENT DEVELOPMENTS
26.25 REGULATORY COMPLIANCES ASSOCIATES (SOTERA HEALTH)
26.25.1 COMPANY OVERVIEW
26.25.2 COMPANY SNAPSHOT
26.25.3 REVENUE ANALYSIS
26.25.4 PRODUCT PORTFOLIO
26.25.5 RECENT DEVELOPMENTS
26.26 RESEARCHDX
26.26.1 COMPANY OVERVIEW
26.26.2 COMPANY SNAPSHOT
26.26.3 REVENUE ANALYSIS
26.26.4 PRODUCT PORTFOLIO
26.26.5 RECENT DEVELOPMENTS
26.27 CMIC HOLDINGS CO., LTD.
26.27.1 COMPANY OVERVIEW
26.27.2 COMPANY SNAPSHOT
26.27.3 REVENUE ANALYSIS
26.27.4 PRODUCT PORTFOLIO
26.27.5 RECENT DEVELOPMENTS
26.28 NORTH AMERICAN SCIENCE ASSOCIATES, LLC
26.28.1 COMPANY OVERVIEW
26.28.2 COMPANY SNAPSHOT
26.28.3 REVENUE ANALYSIS
26.28.4 PRODUCT PORTFOLIO
26.28.5 RECENT DEVELOPMENTS
26.29 QARAD BV
26.29.1 COMPANY OVERVIEW
26.29.2 COMPANY SNAPSHOT
26.29.3 REVENUE ANALYSIS
26.29.4 PRODUCT PORTFOLIO
26.29.5 RECENT DEVELOPMENTS
26.30 TRANSCRIP
26.30.1 COMPANY OVERVIEW
26.30.2 COMPANY SNAPSHOT
26.30.3 REVENUE ANALYSIS
26.30.4 PRODUCT PORTFOLIO
26.30.5 RECENT DEVELOPMENTS
26.31 CLIN-R+
26.31.1 COMPANY OVERVIEW
26.31.2 COMPANY SNAPSHOT
26.31.3 REVENUE ANALYSIS
26.31.4 PRODUCT PORTFOLIO
26.31.5 RECENT DEVELOPMENTS
26.32 VCLS
26.32.1 COMPANY OVERVIEW
26.32.2 COMPANY SNAPSHOT
26.32.3 REVENUE ANALYSIS
26.32.4 PRODUCT PORTFOLIO
26.32.5 RECENT DEVELOPMENTS
26.33 PROPHARMA GROUP
26.33.1 COMPANY OVERVIEW
26.33.2 COMPANY SNAPSHOT
26.33.3 REVENUE ANALYSIS
26.33.4 PRODUCT PORTFOLIO
26.33.5 RECENT DEVELOPMENTS
26.34 ARRIELLO IRELAND LIMITED
26.34.1 COMPANY OVERVIEW
26.34.2 COMPANY SNAPSHOT
26.34.3 REVENUE ANALYSIS
26.34.4 PRODUCT PORTFOLIO
26.34.5 RECENT DEVELOPMENTS
NOTE: THE COMPANIES PROFILED IS NOT EXHAUSTIVE LIST AND IS AS PER OUR PREVIOUS CLIENT REQUIREMENT. WE PROFILE MORE THAN 100 COMPANIES IN OUR STUDY AND HENCE THE LIST OF COMPANIES CAN BE MODIFIED OR REPLACED ON REQUEST
27. RELATED REPORTS
28. QUESTIONNAIRE
29. ABOUT DATA BRIDGE MARKET RESEARCH
Методология исследования
Сбор данных и анализ базового года выполняются с использованием модулей сбора данных с большими размерами выборки. Этап включает получение рыночной информации или связанных данных из различных источников и стратегий. Он включает изучение и планирование всех данных, полученных из прошлого заранее. Он также охватывает изучение несоответствий информации, наблюдаемых в различных источниках информации. Рыночные данные анализируются и оцениваются с использованием статистических и последовательных моделей рынка. Кроме того, анализ доли рынка и анализ ключевых тенденций являются основными факторами успеха в отчете о рынке. Чтобы узнать больше, пожалуйста, запросите звонок аналитика или оставьте свой запрос.
Ключевой методологией исследования, используемой исследовательской группой DBMR, является триангуляция данных, которая включает в себя интеллектуальный анализ данных, анализ влияния переменных данных на рынок и первичную (отраслевую экспертную) проверку. Модели данных включают сетку позиционирования поставщиков, анализ временной линии рынка, обзор рынка и руководство, сетку позиционирования компании, патентный анализ, анализ цен, анализ доли рынка компании, стандарты измерения, глобальный и региональный анализ и анализ доли поставщика. Чтобы узнать больше о методологии исследования, отправьте запрос, чтобы поговорить с нашими отраслевыми экспертами.
Доступна настройка
Data Bridge Market Research является лидером в области передовых формативных исследований. Мы гордимся тем, что предоставляем нашим существующим и новым клиентам данные и анализ, которые соответствуют и подходят их целям. Отчет можно настроить, включив в него анализ ценовых тенденций целевых брендов, понимание рынка для дополнительных стран (запросите список стран), данные о результатах клинических испытаний, обзор литературы, обновленный анализ рынка и продуктовой базы. Анализ рынка целевых конкурентов можно проанализировать от анализа на основе технологий до стратегий портфеля рынка. Мы можем добавить столько конкурентов, о которых вам нужны данные в нужном вам формате и стиле данных. Наша команда аналитиков также может предоставить вам данные в сырых файлах Excel, сводных таблицах (книга фактов) или помочь вам в создании презентаций из наборов данных, доступных в отчете.