Las pruebas de diagnóstico rápido se prefieren a las pruebas de diagnóstico estándar, ya que pueden optimizar el análisis etiológico de infecciones en diversas situaciones (por ejemplo, sepsis, infecciones de las vías respiratorias y meningitis). La elucidación de las pruebas de diagnóstico rápido disponibles actualmente no siempre es clara y, por lo tanto, aún no pueden reemplazar a las pruebas convencionales. Existen tres tipos de pruebas de diagnóstico rápido. Las tiras o casetes de inmunoensayo rápido se utilizan para medir la concentración de una sustancia química. Las tiras reactivas se utilizan con mayor frecuencia para analizar el nivel de pH de un líquido en una muestra, pero algunos tipos de tiras reactivas sirven para otros fines, como detectar la presencia de un contaminante. Los ensayos inmunocromatográficos son fáciles y prácticos; las pruebas rápidas representan una alternativa adecuada al método convencional de subcultivo para la identificación primaria de patógenos. La reacción en cadena de la polimerasa (PCR) con transcriptasa inversa (RT) se utiliza para analizar el material genético presente en la muestra. Las ventajas de las pruebas de diagnóstico rápido incluyen la facilidad de uso, los requisitos mínimos de capacitación, la rapidez de los resultados y la instrumentación limitada. Sin embargo, las debilidades detectadas son la interpretación subjetiva de la lectura, una menor tasa de entrega de datos biológicos y una menor sensibilidad en relación con las pruebas de referencia.
Acceda al informe completo en https://www.databridgemarketresearch.com/reports/europe-rapid-diagnostic-tests-rdt-market
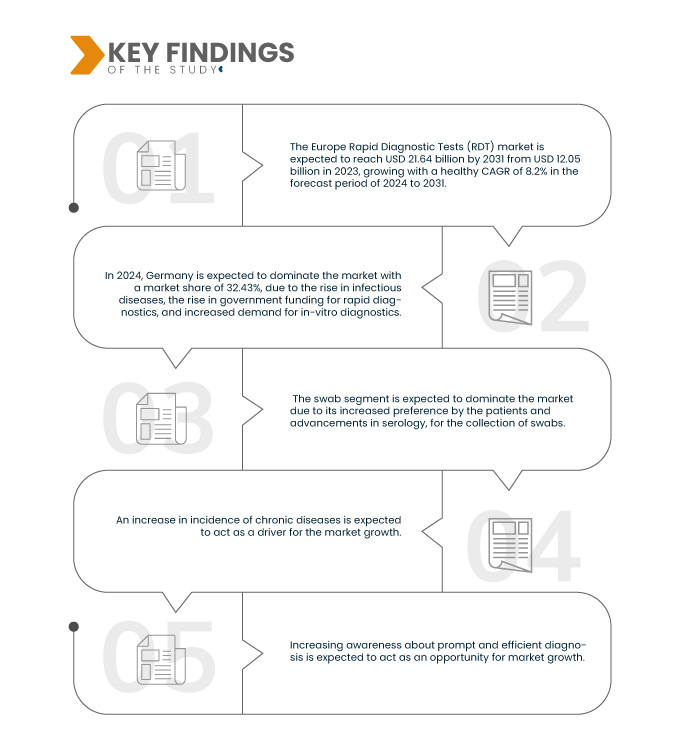
Data Bridge Market Research analiza que se espera que el mercado europeo de pruebas de diagnóstico rápido (RDT) alcance los 21.640 millones de dólares en 2031 desde los 12.050 millones de dólares en 2023, creciendo con una CAGR saludable del 8,2 % en el período de pronóstico de 2024 a 2031.
Principales hallazgos del estudio
- Aumento de la incidencia de enfermedades crónicas
Los factores que impulsan el crecimiento del mercado europeo de pruebas de diagnóstico rápido (PDR) son el aumento de la incidencia de enfermedades crónicas, el aumento de la población geriátrica, los avances tecnológicos en pruebas de diagnóstico rápido y el incremento en el lanzamiento de productos. Sin embargo, se prevé que los factores que frenarán el mercado son el aumento del coste de los diagnósticos rápidos, las retiradas de productos de las pruebas de diagnóstico rápido y la falta de conocimiento sobre su uso. Además, las iniciativas estratégicas de los actores del mercado y el aumento del gasto sanitario impulsan el crecimiento del mercado. No obstante, la necesidad de mano de obra cualificada para la recogida de muestras y la aprobación tardía de los lanzamientos de productos son desafíos que pueden frenar el crecimiento del mercado.
Alcance del informe y segmentación del mercado
Métrica del informe
|
Detalles
|
Período de pronóstico
|
2024 a 2031
|
Año base
|
2023
|
Años históricos
|
2022 (personalizable para 2016-2021)
|
Unidades cuantitativas
|
Ingresos en miles de millones de dólares
|
Segmentos cubiertos
|
Tipo de producto (consumibles y kits, instrumentos y otros), modo (profesional y de venta libre [OTC]), tecnología (basada en PCR, ensayos de flujo continuo, ensayos inmunocromatográficos de flujo lateral, ensayo de aglutinación, microfluídica , tecnología de sustrato y otros), modalidad (prueba basada en laboratorio y prueba no basada en laboratorio), grupo de edad (adulto y pediátrico), tipo de prueba (determinación de confirmación, pruebas serológicas y secuenciación viral), enfoque (diagnóstico in vitro y diagnóstico molecular ), muestra (hisopo, sangre, orina, saliva, esputo y otros), aplicación (pruebas de enfermedades infecciosas, monitoreo de glucosa, pruebas de cardiología, pruebas oncológicas, pruebas cardiometabólicas, pruebas de drogas de abuso, pruebas de embarazo y fertilidad, pruebas toxicológicas y otros), usuario final (hospital) y clínicas, laboratorios de diagnóstico, entornos de atención domiciliaria, institutos de investigación y académicos, y otros), canal de distribución (licitación directa y ventas minoristas)
|
Países cubiertos
|
Alemania, Francia, Reino Unido, Italia, España, Rusia, Turquía, Bélgica, Países Bajos, Suiza y resto de Europa
|
Actores del mercado cubiertos
|
Abbott (EE. UU.), Danaher (EE. UU.), Cellex (EE. UU.), Fujirebio (Japón), Access Bio (EE. UU.), Cardinal Health (EE. UU.), Bio-Rad Laboratories, Inc. (EE. UU.), BD (EE. UU.), F. Hoffmann-La Roche Ltd (Suiza), bioMérieux SA (Francia), InBios International, Inc (EE. UU.), Luminex Corporation (EE. UU.), Gnomegen LLC (EE. UU.), QIAGEN (Países Bajos), Quidel Corporation (EE. UU.), Sysmex Europe GMBH (Alemania), Cardinal Health (EE. UU.), Siemens Healthcare Gmbh (una subsidiaria de Siemens Healthineers AG) (Alemania), MEGACOR DIAGNOSTIKGMBH (Alemania), PerkinElmer Inc. (EE. UU.), Sekisui Diagnostics (EE. UU.), PTS Diagnostics (EE. UU.), werfen (España), Nova Biomedical (EE. UU.) y Trinity Biotech (Irlanda), entre otros.
|
Puntos de datos cubiertos en el informe
|
Además de los conocimientos sobre escenarios de mercado como el valor de mercado, la tasa de crecimiento, la segmentación, la cobertura geográfica y los principales actores, los informes de mercado seleccionados por Data Bridge Market Research también incluyen un análisis profundo de expertos, epidemiología de pacientes, análisis de cartera, análisis de precios y marco regulatorio.
|
Análisis de segmentos
El mercado europeo de pruebas de diagnóstico rápido (RDT) se clasifica en once segmentos notables según el tipo de producto, modo, tecnología, modalidad, grupo de edad, tipo de prueba, enfoque, muestra, aplicación, usuario final y canal de distribución.
- Según el tipo de producto, el mercado se segmenta en consumibles y kits, instrumentos y otros.
En 2024, se espera que el segmento de consumibles y kits domine el mercado europeo de pruebas de diagnóstico rápido (RDT)
Se espera que en 2024, el segmento de consumibles y kits domine el mercado con una participación de mercado del 55,54% debido a la facilidad de uso, la disponibilidad de kits de prueba y la entrega más rápida de resultados.
- En función del modo, el mercado se segmenta en profesional y Over-The-Counter [OTC].
En 2024, se espera que el segmento profesional domine el mercado europeo de pruebas de diagnóstico rápido (RDT)
Se espera que en 2024, el segmento de productos de pruebas de diagnóstico rápido profesionales domine el mercado con una participación de mercado del 76,11 % debido a la precisión y al mayor uso en puntos de atención, como los hogares.
- En cuanto a la tecnología, el mercado se segmenta en ensayos basados en PCR, de flujo continuo, inmunocromatográficos de flujo lateral, de aglutinación, microfluídica, tecnología de sustratos, entre otros. En 2024, se prevé que el segmento basado en PCR domine el mercado con una cuota de mercado del 37,51%.
- Según la modalidad, el mercado se segmenta en pruebas de laboratorio y pruebas no de laboratorio. En 2024, se prevé que el segmento de pruebas de laboratorio domine el mercado con una cuota de mercado del 71,68%.
- Según el grupo de edad, el mercado se segmenta en adultos y niños. En 2024, se prevé que el segmento adulto domine el mercado con una cuota de mercado del 84,94%.
- Según el tipo de prueba, el mercado se segmenta en confirmación de diagnóstico, pruebas serológicas y secuenciación viral. En 2024, se prevé que el segmento de confirmación de diagnóstico domine el mercado con una cuota de mercado del 43,27 %.
- Según el enfoque, el mercado se segmenta en diagnóstico in vitro y diagnóstico molecular. En 2024, se prevé que el segmento de diagnóstico in vitro domine el mercado con una cuota de mercado del 73,88%.
- Según la muestra, el mercado se segmenta en hisopos, sangre, orina, saliva, esputo y otros. En 2024, se prevé que el segmento de hisopos domine el mercado europeo de pruebas de diagnóstico rápido (PDR), con una cuota de mercado del 45,04%.
- Según la aplicación, el mercado se segmenta en pruebas de enfermedades infecciosas, monitorización de glucosa, pruebas cardiológicas, pruebas oncológicas, pruebas cardiometabólicas, pruebas de drogas de abuso, pruebas de embarazo y fertilidad, pruebas toxicológicas, entre otras. En 2024, se prevé que el segmento de pruebas de enfermedades infecciosas domine el mercado con una cuota de mercado del 33,74%.
- En función del usuario final, el mercado se segmenta en hospitales y clínicas, laboratorios de diagnóstico, centros de atención domiciliaria, institutos de investigación y académicos, entre otros. En 2024, se prevé que el segmento de hospitales y clínicas domine el mercado con una cuota de mercado del 55,10 %.
- Según el canal de distribución, el mercado se segmenta en licitación directa y venta minorista. En 2024, se prevé que el segmento de licitación directa domine el mercado con una cuota de mercado del 61,53%.
Actores principales
Data Bridge Market Research analiza a Abbott (EE. UU.), F. Hoffmann-La Roche Ltd (Suiza), Siemens Healthcare Gmbh (una subsidiaria de Siemens Healthineers AG) (Alemania), Danaher (EE. UU.), Cardinal Health (EE. UU.) como los principales actores del mercado de pruebas de diagnóstico rápido (RDT) de Europa.
Desarrollos del mercado
- En mayo de 2020, según un informe de la OMS, se estimó que las enfermedades crónicas serían responsables de tres cuartas partes de las muertes a nivel mundial. El número de personas que desarrollarían enfermedades como la diabetes de tipo 2 y el cáncer de pulmón ascendería a 228 millones en 2025, frente a los 80 millones actuales. El rápido aumento de las enfermedades crónicas, junto con el cambio en el estilo de vida, conlleva un aumento de la tasa de obesidad a nivel mundial, la cual es altamente prevenible mediante un diagnóstico temprano.
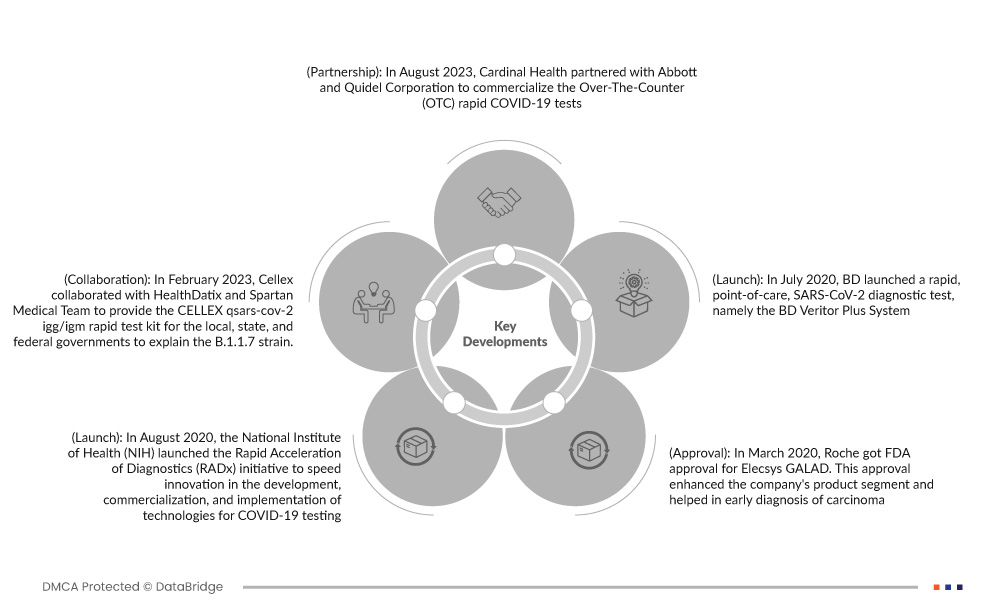
- En abril y agosto de 2020, Cardinal Health se asoció con Abbott y Quidel Corporation para comercializar las pruebas rápidas de COVID-19 de venta libre (OTC). Esta alianza permitiría a Cardinal Health ampliar su oferta de pruebas y vigilancia de COVID-19 y acceder a la prueba de COVID-19 de venta libre en casa QuickVue de Quidel y a la prueba de autodiagnóstico de antígenos BinaxNOW de Abbott, que permiten a los pacientes realizar pruebas sin receta fácilmente.
- En agosto de 2020, el Instituto Nacional de Salud (NIH) lanzó la iniciativa de Aceleración Rápida del Diagnóstico (RADx) para impulsar la innovación en el desarrollo, la comercialización y la implementación de tecnologías para las pruebas de COVID-19. Esta prueba de diagnóstico rápido ofrece resultados precisos y óptimos.
- En marzo de 2020, Roche obtuvo la aprobación de la FDA para Elecsys GALAD. Esta aprobación mejoró el segmento de productos de la compañía y contribuyó al diagnóstico temprano del carcinoma. Esta aprobación también mejoró las finanzas de la compañía.
- En julio de 2020, BD lanzó una prueba rápida de diagnóstico del SARS-CoV-2 en el punto de atención: el sistema BD Veritor Plus. Estos nuevos ensayos pueden proporcionar resultados en 15 minutos, son fáciles de usar y constituyen un instrumento altamente portátil, fundamental para mejorar el acceso al diagnóstico de la COVID-19. Este nuevo lanzamiento ha diversificado la cartera de productos de la compañía.
Análisis regional
Geográficamente, los países cubiertos en el informe de mercado son Alemania, Francia, Reino Unido, Italia, España, Rusia, Turquía, Bélgica, Países Bajos, Suiza y el resto de Europa.
Según el análisis de investigación de mercado de Data Bridge:
Se espera que Alemania sea el país dominante y de más rápido crecimiento en el mercado europeo de pruebas de diagnóstico rápido (RDT)
Se espera que Alemania domine el mercado debido al aumento de enfermedades infecciosas con el envejecimiento de la población.
Para obtener información más detallada sobre el Informe de mercado de pruebas de diagnóstico rápido (RDT) de Europa, haga clic aquí: https://www.databridgemarketresearch.com/reports/europe-rapid-diagnostic-tests-rdt-market